| |
| Med Sci (Paris). 32(4): 345–347. doi: 10.1051/medsci/20163204011.Amélioration du transfert cytosolique de protéines grâce à leur organisation dans un système de délivrance Guy Zuber1* 1Laboratoire de Conception et d’Application de Molécules Bioactives, UMR 7199, CNRS-université de Strasbourg, faculté de pharmacie, 74, route du Rhin, 67400Illkirch, France |
Soigner des pathologies humaines à l’aide de protéines recombinantes et d’anticorps monoclonaux est désormais d’actualité et plus d’une centaine de ces molécules sont actuellement sur le marché [1]. Toutes ces protéines médicaments ont une action extracellulaire. Or, il est estimé que 70 % des protéines, et donc des cibles thérapeutiques potentielles, se situent à l’intérieur de la cellule [2]. Trouver des méthodes efficaces pour assister le transfert (ou la vectorisation) de protéines dans la cellule est donc un enjeu important pour le développement de nouveaux médicaments [3] (→).
(→) Voir la Synthèse de C. Poillot et M. De Waard, m/s n° 5, mai 2011, page 527
|
Transduction de protéines avec des systèmes de délivrance Le franchissement de la membrane plasmique par une macromolécule n’est pas aisé. La bicouche lipidique doit en effet être perméabilisée, avec sélectivité, sans toutefois diminuer la viabilité cellulaire. Cette perméabilisation, par rupture membranaire, peut être provoquée soit directement à la surface des cellules, soit dans la cellule, au niveau des compartiments vacuolaires intracellulaires, après endocytose de la macromolécule. Ce dernier mode de perméabilisation (la rupture membranaire intracellulaire) est particulièrement intéressant car plusieurs types d’évènements spécifiques impliqués dans l’endocytose (notamment l’acidification de l’endosome) peuvent être visés pour provoquer une rupture contrôlée. Des assemblages supramoléculaires chimiques utilisant ce mode d’entrée ont été développés pour la délivrance d’acides nucléiques [4]. Les éléments de base de ces assemblages, appelés vecteurs, ont invariablement (1) une charge positive et (2) une activité endosomolytique. La charge cationique permet d’associer les acides nucléiques avec les vecteurs pour former des assemblages cohésifs. Cette charge cationique sert aussi à ancrer les assemblages à la surface des cellules et favorise leur endocytose en quantité dans les cellules. En théorie, cette voie d’internalisation d’assemblages cationiques dans les cellules n’est pas réservée qu’aux acides nucléiques et offre une opportunité pour délivrer des protéines. Ce mode de délivrance de protéines a été testé et est effectivement possible, cependant l’efficacité de la transduction varie selon la protéine choisie [5]. Ce résultat n’est pas surprenant car les protéines sont caractérisées par une hétérogénéité physicochimique et elles s’associent plus ou moins bien (plutôt moins) avec un vecteur cationique. La cohésion de l’assemblage (protéine/vecteur), et par conséquence son endocytose, s’en trouvent compromises. |
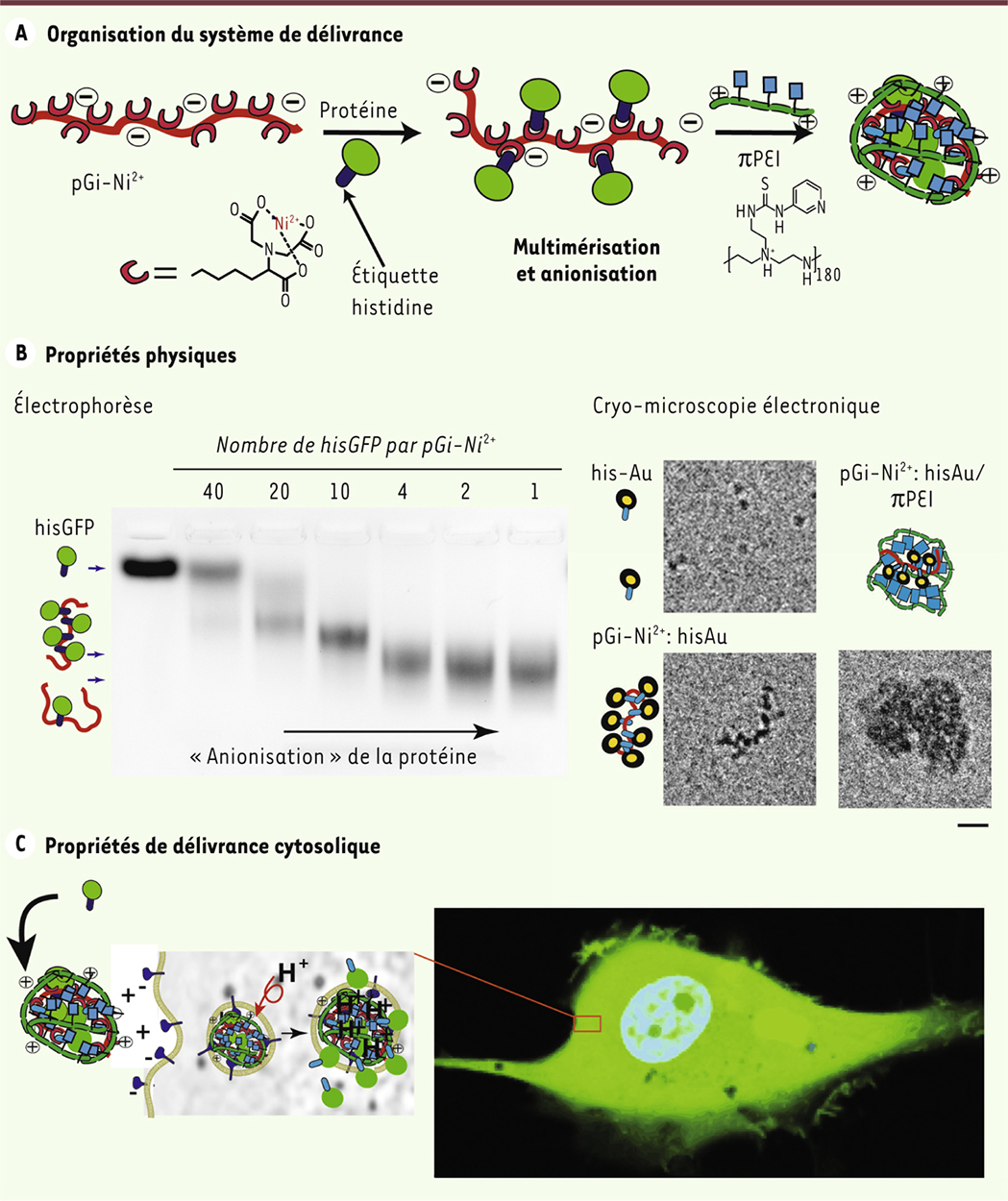
Organisation supramoléculaire de protéines En collaboration avec les équipes d’Étienne Weiss de l’école de biotechnologie de Strasbourg et Patrick Schultz de l’institut de génétique et de biologie moléculaire et cellulaire, nous avons optimisé l’organisation de la protéine avant association avec le vecteur cationique [6]. L’organisation à laquelle nous sommes parvenus est schématisée dans la Figure 1A. Il s’agit de fixer transitoirement plusieurs protéines sur un polymère anionique grâce à des interactions non-covalentes. Cette pré-organisation des protéines permet de faciliter leur emballage efficace dans un vecteur constitué de polyéthylènimine1 modifiée avec un groupement pyridylthiourée (pPEI [C6H7N3S]). Ce vecteur a été sélectionné car il a montré une bonne efficacité pour délivrer des petits acides nucléiques [7] et des protéines [8] dans le cytosol. Pour fixer la protéine au vecteur, nous avons utilisé l’affinité de l’histidine pour l’ion nickel (Ni2+) immobilisé avec un groupement nitrilotriacétate (NTA) [9], une solution pertinente pour au moins trois raisons. Premièrement, de nombreuses protéines recombinantes sont équipées d’une étiquette polyhistidine (his) afin de pouvoir les purifier par chromatographie d’affinité. Deuxièmement, le groupement NTA est chargé négativement et favorise l’emballage de la protéine avec le vecteur cationique grâce à un plus grand nombre d’interactions électrostatiques. Troisièmement, l’affinité de l’étiquette polyhistidine pour le groupement NTA-Ni2+ est sensible à l’acidité du milieu. L’affinité est forte à pH extracellulaire (constante de dissociation entre 1 et 10 µm) mais elle est faible aux pH acides rencontrés dans les endosomes. Ceci permet une dissociation contrôlée des protéines uniquement après entrée dans les cellules.
 | Figure 1.
Représentation schématique du système de délivrance et présentation de ses propriétés. A. Plusieurs protéines recombinantes avec étiquette polyhistidine (ici la protéine fluorescente verte « hisGFP ») sont concentrées sur un polymère anionique pGi-Ni2+ grâce à l’affinité de l’histidine pour le Ni2+ immobilisé. Ceci favorise l’association électrostatique avec le pPEI, un vecteur cationique. B. Une électrophorèse sur gel d’agarose montre que la mobilité de hisGFP augmente en présence du polymère pGi-Ni2+, indiquant une fixation et un apport de charge négative autour de la protéine. La microscopie électronique de solutions gelées dans de la glace vitreuse montre que le polymère rassemble et aligne des billes d’or de 2 nm avec étiquette polyhistidine. L’emballement avec du pPEI conduit à la formation de particules sphériques de 30-40 nm de diamètre. Échelle : 10 nm. C. Un système de délivrance, formé à partir de hisGFPs pré-organisées et de pPEI, est ajouté sur des cellules gliales tumorales vivantes. Après 24 h d’incubation, la microscopie à fluorescence montre une libération de hisGFP dans toute la cellule, noyau et cytosol inclus. hisGFP : histidine-green fluorescent protein ; pGi-Ni2+ : polymère de fixation de protéines avec immobilisation d’ions nickel ; pPEI : polyéthylènimine modifiée avec un groupement pyridylthiourée ; Au : or. |
Le polymère de fixation de protéines, nommé pGi, a été synthétisé chimiquement à partir d’un polymère linéaire constitué d’un enchaînement de 190 ornithines2, en équipant les amines des chaînes latérales avec des groupements NTA. Après immobilisation d’ions nickel (Ni2+) au niveau des groupements NTA, nous avons évalué la manière dont ce polymère fixe des protéines possédant une étiquette polyhistidine (his) grâce à plusieurs techniques. Tout d’abord, en utilisant une protéine fluorescente verte (hisGFP, histidine-green fluorescent protein), nous avons déterminé par des techniques de dialyse que chaque polymère pGi-Ni2+ fixe au maximum 10 hisGFPs. Cette association a été confirmée par des analyses physiques complémentaires (Figure 1B). En effet, une électrophorèse sur gel d’agarose montre que, lorsque le nombre de protéines par polymère est diminué, la mobilité électrophorétique de la protéine vers la cathode augmente. Ce résultat démontre que le polymère lié apporte une contribution anionique à la protéine. La cryo-microscopie électronique a ensuite été utilisée pour visualiser comment le polymère fixe des macromolécules possédant une étiquette polyhistidine. Pour permettre une visualisation avec un meilleur contraste, la protéine a été substituée par une bille d’or de 2 nm de diamètre. Des billes d’or seules, ou fixées sur le polymère pGi-Ni2+, ont été rapidement gelées dans de la glace vitreuse3. Les échantillons ont ensuite été observés par microscopie électronique. Les images montrent que les billes d’or seules sont aléatoirement distribuées alors que la présence du polymère provoque un rassemblement d’environ 10 billes d’or plus ou moins alignées (Figure 1B). Les protéines pré-organisées grâce au polymère pGi-Ni2+ ont finalement été mélangées avec le vecteur cationique pPEI pour former des assemblages de délivrance sphériques de 30-40 nm de diamètre. Leur efficacité de transduction protéique a été comparée aux assemblages sans pré-organisation (Figure 1C). Pour hisGFP, une quantification relative de la fluorescence montre que le complexe [pGi-Ni2+:hisGFP/pPEI] délivre environ dix fois plus de protéines dans les cellules que le complexe [hisGFP/pPEI]. Ce bénéfice de la pré-organisation a aussi été observé pour d’autres protéines, notamment la caspase 3, une protéase dont les propriétés pro-apoptotiques s’exercent uniquement lorsqu’elle est située dans le cytosol. |
Conclusion et perspectives Nous avons amélioré la délivrance cytosolique de protéines en optimisant l’organisation d’un système de délivrance. Pour cela, nous avons préparé un polymère anionique qui est capable à la fois de multimériser/condenser plusieurs protéines recombinantes puis de favoriser l’association électrostatique avec un vecteur cationique. Nos preuves de concept montrent que le nombre de protéines transférées dans le cytosol est augmenté, suffisamment pour induire un effet biologique marqué. Cette stratégie ouvre la voie à l’utilisation directe de protéines à action cytosolique comme outils pour moduler l’activité cellulaire. Elle a toutefois encore des limites : (1) elle exclut les protéines n’ayant pas d’affinité forte pour le nickel immobilisé ; et (2) le rendement du système final reste encore modeste en raison de l’activité endosomolytique modérée du vecteur. En conséquence, une grande partie des protéines reste encore piégée dans les endosomes. Néanmoins, les polymères utilisés ici et la manière d’organiser le système supramoléculaire restent encore simples et laissent des marges d’amélioration. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Dimitrov D. Therapeutic proteins . In: Voynov V, Caravella JA, eds. New York: : Humana Press; , 2012 : :1.–26. 2.
Wang X, Wang R, Zhang Y, Zhang H. Evolutionary survey of druggable protein targets with respect to their subcellular localizations . Genome Biol Evol. 2013; ; 5 : :1291.–1297. 3.
Poillot C, De Waard M. Administration de molécules actives dans les cellules : le potentiel des peptides de pénétration cellulaire . Med Sci (Paris). 2011; ; 27 : :527.–534. 4.
Wagner E. Polymers for nucleic acid transfer-an overview . Adv Genet. 2014; ; 88 : :231.–261. 5.
Zuris JA, Thompson DB, Shu Y, et al. Cationic lipid-mediated delivery of proteins enables efficient protein-based genome editing in vitro and in vivo . Nat Biotechnol. 2015; ; 33 : :73.–80. 6.
Postupalenko V, Desplancq D, Orlov I, et al. Protein delivery system containing a nickel-immobilized polymer for multimerization of affinity-purified His-tagged proteins enhances cytosolic transfer . Angew Chem Int Ed Engl. 2015; ; 54 : :10583.–10586. 7.
Creusat G, Thomann JS, Maglott A, et al. Pyridylthiourea-grafted polyethylenimine offers an effective assistance to siRNA-mediated gene silencing in vitro and in vivo . J Control Release. 2012; ; 157 : :418.–426. 8.
Postupalenko V, Sibler AP, Desplancq D, et al. Intracellular delivery of functionally active proteins using self-assembling pyridylthiourea-polyethylenimine . J Control Release. 2014; ; 178 : :86.–94. 9.
Porath J, Carlsson J, Olsson I, Belfrage G. Metal chelate affinity chromatography, a new approach to protein fractionation . Nature. 1975; ; 258 : :598.–599. |