| |
| Med Sci (Paris). 32(5): 438–441. doi: 10.1051/medsci/20163205004.L’auto-antigène Ro60 se lie aux rétro-éléments endogènes et régule l’expression des gènes inflammatoires Alexandre Belot1,2* and Cécile Picard1,2 1Service de Néphrologie, Rhumatologie, Dermatologie Pédiatriques, Hôpital Femme Mère Enfant, Hospices Civils de Lyon, 59, boulevard Pinel, 69677Bron, France 2CIRI, Centre International de Recherche en Infectiologie, Université de Lyon, Inserm, U1111, 21, avenue Tony Garnier, 69365Lyon Cedex 07, France MeSH keywords: Autoantigènes, Maladies auto-immunes, Auto-immunité, Humains, Inflammation, ARN, Petit ARN cytoplasmique, ARN viral, Ribonucléoprotéines, Transduction du signal, physiologie, génétique, immunologie, métabolisme |
Ro60 est un antigène nucléaire qui a la capacité de se lier aux ARN. Des anticorps spécifiques de cet antigène sont retrouvés dans certaines maladies auto-immunes comme le lupus érythémateux systémique1,, le syndrome de Gougerot-Sjögren2, ou le lupus néonatal [1] (→).
(→) Voir la Synthèse de B. Terrier et L. Mouthon, m/s n° 1, janvier 2013, page 65
Cependant, jusqu’à récemment, aucun rôle pathogène de Ro60 n’était connu. L’implication des acides nucléiques dans le développement des maladies auto-immunes a connu un regain d’intérêt ces dernières années avec l’identification de nouvelles formes d’auto-immunité monogéniques secondaires à des anomalies du métabolisme des acides nucléiques cytoplasmiques ou les récepteurs de l’immunité innée tels les RLR (rig-like receptors) qui détectent spécifiquement l’ARN viral par exemple. Dans un article récent publié dans Science, les auteurs ont identifié des rétroéléments endogènes dont la reconnaissance par les récepteurs de l’immunité innée est prévenue par leur liaison à la protéine Ro60 réduisant ainsi l’expression des gènes pro-inflammatoires [2]. |
Métabolisme des acides nucléiques intracellulaires et auto-immunité : l’enseignement des interféronopathies Les interféronopathies représentent un champ nouveau de maladies liées à une réponse immunitaire innée inappropriée impliquant des détecteurs (senseurs) des acides nucléiques cytoplasmiques et aboutissant à une production excessive d’interférons de type I (IFN-α et β) [3]. Les cellules possèdent en effet, un système de détection des acides nucléiques intracytoplasmique très conservé qui permet d’engager une réponse immunitaire pour lutter contre l’invasion d’agents pathogènes comme les virus ou les bactéries intracellulaires. Ce système vertueux peut être mis en échec dans certaines situations de dérégulation. L’étude des maladies neuro-inflammatoires génétiques, appelées syndromes d’Aicardi-Goutières3 (→) a conduit à identifier différents gènes impliqués dans le métabolisme intracellulaire des acides nucléiques. Ces maladies sont associées, avec différents niveaux de sévérité, à des atteintes neurologiques (encéphalopathie, parésie), pulmonaires (pneumopathie interstitielle), cutanées (engelure), des vascularites et d’autres symptômes de maladies auto-immunes que l’on retrouve dans le lupus systémique [4].
(→) Voir Brève, m/s n° 22, novembre 2006, page 937
Deux principales voies de régulation ont été identifiées par la mise en évidence de mutations spécifiques : (1) la voie liée à des mutations touchant des enzymes impliquées dans le métabolisme des acides nucléiques intracellulaires : TREX1 (three prime repair exonuclease 1), SAMHD1 (SAM domain and HD domain-containing protein 1), RNASEH2A (ribonuclease H2 subunit A), RNASEH2B, RNASEH2C, et ADAR1 (adenosine deaminases acting on RNA) ; et (2) la voie liée à une activation spontanée des récepteurs de l’immunité innée, secondaire à des mutations gain de fonction des récepteurs eux-mêmes, et responsable d’une production non régulée d’interféron de type I, indépendamment du ligand : mutation activatrice de IFIH1 (interferon induced with helicase C domain 1) codant MDA5 (melanoma differentiation-associated protein 5), ou de TMEM173 (transmembrane protein 173) qui code STING (stimulator of interferon genes protein). Ces travaux soulignent ainsi l’impact que peuvent présenter les acides nucléiques endogènes dans le développement d’une auto-immunité précoce. L’origine de ces acides nucléiques endogènes est mal connue mais ils pourraient provenir du cycle de rétrovirus endogènes intégrés au génome. |
La protéine Ro60 est un régulateur négatif de la réponse interféron À l’aide d’une technique innovante, appelée iCLIP (individual nucleotide crosslinking and immunoprecipitation), Hung et al. ont analysé l’ensemble des ARN capables de se lier à la protéine Ro60. Les ARN ainsi identifiés ont été alignés puis comparés à des banques d’ARN provenant de lignées cellulaires de deux types : une première lignée de lymphocytes B (LyB), transformés par le virus d’Epstein-Barr (GM12878), et une lignée cellulaire de leucémie érythro-myéloblastique (K562). Ces deux lignées cellulaires avaient été préalablement traitées avec de l’interféron-alpha, pendant 6 heures. L’alignement des transcrits ARN liés à Ro60, avec les transcrits induits dans les deux lignées traitées par l’interféron, a permis de mettre en évidence un pool commun de transcrits, majoritairement localisés dans les introns (portion non codante des gènes), avec une représentation importante d’ARN contenant la séquence Alu4. Afin d’évaluer si la liaison des ARN à la protéine Ro60 jouait un rôle propre dans l’induction de la production d’interféron de type I, les auteurs ont invalidé la lignée cellulaire GM12878 (LyB transformés) pour le gène TROVE2 qui code la protéine Ro60. Une analyse par séquençage des ARN des cellules exprimant ou non Ro60 cultivées en présence ou en absence d’interféron-alpha, a révélé une induction des mêmes transcrits dans les cellules TROVE2-KO (knock-out), n’exprimant plus Ro60, et dans la lignée cellulaire traitée par interféron. Ces observations témoignent donc d’une activation aberrante des cellules n’exprimant pas l’antigène Ro60. Une explication, proposée par les auteurs, serait que, dans le cas d’une expression aberrante des séquences ARN Alu endogènes (non liées à Ro60), il existerait une stimulation des récepteurs des acides nucléiques intracellulaires à l’origine d’une induction de la réponse inflammatoire. Afin de tester cette hypothèse, l’ARN a été transfecté dans des cellules mononuclées (PBMC, peripheral blood mononuclear cells) isolées du sang de donneurs sains. Dans ces conditions, on observe que les motifs ARN avec séquence Alu sont à l’origine d’une plus forte stimulation de sécrétion de cytokines comprenant l’interféron-alpha, l’IL(interleukine)-6 et le TNF(tumor necrosis factor)-alpha [2]. |
Voie d’activation de l’interféron de type I L’induction de cytokines par les éléments ARN Alu est bloquée lorsque les cellules sont traitées, concomitamment, par la chloroquine connue pour modifier la voie de signalisation des TLR (toll-like receptors) endosomaux (TLR3, 7, 8 et 9). En revanche, le BX795, inhibiteur de TBK (serine/threonine-protein kinase), qui bloque la signalisation des récepteurs cytoplasmiques RLR, RIG-I (retinoic acid-inducible gene 1) et MDA5, et le TLR3, n’a pas d’effet sur la production de cytokine, suggérant que ces voies de reconnaissance des acides nucléiques, non endosomales (c’est-à-dire autres que les TLR), ne sont pas impliquées. Afin de déterminer si ces résultats obtenus in vitro avaient une validité clinique, les auteurs ont purifié les immunoglobulines provenant de patients avec lupus positifs pour les anticorps anti-Ro. Par immuno-précipitation de lysats de cellules des lignées K562 ou GM12878, ils ont isolé les ARN associés à la protéine et les ont analysés par RT-PCR (reverse transcription polymerase chain reaction). Ils ont ainsi pu montrer qu’il existait chez certains des patients présentant des anticorps anti-Ro, un enrichissement des ARN porteurs de séquences consensus Alu. Plus généralement, l’expression des transcrits Alu a également été évaluée en utilisant une méthode de séquençage ARN, dans les cellules sanguines de quatre-vingt-dix-neuf patients présentant un lupus actif comparés à dix-huit individus sains. Les auteurs ont ainsi pu montrer que les séquences Alu étaient retrouvées à un niveau significativement plus élevé chez les patients lupiques en comparaison avec les contrôles. De plus, ces séquences étaient le plus fortement exprimées dans une sous-population de patients lupiques qui présentaient une signature interféron importante (c’est-à-dire un niveau de transcription de gènes induits par l’interféron augmenté). Bien que le niveau d’expression des ARN Alu soit le plus élevé chez les patients lupiques ayant des anticorps anti-Ro60, un certain pourcentage de patients sans anticorps présente une forte signature interféron avec, cependant, un faible nombre de séquences Alu. Ceci pourrait être dû, selon les auteurs, à d’autres mécanismes de régulation de la production d’interféron, impliquant, par exemple, des auto-anticorps pouvant être dirigés contre d’autres nucléoprotéines capables de se lier aux ARN. Récemment, les rétro-éléments endogènes ont été identifiés comme des éléments responsables, chez la souris, d’une accumulation aberrante, au niveau intra-cytoplasmique, d’acides nucléiques responsable d’une production excessive d’interféron de type I en cas de déficit de l’endonucléase TREX1 [5]. Les ARN avec séquence Alu qui se lient à la protéine Ro60, sont donc capables, s’ils ne sont pas liés à la ribonucléprotéine, d’induire une réponse inflammatoire. Par extension, ces rétro-éléments pourraient ainsi être impliqués dans le développement de l’auto-immunité chez l’homme (Figure 1). La stimulation des récepteurs intracellulaires des acides nucléiques apparaît de plus en plus au centre des mécanismes de développement de l’auto-immunité systémique. Les rétro-éléments présentant la séquence Alu pourraient stimuler la réponse inflammatoire via les TLR endosomaux. Les auteurs proposent que ces séquences Alu, au nombre de plus d’un million, qui ont intégré le génome au cours de l’évolution des primates, pourraient avoir joué un rôle en protégeant l’hôte contre différents stress et infections. Ces ARN avec séquence Alu ont la capacité d’amplifier la réponse immunitaire en activant des senseurs intracellulaires de l’ARN. Ces rétro-éléments seraient ainsi bénéfiques pour la défense anti-infectieuse mais ils prédisposeraient à l’auto-immunité systémique.
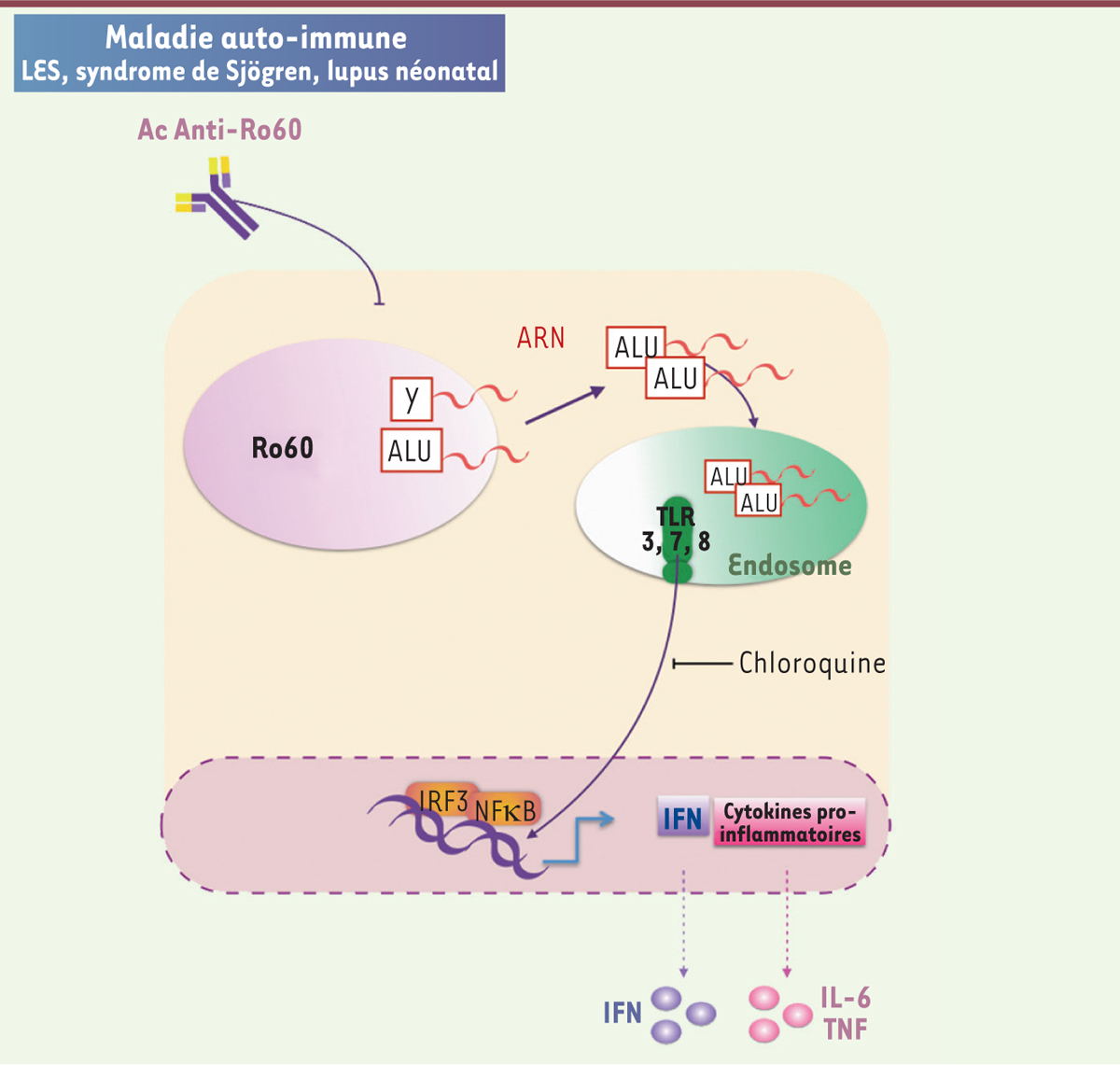
 | Figure 1.
Rôle du déficit en Ro60 dans la surexpression des gènes pro-inflammatoires. Dans certaines maladies auto-immunes, les anticorps anti-Ro60 (SSA) pourraient jouer un rôle dans la diminution de ribonucléoprotéine Ro60 et libérer des ARN possédant une séquence Alu en provenance de rétro-éléments endogènes. Ces séquences Alu se trouvent en conséquence en excès et sont capables de stimuler les TLR endosomaux responsables d’une surexpression des cytokines pro-inflammatoires TNF-α et IL-6 et de l’interféron de type I. Ac : anticorps ; IFN : interféron ; IL : interleukine ; IRF3 : interferon regulatory factor 3 ; LES : lupus érythémateux systémique ; NFkB : nuclear factor-kappa B ; TNF : facteur de nécrose tumorale ; TLR : toll-like receptor. |
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Terrier B, Mouthon L. Lupus érythémateux systémique : traitements par anticorps monoclonaux et molécules recombinantes . Med Sci (Paris). 2013; ; 29 : :65.–73. 2.
Hung T, Pratt GA, Sundararaman B, et al. The Ro60 autoantigen binds endogenous retroelements and regulates inflammatory gene expression . Science. 2015; ; 350 : :455.–459. 3.
Crow YJ, Manel N. Aicardi-Goutières syndrome and the type I interferonopathies . Nat Rev Immunol. 2015; ; 15 : :429.–440. 4.
Picard C, Mathieu AL, Hasan U, et al. Inherited anomalies of innate immune receptors in pediatric-onset inflammatory diseases . Autoimmun Rev. 2015; ; 14 : :1147.–1153. 5.
Stetson DB, Ko JS, Heidmann T, Medzhitov R. Trex1 prevents cell-intrinsic initiation of autoimmunity . Cell. 2008; ; 134 : :587.–598. |