| |
| Med Sci (Paris). 32(5): 478–484. doi: 10.1051/medsci/20163205014.Le come-back de la mitochondrie dans l’apoptose chez la drosophile
Amandine Clavier,1,2 Aurore Rincheval-Arnold,1 Bernard Mignotte,1,2 and Isabelle Guénal1* 1Laboratoire de génétique et biologie cellulaire, université de Versailles Saint-Quentin-en-Yvelines, université Paris-Saclay, 2, avenue de la Source de la Bièvre, 78180Montigny-le-Bretonneux, France 2Laboratoire de génétique moléculaire et physiologique, École pratique des hautes études, PSL research university, 78180Montigny-le-Bretonneux, France |
Vignette (Photo © Manuel Rojo). La base génétique de la mort cellulaire chez les métazoaires a d’abord été découverte chez Caenorhabditis elegans mais le cœur de la machinerie apoptotique qui comprend les caspases et leurs activateurs ainsi que les membres de la famille Bcl-2 (B-cell lymphoma 2) est conservé chez les mammifères et les insectes (Tableau I). Quel que soit l’organisme considéré, les caspases sont les principaux effecteurs de l’apoptose [1, 2] (→).
Tableau I.
| Protéines de mammifères | Protéines de drosophile | Fonction |
|---|
| OPA1 | OPA1 | Acteur de la dynamique mitochondriale | | Mfn1/Mfn2 | Marf, Fzo | | | Drp1 | Drp1 | |
| | Bax, Bak, Bok, Bid, Bcl-2, Bcl-XL, Mcl-1, etc. | Debcl, Buffy | Membre de la famille Bcl-2 (fonction anti- ou pro-apoptotique) |
| | Smac/Diablo, HtrA2/Omi, ARTS | Rpr, Hid, Grim | Membre de la famille RHG, inhibiteur de IAP |
| | Xiap, cIAP1, cIAP2, survivin | Diap1 | Membre de la famille des IAP, inhibiteur de caspase |
| | Apaf1 | Dark | Activateur de caspase |
| | Caspases 2, 8, 9, 10 | Dronc | Caspase initiatrice |
| | Caspases 3, 6, 7 | Dcp1, Drice | Caspase effectrice |
Comparaison des protéines de mammifères et de drosophile impliquées dans l’apoptose mitochondriale (voir Glossaire). |
(→) Voir la Minisynthèse de S. Gaumer et al., m/s n° 8-9, août-septembre 2002, page 880, et la Synthèse de L. Cabon et al., m/s n° 12, décembre 2013, page 1117
Des signaux opposés modulent leur activité : des protéines adaptatrices, telles Apaf1 (apoptotic protease activating factor 1) chez les mammifères, Ced-4 (cell death protein 4) chez C. elegans, ou Dark (death-associated APAF1-related killer) chez Drosophila melanogaster (Tableau I), les régulent positivement alors qu’un contrôle négatif est assuré par la famille des IAP (inhibitors of apoptosis proteins). Plusieurs stratégies sont donc utilisées pour contrôler l’activité des caspases, mais leur importance varie en fonction de l’organisme considéré. Chez le nématode, Ced-9, un membre anti-apoptotique de la famille Bcl-2, séquestre l’activateur de caspase Ced-4 au niveau des mitochondries et empêche ainsi l’activation de la caspase Ced-3. Dans les cellules de mammifères, de nombreuses protéines régulant l’apoptose agissent au niveau de la mitochondrie ou sont libérées de celle-ci. Chez les mammifères, ce rôle central de la mitochondrie dans l’apoptose est reconnu depuis une vingtaine d’années mais ce n’est que récemment qu’une place a été accordée à cet organite dans les processus apoptotiques chez la drosophile. |
Le cytochrome c n’est pas un acteur majeur de l’apoptose chez la drosophile Dans les cellules de mammifères, en réponse à un stimulus apoptotique, le cytochrome c1 initialement localisé dans l’espace intermembranaire mitochondrial, est libéré dans le cytosol où il va permettre l’activation de la caspase 9 au sein d’un complexe formé avec Apaf1, l’apoptosome. La libération du cytochrome est un phénomène considéré comme essentiel pour l’apoptose chez les vertébrés. Au contraire, chez la drosophile, l’éventuelle libération du cytochrome c au cours de l’apoptose est un sujet de controverse. En effet, bien que les études originelles suggèrent que le cytochrome c serait effectivement libéré de l’espace intermembranaire mitochondrial, il resterait cependant associé à la membrane externe de la mitochondrie [3]. Une étude plus récente met néanmoins en évidence une diffusion rapide du cytochrome c dans le cytosol des cellules en train de mourir [4]. Des différences techniques pourraient expliquer la divergence entre ces observations. Quoiqu’il en soit, à quelques rares exceptions près, le cytochrome c n’est pas requis pour l’apoptose chez la drosophile [4, 5]. Ainsi, étant donnée l’absence de rôle crucial du cytochrome c dans la mort cellulaire chez la drosophile, l’implication de la mitochondrie dans l’apoptose a longtemps été négligée chez cet organisme modèle. L’activité des caspases dans l’apoptose est, dans ce modèle, principalement contrôlée par la protéine anti-apoptotique Diap1 (drosophila inhibitor of apoptosis protein 1), elle-même régulée négativement par les protéines de la famille RHG (Rpr [Reaper], Hid [head involution defective] et Grim). |
Rôle des protéines RHG dans une voie de mort mitochondriale chez la drosophile Chez la drosophile, Diap1 est essentiel à la survie cellulaire. Par ses motifs BIR (baculoviral IAP repeat), Diap1 lie et inhibe les caspases. Ce facteur anti-apoptotique est régulé négativement par les protéines de la famille RHG qui ont un mode d’action similaire à celui de la protéine Smac (second mitochondria-derived activator of caspases, également nommée Diablo) des mammifères. Le mode de régulation de l’activité de ces protéines est toutefois très différent. Smac/Diablo est une protéine mitochondriale qui, à la suite d’un stimulus apoptotique, est libérée dans le cytosol où elle va assurer sa fonction apoptotique. Les RHG sont, quant à elles, régulées à un niveau transcriptionnel (pour Rpr et Grim) ou post-traductionnel (pour Hid). Les RHG présentent peu de similarité entre elles mais possèdent un motif conservé situé à leur extrémité N-terminale appelé IBM (IAP binding motif) (Figure 1). Ce motif est nécessaire pour que les RHG assurent pleinement leurs fonctions pro-apoptotiques [6], en leur permettant de se lier aux motifs BIR de Diap1. Ainsi, par compétition au niveau de BIR, les RHG perturbent l’interaction entre Diap1 et les caspases. Les RHG favorisent l’ubiquitination [7] (→) de Diap1 et donc sa dégradation par le protéasome. En dépit de la forte conservation du motif IBM et de son rôle dans la fonction pro-apoptotique des RHG, de façon intrigante, les protéines Rpr et Grim qui en sont dépourvues, conservent la capacité d’induire la mort cellulaire [8, 9], ce qui suggère qu’une autre région, au moins, de Rpr et Grim permet d’assurer le rôle pro-apoptotique de ces protéines. Un second motif conservé entre Rpr et Grim a en effet été identifié. Ce motif, nommé domaine GH3 (Grim helix 3), correspond à une hélice α amphiphatique2, [8] (Figure 1). Il est requis pour la fonction pro-apoptotique de Rpr et Grim et il est suffisant, in vitro, pour induire la mort cellulaire [8, 10]. De façon intéressante, la localisation de Rpr et Grim, à la mitochondrie, dépend du motif GH3 [8, 10]. En revanche, Hid, qui ne possède pas ce motif, présente à son extrémité C-terminale, une séquence qui permet son adressage à la mitochondrie. Plusieurs études indiquent que la localisation mitochondriale des RHG est importante pour leur fonction pro-apoptotique. Ainsi, une protéine Rpr dépourvue du motif GH3 (Rpr∆GH3) ne se localise pas à la mitochondrie et a une capacité réduite à induire de la mort cellulaire [10]. Bien que Rpr∆GH3 puisse lier les IAP, elle est incapable de stimuler l’ubiquitination et la dégradation de Diap1 [10]. L’ajout d’une séquence d’adressage mitochondriale à la molécule Rpr∆GH3 est toutefois suffisant pour restaurer sa capacité de dégradation de Diap1 et d’induction efficace de mort cellulaire [10]. La dégradation de Diap1, induite par Rpr, requiert donc que ce dernier soit localisé à la mitochondrie où il serait plus actif du fait de la concentration locale de différents régulateurs de l’apoptose (Figure 2). Il a en effet été montré que la caspase initiatrice Dronc (death regulator Nedd2-like caspase), l’équivalent de la caspase-9 des mammifères, et la caspase exécutrice Drice (drosophila ICE [interleukin-1β converting enzyme]), l’équivalent des caspases 3 et 7, se localisent à la mitochondrie (Figure 3). Rpr pourrait donc participer à un complexe multiprotéique, localisé à la mitochondrie, qui régulerait la stabilité de Diap1 et l’activation des caspases. Au-delà de la localisation mitochondriale de Rpr, Hid et Grim, d’autres données soutiennent l’existence d’une voie de mort mitochondriale en aval de ces protéines pro-apoptotiques. Par exemple, une perméabilisation de la membrane externe de la mitochondrie qui dépend des RHG est observée au cours de l’apoptose induite par des dommages à l’ADN dans des embryons de mouches [4]. De même, la surexpression du gène rpr conduit à une chute du potentiel de membrane mitochondriale qui peut-être contrecarrée par la protéine anti-apoptotique Bcl-2 [11]. Ces données suggèrent donc une similitude fonctionnelle entre les RHG de drosophile et les membres de la famille Bcl-2 de mammifères. De plus, le remplacement du motif BH3 (Bcl-2 homology 3) de Bad (une protéine de la famille Bcl-2 pro-apoptotique à BH3 [12]) par le motif GH3 de Grim, n’altère ni la localisation mitochondriale, ni la capacité de Bad à induire la libération de cytochrome c et la mort de cellules de mammifère [13]. Les RHG pourraient donc assurer une fonction comparable à celle des membres de la famille Bcl-2 des mammifères.
 | Figure 1. Lien entre structure des RHG (Reaper, Hid et Grim) et localisation mitochondriale. Outre leur motif IBM (IAP binding motif) amino-terminal (en gris), certains membres de la famille RHG (Rpr et Grim) possèdent une région en hélice appelée domaine GH3 (Grim helix 3) (en vert). Cette région est requise pour leur localisation mitochondriale. Hid possède une séquence d’adressage mitochondriale (riche en acides aminés hydrophobes) en C-terminal (en violet). IAP : inhibitors of apoptosis proteins ; famille RHG : Reaper, Hid et Grim ; IBM : IAP binding motif ; Rpr : Reaper. |
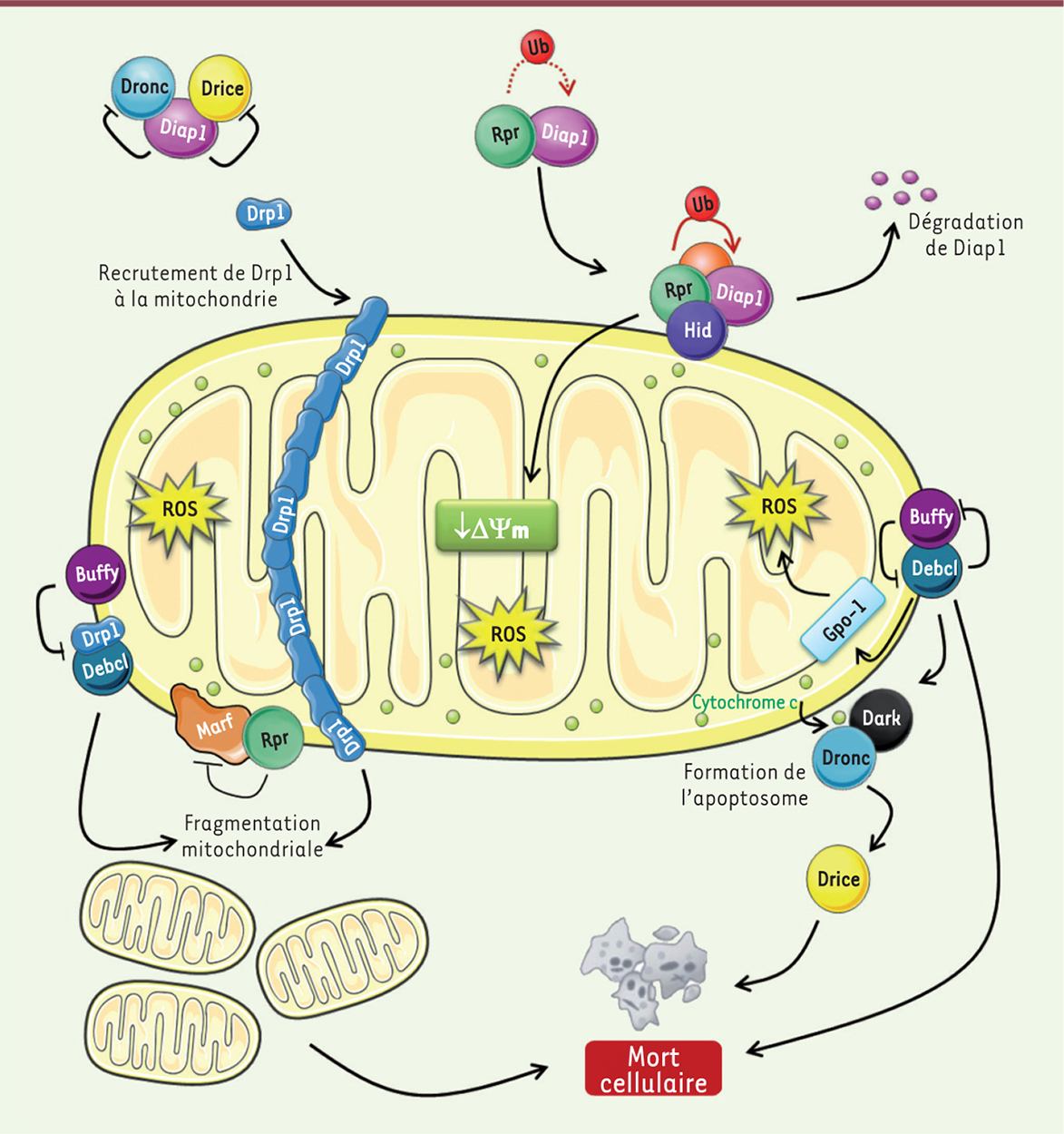
 | Figure 2. Voie de mort mitochondriale chez la drosophile. Le cytochrome c est exposé à la surface mitochondriale en réponse à un stimulus apoptotique. Cette exposition favoriserait la formation d’un apoptosome à proximité de la mitochondrie. Debcl et Buffy, toutes deux mitochondriales, jouent un rôle dans la mort induite par un stress. Gpo-1 (glycérophosphate oxydase-1) participe à la mort cellulaire induite par Debcl en favorisant l’accumulation de ROS (espèces réactives de l’oxygène). Les RHG sont recrutés à la mitochondrie en réponse au stimulus apoptotique. Cette localisation mitochondriale accroît la capacité de Rpr d’induire la dégradation de Diap1 (drosophila inhibitor of apoptosis protein). Rpr peut également altérer le potentiel de membrane mitochondriale (ΔΨm). En outre, Rpr favorise la fragmentation mitochondriale en inhibant la protéine pro-fusion Marf (mitochondrial assembly regulatory factor). Debcl induit également une fragmentation mitochondriale en interagissant avec la protéine pro-fission Drp1 (dynamin-related protein1). Cette fragmentation mitochondriale est requise pour une mort cellulaire efficace. Ub : ubiquitination (voir Glossaire). |
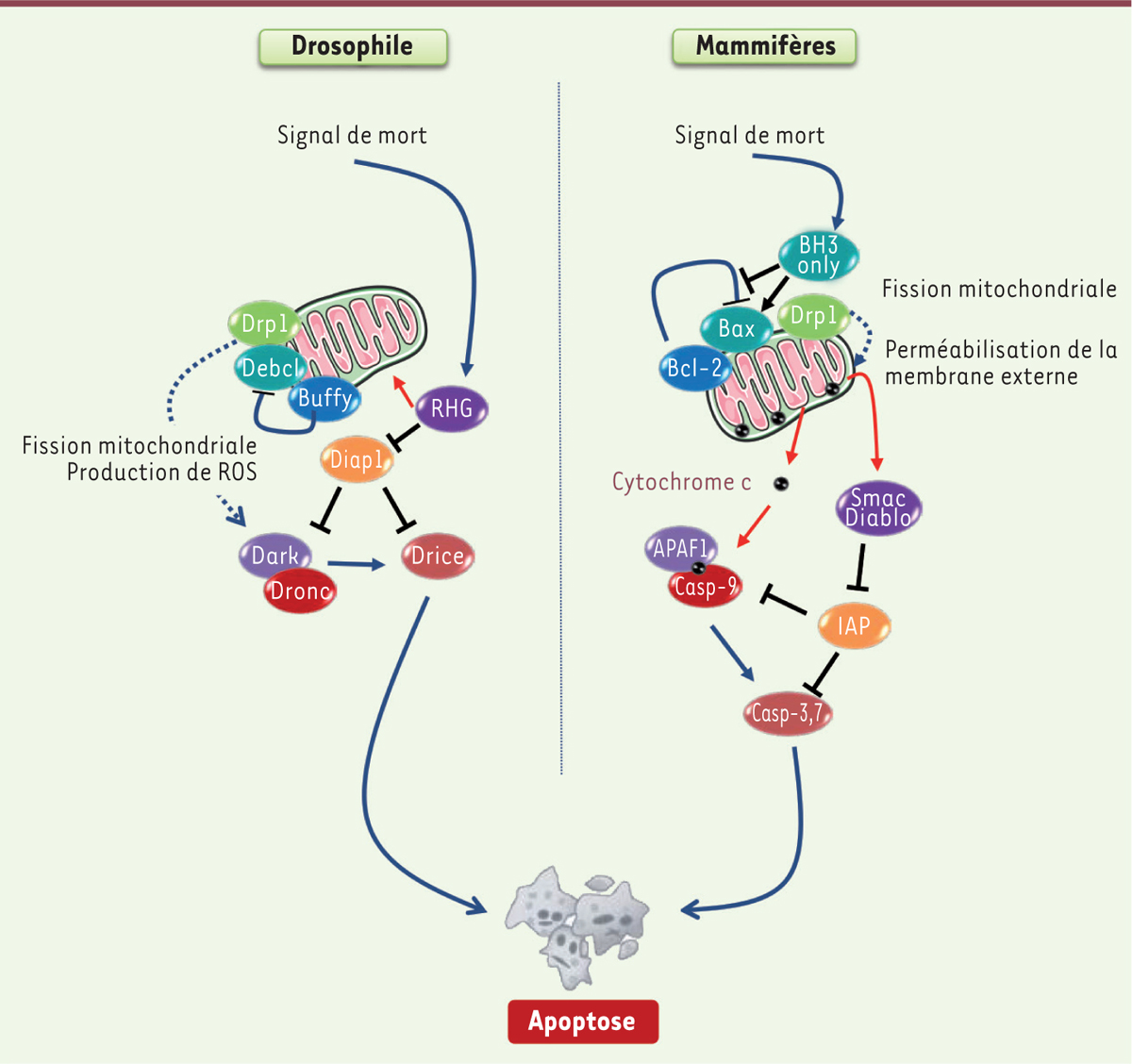
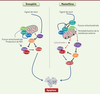 | Figure 3. Comparaison des événements impliqués dans la voie mitochondriale de l’apoptose chez les mammifères et chez la drosophile. Les principaux acteurs de l’apoptose sont conservés entre la drosophile (à gauche) et les mammifères (à droite). Les deux modèles possèdent des caspases (en rouge/orange), des activateurs de caspases (en jaune) et des membres de la famille Bcl-2 (B-cell lymphoma 2) (en bleu) qui peuvent être pro- ou anti-apoptotiques. Chez la drosophile, les liens entre les protéines de la famille Bcl-2 et l’activateur de caspases Dark ne sont pas clairement définis. La drosophile et les mammifères possèdent également des inhibiteurs de caspases (en vert) et des antagonistes de ces inhibiteurs (en violet). La protéine de fission Drp1 (dynamin-related protein1) est en vert. Les flèches rouges indiquent un changement de localisation de la protéine (voir Glossaire). |
(→) Voir la Synthèse de E. Andermarcher et al., m/s n° 2, février 2005, page 141
|
Fonctions de la famille Bcl-2 dans l’apoptose chez la drosophile Dans les cellules de mammifères, en réponse à différents stress, la membrane externe mitochondriale est perméabilisée, ce qui conduit à la libération de plusieurs facteurs pro-apoptotiques. Cette perméabilisation est étroitement contrôlée par la famille Bcl-2, qui comprend des membres pro- et anti-apoptotiques. Étant donné le rôle mineur du cytochrome c dans l’apoptose chez la drosophile, on peut s’interroger sur la place des protéines de la famille Bcl-2 au sein des processus de mort cellulaire chez cet organisme modèle. Deux membres de la famille Bcl-2 ont été identifiés chez la drosophile : Buffy et Debcl (death executioner Bcl-2 homologue) [14, 15]. Debcl et Buffy se localisent pour tout ou partie à la mitochondrie [14, 15]. Les gènes qui les codent, debcl et buffy, sont exprimés de façon dynamique à tous les stades de développement de la mouche [14, 15]. Peu de données concernant la régulation de leur transcription existent. Toutefois, une étude a mis en évidence que le facteur de transcription NF-YB (nuclear factor Y-box B) se liait à la région promotrice du gène debcl pour réguler son expression, au moins dans des cellules en culture. Le niveau de la protéine Debcl est régulé par la voie ubiquitine/protéasome. Slimb (un homologue de la β-TrCP qui permet la reconnaissance des substrats dans le complexe SCF [Skp1-Cullin 1-F-box protein] ubiquitine-E3 ligase) interagit avec Debcl et l’adresse au protéasome [16]. En ce qui concerne Buffy, nous avons montré récemment que Rbf1 (l’homologue chez la drosophile du suppresseur de tumeurs pRb [retinoblastoma protein]) coopère avec le facteur de transcription dE2F23 pour réprimer la transcription du gène buffy pendant le développement [17]. De façon intéressante, les profils d’expression de buffy et de debcl sont corrélés au profil de mort cellulaire dans l’embryon [14], ce qui suggère un rôle de ces gènes dans l’apoptose chez la drosophile. De même, l’expression ectopique de debcl induit la mort cellulaire [15] alors que la surexpression de buffy sauve de la mort induite par les RHG [14]. Debcl apparaît donc avoir une activité pro-apoptotique tandis que Buffy assurerait des fonctions anti-apoptotiques. En réalité, Debcl et Buffy ont tous deux des fonctions pro- et anti-survie cellulaire. En effet, l’expression de debcl, supposé pro-apoptotique, protège en fait les neurones de la toxicité des protéines à polyglutamines, et, inversement, celle de buffy, qui serait anti-apoptotique, favorise cette dégénérescence neuronale [18]. Debcl et Buffy ne sont pas essentiels à la plupart des morts cellulaires développementales [19], leur rôle est restreint à certains tissus et à certains stades de développement [20]. En revanche, ils jouent un rôle important dans la mort cellulaire induite par un stress. En effet, Debcl et Buffy modulent la réponse apoptotique embryonnaire provoquée par irradiation [19]. Par ailleurs, Debcl joue un rôle crucial dans l’apoptose induite par Rbf1 alors que Buffy s’y oppose [17, 21]. Ainsi, chez la drosophile, bien que le rôle des protéines de la famille Bcl-2 dans le contrôle de la mort cellulaire développementale apparaisse mineur, ces protéines semblent jouer un rôle majeur dans l’apoptose induite par un stress ou par l’homologue, chez la drosophile, de la protéine oncosuppressive pRb. Debcl interagit physiquement avec Buffy [14]. Il est donc probable que ces deux protéines agissent comme leurs homologues de mammifères, en se liant l’une à l’autre et en se neutralisant mutuellement. Des données génétiques confirment cette hypothèse. En effet, la surexpression de buffy inhibe la mort induite par Debcl [14] et des expériences de coexpression de buffy et debcl indiquent que Buffy doit inactiver Debcl pour pouvoir induire la dégénérescence des neurones en réponse aux protéines à polyglutamines [18]. Toutefois, buffy et debcl peuvent, dans de rares cas, coopérer pour induire la mort cellulaire [20]. Bien que cela n’ait pas été aujourd’hui mis en évidence, il est envisageable que des modifications post-traductionnelles, telles que celles qui ont été décrites pour Bcl-2 chez les mammifères, puissent contrôler les activités pro- ou anti-apoptotiques de Debcl et Buffy. Jusqu’à récemment, les bases moléculaires de l’apoptose induite par Debcl étaient peu décrites et les quelques informations présentes dans la littérature étaient souvent contradictoires. En effet, selon l’étude considérée, la mort induite par debcl peut être totalement, partiellement, ou même pas du tout, inhibée par un inhibiteur de caspases [15, 22, 23]. Debcl pourrait donc induire la mort cellulaire selon des voies qui seraient dépendantes ou indépendantes des caspases. Bien que ceci n’ait pas été systématiquement testé, les RHG ne semblent pas nécessaires pour la mort induite par Debcl. Inversement, Debcl ne serait pas impliqué dans l’activité pro-apoptotique des RHG. Nos travaux ont récemment permis une avancée significative dans la compréhension du mode d’action de Debcl. Nous avons réalisé un crible génétique dans le but d’identifier des modificateurs de la mort cellulaire induite par Debcl. Nous avons pu ainsi montrer que la glycérophosphate oxydase-1 (Gpo-1), une oxydoréductase participant au métabolisme des glycérophospholipides, participe à l’apoptose induite par Debcl en modulant l’accumulation d’espèces réactives de l’oxygène (ROS) [24] (Figure 2). Le stress oxydant mitochondrial joue donc un rôle important dans la mort cellulaire induite par Debcl. Debcl pourrait ainsi être à l’origine d’une altération du fonctionnement, ou de la dynamique, mitochondriale. |
Il existe, chez la drosophile, un lien étroit entre la dynamique mitochondriale, la famille Bcl-2 et la mort cellulaire Les mitochondries existent sous la forme d’un réseau qui se fragmente précocement au cours du processus de mort cellulaire, chez les mammifères et chez la drosophile [4, 25–27]. La dynamique mitochondriale est donc altérée au cours de l’apoptose [28] (→).
(→) Voir la Synthèse de C. Castanier et D. Arnoult, m/s n° 10, octobre 2010, page 830
Les molécules impliquées dans la fission et la fusion de ces organites ont été identifiées et sont conservées au cours de l’évolution. Ces processus impliquent plusieurs GTPases de la famille de la dynamine : OPA1 (optic atrophy type 1) et les mitofusines (Marf et Fuzzy onions, chez la drosophile, et Mfn1 [mitofusin1] et Mfn2, chez les mammifères), qui sont impliquées dans la fusion mitochondriale, alors que Drp1 (dynamin-related protein1) est le principal effecteur de la fission mitochondriale [29] (→).
(→) Voir la Synthèse de C. Sauvanet et al., m/s n° 10, octobre 2010, page 823
Il existe plusieurs arguments en faveur d’un rôle actif de la fragmentation mitochondriale dans la régulation de l’apoptose. Quelle que soit l’espèce considérée, l’inhibition des caspases ne bloque pas cette fragmentation [25, 27]. En revanche, l’inhibition de drp1 empêche l’activation des caspases et la mort cellulaire, là encore, que ce soit chez la drosophile ou dans des cellules de mammifères [4, 25]. La fission mitochondriale semble donc nécessaire pour l’activation des caspases et l’apoptose. Toutefois, ces expériences n’excluent pas l’existence d’une fonction de Drp1 dans le processus de mort cellulaire qui soit indépendante de son rôle dans la dynamique mitochondriale. La déplétion des mitofusines, ou au contraire leur surexpression, module la réponse des cellules à l’apoptose [30, 31] et Rpr induit la fragmentation mitochondriale en liant et en inhibant la protéine pro-fusion Marf (mitochondrial assembly regulatory factor) [31] (Figure 2). Cette perturbation de la dynamique mitochondriale est nécessaire à l’activité pro-apoptotique de Rpr. Chez les mammifères, les protéines de la famille Bcl-2 modulent également la dynamique mitochondriale et cette activité est importante pour la régulation de l’apoptose. Chez la drosophile, il existe beaucoup moins de données sur un lien éventuel entre les membres de la famille Bcl-2 et la dynamique mitochondriale. La perte de fonction de debcl n’induit pas, in vivo, de défauts d’organisation des mitochondries dans les cellules vivantes [26]. En revanche, l’expression de buffy supprime les changements mitochondriaux associés à l’apoptose induite par la perte de fonction de pink1 [32], un gène codant une kinase mitochondriale dont la perte de fonction, chez l’homme, est associée à la maladie de Parkinson. Buffy et Debcl sont, par ailleurs, requis pour la mort des cellules nourricières au cours de l’ovogenèse où la perte de fonction de debcl ou de buffy conduit à une élongation du réseau mitochondrial [20]. Chez la drosophile, un lien existe entre les membres de la famille Bcl-2, la dynamique mitochondriale et la mort cellulaire. Nous avons récemment montré que Debcl et Drp1 pouvaient interagir entre eux et que Buffy inhibait cette interaction (Figure 2) [21]. De façon intéressante, Debcl module la localisation mitochondriale de Drp1 au cours de l’apoptose et l’apoptose induite par Debcl, nécessite Drp1 et implique une fragmentation mitochondriale. Cette altération de la dynamique mitochondriale induite par Debcl déclenche une accumulation de ROS qui sont eux-mêmes nécessaires au déclenchement de l’apoptose [21]. Ces résultats permettent donc d’identifier un mécanisme par lequel Debcl peut contrôler l’apoptose. Ils établissent le lien, in vivo, entre les membres de la famille Bcl-2 et la dynamique mitochondriale au cours de la mort cellulaire chez la drosophile. |
Contrairement à ce que laissaient présager les premières études concernant les mécanismes d’apoptose chez la drosophile, la mitochondrie a une place de choix dans la mort cellulaire chez cet organisme modèle. Toutefois, à l’inverse de ce qui est observé dans des cellules de mammifères, chez la drosophile, peu de protéines semblent être libérées de la mitochondrie pendant les phases précoces du processus apoptotique. L’existence d’une perméabilisation de la membrane externe mitochondriale reste, aujourd’hui encore, un sujet de débat. Néanmoins, plusieurs protéines mitochondriales sont impliquées dans le programme de mort cellulaire chez cet insecte et diverses protéines, dont les RHG, sont recrutées à la mitochondrie en condition apoptotique. Il a été proposé que la cascade apoptotique soit, en quelque sorte, inversée entre la drosophile et les mammifères : chez les mammifères, les acteurs de l’apoptose sont libérés depuis la mitochondrie dans le cytosol alors que, chez la drosophile, les régulateurs de l’apoptose subiraient une relocalisation inverse, se concentrant dans, ou à proximité de la mitochondrie, pendant l’apoptose (Figure 3) [33]. Que ce soit chez la drosophile ou les mammifères une fragmentation mitochondriale est observée durant le processus apoptotique. L’implication des protéines de la machinerie de fission/fusion des mitochondries dans la voie de mort mitochondriale semble être conservée entre les deux espèces (Figure 3). La mitochondrie apparaît donc aujourd’hui au cœur de la régulation du processus de mort cellulaire chez la drosophile. L’altération de la dynamique mitochondriale pourrait constituer chez les mammifères, le nématode, et les insectes, un élément clé de l’activation des caspases et donc de la mort cellulaire. Les différences observées entre drosophile et mammifères pourraient représenter une certaine variabilité des voies d’apoptose mitochondriale due à une vitesse d’évolution relativement rapide des ecdysozoaires (clade des protostomiens dont font partie C. elegans et D. melanogaster chez lesquels le développement s’effectue par une ou plusieurs mues cuticulaires). Il se pourrait également que la voie mitochondriale de l’apoptose, impliquant la perméabilisation de la membrane mitochondriale externe, soit apparue très tôt au cours de l’évolution [34] (→), mais qu’elle ait été perdue chez certains ecdysozoaires [35, 36]. Le rôle conservé des protéines de la famille Bcl-2 dans la dynamique mitochondriale pourrait alors représenter un vestige de cette voie. Quoi qu’il en soit, certaines différences qui semblent exister aujourd’hui entre les voies de mort mitochondriale chez ces différentes espèces pourraient aussi refléter l’état encore incomplet de nos connaissances. La drosophile est un système modèle de choix pour comprendre les maladies humaines impliquant une voie de mort mitochondriale, ou associées à une altération du fonctionnement mitochondrial [37–39]. La poursuite des études sur la contribution de la mitochondrie dans l’apoptose chez la drosophile pourrait bien nous révéler encore d’autres aspects de la mort cellulaire programmée impliqués dans des pathologies.
(→) Voir la synthèse de B. Mignotte et al. m/s n° 1, janvier 1998, page 54
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Les auteurs remercient A. Aouacheria pour les fructueuses discussions sur l’évolution des voies mitochondriales d’apoptose.
|
| Apaf1 | apoptotic protease activating factor 1 |
| ARTS | apoptosis-related protein in the TGF-beta signalling pathway |
| Bak | Bcl-2 homologous antagonist/killer |
| Bax | Bcl-2-associated X protein |
| Bcl-2 | B-cell lymphoma 2 |
| Bcl-XL | B-cell lymphoma-extra large |
| Bid | BH3 [Bcl-2 homology domain 3] interacting-domain death agonist |
| Bok | Bcl-2 related ovarian killer |
| Casp | caspase |
| cIAP | cellular inhibitor of apoptosis |
| Dark | death-associated APAF1-related killer |
| Dcp1 | drosophila caspase-1 |
| Debcl | death executioner Bcl-2 homologue |
| Diap1 | death-associated inhibitor of apoptosis 1 |
| Drice | Drosophila ICE [interleukin-1β converting enzyme] |
| Dronc | death regulator Nedd2-like caspase |
| Drp1 | dynamin-related protein1 |
| Fzo | fuzzy onion |
| Hid | head involution defective |
| HtrA2/Omi | HtrA [high temperature requirement A] serine peptidase 2 |
| IAP | inhibitors of apoptosis proteins |
| Marf | mitochondrial assembly regulatory factor |
| Mcl-1 | myeloid cell leukemia 1 |
| Mfn1/Mfn2 | mitofusin 1/2 |
| OPA1 | optic atrophy type 1 |
| RHG | Rpr, Hid, Grim |
| ROS | reactive oxygen species |
| Rpr | Reaper |
| Smac/Diablo | second mitochondria-derived activator of caspases |
| Ub | ubiquitination |
| Xiap | X-linked inhibitor of apoptosis protein |
|
Footnotes |
1.
Gaumer S, Guénal I, Brun S, Mignotte B. L’apoptose chez la drosophile : conservation et originalité . Med Sci (Paris). 2002; ; 18 : :875.–880. 2.
Cabon L, Martinez-Torres CA, Susin SA. La mort cellulaire programmée ne manque pas de vocabulaire . Med Sci (Paris). 2013; ; 29 : :1117.–1124. 3.
Varkey J, Chen P, Jemmerson R, Abrams JM. Altered cytochrome c display precedes apoptotic cell death in Drosophila . J Cell Biol. 1999; ; 144 : :701.–710. 4.
Abdelwahid E, Yokokura T, Krieser RJ, et al. Mitochondrial disruption in Drosophila apoptosis . Dev Cell. 2007; ; 12 : :793.–806. 5.
Dorstyn L, Mills K, Lazebnik Y, Kumar S. The two cytochrome c species, DC3 and DC4, are not required for caspase activation and apoptosis in Drosophila cells . J Cell Biol. 2004; ; 167 : :405.–410. 6.
Wing JP, Schwartz LM, Nambu JR. The RHG motifs of Drosophila Reaper and Grim are important for their distinct cell death-inducing abilities . Mech Dev. 2001; ; 102 : :193.–203. 7.
Andermarcher E, Bossis G, Farras R, Jariel-Encontre I et Piechaczyk M. La dégradation protéasomique : de l’adressage des protéines aux nouvelles perspectives thérapeutiques . Med Sci (Paris). 2005; ; 21 : :141.–149. 8.
Claveria C, Caminero E, Martinez AC, et al. GH3, a novel proapoptotic domain in Drosophila Grim, promotes a mitochondrial death pathway . EMBO J. 2002; ; 21 : :3327.–3336. 9.
Chen P, Ho SI, Shi Z, Abrams JM. Bifunctional killing activity encoded by conserved reaper proteins . Cell Death Differ. 2004; ; 11 : :704.–713. 10.
Olson MR, Holley CL, Gan EC, et al. A GH3-like domain in reaper is required for mitochondrial localization and induction of IAP degradation . J Biol Chem. 2003; ; 278 : :44758.–44768. 11.
Brun S, Rincheval V, Gaumer S, et al. Reaper and bax initiate two different apoptotic pathways affecting mitochondria and antagonized by bcl-2 in Drosophila . Oncogene. 2002; ; 21 : :6458.–6470. 12.
Aouacheria A, Combet C, Tompa P, Hardwick JM. Redefining the BH3 death domain as a short linear motif . Trends Biochem Sci. 2015; ; 40 : :736.–748. 13.
Claveria C, Martinez AC, Torres M. A Bax/Bak-independent mitochondrial death pathway triggered by Drosophila Grim GH3 domain in mammalian cells . J Biol Chem. 2004; ; 279 : :1368.–1375. 14.
Quinn L, Coombe KM, Tasman D, et al. Buffy, a Drosophila Bcl-2 protein, has anti-apoptotic and cell cycle inhibitory functions . EMBO J. 2003; ; 22 : :3568.–3579. 15.
Brachmann CB, Jassim OW, Wachsmuth BD, Cagan RL. The Drosophila bcl-2 family member dBorg-1 functions in the apoptotic response to UV-irradiation . Curr Biol. 2000; ; 10 : :547.–550. 16.
Colin J, Garibal J, Clavier A, et al. The drosophila Bcl-2 family protein Debcl is targeted to the proteasome by the beta-TrCP homologue slimb . Apoptosis. 2014; ; 19 : :1444.–1456. 17.
Clavier A, Baillet A, Rincheval-Arnold A, et al. The pro-apoptotic activity of Drosophila Rbf1 involves dE2F2-dependent downregulation of diap1 and buffy mRNA . Cell Death Dis. 2014; ; 5 : :e1405.. 18.
Senoo-Matsuda N, Igaki T, Miura M. Bax-like protein Drob-1 protects neurons from expanded polyglutamine-induced toxicity in Drosophila . EMBO J. 2005; ; 24 : :2700.–2713. 19.
Sevrioukov EA, Burr J, Huang EW, et al. Drosophila Bcl-2 proteins participate in stress-induced apoptosis, but are not required for normal development . Genesis. 2007; ; 45 : :184.–193. 20.
Tanner EA, Blute TA, Brachmann CB, McCall K. Bcl-2 proteins and autophagy regulate mitochondrial dynamics during programmed cell death in the Drosophila ovary . Development. 2011; ; 138 : :327.–338. 21.
Clavier A, Ruby V, Rincheval-Arnold A, et al. The Drosophila retinoblastoma protein, Rbf1, induces a debcl and drp1-dependent mitochondrial apoptosis . J Cell Sci. 2015; ; 128 : :3239.–3249. 22.
Igaki T, Kanuka H, Inohara N, et al. Drob-1, a Drosophila member of the bcl-2/CED-9 family that promotes cell death . Proc Natl Acad Sci USA. 2000; ; 97 : :662.–667. 23.
Colussi PA, Quinn LM, Huang DC, et al. Debcl, a proapoptotic Bcl-2 homologue, is a component of the Drosophila melanogaster cell death machinery . J Cell Biol. 2000; ; 148 : :703.–714. 24.
Colin J, Garibal J, Clavier A, et al. Screening of suppressors of bax-induced cell death identifies glycerophosphate oxidase-1 as a mediator of debcl-induced apoptosis in Drosophila . Genes Cancer. 2015; ; 6 : :241.–253. 25.
Frank S, Gaume B, Bergmann-Leitner ES, et al. The role of dynamin-related protein 1, a mediator of mitochondrial fission, in apoptosis . Dev Cell. 2001; ; 1 : :515.–525. 26.
Galindo KA, Lu WJ, Park JH, Abrams JM. The Bax/Bak ortholog in Drosophila, Debcl, exerts limited control over programmed cell death . Development. 2009; ; 136 : :275.–283. 27.
Goyal G, Fell B, Sarin A, et al. Role of mitochondrial remodeling in programmed cell death in Drosophila melanogaster . Dev Cell. 2007; ; 12 : :807.–816. 28.
Castanier C, Arnoult D. Dynamique mitochondriale : de la géométrie à la fonction des mitochondries . Med Sci (Paris). 2010; ; 26 : :830.–835. 29.
Sauvanet C, Arnaune-Pelloquin L, David C, et al. Dynamique et morphologie mitochondriales - Acteurs, mécanismes et pertinence fonctionnelle . Med Sci (Paris). 2010; ; 26 : :823.–829. 30.
Lee YJ, Jeong SY, Karbowski M, et al. Roles of the mammalian mitochondrial fission and fusion mediators Fis1, Drp1, and Opa1 in apoptosis . Mol Biol Cell. 2004; ; 15 : :5001.–5011. 31.
Thomenius M, Freel CD, Horn S, et al. Mitochondrial fusion is regulated by Reaper to modulate Drosophila programmed cell death . Cell Death Differ. 2011; ; 18 : :1640.–1650. 32.
Park J, Lee SB, Lee S, et al. Mitochondrial dysfunction in Drosophila PINK1 mutants is complemented by parkin . Nature. 2006; ; 441 : :1157.–1161. 33.
Estaquier J, Vallette F, Vayssiere JL, Mignotte B. The mitochondrial pathways of apoptosis . Adv Exp Med Biol. 2012; ; 942 : :157.–183. 34.
Mignotte B, Zamzami N, Petit P, et al. Contrôle mitochondrial de l’apoptose : la mort cellulaire programmée est-elle apparue à la suite de l’événement endosymbiotique à l’origine des mitochondries ? . Med Sci (Paris). 1998; ; 14 : :54.–60. 35.
Oberst A, Bender C, Green DR. Living with death: the evolution of the mitochondrial pathway of apoptosis in animals . Cell Death Differ. 2008; ; 15 : :1139.–1146. 36.
Lee EF, Clarke OB, Evangelista M, et al. Discovery and molecular characterization of a Bcl-2-regulated cell death pathway in schistosomes . Proc Natl Acad Sci USA. 2011; ; 108 : :6999.–7003. 37.
Abdelwahid E, Rolland S, Teng X, et al. Mitochondrial involvement in cell death of non-mammalian eukaryotes . Biochim Biophys Acta. 2011; ; 1813 : :597.–607. 38.
Bueler H. Mitochondrial dynamics, cell death and the pathogenesis of Parkinson’s disease . Apoptosis. 2010; ; 15 : :1336.–1353. 39.
Guo M. Drosophila as a model to study mitochondrial dysfunction in Parkinson’s disease . Cold Spring Harb Perspect Med. 2012; ; 2 : :a009944.. |