| |
| Med Sci (Paris). 32(6-7): 547–550. doi: 10.1051/medsci/20163206006.Un circuit impliqué dans les démangeaisons mécaniques identifié au niveau de la moelle épinière Steeve Bourane1* 1Molecular Neurobiology Laboratory, The Salk Institute for Biological Studies, 10010 North Torrey Pines Road, La Jolla, CA 92037, États-Unis MeSH keywords: Animaux, Interneurones, Phénomènes mécaniques, Souris, Souris transgéniques, Réseau nerveux, Neuropeptide Y, Stimulation physique, Prurit, Moelle spinale, métabolisme, physiologie, étiologie, cytologie |
Les informations sensorielles telles que la douleur, la température, le toucher et les démangeaisons sont initialement détectées au niveau de la peau, des muscles et/ou des organes internes par les neurones périphériques des ganglions rachidiens dorsaux1,. Elles sont transmises à la moelle épinière où elles sont traitées par des réseaux neuronaux complexes. Dans la corne dorsale de la moelle épinière1, il existe un grand nombre d’interneurones distincts, excitateurs ou inhibiteurs, qui intègrent et modulent l’information sensorielle avant sa transmission au cerveau. Les changements pathologiques affectant ces réseaux neuronaux peuvent notamment conduire à des douleurs et démangeaisons chroniques qui sont à l’origine de problèmes cliniques majeurs pour lesquels peu de thérapies efficaces sont disponibles. L’étude et la caractérisation de ces réseaux spinaux2 représentent donc une nécessité pour le développement de nouvelles stratégies thérapeutiques. |
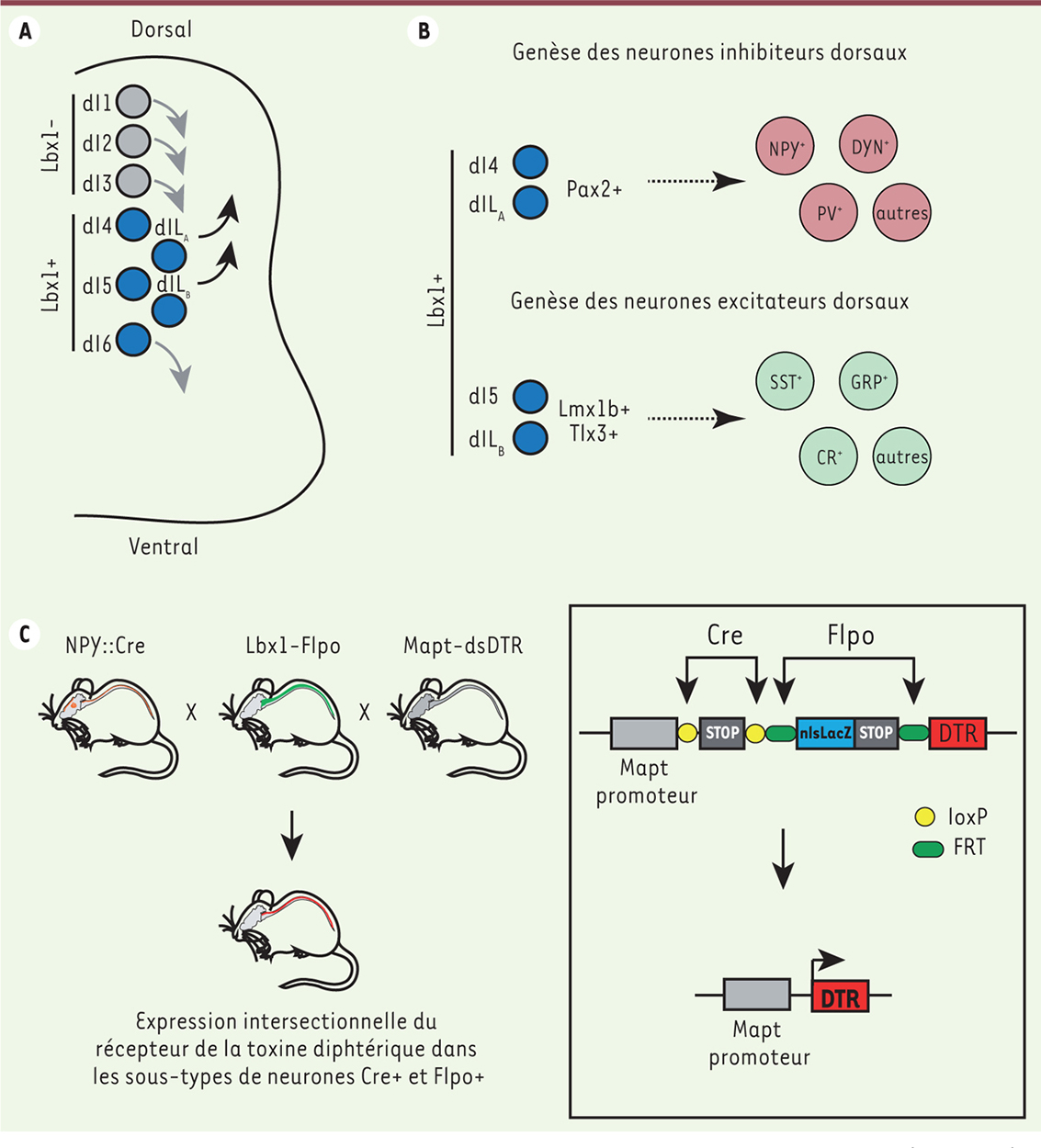
Diversité neuronale au sein de la corne dorsale de la moelle épinière La corne dorsale de la moelle épinière contient une multitude de types neuronaux distincts organisés en couches ou laminae. Au cours du développement embryonnaire, huit groupes de progéniteurs neuronaux, produisant huit types d’interneurones dorsaux différents, ont pu être identifiés par l’expression combinatoire de facteurs de transcription. Les populations neuronales ainsi formées sont nommées dI (dorsal interneuron) : dI1 à dI6, dILA et dILB. Ces neurones sont classiquement divisés en 2 groupes selon l’expression post-mitotique du facteur de transcription Lbx1 (Ladybird homeobox 1) : les dI1 à 3 sont Lbx1-négatifs (-) ; les dI4 à 6, dILA et dILB sont Lbx1-positifs (+) [1, 2]. Une fois générés, les neurones des groupes dI1 à 3 et dI6 migreront ventralement pour former les couches profondes de la moelle épinière alors que les neurones des groupes dI4, dI5, dILA et dILB vont migrer dorsalement pour former les couches superficielles de la corne dorsale (Figure 1A). Les neurones Lbx1+ des couches superficielles peuvent de plus être subdivisés en deux sous-groupes grâce à l’expression différentielle de facteurs de transcription et la nature excitatrice ou inhibitrice de leur neurotransmetteur. Ainsi les neurones dI4 et dILA, qui expriment le facteur de transcription Pax2 (paired box 2), produisent les différents sous-types de neurones inhibiteurs, alors que les neurones dI5 et dILB, exprimant les facteurs de transcription Lmx1b (LIM homeobox transcription factor 1-beta) et Tlx3 (T-cell leukemia homeobox 3), donnent naissance aux différents sous-types de neurones excitateurs de la corne dorsale de la moelle épinière (Figure 1B).
 | Figure 1.
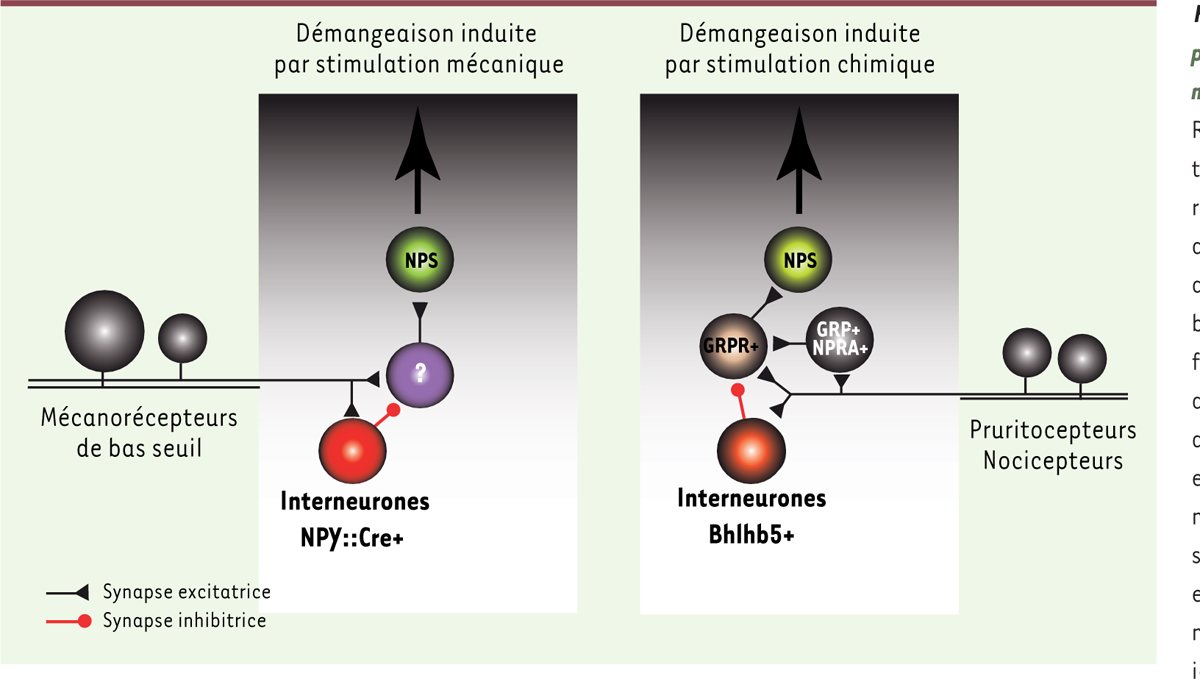
Établissement de la diversité neuronale au sein de la corne dorsale de la moelle épinière et utilisation d’une approche de génétique intersectionnelle pour son étude. A. Les neurones de la corne dorsale de la moelle épinière sont générés à partir de huit groupes distincts d’interneurones au cours du développement embryonnaire : dI1 à dI6, dILA et dILB. L’expression post-mitotique du facteur de transcription Lbx1 permet de les diviser en deux groupes : a) Lbx1-négatif : dI1 à dI3 et b) Lbx1-positif : dI4 à dI6, dILA et dILB. Les neurones des groupes dI1 à dI3 et dI6 migreront ventralement pour former les couches profondes de la moelle épinière alors que les neurones des groupes dI4, dI5, dILA et dILB formeront les couches superficielles. B. Les neurones post-mitotiques exprimant Lbx1 formant les couches superficielles peuvent être ensuite divisés en deux sous-groupes distincts : les neurones inhibiteurs exprimant le facteur de transcription Pax2 (dI4 et dILA) et les neurones excitateurs exprimant les facteurs de transcription Lmx1b et Tlx3 (dI5 et dILB). L’expression de neuropeptides, de protéines liant le calcium et d’autres marqueurs permettent de diviser ces deux groupes en plusieurs sous-types au stade adulte. C. Le croisement entre des souris génétiquement modifiées exprimant (i) la Cre recombinase sous le contrôle du gène NPY, (ii) la Flpo recombinase sous le contrôle du gène Lbx1 et (iii) le récepteur à la toxine diphtérique précédé de deux cassettes STOP (dépendantes de la Cre et la Flpo, Mapt-dsDTR) permet de restreindre l’expression du récepteur aux sous-types de neurones inhibiteurs de la corne dorsale de la moelle épinière exprimant à la fois la NPY::Cre et la Lbx1-Flpo. Le système de recombinaison Flp-FRT est équivalent au système Cre-lox, la recombinase Flpo, issue de la levure, ciblant les séquences FRT. dI : dorsal interneuron ; Lbx1 : Ladybird homeobox 1 ; Pax2 : paired box 2 ; Lmx1b : LIM homeobox transcription factor 1-beta ; Tlx3 : T-cell leukemia homeobox 3 ; NPY : neuropeptide Y ; DYN : dynorphine ; PV : parvalbumine ; SST : somatostatine ; GRP : gastrin releasing peptide ; CR : calrétinine ; DTR : diphtheria toxin receptor ; Mapt : microtubule-associated protein tau ; FRT : flippase recognition target ; nlsLacZ : nuclear location signal ß-galactosidase. |
Au cours des dernières années, diverses approches expérimentales, comme des analyses morphologiques, électrophysiologiques et immunohistochimiques, ont été utilisées afin de caractériser ces différents sous-types d’interneurones dorsaux. Cependant, aucune classification claire n’a pu se dégager afin d’établir leur rôle fonctionnel. Néanmoins, plusieurs populations ont pu être identifiées chez l’adulte sur la base de l’expression de neuropeptides et de diverses protéines. Ainsi certains neuropeptides (comme la somatostatine, la substance P ou la neurotensine) ou des protéines fixant le calcium (la calbindine et la calrétinine) ont été identifiés dans des sous-types d’interneurones excitateurs alors que d’autres (le neuropeptide Y [NPY], la galanine, la parvalbumine) sont majoritairement exprimés dans des sous-types de neurones inhibiteurs [3, 4] (Figure 1B). |
La génétique intersectionnelle pour l’étude fonctionnelle des sous-populations d’interneurones de la corne dorsale de la moelle épinière Ces différentes classes d’interneurones dorsaux représentent-elles des populations fonctionnelles distinctes ? Sont-elles impliquées dans la formation de circuits spinaux spécifiquement impliqués dans la douleur, le toucher, les démangeaisons ? Répondre formellement à ces questions resta longtemps un véritable challenge du fait de cette diversité neuronale et du manque d’outils génétiques permettant, d’une part, d’analyser les propriétés propres à chacune de ces sous-populations et, d’autre part, de disséquer les circuits entremêlés au sein de la corne dorsale de la moelle épinière. Grâce aux connaissances acquises sur le développement embryonnaire combinées à l’identification de nouveaux marqueurs moléculaires, nous avons développé une stratégie dite de « génétique intersectionnelle3 » (Figure 1C) qui permet de manipuler génétiquement la plupart de ces interneurones. Il est en effet maintenant possible de spécifiquement les visualiser, les éliminer, les activer, les rendre fonctionnellement silencieux ou encore de déterminer leur connectivité. L’utilisation de ce type d’approche a permis récemment d’identifier, au sein de la corne dorsale de la moelle épinière, un circuit neuronal spécifiquement impliqué dans le contrôle des démangeaisons induites par des stimuli mécaniques légers, non douloureux [5]. |
Les interneurones exprimant le neuropeptide NPY Afin de caractériser les fonctions des interneurones Lbx1+/NPY+ des couches superficielles de la moelle épinière, nous avons utilisé des animaux transgéniques qui expriment la Cre recombinase4 sous le contrôle du promoteur du gène NPY (NPY::Cre). En les croisant avec une souris reportrice, nous avons observé que les neurones Cre+ sont majoritairement localisés dans les couches III/IV de la corne dorsale de la moelle épinière, et confirmé qu’ils sont principalement de type inhibiteur. Nous les avons ensuite sélectivement ciblés en y exprimant le récepteur pour la toxine diphtérique, puis spécifiquement éliminés au stade adulte en injectant la toxine aux souris. De manière frappante, deux semaines après l’ablation des neurones NPY::Cre+ au niveau de la corne dorsale de la moelle épinière, les souris développent des démangeaisons chroniques, avec comme conséquence visible, l’apparition de plaies au niveau de leur pelage. Il existe deux grands types de démangeaisons : celles induites par des stimuli mécaniques légers (comme la présence de fibres de laine d’un pullover ou le déplacement d’un insecte sur notre peau) et celles induites chimiquement (suite à une piqûre de moustique ou lors de réactions allergiques). Chez les animaux dépourvus d’interneurones NPY+ soumis, avant l’apparition de leur symptômes, soit à une stimulation chimique (injection d’agents chimiques irritants dans la peau) soit à une stimulation mécanique (utilisation d’une sonde mécanique délivrant une stimulation tactile au niveau du pelage), une nette augmentation de la fréquence des démangeaisons, chez les souris transgéniques par rapport aux souris contrôles, n’est observée que dans le second cas, suggérant que la population d’interneurones NPY+ est impliquée dans un circuit neuronal contrôlant spécifiquement les démangeaisons mécaniques. Ces résultats ont été confirmés en utilisant une autre stratégie permettant, non pas d’éliminer les neurones NPY::Cre+, mais de les rendre transitoirement fonctionnellement silencieux. Les souris dépourvues d’interneurones NPY::Cre+ ne présentent pas de défaut majeur dans leur réponse aux stimulus douloureux, qu’ils soient d’origine mécanique, chimique ou thermique. Il existe donc des circuits spécifiques au niveau de la corne dorsale de la moelle épinière, les interneurones NPY+ participant au circuit contrôlant les démangeaisons mécaniques mais pas à celui contrôlant les douleurs mécaniques, qui est, lui, constitué d’interneurones dorsaux exprimant le peptide opioïde dynorphine [6]. |
Différents circuits spinaux sont impliqués pour les démangeaisons chimiques et mécaniques Afin de déterminer si, plus généralement, le circuit spinal contrôlant les démangeaisons mécaniques utilisait les mêmes voies neuronales que celles intervenant dans le contrôle des démangeaisons chimiques, les souris dépourvues de neurones NPY::Cre+ ont été traitées avec des agents antihistaminiques qui apaisent les démangeaisons chimiques. Dans ce cas, aucune diminution significative de la fréquence des démangeaisons induites mécaniquement n’est observée. Le circuit des démangeaisons mécaniques ne dépend donc pas des histamines, conformément à ce qui avait été suggéré chez l’homme [7]. Une population d’interneurones dorsaux exprimant GRPR, le récepteur au GRP (gastrin-releasing peptide), a récemment été identifiée comme intervenant dans le contrôle spinal des démangeaisons chimiques [8–10] (→).
(→) Voir la Synthèse de L. Misery, m/s n° 12, décembre 2014, page 1123
En utilisant un antagoniste de GRPR, ou en éliminant les interneurones GRPR+ chez nos animaux dépourvus de neurones NPY+, aucune diminution des démangeaisons induites mécaniquement n’a été observée. L’ensemble de ces données indique donc que les informations sensorielles activant les circuits neuronaux impliquant les interneurones NPY+ et contrôlant les démangeaisons mécaniques, transitent vers le cerveau par des voies différentes de celles activées pour induire les démangeaisons chimiques. |
Mécanisme d’inhibition des démangeaisons mécaniques La caractérisation des interneurones NPY+ et plus généralement du circuit spinal contrôlant les démangeaisons mécaniques, a été entreprise grâce à l’injection de traceurs trans-synaptiques5 dans la peau, pour identifier les neurones sensoriels des ganglions rachidiens dorsaux qui les connectent. Les résultats obtenus montrent que les neurones inhibiteurs exprimant NPY::Cre+ reçoivent majoritairement des projections sensorielles provenant des neurones mécanorécepteurs innervant spécifiquement la peau velue. Par une analyse comparative in vivo de l’activité électrique au sein de la corne dorsale de la moelle épinière chez des souris contrôles et des souris dépourvues de neurones NPY::Cre+, une activité spinale aberrante suite à une stimulation mécanique légère au niveau de la peau velue mais pas de la peau glabre, a pu être mise en évidence chez les animaux transgéniques. De plus, une stimulation mécanique douloureuse (par pincement) au niveau de la peau - velue ou glabre - ne provoque pas de changement significatif de l’activité spinale chez les souris dépourvues de neurones NPY::Cre+, confirmant ainsi nos résultats comportementaux. Ces données révèlent ainsi que les interneurones NPY+ jouent un rôle spécifique dans le traitement des informations sensorielles du toucher léger émanant de la peau velue. |
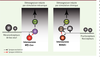
Conclusions et perspectives Ces résultats, ainsi que d’autres travaux récents, mettent en évidence l’existence d’au moins deux circuits distincts impliqués dans le contrôle des démangeaisons au niveau de la corne dorsale de la moelle épinière (Figure 2). Les interneurones inhibiteurs NPY::Cre+ sont spécifiquement requis pour le contrôle des démangeaisons induites par des stimuli mécaniques [5], alors que celles induites par les agents chimiques irritants seraient contrôlées par les interneurones inhibiteurs Bhlhb5(basic helix-loop-helix domain containing, class B, 5)-dépendants [11]. L’identification de ce nouveau circuit souligne l’importance du contrôle fin au niveau spinal des informations sensorielles du toucher léger émanant de la peau velue, en particulier pour la sensation de démangeaison et de ses pathologies associées. Plusieurs questions restent cependant encore en suspens, telles que l’identité précise des neurones excitateurs impliqués dans la transmission des démangeaisons mécaniques ainsi que celle des neurones sensoriels responsables de ces démangeaisons. Dans l’avenir, l’élucidation des différents composants de ce circuit devrait conduire à une meilleure compréhension des circuits de la démangeaison et certainement permettre le développement de nouvelles thérapies dans le traitement des démangeaisons chroniques. Ces résultats illustrent donc la grande complexité et la diversité des réseaux neuronaux au sein de la corne dorsale de la moelle épinière, dans laquelle différents sous-groupes d’interneurones sont spécifiquement requis pour le traitement, l’intégration et la modulation des différentes informations sensorielles provenant de la périphérie.
 | Figure 2.
Différents circuits pour les démangeaisons mécaniques et chimiques. Représentation schématique simplifiée des différents circuits spinaux de la démangeaison. L’activation des mécanorécepteurs de bas seuil peut induire une forme de démangeaison dite mécanique. L’absence des neurones inhibiteurs exprimant NPY::Cre au niveau de la corne dorsale de la moelle épinière entraîne la désinhibition de neurones excitateurs non identifiés (?) et l’apparition de démangeaisons mécaniques chroniques. Les démangeaisons dues aux irritants chimiques sont induites par l’activation des neurones périphériques pruritocepteurs. Elles transitent au niveau spinal par les neurones excitateurs exprimant le récepteur GRPR, son ligand GRP et le récepteur NPRA. Ces démangeaisons sont contrôlées par les neurones inhibiteurs exprimant le facteur de transcription Bhlhb5 via l’activation de neurones nocicepteurs. Ces deux formes de démangeaisons sont transmises au cerveau via des neurones de projection spinale (NPS). GRPR : gastrin releasing peptide receptor ; GRP : gastrin releasing peptide ; NPRA : natriuretic peptide receptor-A. |
|
L’auteur déclare n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Je remercie Alexandre Pattyn, Stéphanie Ventéo, Antoine Dalet et Lucie Elzière pour leur aide lors de la rédaction de cet article.
|
Footnotes |
1.
Gross MK, Dottori M, Goulding M. Lbx1 specifies somatosensory association interneurons in the dorsal spinal cord . Neuron. 2002; ; 34 : :535.–549. 2.
Muller T, Brohmann H, Pierani A, et al. The homeodomain factor lbx1 distinguishes two major programs of neuronal differentiation in the dorsal spinal cord . Neuron. 2002; ; 34 : :551.–562. 3.
Brohl D, Strehle M, Wende H, et al. A transcriptional network coordinately determines transmitter and peptidergic fate in the dorsal spinal cord . Dev Biol. 2008; ; 322 : :381.–393. 4.
Todd AJ. Neuronal circuitry for pain processing in the dorsal horn . Nat Rev Neurosci. 2010; ; 11 : :823.–836. 5.
Bourane S, Duan B, Koch SC, et al. Gate control of mechanical itch by a subpopulation of spinal cord interneurons . Science. 2015; ; 350 : :550.–554. 6.
Duan B, Cheng L, Bourane S, et al. Identification of spinal circuits transmitting and gating mechanical pain . Cell. 2014; ; 159 : :1417.–1432. 7.
Fukuoka M, Miyachi Y, Ikoma A. Mechanically evoked itch in humans . Pain. 2013; ; 154 : :897.–904. 8.
Sun YG, Chen ZF. A gastrin-releasing peptide receptor mediates the itch sensation in the spinal cord . Nature. 2007; ; 448 : :700.–703. 9.
Sun YG, Zhao ZQ, Meng XL, et al. Cellular basis of itch sensation . Science. 2009; ; 325 : :1531.–1534. 10.
Misery L. Le prurit : des avancées physiopathologiques considérables . Med Sci (Paris). 2014; ; 30 : :1123.–1128. 11.
Ross SE, Mardinly AR, McCord AE, et al. Loss of inhibitory interneurons in the dorsal spinal cord and elevated itch in Bhlhb5 mutant mice . Neuron. 2010; ; 65 : :886.–898. |