| |
| Med Sci (Paris). 32(6-7): 568–571. doi: 10.1051/medsci/20163206014.Implication de la réponse au stress du réticulum endoplasmique dans le contrôle de la neurogenèse corticale Sophie Laguesse,1,2* Catherine Creppe,1,2 Juliette D. Godin,3 and Laurent Nguyen1,2 1GIGA-Neurosciences, université de Liège, CHU Sart Tilman, Avenue de l’Hopital, 1, Liège4020, Belgique 2Interdisciplinary cluster for applied genoproteomics (GIGA-R), université de Liège, CHU Sart Tilman, Liège4000, Belgique 3Institut de génétique et de biologie moléculaire et cellulaire (IGBMC), Inserm U964, CNRS UMR7104, université de Strasbourg, Illkirch, France MeSH keywords: Animaux, Cortex cérébral, Réticulum endoplasmique, Stress du réticulum endoplasmique, Humains, Souris, Souris transgéniques, Protéines de tissu nerveux, Neurogenèse, Neurones, Stress physiologique, Réponse aux protéines mal repliées, cytologie, physiologie, métabolisme, génétique |
Le développement du cortex cérébral Le cortex cérébral est la couche de matière grise qui recouvre les hémisphères cérébraux. Il est le siège des fonctions neurologiques élaborées comme le mouvement volontaire, le traitement des informations sensorielles, l’apprentissage ou encore la mémoire. Au cours de la corticogenèse, les progéniteurs neuronaux prolifèrent puis se différencient pour produire des neurones. Dans le cortex cérébral des rongeurs, on distingue essentiellement deux types de progéniteurs selon leur morphologie, l’expression de marqueurs moléculaires et leur mode de division : les progéniteurs apicaux (PA) et les progéniteurs intermédiaires (PI) [1]. Les premiers jours du développement cortical sont marqués par des étapes d’amplification des PA, au cours desquelles la majorité de ces progéniteurs se divisent au niveau de la surface apicale pour donner naissance à deux nouveaux PA. On parle alors de divisions « prolifératrices ». Plus tard au cours du développement, le mode de division des PA change. Grâce à des divisions dites « neurogéniques », un PA génère alors un nouveau PA ainsi qu’un autre type cellulaire différencié. Cette nouvelle cellule différenciée est soit un neurone soit un PI. Les PI se divisent ensuite à distance de la surface apicale et la plupart d’entre eux donnent naissance à deux neurones. La production de neurones directement à partir de PA est appelée neurogenèse directe. La neurogenèse indirecte, elle, implique l’étape intermédiaire des PI et permet d’accroître le nombre de neurones produits par unité de temps et de surface [2] (Figure 1).
 | Figure 1.
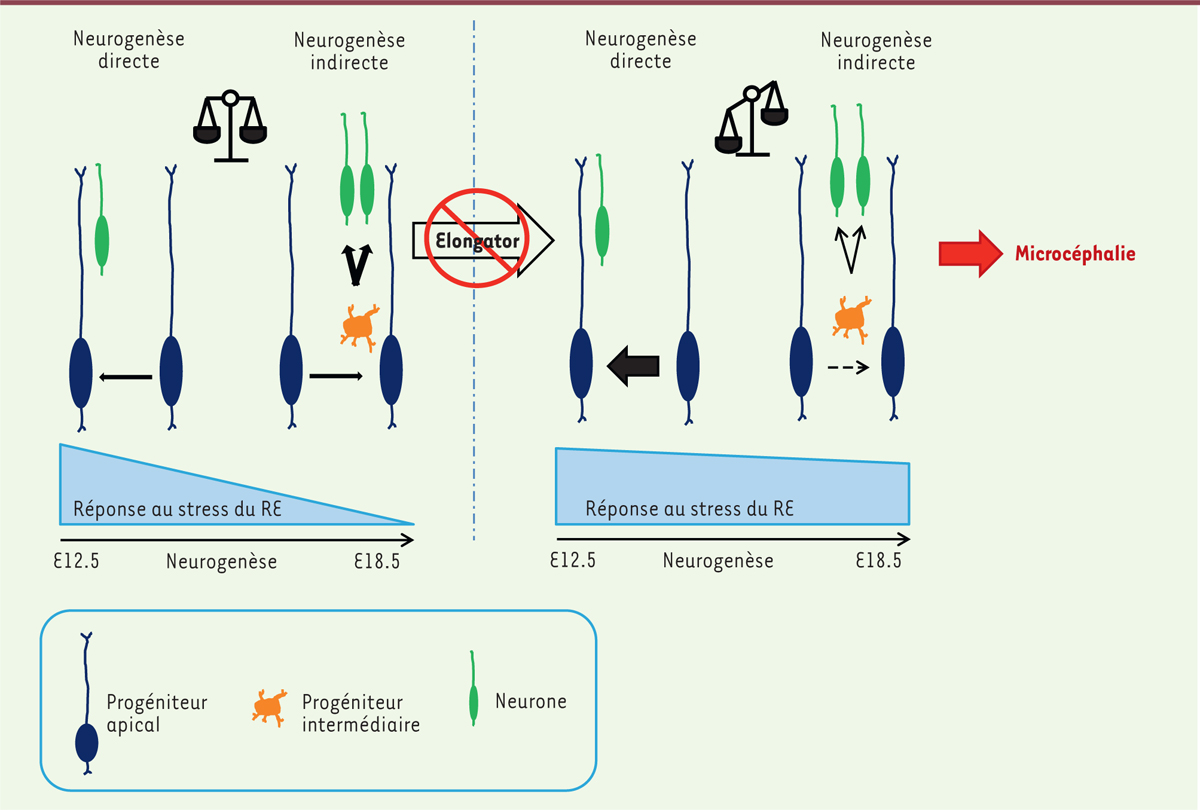
Modèle suggérant l’implication de l’UPR (réponse au stress du RE) dans le contrôle de la neurogenèse au cours du développement du cortex cérébral. En conditions normales (à gauche), on observe une diminution progressive de l’UPR dans les progéniteurs apicaux (PA) qui coïncide avec l’apparition de la neurogenèse indirecte. L’invalidation d’Elp3 dans les PA (à droite) provoque un défaut de traduction protéique responsable de l’accumulation de protéines mal repliées et d’un stress accru du RE. On observe alors une activation excessive de l’UPR qui dérègle l’équilibre entre les neurogenèses directe et indirecte, conduisant in fine à un nombre réduit de PI et à la microcéphalie. E12.5 : jour 12.5 de l’embryogenèse ; Elp3 : Elongator complex protein 3 ; PI : progéniteurs indirects ; RE : réticulum endoplasmique ; UPR : unfolded protein response. |
|
Elongator est un complexe macromoléculaire jouant un rôle critique dans la maturation des neurones de projection1 [3, 4] (→).
(→) Voir la Nouvelle de C. Creppe et al., m/s n° 2, février 2010, page 135
Il est composé de deux copies de chacune de ses six sous-unités (Elp[Elongator complex protein]1 à Elp6). Elp1 est une protéine de structure essentielle à l’assemblage du complexe tandis qu’Elp3 est la sous-unité enzymatique présentant à la fois une activité d’acétyltransférase et de déméthylase [5, 6]. Le complexe Elongator est présent dans le noyau et dans le cytoplasme de tous les neurones corticaux ainsi que leurs progéniteurs, où il exerce différentes fonctions [7]. Une activité cytoplasmique majeure de ce complexe est son implication dans la maturation de certains ARN de transfert (ARNt). Plus particulièrement, Elongator est requis pour l’ajout d’un groupement chimique 5-méthoxycarbonylméthyl (mcm5) sur l’uridine présente en position 34 (U34) de l’anticodon de certains ARNt. Cette modification est nécessaire pour assurer une traduction fidèle et efficace de l’ARN messager (ARNm) en protéine [8]. |
Elongator contrôle l’équilibre entre les neurogenèses directe et indirecte Afin d’étudier le rôle d’Elongator au sein des progéniteurs corticaux, nous avons créé un modèle murin d’invalidation conditionnelle de la sous-unité Elp3. Pour cela, nous avons croisé des souris transgéniques où une partie de la séquence codante d’Elp3 est flanquée de sites « loxp2, » (Elp3lox/lox) avec des souris exprimant la recombinase Cre sous le promoteur de FoxG1, un gène exprimé par les progéniteurs de neurones corticaux (FoxG1Cre). Dans la lignée de souris transgéniques résultant de ce croisement (Elp3lox/lox;FoxG1Cre), Elp3 est ainsi invalidé de façon spécifique dans les progéniteurs neuronaux. Les souris déficientes en Elp3 présentent une microcéphalie3, sévère, causée par une réduction du nombre de neurones affectant toutes les couches du cortex. Nous avons analysé plus en détail les causes de cette microcéphalie et identifié une diminution spécifique de la population des PI. Grâce à la technique d’électroporation in utero
4,, nous avons suivi le destin cellulaire des PA et démontré que l’absence d’Elp3 induit une augmentation de la neurogenèse directe aux dépens de la neurogenèse indirecte, menant ainsi à un nombre réduit de neurones et à une microcéphalie. Afin d’étudier cette fonction d’Elongator dans la neurogenèse, nous avons utilisé des cellules souches embryonnaires humaines (hESC) pour modéliser la formation du tube neural en développement. Les cellules souches cultivées sur un tapis de cellules stromales5, forment ainsi des rosettes neurales en bordure desquelles sont présentes des cellules qui possèdent des caractéristiques semblables aux PA, tandis qu’on retrouve en périphérie des cellules plus différenciées, comparables aux PI. L’invalidation d’Elp3 dans les hESCs provoque une réduction du nombre de PI dans les rosettes, produisant un phénotype comparable à celui observé lors de la corticogenèse murine. Après avoir étudié l’influence d’Elp3, nous nous sommes tournés vers l’étude d’Elp1. Chez l’homme, la dysautonomie familiale [4] (→) est une maladie héréditaire causée par une mutation du gène codant pour la sous-unité Elp1 [9]. Nous avons donc examiné la composition des rosettes formées à partir de cellules souches pluripotentes induites (hiPSC) provenant de fibroblastes de patients atteints de cette maladie. De même que pour les hESC déficientes en Elp3, nous avons observé, dans les rosettes déficientes en Elp1, une réduction de la production de PI par neurogenèse indirecte. Dans leur ensemble, nos résultats suggèrent que l’expression et l’activité d’Elongator sont requises pour le maintien de l’équilibre entre les neurogenèses directe et indirecte, à la fois dans le cortex cérébral murin en développement et dans le tissu neural dérivé de cellules souches humaines.
(→) Voir la Nouvelle de C. Creppe et al., m/s n° 2, février 2010, page 135
|
L’invalidation d’Elp3 provoque un stress du réticulum endoplasmique (RE), accroît l’UPR (réponse au stress du RE) et induit un défaut de neurogenèse L’importance du complexe Elongator dans la modification des ARNt a été démontrée dans plusieurs modèles eucaryotes [10]. Nos résultats ont confirmé son implication dans la modification de l’uridine en position 34 (U34) de certains ARNt au cours de la corticogenèse. En effet, en l’absence d’Elp3, les ribosomes marquent des pauses plus longues sur l’ARNm et cela spécifiquement sur les codons reconnus par les ARNt dont l’U34 est normalement modifiée par l’ajout d’un groupement chimique de type mcm5. Cette observation suggère un défaut de décodage entre le codon et l’anti-codon pouvant conduire à des problèmes de traduction protéique. En effet, il a récemment été montré chez les levures et les nématodes que l’absence de modification sur l’U34 est responsable non seulement d’un taux réduit de traduction protéique, mais également d’une accumulation de protéines agrégées [11]. Par microscopie électronique, nous avons mis en évidence des signes de stress du réticulum endoplasmique (RE) dans les PA des animaux invalidés pour Elp3, indiquant une accumulation de protéines mal repliées, dont le nombre important excède celui des chaperonnes6, affectant ainsi leur bon fonctionnement. La réponse cellulaire au stress du RE, appelée également UPR (unfolded protein response), peut se traduire par l’activation de plusieurs voies de signalisation permettant de lutter contre l’accumulation de protéines mal conformées afin de restaurer l’homéostasie cellulaire. Dans notre modèle, l’UPR se traduit par l’activation spécifique de la voie de signalisation régulée par PERK (PKR[protein kinase RNA]-like endoplasmic reticulum kinase), une protéine réceptrice du stress, présente dans la membrane du RE, qui active d’autres effecteurs dont eIF2α (eukaryotic initiation factor 2 alpha subunit) et ATF4 (activating transcription factor 4), et qui stimule notamment l’autophagie. L’analyse du cortex des animaux invalidés pour Elp3 a en effet démontré la présence de nombreux autophagolysosomes7, ainsi qu’une augmentation de l’expression d’eIF2α et d’ATF4. Afin de déterminer si cette augmentation du stress du RE et sa transduction via l’UPR jouent un rôle dans les défauts de neurogenèse observés, nous avons bloqué la voie UPR incriminée en rétablissant les niveaux d’expression d’ATF4 dans le cortex d’embryons déficients en Elp3. Dans ces conditions, la production de PI par neurogenèse indirecte apparaît normale indiquant un rétablissement de l’équilibre entre les neurogenèses directe et indirecte. Inversement, l’induction pharmacologique d’un stress du RE dans le cortex d’embryons sauvages par injection de tunicamycine8 provoque l’apparition de défauts de neurogenèse semblables à ceux observés en l’absence d’Elp3. |
La régulation dynamique de l’UPR est nécessaire au contrôle de la neurogenèse corticale Nos résultats montrent l’importance d’un contrôle précis de l’équilibre entre les neurogenèses directe et indirecte au cours du développement du cortex cérébral. L’invalidation d’Elongator dans les progéniteurs corticaux provoque des défauts de traduction protéique, causant un stress du RE accru et une sur-activation de l’UPR qui conduit à un dérèglement de l’équilibre neurogénique (Figure 1), induisant in fine une microcéphalie. De façon intéressante, en conditions physiologiques, nous avons observé, au cours du développement cortical, une diminution progressive de l’expression des effecteurs de l’UPR tels ATF4, ATF5 et CHOP (C/EBP [CCAAT/enhancer binding protein] homologous protein) qui coïncide avec la réduction progressive des divisions des PA par neurogenèse directe. De plus, l’invalidation d’ATF4 au début du développement cortical conduit à une réduction de la neurogenèse directe, mettant ainsi en évidence l’importance de l’UPR au cours de la neurogenèse. Dans leur ensemble, nos résultats suggèrent qu’une régulation dynamique des différentes composantes de l’UPR est nécessaire pour un contrôle précis de la neurogenèse corticale. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Gotz M, Huttner WB. The cell biology of neurogenesis . Nat Rev Mol Cell Biol. 2005; ; 6 : :777.–788. 2.
Noctor SC, Martinez-Cerdeno V, Ivic L, Kriegstein AR. Cortical neurons arise in symmetric and asymmetric division zones and migrate through specific phases . Nat Neurosci. 2004; ; 7 : :136.–144. 3.
Creppe C, Malinouskaya L, Volvert ML, et al. Elongator controls the migration and differentiation of cortical neurons through acetylation of alpha-tubulin . Cell. 2009; ; 136 : :551.–564. 4.
Creppe C, Malinouskaya L, Volvert ML, et al. Elongator orchestre la neurogenèse du cortex cérébral . Med Sci (Paris). 2010; ; 26 : :135.–137. 5.
Winkler GS, Kristjuhan A, Erdjument-Bromage H, et al. Elongator is a histone H3 and H4 acetyltransferase important for normal histone acetylation levels in vivo . Proc Natl Acad Sci USA. 2002; ; 99 : :3517.–3522. 6.
Okada Y, Yamagata K, Hong K, et al. A role for the elongator complex in zygotic paternal genome demethylation . Nature. 2010; ; 463 : :554.–558. 7.
Nguyen L, Humbert S, Saudou F, Chariot A. Elongator - an emerging role in neurological disorders . Trends Mol Med. 2010; ; 16 : :1.–6. 8.
Grosjean H, de Crecy-Lagard V, Marck C. Deciphering synonymous codons in the three domains of life: co-evolution with specific tRNA modification enzymes . FEBS Lett. 2010; ; 584 : :252.–264. 9.
Slaugenhaupt SA, Blumenfeld A, Gill SP, et al. Tissue-specific expression of a splicing mutation in the IKBKAP gene causes familial dysautonomia . Am J Hum Genet. 2001; ; 68 : :598.–605. 10.
Karlsborn T, Tukenmez H, Mahmud AK, et al. Elongator, a conserved complex required for wobble uridine modifications in eukaryotes . RNA Biol. 2014; ; 11 : :1519.–1528. 11.
Nedialkova DD, Leidel SA. Optimization of codon translation rates via tRNA modifications maintains proteome integrity . Cell. 2015; ; 161 : :1606.–1618. |