| |
| Med Sci (Paris). 32(8-9): 668–671. doi: 10.1051/medsci/20163208003.Le syndrome d’insensibilité aux androgènes et activité cérébrale chez la femme Influence des hormones et des chromosomes sexuels Julie Bakker1* and Judy van Hemmen2 1Neuroendocrinologie, GIGA Neurosciences, université de Liège, Avenue Hippocrate 15, 4000Liège, Belgique 2Netherlands Institute for Neurosciences, Meibergdreef 47, Amsterdam, Pays-Bas MeSH keywords: Syndrome d'insensibilité aux androgènes, Encéphale, Cognition, Femelle, Humains, Mâle, Neurones, Facteurs sexuels, Perception de l'espace, physiopathologie, psychologie, physiologie |
Dans l’espèce humaine, des différences entre sexes ont été observées à différents niveaux : les capacités cognitives [1], la structure du cerveau [2] et l’activité cérébrale associée à l’exécution de tâches cognitives ou émotionnelles [3]. Cependant, les mécanismes exacts impliqués dans la différenciation sexuelle du cerveau et du comportement chez l’homme sont encore fortement discutés. La théorie classique de la différenciation sexuelle du comportement est fondée sur l’étude de Phoenix et ses collègues [4]. Cette étude réalisée en 1959 chez le cobaye, montre que l’exposition aux androgènes, pendant certaines périodes spécifiques du développement, a des effets permanents (appelés organisateurs) en permettant l’expression de comportements sexuels typiquement masculins (comme le comportement de monte) en réponse aux stéroïdes sexuels à l’âge adulte. En revanche, l’absence d’androgènes, au cours de ces périodes, induira l’expression de comportements sexuels typiquement féminins (comme le comportement de lordose1). Des études ultérieures réalisées chez les rongeurs [5] (→) ont suggéré que les œstrogènes, synthétisés dans le cerveau par l’enzyme aromatase, sont à l’origine d’un bon nombre de ces effets organisateurs des androgènes. Des études réalisées chez les primates [6], ainsi que des données obtenues chez l’homme concernant des troubles endocriniens rares [7], ont suggéré que, chez l’homme, les androgènes agissent directement sur le cerveau par leur liaison au récepteur aux androgènes. Dès d’adolescence, une fois la puberté installée, les taux circulants d’hormones sexuelles ont des effets « activateurs » sur le cerveau et le comportement et induisent de façon réversible les comportements qui ont été organisés au cours du développement.
(→) Voir la Nouvelle de J. Bakker, m/s n° 5, mai 2006, page 459
|
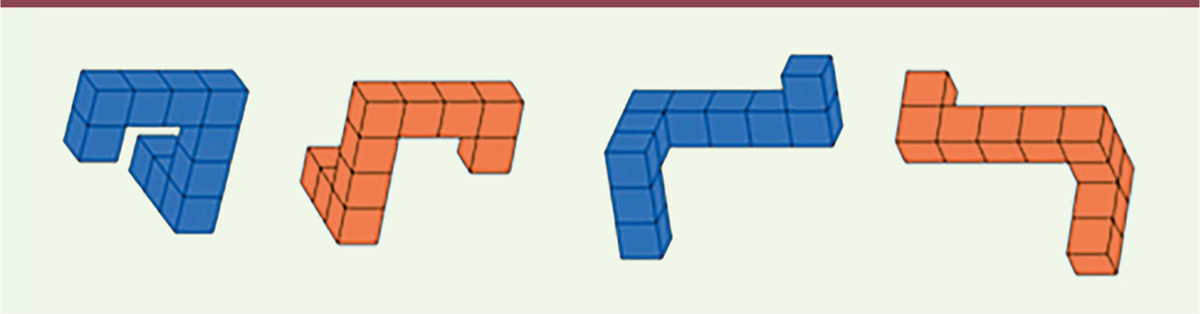
Des différences sexuelles dans les capacités cognitives spatiales Les différences sexuelles cognitives ont surtout été démontrées au niveau des capacités spatiales en réalisant, par exemple, des tests de rotation mentale d’objets tridimensionnels [8]. Dans ces tests, les sujets doivent déterminer, en effectuant des rotations mentales, si deux objets sont identiques ou le miroir l’un de l’autre (Figure 1). Ce type de tests est l’un de ceux qui dévoilent la plus grande différence entre les deux sexes, les hommes étant en général plus rapides et faisant moins d’erreurs. Des études utilisant l’imagerie par résonance magnétique fonctionnelle (IRMf) ont révélé des différences entre les sexes dans l’activité cérébrale pendant l’exécution de cette tâche : plus d’activation dans les régions pariétales chez les hommes et plus d’activation dans les régions frontales et temporales chez les femmes [9]. Il a donc été proposé que les femmes utilisent une stratégie différente de celle des hommes pour résoudre la tâche. Elles analysent et manipulent les différents éléments des objets tridimensionnels. Au contraire, les hommes utiliseraient plutôt une image mentale de l’objet entier [9].
 | Figure 1.
Représentation schématique de la tâche de rotation mentale. Les objets tridimensionnels sont soit des images en miroir l’un de l’autre (à gauche) soit identiques (à droite). Ils peuvent différer par des rotations soit dans le plan, soit en profondeur. La tâche est de décider, aussi rapidement que possible, si les objets sont identiques ou non en appuyant sur le bouton d’une souris. |
La plupart des études portant sur l’origine des différences sexuelles dans les capacités spatiales ont mis l’accent sur les effets organisateurs et/ou activateurs des hormones gonadiques. Ces effets organisateurs ont ainsi été mis en évidence chez des individus ayant des taux d’androgènes atypiques avant et juste après la naissance. Par exemple, les femmes ayant une hyperplasie congénitale des glandes surrénales, ce qui induit une production excessive d’androgènes surrénaux pendant le développement embryonnaire, sont bien meilleures dans les tâches spatiales en comparaison avec leurs sœurs qui ne sont pas affectées [10]. De même, les hommes ayant des taux d’androgènes faibles, en raison d’un hypogonadisme hypogonadotrope, montrent des capacités spatiales diminuées par rapport à des hommes non affectés [11]. Un traitement, à l’âge adulte, avec de la testostérone n’est pas suffisant pour améliorer leurs performances. Les capacités spatiales pourraient donc être influencées par des androgènes au moment du développement embryonnaire. Cependant, l’étude sur des effets activateurs potentiels des hormones gonadiques sur la capacité spatiale n’a fourni que des résultats contradictoires. Certaines études (par exemple [12]) ont montré des effets négatifs des œstrogènes et positifs des androgènes sur la performance, mais d’autres n’ont pu confirmer ces effets (par exemple [13]). Les chromosomes sexuels (XX ou XY) pourraient être un autre facteur impliqué dans la différenciation sexuelle des capacités spatiales. En effet, chez les rongeurs, des études [14] ont suggéré que les chromosomes sexuels avaient des effets directs sur certains comportements qui diffèrent en fonction du sexe. Chez l’homme, cette question n’a pas encore été bien étudiée. Une piste de recherche pourrait être l’étude de personnes souffrant de troubles du développement sexuel (DSD), chez lesquelles le développement chromosomique ou gonadique est affecté, résultant en un sexe anatomique atypique. |
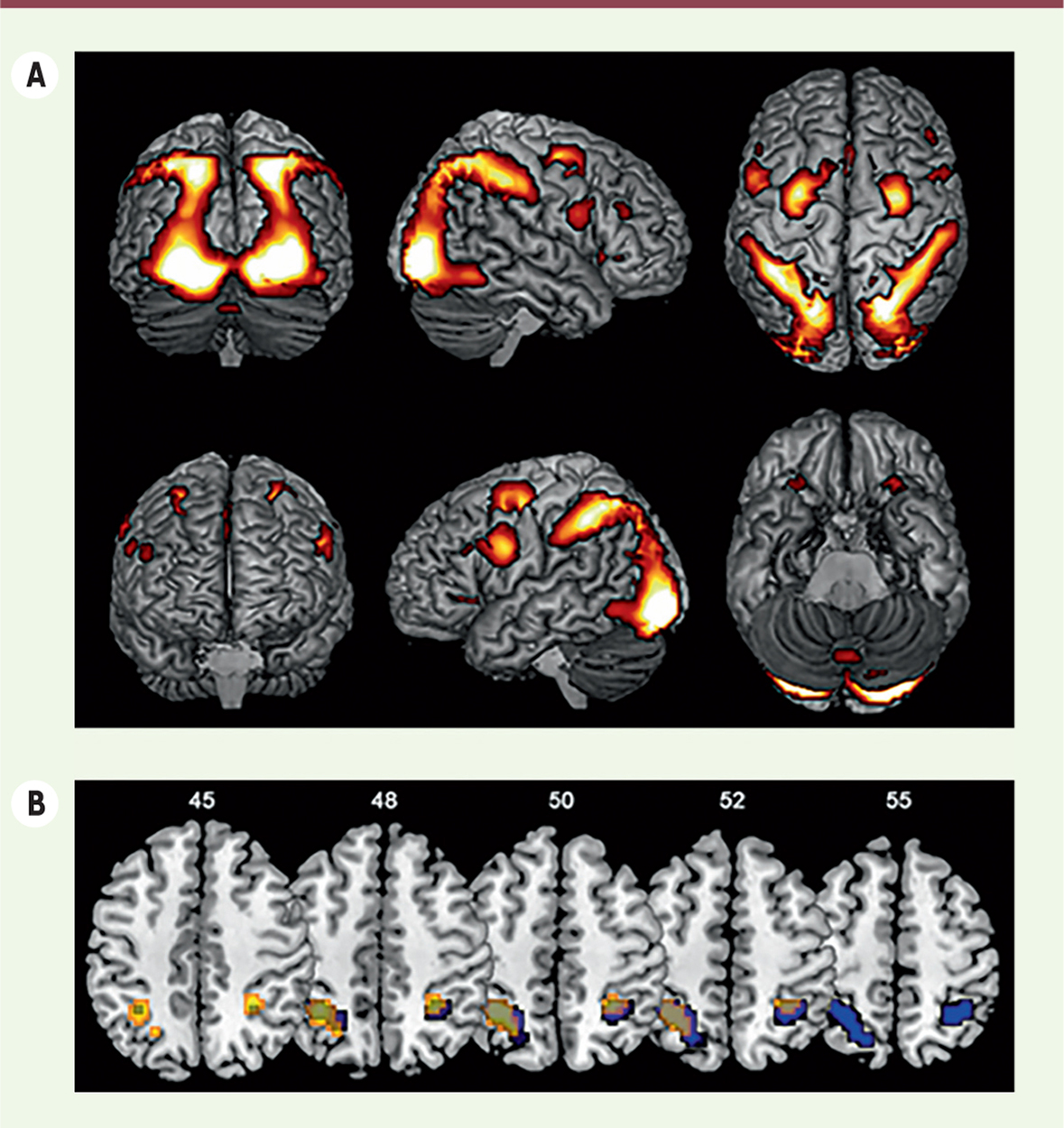
Syndrome d’insensibilité complète aux androgènes et capacités cognitives spatiales Le syndrome d’insensibilité complète aux androgènes (SICA), aussi connu sous le nom de syndrome du testicule féminisant, est un trouble de la différenciation sexuelle qui se caractérise par une absence complète, ou une anomalie de fonctionnement, du récepteur aux androgènes à la suite de mutations touchant le gène codant ce récepteur. En cas d’absence totale de ces récepteurs, la différenciation sexuelle est féminine. Le patient a donc un génotype masculin, plus précisément un caryotype 46 XY, mais il présente à la naissance un phénotype typiquement féminin. L’incidence est estimée entre 1/20 000 dans la population générale et 1/99 000 naissances vivantes de garçons. En règle générale, les personnes atteintes de ce syndrome ont une identité sexuelle féminine, elles sont donc considérées comme des femmes. Pour savoir si les différences sexuelles dans les tâches de rotation mentale reflètent des effets organisateurs des androgènes ou des gènes des chromosomes sexuels, nous avons comparé par IRMf l’activation cérébrale au cours de tâches de rotation mentale chez des femmes atteintes du SICA et chez des groupes d’hommes et de femmes contrôles. Nous avons observé des activations cérébrales assez similaires chez tous les sujets lors de la rotation mentale (Figure 2A). Les trois groupes ont montré des activations bilatérales dans le lobe pariétal2,, principalement dans les régions inférieures et supérieures, se prolongeant dans le lobe occipital3,. Des activations ont également été observées dans les régions frontales4, dans la région précentrale et le gyrus supérieur et intermédiaire frontal.
 | Figure 2.
Activations cérébrales lors de la tâche de rotation mentale. A. Effet principal de la tâche de rotation mentale pour tous les groupes expérimentaux pris ensemble. Les régions corticales plus activées par la condition de rotation que par la condition contrôle (dans laquelle aucune rotation mentale n’est nécessaire) sont affichées sur un modèle anatomique normalisé du cerveau en utilisant le logiciel MRIcron. Les régions les plus jaunes correspondent à celles présentant les différences entre les deux conditions les plus significatives. Seules les activations significatives sont représentées (p < 0,05, FWE [family-wise error] corrigée). B. Comparaisons de l’activité cérébrale des trois groupes lors de la rotation mentale. Les activités cérébrales présentées correspondent à la soustraction entre la condition rotation et la condition contrôle. En bleu : différences significatives entre les hommes et les femmes contrôles dans le lobe pariétal inférieur gauche et droit. En jaune : différences significatives entre les hommes contrôles et les femmes atteintes du SICA dans le lobe pariétal inférieur gauche. Les numéros correspondent aux coordonnées z de chaque coupe (MNI, Montréal Neurological Institute). Les activations sont affichées sur un modèle anatomique normalisé en utilisant le logiciel MRIcron. SICA : syndrome d’insensibilité complète aux androgènes. |
Cependant, des analyses de comparaison des trois groupes ont révélé l’existence de différences sexuelles significatives. Les hommes contrôles montrent en effet une plus grande activation dans les lobes pariétaux inférieurs gauche et droit par comparaison avec les femmes contrôles (
Figure 2B
, en bleu). Inversement, aucune région cérébrale n’est davantage activée chez les femmes que chez les hommes. Enfin, les femmes atteintes du SICA montrent une activation cérébrale très similaire à celle observée chez les femmes contrôles (et donc une différence avec les hommes contrôles,
Figure 2B
en jaune). Ces résultats suggèrent donc que la différenciation sexuelle de l’activation neuronale lors d’une tâche visuelle-spatiale n’est pas directement influencée par les chromosomes sexuels. Elle est plus probablement déterminée par l’exposition aux hormones gonadiques, vraisemblablement les androgènes. Cette conclusion expliquerait ainsi l’activation cérébrale typiquement féminine observée chez les femmes atteintes du SICA, ayant des chromosomes masculins. L’absence d’une activation typiquement masculine chez les femmes atteintes du SICA (sujets XY) soutient l’hypothèse que, chez les humains, les androgènes, et non pas les œstrogènes, ont des effets masculinisants et/ou déféminisants sur le cerveau. Cependant, il est impossible de faire une distinction entre les effets organisateurs et activateurs des androgènes puisque l’insensibilité aux androgènes est déjà bien présente avant la naissance et se poursuit tout au long de la vie des sujets concernés par l’étude. L’activation cérébrale typiquement féminine des femmes atteintes du SICA pourrait de plus refléter les actions féminisantes de l’œstradiol. En effet, si leurs niveaux d’œstrogènes sont comparables aux taux observés chez les hommes lorsque leurs gonades (testicules abdominaux) sont toujours in situ, elles sont ensuite traitées avec de l’œstradiol, après avoir subi une gonadectomie. À cet égard, il serait intéressant de pouvoir étudier les femmes atteintes du SICA sans traitement aux œstrogènes car cela permettrait de déterminer si l’activation cérébrale typiquement féminine est effectivement produite par le manque d’action des androgènes ou si des effets œstrogéniques activateurs sont impliqués. Cette approche n’est cependant pas éthiquement acceptable car les femmes adultes atteintes du SICA, qui ont subi une gonadectomie, ont besoin d’un traitement œstrogénique pour des raisons médicales (en particulier pour prévenir l’ostéoporose). Il n’est donc évidemment pas possible de leur demander d’arrêter leur traitement hormonal pendant une période prolongée à des seules fins de recherche. Il faut enfin noter que les différences sexuelles observées, ainsi que l’activation cérébrale typiquement féminine présentée par les femmes atteintes du SICA, pourraient refléter des effets de la socialisation sur les capacités spatiales. Il a en effet été proposé que l’exposition aux jouets et aux activités typiquement masculines pendant l’enfance améliorent la performance dans des tâches spatiales. Tous nos participants interrogés sur ce sujet ont ainsi signalé qu’ils avaient eu des activités typiques de leur genre pendant leur enfance et adolescence ; les hommes avaient une préférence pour les jouets et activités typiquement masculins et les femmes contrôles et celles atteintes du SICA pour les jouets et activités typiquement féminins. Nous ne pouvons donc pas totalement exclure un effet potentiel de socialisation. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Maccoby EE, Jacklin CN. The psychology of sex differences . Stanford (CA): : Stanford University Press; , 1974 : :634. p. 2.
Ruigrok AN, Salimi-Khorshidi G, Lai MC, et al. A meta-analysis of sex differences in human brain structure . Neurosci Biobehav Rev. 2014; ; 39 : :34.–50. 3.
Cahill L. Why sex matters for neuroscience . Nat Rev Neurosci. 2006; ; 7 : :477.–484. 4.
Phoenix CH, Goy RW, Gerall AA, et al. Organizing action of prenatally administered testosterone propionate on the tissues mediating mating behavior in the female guinea pig . Endocrinology. 1959; ; 65 : :369.–382. 5.
Bakker J. L’α-foetoprotéine protège le cerveau femelle en développement des effets masculinisants et déféminisants des œstrogènes . Med Sci (Paris). 2006; ; 22 : :459.–461. 6.
Wallen K. Hormonal influences on sexually differentiated behavior in nonhuman primates . Front Neuroendocrinol. 2005; ; 26 : :7.–26. 7.
Cohen-Bendahan CCC, Van De Beek C, Berenbaum SA Prenatal sex hormone effects on child and adult sex-typed behavior: methods and findings . Neurosci Biobehav Rev. 2005; ; 29 : :353.–384. 8.
Linn MC, Petersen AC Emergence and characterization of sex differences in spatial ability: a meta-analysis . Child Dev. 1985; ; 56 : :1479.–1498. 9.
Jordan K, Wüstenberg T, Heinze HJ, et al. Women and men exhibit different cortical activation patterns during mental rotation tasks . Neuropsychologia. 2002; ; 40 : :2397.–2408. 10.
Berenbaum SA, Bryk KLK, Beltz AM Early androgen effects on spatial and mechanical abilities: evidence from congenital adrenal hyperplasia . Behav Neurosci. 2012; ; 126 : :86.–96. 11.
Hier DB, Crowley WF Spatial ability in androgen-deficient men . N Engl J Med. 1982; ; 306 : :1202.–1205. 12.
Aleman A, Bronk E, Kessels RPC, et al. A single administration of testosterone improves visuospatial ability in young women . Psychoneuroendocrinology. 2004; ; 29 : :612.–617. 13.
Peters M, Laeng B, Latham K, et al. A redrawn Vandenberg and Kuse mental rotations testm different versions and factors that affect performance . Brain Cogn. 1995; ; 28 : :39.–58. 14.
Arnold AP, Chen X What does the four core genotypes mouse model tells us about sex differences in the brain and other tissues? Front Neuroendocrinol. 2009; ; 30 : :1.–9. |