| |
| Med Sci (Paris). 32(8-9): 713–715. doi: 10.1051/medsci/20163208017.Effet papillon et cancer : ou comment une pression mécanique induite in vivo active la tumorigenèse des cellules voisines saines
Camille Kieffer¹,1d Ye Wang¹,1c Fatma Bagca¹,1b and Christophe Lamaze2a 1M1 Biologie Santé, Université Paris-Saclay, 91405Orsay, France 2Institut Curie – Centre de recherche, Paris Sciences et Lettres (PSL research university), équipe dynamique et mécanique membranaires de la signalisation intracellulaire, Inserm U1143, CNRS UMR 3666, Paris, France MeSH keywords: Animaux, Carcinogenèse, Transformation cellulaire néoplasique, Évolution de la maladie, Humains, Mécanotransduction cellulaire, Souris, Tumeurs, Stimulation physique, Pression, Contrainte mécanique, Microenvironnement tumoral, physiologie, anatomopathologie |
La prolifération et la différenciation des cellules d’un organisme reposent sur des interactions étroites avec l’environnement tissulaire et cellulaire. De même, une tumeur ne se développe pas de manière indépendante des cellules voisines non tumorales (→).
(→) Voir à ce propos le numéro thématique Microenvironnements tumoraux : conflictuels et complémentaires, m/s n° 4, avril 2014
En effet, au cours du processus de carcinogenèse, les cellules tumorales agissent sur l’ensemble des tissus avoisinants. Ces tissus, en réponse aux facteurs aussi bien chimiques, sécrétés par la tumeur, que mécaniques, sont susceptibles de subir des processus carcinogènes [1]. Les interactions chimiques, telles que la sécrétion de VEGF (vascular endothelial growth factor) ou de FGF (fibroblast growth factor) dans les processus d’angiogenèse, sont très étudiées car elles représentent de très larges opportunités thérapeutiques [2]. En revanche, les études concernant les implications des forces mécaniques dans le développement des tumeurs sont moins nombreuses. Elles ont tout de même permis de montrer qu’une pression mécanique sur des cellules tumorales non invasives pouvait aboutir à l’expression d’un phénotype invasif. Ces études ont cependant été limitées à des approches in vitro [3]. La problématique soulevée dans l’article de Nature publié par les chercheurs de l’institut Curie (Paris) [4] est la suivante : tester si la pression mécanique de croissance tumorale peut engendrer des phénomènes de tumorigenèse dans les tissus sains (non tumoraux) avoisinant la tumeur, au sein d’un organisme in vivo. Un groupe de chercheurs a mis au point une approche tout à fait novatrice afin d’étudier les conséquences, sur les tissus avoisinants, de la pression mécanique générée au cours de la croissance tumorale [4]. Les auteurs ont analysé les voies de transduction activées dans les cellules subissant cette force, et se sont intéressés plus particulièrement à la voie de la β-caténine. Celle-ci a la particularité d’être présente dans les jonctions adhérentes et desmosomales, et d’être un cofacteur transcriptionnel, pouvant potentiellement coupler les propriétés mécaniques et transcriptionnelles des tissus épithéliaux. Sa translocation nucléaire et sa fixation sur les facteurs de transcription TCF/LEF (T-cell factor/lymphoid enhancer factor) enclenchent alors la transcription de gènes tumorigènes comme cmyc et ccnd1 (codant la cycline D) [5]. |
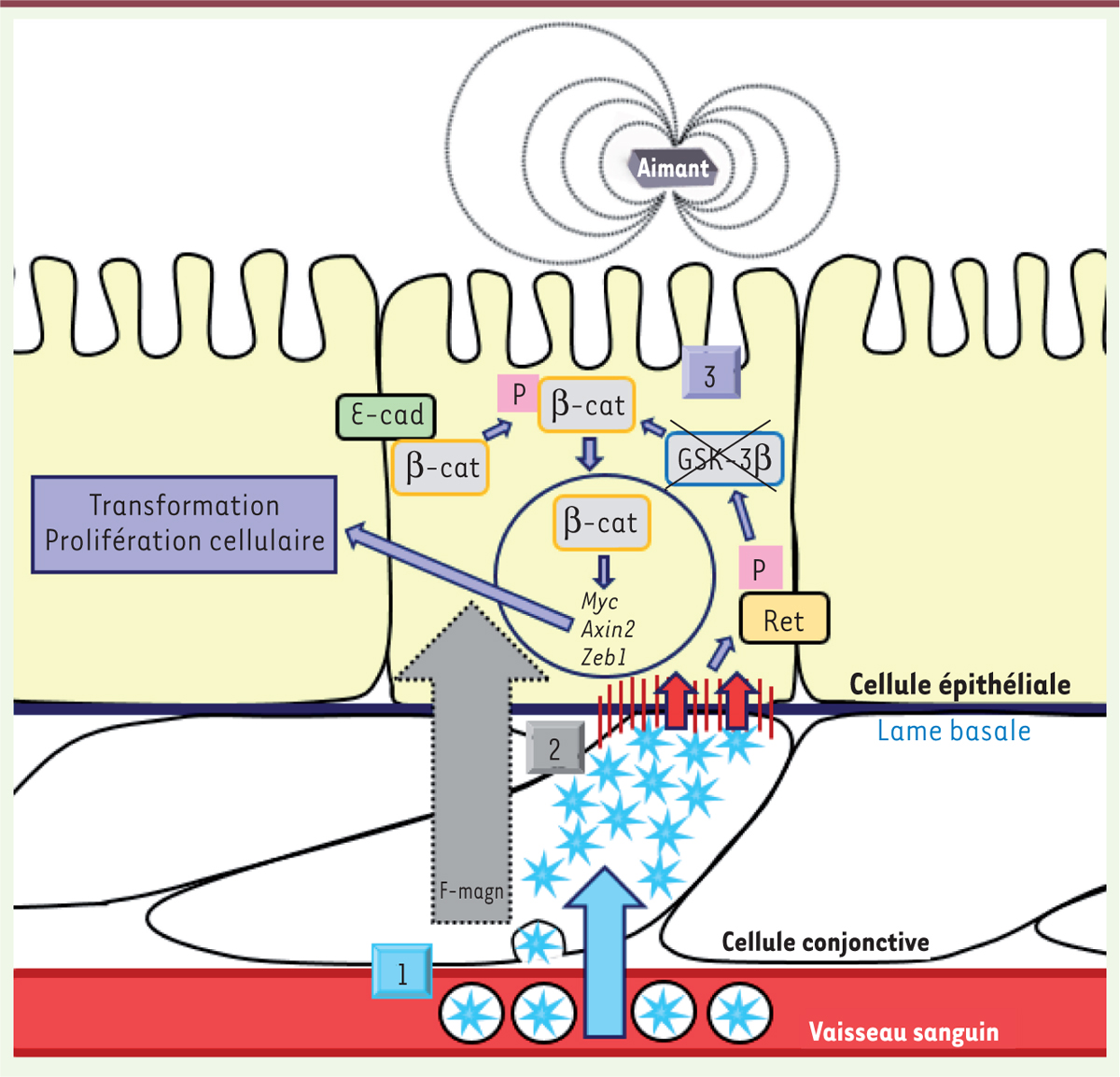
Une technique innovante induisant des contraintes de pression sur les cellules L’expérience a consisté à mimer la pression exercée par la croissance des cryptes hyperprolifératives d’une tumeur colique sur le tissu intestinal adjacent grâce à l’utilisation d’un aimant et de liposomes ultra-magnétisés (Figure 1). L’aimant est inséré en sous-cutané en regard du côlon préalablement à l’injection intraveineuse des liposomes ultra-magnétisés, ce qui favorise l’extravasation de ces derniers dans le tissu conjonctif mésenchymateux du côlon. De par leur nature lipidique, les liposomes pénètrent facilement par endocytose au sein des cellules du tissu mésenchymateux, entourant les cryptes grâce à l’attraction de l’aimant, et ils y restent stabilisés jusqu’à un mois. Le champ magnétique permet d’appliquer une force sur les liposomes ultra-magnétisés et de générer ainsi une pression mécanique sur les cellules adjacentes. Les différentes mesures physiques des forces de compression ainsi appliquées montrent que celles-ci sont de l’ordre de grandeur du stress physiopathologique (de 1 kPa) engendré par la croissance tumorale, comme rapporté dans la littérature. Ces expériences sont réalisées chez des souris sauvages et Apc+/1638N (souris hétérozygotes pour une mutation perte de fonction d’un allèle du gène Apc [adenomatous polyposis coli]). APC est une protéine qui séquestre la β-caténine dans le cytosol et empêche ses effets transcriptionnels. Ainsi, elle agit en tant que suppresseur de tumeur. De plus, il est connu que 80 % des cancers du côlon d’origine génétique se caractérisent par une mutation d’APC, la mutation APC+/1638N.
 | Figure 1.
Induction de la voie Ret/β-caténine par l’application d’une pression mécanique sur les entérocytes sains. 1. Extravasation des liposomes encapsulant des nanoparticules ultra-magnétisées et endocytose dans les cellules conjonctives. 2. Production d’un stress mécanique sur les cellules épithéliales par l’application d’une force magnétique (F-magn) par les cellules mésenchymateuses, chargées en liposomes ultramagnétiques. 3. Mécanotransduction : la phosphorylation de Ret conduit à l’inactivation de la GSK-3β, qui, lorsqu’elle est activée, séquestre la β-caténine et la dirige vers la voie de dégradation. La libération de la β-caténine du complexe qui la séquestre et des jonctions adhérentes permet son accumulation dans le cytosol. Sa translocation dans le noyau transforme la cellule épithéliale. β-cat : β-caténine ; E-cad : E-cadhérine ; GSK-3β : glycogen synthase kinase 3 ; Axin2 : axin-related protein ; Zeb1 : zinc finger E-box-binding homeobox 1. |
La pression mécanique exercée de façon chronique (elle se prolonge ici de plusieurs jours à plusieurs mois) entraîne une phosphorylation de la protéine kinase membranaire Ret, connue pour contrôler des voies de signalisation tumorigènes [6]. Ret est impliquée dans l’inactivation de la GSK-3β (glycogen synthase kinase 3), une protéine du complexe retenant la β-caténine phosphorylée dans le cytosol et induisant sa dégradation. Par ailleurs, l’application de la pression mécanique induit la phosphorylation – dépendante de Ret – de la β-caténine, qui se détache des E-cadhérines avec lesquelles elle interagissait à la membrane plasmique, et s’accumule dans le cytosol et dans le noyau. Des études par q-PCR (quantitative polymerase chain reaction) montrent que cette accumulation dans le noyau entraîne l’expression de gènes tumorigènes tels que cMyc, Axin2 (axin-related protein) et Zeb1 (zine finger E-box-binding homeobox 1). D’un point de vue cellulaire, l’activation de ces voies entraîne une augmentation du nombre de cryptes intestinales proliférant de manière anormale. Ces résultats sont obtenus aussi bien chez les souris sauvages que chez les souris APC+/1638N ; cependant, l’induction des processus carcinogènes est plus longue chez les souris sauvages, alors qu’elle peut mener à la production de tumeurs au bout d’un à deux mois chez les souris APC+/1638N. Ainsi, une cellule saine subissant des contraintes mécaniques chroniques est bel et bien susceptible d’activer des voies de signalisation tumorigènes (Figure 1). |
Transposition du modèle dans les conditions physiopathologiques de la croissance tumorale. Quelles perspectives ? La validation du modèle se fait chez des souris Notch-IC/Apc+/1638N, qui développent, après l’administration de tamoxifène, des tumeurs exprimant le domaine intracytoplasmique du récepteur Notch au niveau du côlon, et ce de façon mosaïque, c’est-à-dire que des cryptes tumorales hyperprolifératives jouxtent des cryptes non tumorales1. La voie Ret/β-caténine est alors également déclenchée dans les cryptes non tumorales n’exprimant pas Notch intracellulaire, mais qui sont comprimées par les domaines tumoraux hyperprolifératifs avoisinants. Or, aucune mutation tumorigène n’est mise en évidence dans ces cellules non tumorales, ce qui amène à penser que l’événement déclenchant est une transduction mécanique tout à fait similaire à celle qui est obtenue par le système magnétique décrit précédemment. La preuve de concept exposée ici présente l’avantage de mettre en évidence l’action mécanique de la tumeur sur son microenvironnement in vivo. Ces travaux montrent qu’un stress mécanique induit par la tumeur sur les cellules environnantes est à l’origine de l’activation de voies de signalisation tumorigènes, dont la voie β-caténine. Cette étude représente la première démonstration in vivo de l’implication de la pression tumorale dans la transformation du microenvironnement cellulaire non tumoral. Les conséquences de l’induction mécanique de voies tumorigènes sont nombreuses. Ainsi, au niveau métastatique, un tel mécanisme pourrait expliquer un détachement physique des cellules épithéliales ayant activé la voie tumorigène et une mobilité accrue de ces cellules suite au décrochage de la β-caténine des jonctions adhérentes et desmosomales. Ces phénomènes mécaniques sont donc susceptibles d’être à l’origine de l’accroissement de l’agressivité tumorale, facilitant notamment un processus de dissémination métastatique de la tumeur. |
Mécanotransduction et cancer Les composants cellulaires à l’origine de la mécanoréception ne sont pas abordés dans cet article. Il est envisageable d’impliquer des mécanorécepteurs comme les intégrines β1, dont le domaine cytoplasmique interagit avec la kinase ILK (integrin-linked kinase). Leur surexpression a un rôle dans la translocation nucléaire de la β-caténine et dans la promotion de la transition épithélio-mésenchymateuse (TEM), contribuant au phénotype cancéreux en inhibant la GSK-3β [7]. De plus, une fonction mécano-sensorielle du stress mécanique a récemment été attribuée aux cavéoles, des invaginations particulières de la membrane plasmique qui, par ailleurs, ont été associées à la transformation des cellules [8]. Les cavéoles sont constituées de l’oligomérisation de la cavéoline 1 (Cav 1), leur principal constituant. Cav1 est exprimée dans les CAF (fibroblastes associés aux carcinomes) et augmente le potentiel métastatique des cellules tumorales par remodelage de la matrice extracellulaire [9]. Il a été montré que lorsqu’une cellule subit un stress mécanique, les cavéoles s’aplatissent jusqu’à disparaître en se fondant totalement dans la membrane plasmique. Ces structures permettent donc de conserver une homéostasie de la tension membranaire en ajoutant le stock membranaire contenu initialement dans la cavéole invaginée à la membrane plasmique lorsque celle-ci subit un stress mécanique [10]. Il serait intéressant de reproduire un microenvironnement tumoral hétérologue in vitro afin d’y étudier les conséquences du stress mécanique engendré par la croissance des cellules tumorales exprimant des taux variables de Cav1 [11]. Il est intéressant de noter que nombre de molécules de signalisation impliquées dans la mécanotransduction sont souvent localisées dans les cavéoles, comme c’est le cas avec les intégrines. Le rôle des cavéoles dans la mécanoréception de la rigidité tumorale n’est pas connu à ce jour. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Gao F, Liang B, Reddy ST, et al. Role of inflammation-associated microenvironment in tumorigenesis and metastasis . Curr Cancer Drug Targets. 2014; ; 14 : :30.–45. 2.
Nishida N, Yano H, Nishida T, et al. Angiogenesis in cancer . Vasc Health Risk Manag. 2006; ; 2 : :213.–219. 3.
Tse JM, Cheng G, Tyrrell JA, et al. Mechanical compression drives cancer cells toward invasive phenotype . Proc Natl Acad Sci USA. 2012; ; 109 : :911.–916. 4.
Fernandez-Sanchez ME, Barbier S, Whitehead J, et al. Mechanical induction of the tumorigenic b-catenin pathway by tumour growth pressure . Nature. 2015; ; 523 : :92.–95. 5.
MacDonald BT, Tamai K, He X. Wnt/β-catenin signaling: components, mechanisms, and diseases . Dev Cell. 2009; ; 17 : :9.–26. 6.
Gujral TS, van Veelen W, Richardson DS, et al. A novel RET kinase-b-catenin signaling pathway contributes to tumorigenesis in thyroid carcinoma . Cancer Res. 2008; ; 68 : :1338.–1346. 7.
Hannigan G, Troussard AA, Dedhar S. Integrin-linked kinase: a cancer therapeutic target unique among its ILK . Nat Rev Cancer. 2005; ; 5 : :51.–63. 8.
Lamaze C, Torrino S. Caveolae and cancer: a new mechanical perspective . Biomed J. 2015; ; 38 : :367.–379. 9.
Goetz JG, Minguet S, Navarro-Lérida I, et al. Biomechanical remodeling of the microenvironment by stromal caveolin-1 favors tumor invasion and metastasis . Cell. 2011; ; 146 : :148.–163. 10.
Sinha B, Köster D, Ruez R, et al. Cells respond to mechanical stress by rapid disassembly of caveolae . Cell. 2011; ; 144 : :402.–413. 11.
Nassoy P, Lamaze C. Stressing caveolae new role in cell mechanics . Trends Cell Biol. 2012; ; 22 : :381.–389. |