| |
| Med Sci (Paris). 32(8-9): 758–767. doi: 10.1051/medsci/20163208025.La cryo-microscopie, une alternative à la cristallographie aux rayons X ? Jean A. Boutin,1* Zhuolun Li,2 Laurent Vuillard,1 and Catherine Vénien-Bryan2 1Pôle d’expertise Biotechnologie, Chimie et Biologie, Institut de Recherches Servier, 125, chemin de Ronde, 78290 Croissy-sur-Seine, France 2Institut de minéralogie, de physique des matériaux et de cosmochimie, UMR 7590, CNRS, UPMC, IRD, MNHN, 75005 Paris, France |
La fascination qu’exerce l’infiniment petit sur le biochimiste moléculaire a toujours été immense. Par exemple, dans la recherche d’inhibiteurs enzymatiques, la visualisation de l’interaction entre une molécule (naturelle ou synthétique) et sa cible protéique a été le Graal d’un grand nombre de chercheurs. L’arrivée des approches de co-cristallisation au service de la découverte de substances actives – improprement appelées « médicaments » alors que ce ne sont que des substances bien loin d’avoir les caractéristiques qui les feront admettre par les Agences dans les pharmacopées – a bouleversé notre vision de nos métiers. Nous avons pu avoir accès à la visualisation de molécules, dont nous connaissions l’activité, en interaction statique (grâce à la co-cristallisation) puis, dans certains cas plus rares, dynamique avec leur cible (par la RMN, résonance magnétique nucléaire). Nous avons pu apporter au chimiste médicinal, qui orchestre les étapes de synthèse qui conduiront la substance active au statut de médicament, des données concrètes – et très pédagogiques – sur l’interaction entre la molécule et sa cible protéique. De très nombreux exemples de ces approches couronnées de succès émaillent la littérature. L’obtention de co-cristaux passe par une succession d’étapes délicates : construction par génie génétique de la protéine ciblée, en excluant souvent les parties trop flexibles (telles qu’elles peuvent être déterminées par prédiction de modélisation moléculaire) ; expression des protéines dans un hôte puissamment producteur, comme la bactérie ou la levure ; purification à homogénéité1, (faute de quoi la protéine « refusera » de cristalliser) ; sélection des conditions de cristallisation (qui sont souvent strictement dépendantes de la séquence de la protéine) ; analyse de ces cristaux sur une ligne de lumière dédiée à la production de rayons X d’un synchrotron2 ; enregistrement de la diffraction des rayons X par ce cristal ; et, enfin, interprétation de ces cartes de diffraction, ce qui permet d’accéder à une fonction appelée densité électronique et de calculer ainsi le modèle tridimensionnel de la protéine telle qu’elle est dans le cristal (voir par exemple Friedmann et al. [1]). Il fut un temps où seules les synthèses successives puis l’analyse de l’influence des molécules obtenues dans un test enzymatique ou réceptoriel, par exemple, permettaient de comprendre la relation structure/activité au sein d’une série chimique synthétisée. Grâce aux approches de co-cristallisation, il est maintenant possible de concevoir les étapes de synthèse de nouvelles molécules (par exemple un inhibiteur enzymatique) sur la base de données concrètes, tridimensionnelles et visualisables : ces approches de visualisation structure/interaction ont permis des progrès immenses. Pourquoi, dès lors, s’ébaubir de ces nouvelles performances de la cryo-microscopie électronique ? Rappelons-nous que les données qui ont été collectées et qui peuplent la PDB (RCSB, protein data bank, http://www.rcsb.org/pdb, une base de données de modélisation moléculaire) furent majoritairement obtenues par la cristallisation, sur des structures figées. Cet état ne montre donc les relations d’atomes à atomes que dans l’état le plus stable qui n’est pas forcément le plus fréquent ni le plus représentatif de celui présent dans une cellule. Rappelons également que ce qui est visualisé dans cet état, est une protéine composée de plusieurs dizaines de milliers d’atomes de carbone, d’oxygène, d’azote, etc. (mais pas d’hydrogène). C’est déjà un tour de force, même si obtenir de telles visualisations sur de nouvelles cibles est devenu routinier. Depuis quelques années, des techniques complémentaires à la cristallisation sont apparues. D’un intérêt certain, elles suscitent l’enthousiasme puisqu’elles permettent de visualiser des protéines dans des états qui ne sont plus figés, mais qui correspondent, à l’origine, à ceux qu’elles adoptent lorsqu’elles sont en solution [2, 3]. Ce virage, nous l’avions nous-mêmes pressenti il y a quelques années [4] et, finalement, ce n’est certainement pas un hasard que le numéro de janvier 2016 de Nature Methods ait consacré cette technologie Technology of the Year (voir l’éditorial de M. Eisenstein à ce sujet [5]). |
Les particularités de la cryo-microscopie électronique à transmission L’histoire de la microscopie électronique et de son application à l’observation d’objets biologiques est jalonnée de découvertes qui, à chaque fois, ont permis de repousser ses limites en termes de résolution. Ces découvertes peuvent concerner la préparation de l’échantillon, la performance des microscopes, la capture ou le traitement des images obtenues. La microscopie électronique à transmission (MET) est un outil idéal d’investigation d’objets biologiques, même si, à l’heure actuelle, le vide poussé dans lequel se propagent les électrons (au niveau de la colonne à l’intérieur du microscope) ne permet pas encore d’explorer de façon satisfaisante la structure de la cellule vivante. Néanmoins, des observations spectaculaires de matériel biologique « vivant » utilisant des porte-échantillons équipés de technologies micro-fluidiques ont été décrites récemment [ 6], mais ceci n’est pas l’objet de la présente revue. La première grande avancée de la microscopie électronique à transmission (MET) fut apportée vers la fin des années 1980, lorsque l’équipe de Jacques Dubochet proposa d’utiliser l’éthane liquide pour la préparation des échantillons de protéines, de macromolécules ou de virus. La congélation ultra rapide à très basse température (inférieure à -185 °C) était, et reste toujours, la clé de cette préparation. En effet, la vitesse de congélation est suffisamment élevée pour éviter que l’eau ne cristallise et ne favorise la formation de glace à l’état vitreux [ 7]. L’échantillon est alors placé dans le vide poussé du microscope électronique et observé, à -180 oC. Cette méthode nouvelle de préparation d’échantillons s’affranchissait ainsi de l’utilisation de colorants (par exemple les sels de métaux lourds tels que l’acétate d’uranyle) et des artefacts qui leur sont associés. Ce progrès spectaculaire dans la préparation des échantillons transforma la MET en cryo-MET (cryo-microscopie électronique à transmission). Depuis trente ans, cette méthode de préparation, cryo-MET, s’est imposée comme un outil majeur en biologie structurale pour l’observation et la prise d’images d’échantillons dans leur environnement physiologique, un prérequis pour toute étude à haute résolution. Dans ces conditions de congélation rapide, la densité de la glace, à l’état vitreux, qui entoure l’échantillon, est inférieure à celle des protéines et des acides nucléiques. Grâce à cette différence de densité, les particules individuelles peuvent donc être observées sur les micrographes. De plus, la cryo-MET préserve les caractéristiques des structures biologiques à une résolution atomique et la basse température utilisée au cours de l’observation en microscopie électronique, permet une certaine protection des échantillons contre les dommages possiblement induits par les bombardements par les électrons. Les images capturées lors de cette observation, avec un microscope électronique produisant un faisceau d’électrons de 200 kV à 300 kV, permettent ensuite de calculer la structure des macromolécules observées. Les images de projection proviennent en fait des multiples macromolécules biologiques possédant des orientations aléatoires, en suspension dans le film vitrifié. La structure en trois dimensions (3D) de ces macromolécules est donc ensuite déterminée en combinant et en reconstruisant les images de projection dans un volume tridimensionnel (
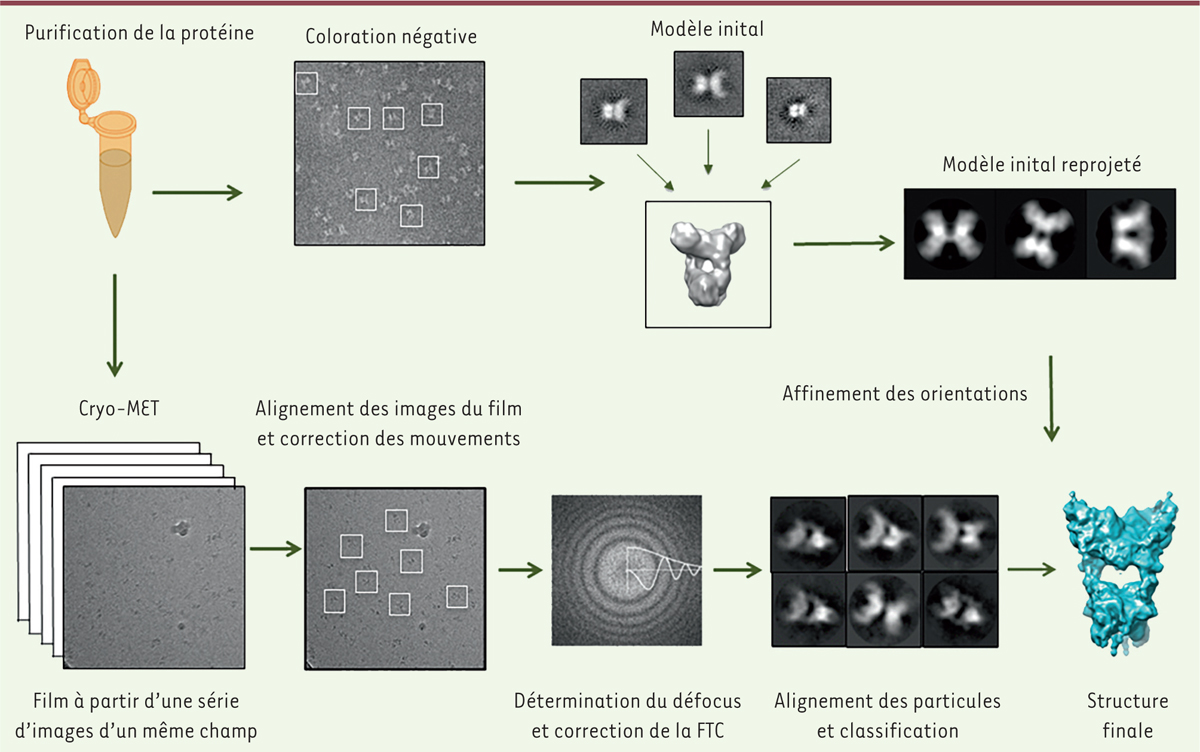
Figure 1
moitié supérieure). Parce que l’information donnée par chaque image est bruyante et incomplète, des dizaines, voire des centaines, de milliers de particules imagées doivent être alignées et moyennées. La qualité de la carte finale de la macromolécule dépend ainsi de la précision avec laquelle les orientations des particules sont déterminées les unes par rapport aux autres par des logiciels ad hoc. Joachim Frank et ses collaborateurs [ 8] ont développé au cours des quarante dernières années des méthodes de traitement d’images de particules isolées. Ils ont ainsi montré qu’en combinant des images à partir de nombreuses particules et en identifiant l’orientation relative de ces particules sur la grille de microscopie électronique, on pouvait augmenter le rapport signal sur bruit, ce qui permettait de calculer les structures dans les trois dimensions de ces macromolécules biologiques. Cette méthode est plus performante pour des particules volumineuses car plus facilement visibles. Il y a donc une limite de taille inférieure pour la visualisation de ces macromolécules en cryo-MET. Jusqu’à très récemment elle était aux alentours de 250 kDa. Cependant, il convient de noter qu’en tenant compte de ces limitations, à partir d’images parfaites et à l’aide de calculs théoriques, Richard Henderson a estimé qu’avec seulement 12 000 particules de taille aussi petite que 40 kDa, on devrait obtenir une résolution finale du volume de reconstruction de 3 Å [ 9].
 | Figure 1.
Présentation schématique de la reconstruction dans les trois dimensions de particules isolées. La pureté élevée de l’échantillon est importante, comme en cristallographie des rayons X. Dans un premier temps, l’observation de l’échantillon en coloration négative est une étape utile car elle permet de visualiser clairement l’échantillon, de vérifier son homogénéité, en particulier pour les petites particules. Les particules sont sélectionnées à partir des micrographes, puis centrées et alignées. La classification et le moyennage des images permettent d’améliorer le rapport signal sur bruit, et les moyennes de classe peuvent être utilisées pour calculer un modèle initial à faible résolution de notre macromolécule d’intérêt. Celui-ci est calculé en utilisant la méthode des lignes communes ou la méthode des séries coniques aléatoires [ 7]. Puis, lors de l’étape de la cryo-MET, l’échantillon vitrifié est imagé en utilisant les détecteurs directs d’électrons (on obtient un film à partir de plusieurs images d’un même champ de la grille de microscopie électronique). La correction de mouvement entre les différentes images du film est effectuée. Les particules sont ensuite fenêtrées, moyennées. La détermination de la valeur de défocus permet la correction de la fonction de transfert de contraste (FTC). Après l’alignement et la classification de l’ensemble des données, on affecte à chaque particule une orientation de projection par rapport au modèle initial. L’affinement des valeurs des orientations est effectué de manière itérative jusqu’à ce que la structure dans les 3 dimensions de la macromolécule d’intérêt converge. |
Malgré les progrès spectaculaires de la cryo-MET, la résolution des structures biologiques était encore récemment limitée à 10 Å et, à ce stade, ne rivalisait en rien avec les données déterminées par cristallographie des rayons X ou par RMN (en tous cas, celles obtenues à une résolution meilleure que 4 Å). On peut voir par exemple les structures du ribosome ou de l’ADN topoisomérase qui ont été décrites par cette méthode [10–12] (→).
(→) Voir la Synthèse de Reynald Gillet et Brice Felden, m/s n° 6-7, juin-juillet 2007, page 633 ; la Dernière heure de S. Marzi et al., m/s n° 10, octobre 2007, page 881 ; la Nouvelle de J. Papillon et al., m/s n° 12, décembre 2014, page 1081
Les défis spécifiques de la cryo-microscopie électronique à transmission Les deux principaux problèmes qui entravent la détermination de structure à haute résolution par cryo-MET combinée à l’analyse d’image sont : (1) le faible rapport signal sur bruit des images capturées, la conséquence étant des images à très faible contraste limitant la taille d’observation des macromolécules biologiques et (2) le mouvement de l’échantillon lors de la prise de vue dans le microscope électronique qui a pour conséquence la dégradation de la qualité des images. Le principal défi en cryo-MET est l’amélioration du faible rapport signal sur bruit ou, en d’autres termes, du mauvais contraste de l’image. Ce faible contraste est l’inévitable conséquence de la masse atomique peu élevée des atomes (H, C, O, N, etc.) qui constituent les objets biologiques (protéines, acides nucléiques, glucides, lipides). De plus, ceux-ci sont très sensibles au rayonnement des électrons. Des doses très faibles d’électrons doivent donc être utilisées pour observer les structures biologiques en cryo-MET. Ainsi, des expositions dépassant une dose limite d’électrons cassent les liaisons covalentes irréversiblement, détruisant les détails structuraux que nous cherchons à élucider. Une autre difficulté contrecarrant les approches pour obtenir des informations à haute résolution est inhérente à l’interaction des électrons avec l’échantillon dans le microscope. En effet, pour obtenir des informations détaillées de structures biologiques, les particules ne doivent pas se déplacer de plus d’un Å, ce qui équivaut au diamètre d’un atome d’hydrogène. Cependant, des mouvements de plus grande amplitude apparaissent lorsque le faisceau d’électrons frappe l’échantillon biologique. Ils ont plusieurs origines. D’abord, l’impact des électrons sur le film de glace vitreuse dans lequel se trouvent les particules biologiques peut provoquer des dilatations thermiques et la libération de contraintes au niveau de celui-ci. L’irradiation par les électrons peut également casser les liaisons covalentes des structures biologiques générant la formation de molécules à l’état gazeux (comme l’hydrogène, l’oxygène, l’azote et le méthane) qui s’échappent du film de glace. Ces mouvements sont inévitablement induits par le faisceau d’électrons et ont rendu extrêmement difficile la collecte des images à haute résolution dans le passé. L’enregistrement d’une image à faible dose sur un support classique (caméras CCD [ charge coupled device pour dispositif à couplage de charge], ou film photographique) prend quelques secondes, période pendant laquelle les mouvements de l’objet biologique vont dégrader les données à haute résolution. Les apports technologiques et méthodologiques récents : une révolution ? Pourquoi ? Depuis 2012, de nouveaux détecteurs sont disponibles. Ils sont plus performants car ils permettent de détecter directement les électrons. Traditionnellement, les images de microscopie électronique étaient enregistrées sur un film argentique puis numérisées. L’avènement de la caméra CCD a permis l’automatisation du processus de collecte de données et par conséquent l’augmentation de l’ensemble des données à la fois en nombre et en taille. Cependant, la limitation majeure de ces caméras provient de ce que les électrons doivent d’abord être convertis en photons par interaction avec un scintillateur. Des événements de diffusion de ces électrons dans le scintillateur donnent naissance à un large «nuage» de photons et cela pour chaque électron qui contribue à la formation de l’image. La taille de ce nuage étant plus grand que la taille des pixels de la caméra CCD, le résultat est une très forte atténuation du signal à haute résolution et donc, une limitation dans la résolution finale de la structure d’intérêt. La détection directe des électrons sur une plaquette de silicium permet de s’affranchir de l’étape des scintillateurs nécessaire pour les caméras CCD mais plusieurs obstacles techniques ont dû être surmontés pour réaliser ces nouvelles caméras. Le plus important fut le développement d’un support résistant aux radiations afin de réduire la détérioration de la puce de silicium et permettre l’utilisation du détecteur pour de nombreuses expositions. Ces caméras, maintenant commercialisées par trois sociétés différentes, possèdent une sensibilité remarquable permettant d’augmenter considérablement le contraste des images (la visualisation aisée de petites protéines de l’ordre de 100 kDa est désormais possible). De plus, les informations structurales à haute résolution sont préservées. Une autre qualité remarquable de ces nouvelles caméras est leur lecture très rapide : au lieu d’enregistrer une seule image par seconde (ce qui est le cas des films et des caméras CCD), les nouvelles caméras enregistrent des films de plusieurs images par seconde. Comme sur un film vidéo, nous disposons donc d’images successives d’un même champ qui permettent de détecter lors de l’enregistrement, des mouvements très petits à l’échelle de l’Å. Une fois identifiés d’un plan film à l’autre, les mouvements des particules sont corrigés à l’aide d’un logiciel approprié. Chaque image est alors additionnée pour donner une image finale beaucoup plus nette car chaque particule est alignée d’un film à l’autre (Figure 2).
 | Figure 2.
Correction de mouvement et récupération d’informations à haute résolution. Moyenne des images successives d’un film, prises sur un même champ de phosphorylase kinase, une macromolécule de 1,3 MDa avant (A) et après (B) l’alignement. Les caractéristiques structurales de la protéine sont floues avant l’alignement. |
En parallèle, de nouveaux logiciels de traitement d’image plus performants sont également apparus : ils permettent de corriger ou de compenser les mouvements décrits ci-dessus [13] mais aussi, d’extraire l’information de détails structuraux à partir des images capturées de manière optimale. Ainsi, une autre avancée majeure dans l’analyse des images obtenues en cryo-EM est l’utilisation de la méthode de maximum de vraisemblance (ML, maximum likelihood), introduite par F. Sigworth [14], ayant la capacité de gérer des données bruitées. En effet, avec cette méthode, on n’attribue pas une orientation précise à une particule, en référence à un critère de similitude, mais plutôt un ensemble de probabilités d’être dans une certaine orientation. Ainsi, le logiciel RELION [15] est maintenant largement adopté. Une interface très conviviale permet son accès par une très large communauté d’utilisateurs pour l’analyse de particules. Il fonctionne en grande partie sans l’intervention de l’utilisateur. Il calcule des modèles dans les trois dimensions moins bruitées et fournit des critères objectifs de validation de la structure finale et, par conséquent, produit des résultats plus fiables [15, 16] (voir aussi
Figure 1
). Ce logiciel dispose également d’une méthode de classification puissante particulièrement efficace pour le tri des particules selon des sous-classes structurales plus homogènes, ce qui permet de séparer les différents états conformationnels de molécules présentes simultanément dans une préparation déposée sur la grille de microscopie électronique [17]. Ainsi, contrairement à la cristallographie aux rayons X, dans laquelle la géométrie des cristaux verrouille les protéines dans une seule conformation, la cryo-MET permet de mettre en évidence des structures de protéines congelées dans plusieurs conformations et d’en déduire des dynamiques moléculaires sur lesquelles repose le fonctionnement de ces protéines. Un exemple frappant est celui du récepteur AMPA3 [18] pour lequel un film réalisé à partir d’images de cryo-MET illustre les très larges réarrangements conformationnels des domaines N-terminal et de liaison au ligand du récepteur à l’état désensibilisé. La méthode permet également de classifier des échantillons inhomogènes (d’un point de vue biochimique). Finalement, l’échantillon peut être « purifié » dans une certaine mesure par le traitement des images plutôt que lors des étapes fastidieuses de purifications biochimiques. |
Quelques exemples Le nombre de protéines étudiées par les méthodes que nous avons décrites suit une progression exponentielle. Pour le moment, les réalisations les plus spectaculaires sont relativement peu nombreuses et un certain nombre de ces réalisations ont une qualité équivalente à celle obtenue par la cristallographie des rayons X (Tableau I). Parmi les molécules analysées, citons, par exemple, de grosses macromolécules telles que le ribosome mais aussi de « petites » protéines comme le complexe γ-sécrétase 4, résolue à 4,5 Å (à partir de 144 000 particules). La carte 4,5 Å révèle la structure secondaire du complexe, à la fois au niveau du domaine cytoplasmique et dans la membrane où est localisé le site actif [ 19].
Tableau I.
| Protéine |
PDB |
Masse moléculaire(kDa) |
PDB pour la microscopie électronique |
Résolution (Å) |
Nature de la protéine |
Référence |
| Canal Sec61 |
3jc2 |
287 |
EMD-3245 |
3,6 |
Le canal de translocation humaine Sec61 |
[32] |
|
| TRPV2 |
5AN8 |
344 |
|
3,8 |
Le récepteur de capaïcine 2 |
[33] |
|
| Complexe Cav1.1 |
3JBR |
275 |
EMD-6475
EMD-6476 |
4,2
6,1 |
Le canal calcique voltage-dépendant de lapin Cav1.l |
[34] |
|
| Gly receptor |
3JAD |
190 |
EMD-6344
EMD-6345 |
3,9 |
Le récepteur alpha-1 glycine |
non publié |
|
| TRPV1 |
|
92x4=368 |
5776 |
3,8 |
Le recepteur à capaïcine 1 |
[35] |
|
| Gamma-sécrétase |
5a63 |
170 |
EMD-3061 |
3,4 |
Le complexe gamma-sécrétase |
[36] |
|
| Gamma-sécrétase |
5fn2 |
170 |
EMD-3237 EMD-3238 EMD-3239 |
4,2
4,1
4,0 |
Le complexe gamma-sécrétase |
[37] |
|
| Complexe 1 |
|
1 000 |
EMD-2676 |
5,0 |
Le complexe respiratoire bovin I |
[38] |
|
| Slo2.2 |
5a6e 5a6f |
97x4=388 |
EMD-3062 |
4,5 |
Le canal à K+ activé par le Na+
|
[39] |
|
| RyR1 |
3J8E |
2 570 |
EMD-6106 et 6107 |
4,8 |
Le récepteur Ryanodine 1 |
[22] |
|
| RyR1 |
3J8H |
|
EMD-2807 |
3,8 |
Le récepteur Ryanodine 1 |
[20] |
|
| RyR1 |
4UWE
4UWA |
|
EMD-2751 |
8,5
6,1 |
Le récepteur Ryanodine 1 |
[21] |
|
| IP3R1 |
3JAV |
1 250 |
EMD-6369 |
4,7 |
Le canal IP3R1 |
[40] |
|
| Piezo1 |
3jac |
900 |
EMD-6343 |
4,8 |
Le canal PIEZO1 mécanosensible mammifère |
[41] |
|
| ATP synthase |
5fil |
600 |
EMD-3170 |
7,1 |
L’ATP synthase mitochondriale bovine |
[42] |
|
| CorA |
3jcf
3jcg
3jch |
208 |
EMD-6551 |
3,8
7,1
7,1 |
Le système de transport du Mg2+
|
[43] |
|
| Composant poly-C9 |
5fmw |
1 220 |
EMD-3235 |
8,0 |
Le complexe d’attaque membranaire assimilé aux perforines |
[44] |
|
| TRPA1 |
3j9p |
670 |
EMD-6267 |
4,2 |
Le canal ionique TRPA1 |
[45] |
Principales structures protéiques membranaires obtenues par cryo-microscopie électronique. Ce tableau rassemble les structures de protéines membranaires obtenues par cryo-microscopie électronique à des résolutions inférieures à 8 Å. C’est un choix délibéré dicté par la difficulté d’obtenir de telles données sur ce type de protéines par cristallographie et diffraction des rayons X. PDB : protein data bank. |
Particulièrement marquantes sont trois publications réalisées par trois groupes différents (et publiées dans le même numéro de Nature), très révélatrices des progrès extraordinaires accomplis. Elles rapportent la résolution à des niveaux remarquables d’un monstre endoplasmique de 4 × 500 000 daltons, le récepteur de la ryanodine 1 (RyR1)5, [20–22, 46] (→).
(→) Voir la Nouvelle de J. Lunardi et al., m/s n° 11, novembre 2008, page 897
Cette protéine, qui régule la sortie massive de calcium du réticulum endoplasmique du muscle squelettique ou cardiaque, initie la contraction. Les deux récepteurs, RyR1 et RyR2, respectivement musculaire ou cardiaque, sont structurellement relativement proches. On peut donc imaginer que ce qui sera acquis sur l’un permettra de comprendre l’autre. Cette protéine est régulée par un florilège de protéines dont les calstabines6. Sa structure n’était connue que par fragments (voir par exemple Tung et al. [23]), rendant difficile non seulement la compréhension globale de son mécanisme d’action et ses régulations au niveau moléculaire, mais également périlleux la synthèse de nouvelles molécules ayant des propriétés régulatrices, en dehors de la ryanodine et de ses analogues [24], de l’imperatoxine [25] ou des analogues de la rapamycine [26]. Il est clair qu’une démarche de cristallographie était inimaginable dans l’état actuel de l’Art. La purification à homogénéité de la protéine naturelle à partir de muscle squelettique (et non recombinante) par chromatographie d’affinité, conduit à l’obtention de matériel d’une très grande pureté. Les différentes approches réalisées dans les trois études se recoupent, et le matériel qui a été utilisé est, dans tous les cas, un nombre assez grand de particules du récepteur pur. Ainsi, entre 100 000 particules [19], 230 000 particules [20] et 245 000 particules [18] issues de 500 à 3 400 micrographes ont été sélectionnées. La détermination de l’architecture du complexe multi-protéique devrait donc permettre de mieux comprendre les relations entre les différents éléments, mais aussi de définir le site où certaines régulations pharmacologiques peuvent prendre place. Le nombre très important de mutations [27] de la forme majoritairement exprimée dans le cœur, RyR2 (très proche, en termes de séquence de RyR1), et leurs associations à différent types de pathologies cardiaques, fait de ce récepteur une cible de choix pour des anti-arythmiques. Il est donc capital d’avoir accès à la visualisation de cet ensemble moléculaire afin d’envisager des voies pharmacologiques de régulation. Ceci n’est qu’un exemple d’élucidation de la structure de complexes pluri-protéines dont les architectures changent en fonction des circonstances physiopathologiques (Figure 3). Des travaux portant sur d’autres complexes, comme celui du pore nucléaire par exemple [28], amènent de nouvelles informations sur ces structures qui sont dans la plupart des cas inatteignables pour le cristallographe parce que trop larges.
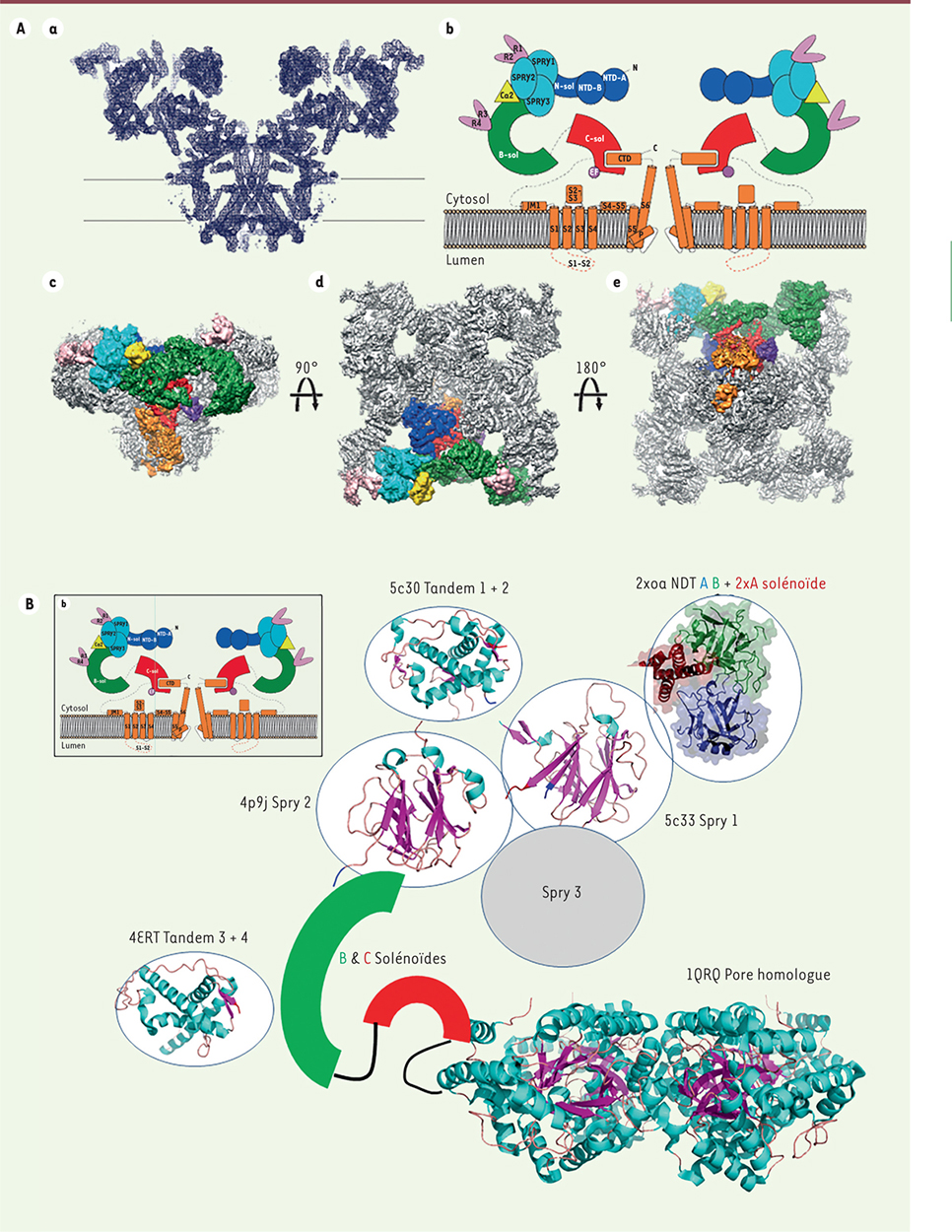
 | Figure 3.
Le récepteur de la ryanodine de type 1 (RyR1). A. Structure de RyR1 (d’après [ 22]). La résolution est à 4,8 Å. (a) L’architecture moléculaire de RyR1 déterminée par cryo-microscopie électronique. (b) Représentation schématique correspondante en coupe dans le plan du canal : en bleu foncé, le domaine N-terminal ; en cyan, les domaines Spry 1 à 3 ; en rose, les domain repeats 1, 2 et 3, 4 ; en vert, le domaine de connexion solénoïde ; en rouge, le domaine solénoïde central ; en orange, les régions transmembranaires et C-terminales. La calstabine est colorée en jaune. Représentations globales issues de la cryo-microscopie électronique perpendiculaire à la membrane (c), parallèle à la membrane : par-dessus (d) et par-dessous (e). Les zones correspondant au descriptif ci-dessus sont colorées selon le même code. B. Représentation schématique de RyR1. Le schéma de la
Figure 3A
est repris et les structures obtenues par cristallographie des domaines de RyR1 ont été placées sur le modèle global obtenu par cryo-microscopie électronique. Les codes PDB sont indiqués sur chaque domaine résolu : 5c30 pour les tandems 1 et 2 ; 2xoa pour la partie du domaine N-terminal, AB avec les deux solénoïdes A ; 4p9j pour Spry 2 ; 5c33 pour Spry1 ; 4ERT pour les domaines tandem 3 et 4 et 1QRQ pour le domaine de la sous-unité β du canal potassique voltage-dépendant. PDB : protein data bank. |
|
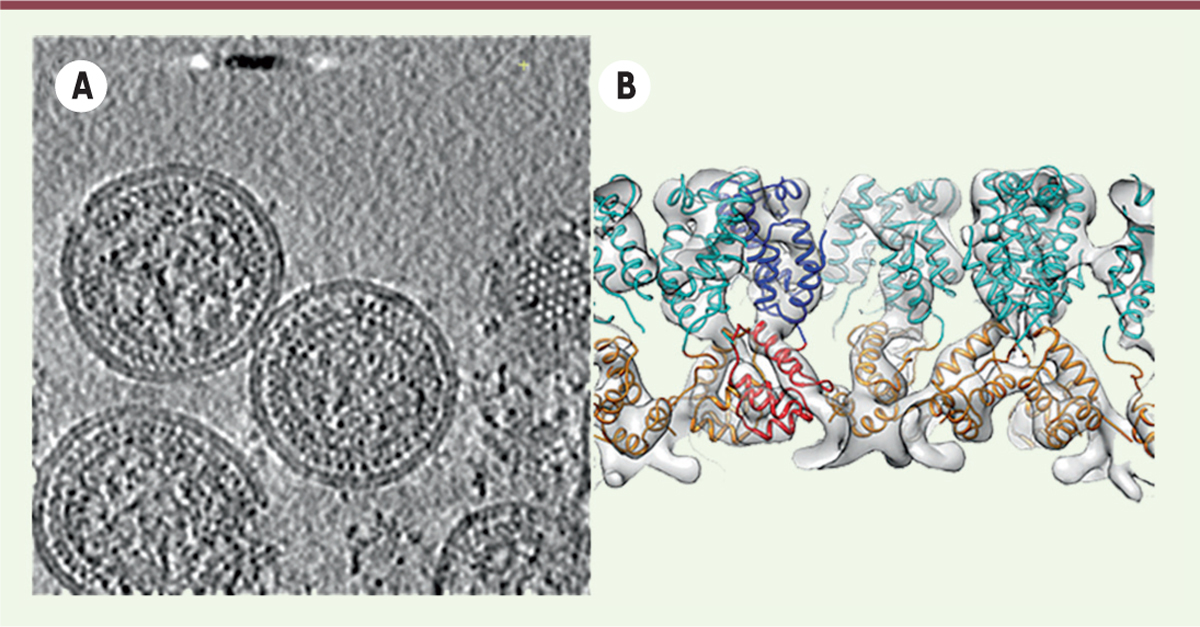
Moins de résolution, mais de superbes structures grâce à la cryo-tomographie électronique Des informations à haute résolution peuvent donc être calculées à partir de complexes macromoléculaires qui ont été purifiés. Désormais, grâce à la cryo-tomographie électronique, des informations structurales à haute résolution de structures biologiques peuvent être récupérées à l’intérieur de la cellule sans besoin de les purifier au préalable. Les récentes avancées technologiques comme les détecteurs directs d’électrons ainsi que l’utilisation de filtres d’énergie à l’intérieur de la colonne du microscope électronique, permettent d’augmenter le rapport signal sur bruit. Ainsi, il est possible d’accéder à des informations beaucoup plus détaillées. Grâce aussi aux progrès informatiques et à des logiciels d’acquisition et de reconstruction dédiés, cette technique est de plus en plus accessible aux biologistes. Le principe de la tomographie se base sur la collecte d’images à partir d’une série d’inclinaisons de l’échantillon contenant un certain nombre de copies du complexe macromoléculaire d’intérêt. On obtient ainsi différentes vues de l’objet biologique et, si le nombre de vues (projections) est suffisant, on peut retrouver par le calcul, l’information tridimensionnelle du volume initial. Cette étape constitue la reconstruction du tomogramme. Les sous-volumes de la macromolécule d’intérêt sont ensuite découpés, extraits du tomogramme puis alignés et classés (méthode des sub-tomogrammes moyennés). Le moyennage des différentes copies de la structure présentes dans différentes orientations permet d’améliorer la résolution. Ainsi, un grand nombre de sous-volumes homogènes facilite l’analyse et permet d’obtenir des caractéristiques moléculaires à haute résolution. Schur et al. [29] ont appliqué la méthode des sub-tomogrammes à l’étude de la capside immature du VIH-1 (virus de l’immunodéficience humaine) à une résolution de 8.8 Å. Cela a permis, sans ambiguïté, de positionner toutes les hélices de la polyprotéine de structure Gag dans l’enveloppe du virus (Figure 4).
 | Figure 4.
Exemple de cryo-tomographie électronique, et de sub-tomogrammes moyennés. A. Tomogramme de capside du VIH-1 (virus de l’immunodéficience humaine de type 1) immature (EMD2708). B. Représentation de la structure finale de la protéine CA-SP1 à 8,8 Å de résolution après moyennage des subtomogrammes. Les structures à haute résolution de CA-NTD (cyan) et CA-CTD (orange) ont été ajustées dans la densité (EMD2707). D’après [ 29]. |
|
Bien que les résultats récemment obtenus soient sans précédent et révolutionnaires, le développement de nouveaux inhibiteurs pharmacologiques nécessite des données structurales meilleures que 3 Å. Cette résolution reste actuellement difficilement accessible pour un ensemble de petites protéines. Mais pour combien de temps ? La cryo-MET continue d’évoluer et des améliorations sont en cours. Parmi celles-ci, citons :
-
Une amélioration des caméras à détection directe d’électrons avec des puces de détection plus minces et avec une vitesse de lecture plus rapide, ce qui améliorera le rapport signal sur bruit à haute résolution.
-
L’amélioration de la technologie des « phases plates » (éléments à rajouter au niveau de la colonne permettant d’augmenter le contraste des images). Permettant la formation d’images à fort contraste, ce sera très avantageux pour l’étude des petites protéines.
-
Les méthodes de compensation de mouvement utilisées actuellement sont toujours relativement peu efficaces au tout début de l’exposition. C’est précisément à ce moment que les mouvements sont les plus larges mais aussi que les données collectées aux plus hautes résolutions disparaissent très rapidement à cause des dommages dus à l’irradiation [15]. Résoudre ce problème est crucial et permettra de récupérer des informations avant l’apparition des phénomènes d’irradiation qui sont irrémédiables.
-
Des améliorations dans la préparation des échantillons, avec par exemple l’utilisation de supports moins susceptibles de se déplacer sous le bombardement d’électrons, ou des méthodes permettant la visualisation plus facile de petites protéines comme l’utilisation d’anticorps spécifiques (particulier du fragment Fab de l’immunoglobuline) ou de protéines de fusion afin d’identifier plus efficacement les protéines sur la grille de microscopie. De telles molécules peuvent être utilisées non seulement comme des « repères » permettant un meilleur alignement lors de la classification des objets mais elles permettent également de valider une reconstruction [30].
Les défis immédiats auxquels nous sommes confrontés sont les coûts élevés d’achat et d’entretien des microscopes performants pour l’étude des structures à haute résolution. Les temps de calcul pour l’analyse des images sont très importants et nécessitent des supercalculateurs. Le faible accès à ces instruments (en relation avec la demande croissante) et leurs coûts appellent donc à un nouveau modèle commun de financement et d’utilisation. En outre, apprendre la cryo-MET combinée à l’analyse d’images à haute résolution n’est finalement pas aussi facile que cela peut paraître. Mais le domaine est en pleine évolution et des logiciels aussi conviviaux que ceux utilisés en cristallographie aux rayons X, devraient par exemple être rapidement proposés aux utilisateurs. Il y a des raisons de penser qu’une fois ces nouveaux développements d’équipements et de logiciels mis en place de façon pratique, peut-être dans une vingtaine d’années, le rêve d’utiliser la cryo-MET pour déterminer les structures protéiques à une résolution atomique avec seulement quelques milliers de particules, comme le décrit Richard Henderson [9], deviendra enfin une réalité. |
Il est clair pour nous que l’arsenal de méthodes permettant d’obtenir des données structurales sur des protéines, qu’elles fussent de taille raisonnable ou pas, ne fait qu’accroître le champ des possibles. Il est clair aussi, que contrairement à ce qu’écrit Callaway [31] : « The revolution will not be crystallized », la cristallisation restera une méthode de choix, et peut-être de facilité, pour continuer à obtenir les informations nécessaires à la découverte et au développement de nouvelles entités chimiques à visée médicamenteuse sur des protéines de tailles « raisonnables ». Que cet arsenal comporte également des méthodologies attractives comme la cryo-MET, cela est évident. Que l’on s’enflamme pour penser qu’aujourd’hui, il est mieux de tout analyser avec la cryo-MET se heurte à quelques difficultés opérationnelles, ne serait-ce que l’achat de l’appareil. Il est d’ailleurs remarquable que quelques-unes des hypothèses sur la structure du récepteur RyR1 aient été en fait validées par cristallographie effectuée sur des portions de la protéine (Figure 3b). |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Friedmann D, Messick T, Marmorstein R. Crystallization of macromolecules . Curr Protoc Protein Sci. 2011; ; 17 : (4) : :1.–26. 2.
Vinothkumar KR. Membrane protein structures without crystals, by single particle electron cryomicroscopy . Curr Opin Struct Biol. 2015; ; 33 : :103.–114. 3.
Rupp B. Reviewing biomolecular crystallography proposals: time for a paradigm change . Trends Biochem Sci. 2015; ; 40 : :419.–421. 4.
Jonic S, Venien-Bryan C. Protein structure determination by electron cryo-microscopy . Curr Opin Pharmacol. 2009; ; 9 : :636.–642. 5.
Eisenstein M. The field that came in from the cold . Nat Methods. 2016; ; 13 : :19.–22. 6.
Peckys DB, Korf U, de Jonge N. Local variations of HER2 dimerization in breast cancer cells discovered by correlative fluorescence and liquid electron microscopy . Sci Adv. 2015; ; 1 : :e1500165.. 7.
Dubochet J, Adrian M, Chang JJ, et al. Cryo-electron microscopy of vitrified specimens . Q Rev Biophys. 1988; ; 21 : :129.–228. 8.
Frank J. Three-dimensional electron microscopy of macromolecular assemblies . New York: : Oxford University Press; , 2006. 9.
Henderson R. The potential and limitations of neutrons, electrons and X-rays for atomic resolution microscopy of unstained biological molecules . Q Rev Biophys. 2016; ; 28 : :171.–193. 10.
Gillet R, Felden B. Lost in translation : le déblocage des ribosomes bactériens par le mécanisme de trans-traduction . Med Sci (Paris). 2007; ; 23 : :633.–639. 11.
Marzi S, Romby P, Klaholz BP. Quand le fil de l’ARN messager s’entortille et bloque sa traduction… . Med Sci (Paris). 2007; ; 23 : :881.–883. 12.
Papillon J, Ménétret JF, Batisse C, et al. L’architecture moléculaire complète de l’AND gyrase révélée par cryo-microscopie électronique . Nouvelles informations sur le mécanisme de surenroulement négatif de l’ADN gyrase Med Sci (Paris). 2014; ; 30 : :1081.–1084. 13.
Li X, Mooney P, Zheng S, et al. Electron counting and beam-induced motion correction enable near-atomic-resolution single-particle cryo-EM . Nat Methods. 2013; ; 10 : :584.–590. 14.
Sigworth FJ. A maximum-likelihood approach to single-particle image refinement . J Struct Biol. 1998; ; 122 : :328.–339. 15.
Scheres SH, Chen S. Prevention of overfitting in cryo-EM structure determination . Nat Methods. 2012; ; 9 : :853.–854. 16.
Rosenthal PB, Henderson R. Optimal determination of particle orientation, absolute hand, and contrast loss in single-particle electron cryomicroscopy . J Mol Biol. 2003; ; 333 : :721.–745. 17.
Amunts A, Brown A, Bai XC, et al. Structure of the yeast mitochondrial large ribosomal subunit . Science. 2014; ; 343 : :1485.–1489. 18.
Durr KL, Chen L, Stein RA, et al. Structure and dynamics of AMPA receptor GluA2 in resting, pre-open, and desensitized states . Cell. 2014; ; 158 : :778.–792. 19.
Lu P, Bai XC, Ma D, et al. Three-dimensional structure of human gamma-secretase . Nature. 2014; ; 512 : :166.–170. 20.
Yan Z, Bai XC, Yan C, et al. Structure of the rabbit ryanodine receptor RyR1 at near-atomic resolution . Nature. 2015; ; 517 : :50.–55. 21.
Efremov RG, Leitner A, Aebersold R, et al. Architecture and conformational switch mechanism of the ryanodine receptor . Nature. 2015; ; 517 : :39.–43. 22.
Zalk R, Clarke OB, des Georges A, et al. Structure of a mammalian ryanodine receptor . Nature. 2015; ; 517 : :44.–49. 23.
Tung CC, Lobo PA, Kimlicka L, et al. The amino-terminal disease hotspot of ryanodine receptors forms a cytoplasmic vestibule . Nature. 2010; ; 468 : :585.–588. 24.
Sutko JL, Airey JA, Welch W, et al. The pharmacology of ryanodine and related compounds . Pharmacol Rev. 1997; ; 49 : :53.–98. 25.
El-Hayek R, Lokuta AJ, Arevalo C, et al. Peptide probe of ryanodine receptor function. Imperatoxin A, a peptide from the venom of the scorpion Pandinus imperator, selectively activates skeletal-type ryanodine receptor isoforms . J Biol Chem. 1995; ; 270 : :28696.–28704. 26.
Brillantes AB, Ondrias K, Scott A, et al. Stabilization of calcium release channel (ryanodine receptor) function by FK506-binding protein . Cell. 1994; ; 77 : :513.–523. 27.
Brini M. Ryanodine receptor defects in muscle genetic diseases . Biochem Biophys Res Commun. 2004; ; 322 : :1245.–1255. 28.
Stuwe T, Correia AR, Lin DH, et al. Nuclear pores. Architecture of the nuclear pore complex coat . Science. 2015; ; 347 : :1148.–1152. 29.
Schur FK, Hagen WJ, Rumlova M, et al. Structure of the immature HIV-1 capsid in intact virus particles at 8.8 A resolution . Nature. 2015; ; 517 : :505.–508. 30.
Wu S, Avila-Sakar A, Kim JM, et al. Fabs enable single particle cryoEM studies of small proteins . Structure. 2016; ; 20 : :582.–592. 31.
Callaway E. The revolution will not be crystallized: a new method sweeps through structural biology . Nature. 2015; ; 525 : :172.–174. 32.
Voorhees RM, Hegde RS. Structure of the Sec61 channel opened by a signal sequence . Science. 2016; ; 351 : :88.–91. 33.
Zubcevik L, Herzik MA, Chung BC, et al. Cryo-electron microscopy structure of the TRPV2 ion channel . Nat Struct Mol Biol. 2016; ; 23 : :180.–188. 34.
Wu J, Yan Z, Li Z, et al. Structure of the voltage-gated calcium channel Cav1.1 complex . Science. 2015; ; 350 : :aad2395.-. 35.
Cao E, Liao M, Julius D. TRPV1 structures indistinct conformations reveal activation mechanisms . Nature. 2015; ; 504 : :107.–112. 36.
Bai XC, Yan C, Yang G, et al. An atomic structure of human gamma-secretase . Nature. 2015; ; 525 : :212.–217. 37.
Bai XC, Rajendra E, Yang G, et al. Sampling the conformational space of the catalytic subunit of human gamma-secretase . eLife. 2015; ; 4 : :e11182.. 38.
Vinothkumar KR, Zhu J, Hirst J. Architecture of mammalian respiratory complex I . Nature. 2014; ; 515 : :80.–84. 39.
Hite RK, Yuan P, Li Z, et al. Cryo-electron microscopy structure of the Slo2.2 Na+-activated K+ channel . Nature. 2015; ; 527 : :198.–203. 40.
Fan G, Baker ML, Wang Z, et al. Gating machinery of InsP3R channels revealed by electron cryomicroscopy . Nature. 2015; ; 527 : :336.–341. 41.
Ge J, Li W, Zhao Q, et al. Architecture of the mammalian mechanosensitive Piezo1 channel . Nature. 2015; ; 527 : :64.–69. 42.
Zhou A, Rohou A, Schep DG, et al. Structure and conformational states of the bovine mitochondrial ATP synthase by cryo-EM . eLife. 2015; ; 4 : :e10180.. 43.
Matthies D, Dalmas O, Borgnia MJ, et al. Cryo-EM structures of the magnesium channel CorA reveal symmetry break upon gating . Cell. 2016; ; 164 : :747.–756. 44.
Dudkina NV, Spicer DA, Reboul CF, et al. Structure of the poly-C9 component of the complement membrane attack complex . Nat Commun. 2016; ; 7 : :10588.. 45.
Paulsen CE, Armache JP, Gao Y, et al. Structure of the TRPA1 ion channel suggests regulatory mechanisms . Nature. 2015; ; 520 : :511.–517. 46.
Lunardi J, Fauré J, Marty I, Monnier N. Le récepteur de la ryanodine de type I . Med Sci (Paris). 2008; ; 24 : :897.–899. |