| |
| Med Sci (Paris). 32(10): 800–802. doi: 10.1051/medsci/20163210003.Déficits intrinsèques des cellules satellites dans la dystrophie musculaire de Duchenne Caroline E. Brun1,2 and Nicolas A. Dumont3,4* 1Sprott center for stem cell research, Institut de recherche de l’hôpital d’Ottawa, Ottawa, ON, Canada 2Université d’Ottawa, Ottawa, ON, Canada 3Centre de recherche du centre hospitalier universitaire Ste-Justine, Montréal, Québec, Canada 4École de réadaptation, faculté de médecine, Université de Montréal, 7077 avenue du Parc, H3N 1X7 Montréal, Québec, Canada MeSH keywords: Animaux, Dystroglycanes, Dystrophine, Humains, Muscles squelettiques, Myopathie de Duchenne, Mutation, Régénération, Cellules satellites du muscle squelettique, génétique, physiologie, physiopathologie, thérapie |
Les cellules satellites dans la dystrophie musculaire de Duchenne Le muscle squelettique possède une capacité régénérative exceptionnelle lui permettant de restaurer son intégrité et ses fonctions suite à une blessure massive, en quelques semaines seulement [1]. Cette capacité est attribuable aux cellules souches musculaires adultes appelées cellules satellites. Dans le muscle sain, ces cellules sont quiescentes. Cependant, suite à un traumatisme, elles s’activent et prolifèrent rapidement, produisant ainsi un grand nombre de cellules musculaires différenciées, ou myoblastes, qui régénèreront les fibres musculaires endommagées [2]. La dystrophie musculaire de Duchenne (DMD) est une maladie dégénérative létale caractérisée par une faiblesse musculaire progressive et irréversible, et causée par une mutation dans le gène de la dystrophine, localisé sur le chromosome X. Ce gène code la protéine dystrophine, une grande protéine dont la région N-terminale se lie aux filaments d’actine et la région C-terminale au complexe dystroglycane à la membrane cellulaire. Grâce à sa structure, la dystrophine permet le maintien de l’architecture et de l’intégrité des fibres musculaires. L’absence de dystrophine dans les fibres musculaires de patients DMD entraîne consécutivement la nécrose primaire des fibres, suivie de l’infiltration chronique de cellules inflammatoires et de l’accumulation de fibrose et de tissu adipeux intramusculaire [3] (→).
(→) Voir la Synthèse de S. Dufresne et al., m/s n° 6-7, juin-juillet 2016, page 591
Les patients DMD présentent donc une dégénérescence des fibres musculaires et une fonte musculaire malgré la présence des cellules satellites au sein du tissu musculaire. Toutefois, les raisons pour lesquelles les cellules satellites ne parviennent pas à régénérer efficacement le tissu musculaire demeurent incertaines. Comme les cellules satellites sont constamment sollicitées dans les muscles dystrophiques, il a été suggéré que l’épuisement de la réserve de ces cellules, causé par le raccourcissement de leurs télomères, était la cause de la perte de la capacité régénérative [4]. Néanmoins, des études chez l’homme et la souris ont démontré que le nombre de cellules satellites dans les muscles dystrophiques est élevé, et ce, même dans les stades avancés de la maladie [5, 6]. |
Rôle du complexe dystroglycane dans les cellules satellites Si, jusqu’à récemment, l’expression de la dystrophine et des protéines du complexe dystroglycane (DGC) était restreinte aux fibres musculaires, l’analyse par puce à ADN a révélé que les cellules satellites expriment également la plupart des composants du DGC [7, 8]. Les cellules satellites expriment ainsi la protéine dystroglycane (Dag1) qui joue un rôle clé dans leur bon fonctionnement [9]. En effet, sa délétion spécifique uniquement dans les fibres musculaires entraîne une dégénérescence musculaire moindre que celle observée suite à sa délétion généralisée dans les fibres musculaires et les cellules satellites [9]. La glycosylation de Dag1 par deux glycosyltransférases, fukutine et LARGE (like-glycosyltransferase), est également essentielle pour permettre l’interaction du DGC avec la matrice extracellulaire [10]. Là encore, la délétion spécifique de la fukutine uniquement dans les fibres musculaires entraîne une dégénérescence musculaire moins importante que sa délétion dans les progéniteurs myogéniques [10]. Enfin, les cellules satellites déficientes pour LARGE présentent une capacité proliférative diminuée [11]. Ces résultats soulignent l’importance des protéines du DGC pour la fonction des cellules satellites et suggèrent que l’incapacité des cellules satellites à régénérer les muscles dystrophiques est due à des déficits cellulaires intrinsèques. Dans une récente étude, nous avons démontré que les cellules satellites sont intrinsèquement déficientes dans la DMD [7]. L’immunomarquage de cellules satellites murines, isolées de muscles sains en régénération ou de fibres musculaires cultivées ex vivo, a révélé que la dystrophine est exprimée dans une fraction de cellules satellites 24 à 36 heures suivant leur activation (c’est-à-dire leur sortie de l’état de quiescence). De plus, nous avons montré que la dystrophine se lie à la protéine Mark2 (microtubule affinity regulating kinase 2), un acteur important pour l’établissement de la polarité cellulaire. Le complexe dystrophine-Mark2 interagit avec un autre acteur de la polarité, la protéine Pard3 (partitioning defective 3 homolog). Cette interaction induit une distribution polarisée de Mark2 et Pard3 à des pôles cellulaires opposés, aboutissant à une division cellulaire asymétrique (Figure 1). La division asymétrique est une caractéristique propre aux cellules souches leur permettant de générer deux cellules filles différentes. Dans le cas des cellules satellites, une cellule fille se différencie en myoblaste nécessaire à la régénération des fibres musculaires, alors que l’autre cellule fille demeure indifférenciée pour maintenir la réserve de cellules satellites.
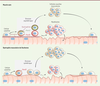 | Figure 1.
Conséquences des déficits intrinsèques des cellules satellites dans la dystrophie musculaire de Duchenne (DMD). La blessure d’un muscle sain induit l’activation des cellules satellites (c’est-à-dire la sortie de leur état de quiescence). Une certaine proportion des cellules satellites activées expriment alors la dystrophine à laquelle se lie la protéine Mark2 (microtubule affinity regulating kinase 2). Ce complexe interagit avec la protéine Pard3 (partitioning defective 3 homolog) pour induire une distribution polarisée du complexe dystrophine-Mark2 et de Pard3 à des pôles cellulaires opposés. Ce processus conduit à la division asymétrique de la cellule satellite permettant de générer un myoblaste différencié et une cellule satellite indifférenciée. Le myoblaste fusionne avec la fibre musculaire endommagée pour la restaurer alors que la cellule indifférenciée permet le maintien de la réserve de cellules satellites en cas de dommages ultérieurs. En absence de dystrophine chez les souris mdx (modèle murin de la DMD), l’expression de Mark2 est diminuée ne permettant pas la polarisation de la protéine Pard3, favorisant ainsi la division symétrique des cellules satellites. Ces divisions successives engendrent un grand nombre de cellules indifférenciées au détriment du nombre de myoblastes, ce qui conduit à une altération des processus régénératifs et participe à la dégradation progressive du tissu musculaire. |
Les cellules satellites des souris mdx (modèle murin de la DMD) présentent une expression diminuée de Mark2 et un dérèglement de la polarité cellulaire [7]. Par conséquent, le nombre de divisions asymétriques des cellules satellites mdx est considérablement réduit, alors que le nombre de divisions symétriques (génération de deux cellules filles indifférenciées) n’est pas affecté (Figure 1). Ceci aboutit à la réduction du nombre de myoblastes et au maintien d’un grand nombre de cellules satellites indifférenciées. Nos résultats apportent ainsi un nouvel éclairage sur les déficits intrinsèques des cellules satellites qui expliqueraient leur incapacité à régénérer adéquatement les muscles des patients DMD. |
Si ces résultats nous indiquent que la DMD est une maladie plus complexe qu’anticipée, ils ouvrent également la voie à de nouvelles stratégies thérapeutiques. En effet, le développement de traitements pharmaceutiques ou génétiques visant à corriger spécifiquement les défauts intrinsèques des cellules satellites permettrait d’améliorer considérablement la fonction musculaire des patients DMD [12]. Dernièrement, il a été démontré que la surexpression de Jagged1, un régulateur de la voie de signalisation Notch [13] (→) améliore le phénotype musculaire de chiens dystrophiques [14]. Cet effet serait partiellement dû à l’augmentation de la prolifération des cellules satellites et de leur potentiel myogénique [14]. Certains inhibiteurs de voies signalétiques améliorent également la capacité régénérative des muscles de souris mdx. Par exemple, l’inhibition de la voie Jak2/Stat3 (Janus kinase 2 / signal transducer and activator of transcription 3) favorise la prolifération des cellules satellites de souris mdx et augmente le calibre de leurs fibres musculaires [15].
(→) Voir la Synthèse de A. Mayeuf et F. Relaix, m/s n° 5, mai 2011, page 521
Réintégrer la dystrophine dans les cellules satellites des muscles DMD pour rétablir leur capacité de division asymétrique est également une thérapie génique envisagée. Ce rétablissement permettrait d’une part de générer des myoblastes différenciés qui restaureraient l’expression de la dystrophine au sein des fibres musculaires avec lesquelles ils fusionnent et, d’autre part, d’augmenter l’efficacité à long terme du traitement en corrigeant la capacité d’auto-renouvellement des cellules satellites. Bien que la transduction d’un gène dans les cellules satellites reste un véritable défi technique, des résultats encourageants ont montré que la transduction d’un gène de micro-dystrophine dans une petite fraction de cellules satellites suffit pour maintenir son expression à long terme [16]. En somme, toutes ces études confirment l’importance des différents composants du DGC pour la fonction des cellules satellites. Bien que des travaux supplémentaires soient nécessaires pour déterminer si ces observations obtenues chez la souris sont transposables chez l’homme, ces résultats suggèrent qu’une solution thérapeutique complète devrait inclure le traitement des défauts intrinsèques des cellules satellites. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Caroline E. Brun détient une bourse post-doctorale du « Ontario Institute for Regenerative Medicine » (OIRM).
|
1.
Dumont NA, Bentzinger CF, Sincennes MC, Rudnicki MA. Satellite cells and skeletal muscle regeneration . Compr Physiol. 2015; ; 5 : :1027.–1059. 2.
Dumont NA, Wang YX, Rudnicki MA. Intrinsic and extrinsic mechanisms regulating satellite cell function . Dev Camb Engl. 2015; ; 142 : :1572.–1581. 3.
Dufresne SS, Frenette J, Dumont NA. Inflammation et régénération musculaire : une arme à double tranchant . Med Sci (Paris). 2016; ; 32 : :591.–597. 4.
Sacco A, Mourkioti F, Tran R, et al. Short telomeres and stem cell exhaustion model Duchenne muscular dystrophy in mdx/mTR mice . Cell. 2010; ; 143 : :1059.–1071. 5.
Jiang C, Wen Y, Kuroda K, et al. Notch signaling deficiency underlies age-dependent depletion of satellite cells in muscular dystrophy . Dis Model Mech. 2014; ; 7 : :997.–1004. 6.
Kottlors M, Kirschner J. Elevated satellite cell number in Duchenne muscular dystrophy . Cell Tissue Res. 2010; ; 340 : :541.–548. 7.
Dumont NA, Wang YX, von Maltzahn J, et al. Dystrophin expression in muscle stem cells regulates their polarity and asymmetric division . Nat Med. 2015; ; 21 : :1455.–1463. 8.
Fukada S, Uezumi A, Ikemoto M, et al. Molecular signature of quiescent satellite cells in adult skeletal muscle . Stem Cells Dayt Ohio. 2007; ; 25 : :2448.–2459. 9.
Cohn RD, Henry MD, Michele DE, et al. Disruption of Dag1 in differentiated skeletal muscle reveals a role for dystroglycan in muscle regeneration . Cell. 2002; ; 110 : :639.–648. 10.
Kanagawa M, Yu CC, Ito C, et al. Impaired viability of muscle precursor cells in muscular dystrophy with glycosylation defects and amelioration of its severe phenotype by limited gene expression . Hum Mol Genet. 2013; ; 22 : :3003.–3015. 11.
Ross J, Benn A, Jonuschies J, et al. Defects in glycosylation impair satellite stem cell function and niche composition in the muscles of the dystrophic largemyd mouse . Stem Cells. 2012; ; 30 : :2330.–2341. 12.
Dumont NA, Rudnicki MA. Targeting muscle stem cell intrinsic defects to treat Duchenne muscular dystrophy . Npj Regen Med. 2016; ; 1 : :16006.. 13.
Mayeuf A, Relaix F. La voie Notch : du développement à la régénération du muscle squelettique . Med Sci (Paris). 2011; ; 27 : :521.–526. 14.
Vieira NM, Elvers I, Alexander MS, et al. Jagged 1 rescues the Duchenne muscular dystrophy phenotype . Cell. 2015; ; 163 : :1204.–1213. 15.
Tierney MT, Aydogdu T, Sala D, et al. STAT3 signaling controls satellite cell expansion and skeletal muscle repair . Nat Med. 2014; ; 20 : :1182.–1186. 16.
Kimura E, Li S, Gregorevic P, et al. Dystrophin delivery to muscles of mdx mice using lentiviral vectors leads to myogenic progenitor targeting and stable gene expression . Mol Ther. 2009; ; 18 : :206.–213. |