| |
| Med Sci (Paris). 32(10): 806–808. doi: 10.1051/medsci/20163210005.De nouvelles variations génétiques préservent les facultés cognitives des personnes âgées Stevan Springer1 and Pascal Gagneux1* 1Département de pathologie, université de Californie San Diego, 9500 Gilman Drive, 92109La Jolla, États-Unis MeSH keywords: Vieillissement, Allèles, Maladie d'Alzheimer, Animaux, Cognition, Variation génétique, Humains, Polymorphisme génétique, Lectine-3 de type Ig liant l'acide sialique, génétique, physiologie |
Les humains ont une durée de vie plus longue que leurs proches cousins, les grands singes. Ils font partie des rares vertébrés chez qui la durée de vie dépasse les années reproductives, survivant souvent encore plusieurs décennies après la période de reproduction. Cette caractéristique de l’espèce humaine se traduit par des particularités sociales et biologiques. D’un point de vue social, les personnes âgées jouent un rôle de transmission de la mémoire de l’espèce. Les grands-parents, par exemple, soutiennent leur jeune parentèle1, et leur transmettent de l’information culturelle précieuse. Il apparaît dès lors nécessaire, d’un point de vue biologique, que des mécanismes, qui permettent la protection des facultés cognitives, soient mis en place. Nous avons étudié des polymorphismes de gènes protégeant les personnes âgées de la démence et contribuant au maintien de leurs facultés cognitives. Nous avons trouvé que plusieurs de ces variations génétiques protectrices sont nouvelles et uniques à notre espèce. Ces résultats suggèrent ainsi que, pour l’espèce humaine, la sélection de parentèle2 est assez puissante pour façonner les phénotypes d’individus post-reproductifs. |
Allèles protecteurs de la maladie d’Alzheimer La maladie d’Alzheimer est une maladie strictement humaine, les chimpanzés et autres grands singes ne la développent pas [1]. Nous avons étudié un gène régulant l’activité des cellules immunitaires microgliales qui interviennent dans la dégradation des enchevêtrements neurofibrillaires qui contribuent à la maladie d’Alzheimer. CD33
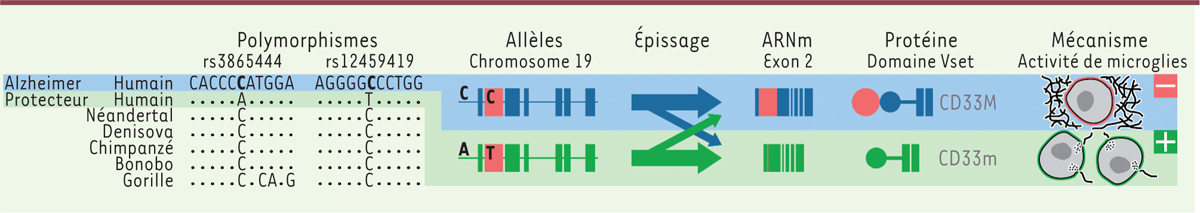
3, est un gène qui code une lectine4 qui, en reconnaissant les acides sialiques présents à la surface des cellules, réduit la réponse inflammatoire [2]. Le gène CD33 est transcrit sous deux formes grâce à un processus d’épissage alternatif (c’est-à-dire que l’ARN transcrit à partir du même segment d’ADN est utilisé de plusieurs manières pour produire des protéines qui ne sont pas identiques) (Figure 1). Une de ces protéines, le CD33M, constitué de la protéine complète, induit, lorsqu’elle se fixe aux acides sialiques exprimés par les cellules de la microglie, des signaux qui freinent leur activation réduisant ainsi l’inflammation [3]. Le CD33m est une version incomplète de la protéine. Elle est dépourvue du domaine terminal responsable des interactions moléculaires avec les acides sialiques présentés par les glycoprotéines et glycolipides cellulaires. L’allèle de CD33 qui favorise la production de la variante courte de la protéine protège contre la maladie d’Alzheimer. CD33m n’induit pas en effet d’inhibition de l’activité des cellules microgliales [4]. Les individus porteurs des allèles protecteurs accumulent ainsi moins de forme bêta-amyloïde dans leurs cerveaux, diminuant fortement leurs risques de maladie d’Alzheimer (Figure 1).
 | Figure 1.
Séquences et polymorphismes au locus CD33 pour l’humain et ses proches cousins. Effet de chaque allèle sur l’épissage et la taille de la protéine et sur la différence d’activité des cellules microgliales. Vset : domaine V (Ig-like domain) qui ressemble au domaine variable des immunoglobulines. Il est uniquement présent dans CD33M. |
Nous avons étudié l’état allélique de CD33 chez les humains et les primates non-humains [5]. L’analyse de l’ensemble des données obtenues grâce au projet « 1 000 Genomes5, » montre que l’allèle protecteur contre la maladie d’Alzheimer est polymorphe dans la population humaine, avec une fréquence allélique variant entre 0,05 chez les africains et 0,48 chez les amérindiens. L’analyse du génome de l’homme de Néandertal, et de l’hominidé de Denisova6, ainsi que ceux des chimpanzés, bonobos et gorilles, montre que l’allèle qui prédispose les humains à la maladie d’Alzheimer est l’allèle ancestral. Ce qui signifie que l’allèle de CD33 qui est protecteur contre la maladie d’Alzheimer représente un état dérivé, c’est-à-dire qu’il a récemment évolué, uniquement dans l’espèce humaine. Nous avons étudié l’expression de CD33 dans des cellules mononucléaires périphériques (PBMC) isolées à partir de sang humain et de chimpanzés, en utilisant des anticorps spécifiques pour les deux formes de la protéine, CD33M et CD33m. Les résultats que nous avons obtenus montrent que les monocytes de chimpanzés expriment moins à leur surface la forme CD33M que les monocytes humains. Des analyses immunohistochimiques réalisées sur des échantillons de micro-sections de cerveaux montrent que les deux isoformes de CD33 sont présentes dans la microglie chez l’homme et les chimpanzés, mais à différents niveaux. La comparaison de cerveaux humains et de chimpanzés confirme l’augmentation de l’expression de CD33M chez les humains homozygotes pour l’allèle ancestral (qui sont à risque pour la maladie d’Alzheimer). En revanche, les niveaux d’expression de la protéine CD33m sont comparables dans les deux espèces. En présence de l’allèle protecteur, une augmentation d’expression de CD33m est observée, rétablissant ainsi un rapport entre les deux formes de la protéine (CD33M/CD33m), équivalent à celui retrouvé chez le chimpanzé [5]. L’allèle protecteur du gène CD33 semblerait donc être compensatoire. Il restaurerait les interactions entre cellules de la microglie et organisme, qui ont été modifiées à la suite de l’évolution spécifique du cerveau humain (taux et durée de croissance, taille absolue, cytoarchitecture et connectivité) [6]. |
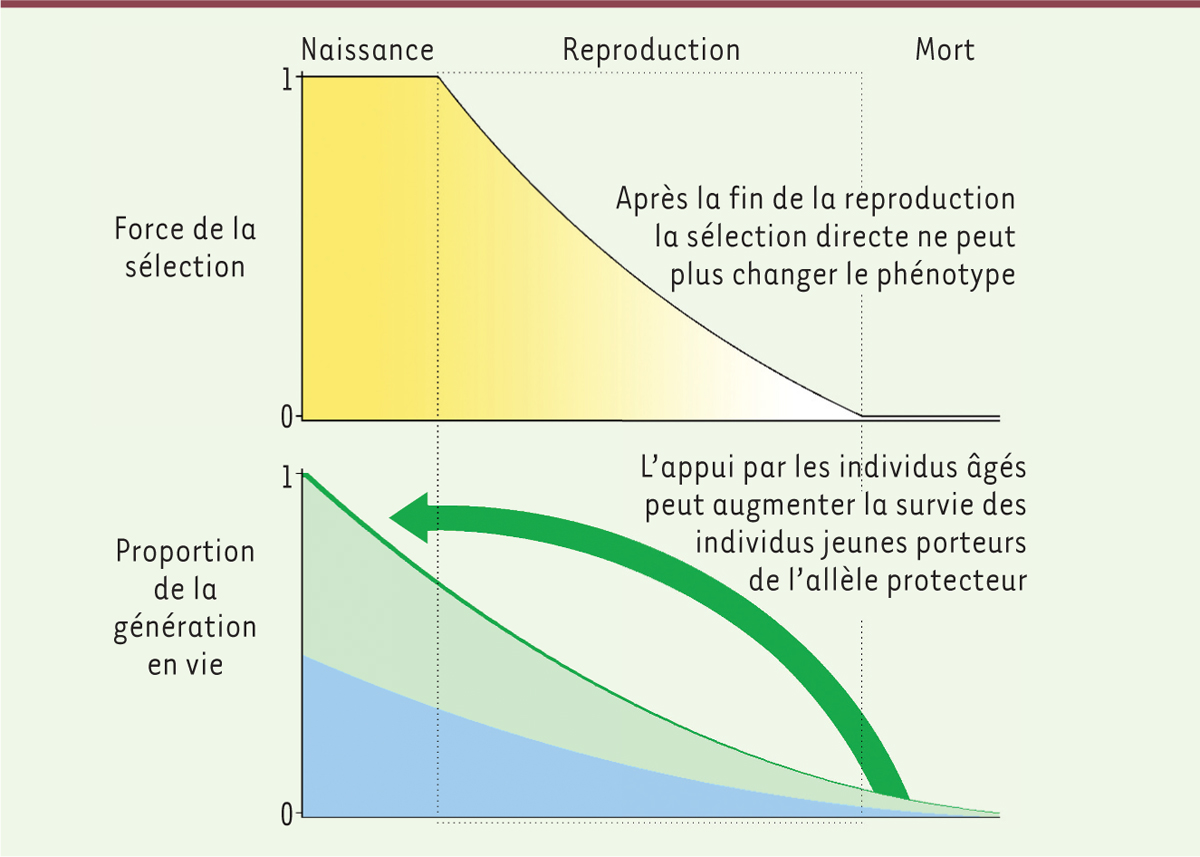
Sélection évolutive directe chez les jeunes ou sélection de parentèle ? De façon surprenante, l’allèle CD33 protecteur contre la maladie d’Alzheimer a évolué de façon spécifique chez l’homme, alors même que son effet n’est bénéfique qu’à un âge avancé. La sélection évolutive directe est en effet sensée être faible, ou même entièrement absente, à cet âge avancé [7] (Figure 2) (→).
(→) Voir la Nouvelle de D. Enard et al., m/s n° 6-7, juin-juillet 2010, page 579
 | Figure 2.
Régime de force de la sélection naturelle au cours de la vie, proportion de la génération en vie et impact de l’appui par les personnes âgées sur leur parentèle très jeune. La force de sélection diminue avec l’âge (en jaune). Les allèles contribuant à des phénotypes qui ne sont exprimés qu’après la reproduction ne sont pas soumis à la sélection. Ainsi, lorsque la durée de vie reproductive est terminée, la sélection ne fonctionne plus. Toutefois, les personnes âgées qui sont protégées du déclin cognitif (en vert) peuvent encore diriger leur appui envers des individus plus jeunes. Lorsque ces avantages sont dirigés principalement à d’autres qui portent également le même allèle protecteur (la parentèle), la fréquence de l’allèle protecteur peut augmenter par la sélection de parentèle (en vert foncé). |
Nous avons trouvé plusieurs autres exemples d’allèles dérivés pour d’autres locus humains, qui protègent contre des détériorations cognitives liées à l’âge ou résultant de maladies neurodégénératives ou d’insuffisance cérébro-vasculaire. Un autre mécanisme par lequel ces allèles pourraient être sélectionnés est la sélection à travers la valeur sélective inclusive, c’est-à-dire à travers les avantages gagnés par la jeune parentèle grâce à l’appui des grands-parents, appelée aussi sélection de parentèle. Ce type de sélection serait donc assez fort pour favoriser des allèles protégeant spécifiquement contre le déclin cognitif chez les humains post-reproductifs. Cette sélection devrait fonctionner en maximisant les contributions de ces individus post-reproductifs à la valeur sélective de leur jeune parentèle. En d’autres termes, les individus âgés qui sont protégés du déclin cognitif peuvent aider les individus plus jeunes de leur parentèle porteurs du même allèle protecteur, faisant ainsi augmenter la fréquence de cet allèle dans la population (Figure 2). Nous avons mis en évidence des allèles protecteurs des capacités cognitives chez les personnes âgées. Cependant, leurs effets chez les individus en bas âge ne peuvent être évalués directement. Considérant que la sélection naturelle est plus puissante en début de vie que plus tard, comment se fait-il alors que de tels allèles puissent être sélectionnés ? Si leurs effets sont directement avantageux pour les jeunes, la population entière devrait porter ces allèles qui sont généralement avantageux (affectant les très jeunes ainsi que les vieux). Par contre, le soutien des jeunes par des individus post-reproductifs, et la transmission culturelle qui y est associée, pourrait permettre de surmonter des effets délétères primaires (chez les jeunes) en augmentant leur survie. Ceci est le scénario que nous privilégions et qui dépend de la valeur sélective inclusive (la force de la sélection de parentèle par les individus âgés), en plus de la sélection directe affectant les jeunes. Nous sommes donc en présence d’allèles protecteurs qui sont polymorphes chez l’homme. Deux possibilités expliquent leur existence : soit les effets phénotypiques directs à bas âge sont neutres et aidés par la sélection de parentèle ; soit la sélection de parentèle surmonte des effets négatifs (modestes) au début de la vie [8]. Dans les deux cas, notre espèce peut être considérée comme tributaire de la transmission culturelle au point où cela a changé le régime de sélection au cours de nos vies rallongées. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Varki NM, Strobert E, Dick EJJ, et al. Biomedical differences between human and nonhuman hominids: potential roles for uniquely human aspects of sialic acid biology . Annu Rev Pathol. 2011; ; 6 : :365.–393. 2.
Crocker PR, Paulson JC, Varki A. Siglecs and their roles in the immune system . Nat Rev Immunol. 2007; ; 7 : :255.–266. 3.
Malik M, Simpson JF, Parikh I, et al. CD33 Alzheimer’s risk-altering polymorphism, CD33 expression, and exon 2 splicing . J Neurosci. 2013; ; 33 : :13320.–13325. 4.
Bradshaw EM, Chibnik LB, Keenan BT, et al. CD33 Alzheimer’s disease locus: altered monocyte function and amyloid biology . Nat Neurosci. 2013; ; 16 : :848.–850. 5.
Schwarz F, Springer SA, Altheide TK, et al. Human-specific derived alleles of CD33 and other genes protect against postreproductive cognitive decline . Proc Natl Acad Sci USA. 2016; ; 113 : :74.–79. 6.
Somel M, Franz H, Yan Z, et al. Transcriptional neoteny in the human brain . Proc Natl Acad Sci USA. 2009; ; 106 : :5743.–5748. 7.
Enard D, Depaulis F. Roest Crollius H. Points chauds de sélection positive dans les génomes de primates . Med Sci (Paris). 2010; ; 26 : :579.–581. 8.
Springer SA, Schwarz F, Altheide TK, et al. Reply to Liu and Jiang: Maintenance of postreproductive cognitive capacity by inclusive fitness . Proc Natl Acad Sci USA. 2016; ; 113 : :E1591.–E1592. |