| |
| Med Sci (Paris). 32(10): 815–818. doi: 10.1051/medsci/20163210008.Contrôle de l’homéostasie glucido-lipidique par les facteurs du cycle cellulaire CDK4 et E2F1 Pierre-Damien Denechaud,1a Isabel C. Lopez-Mejia,1b and Lluis Fajas1c 1Département de physiologie, université de Lausanne, rue du Bugnon 7, 1005Lausanne, Suisse MeSH keywords: Tissu adipeux, Kinase-4 cycline-dépendante, Facteur de transcription E2F1, Stéatose hépatique, Glucose, Glycolyse, Homéostasie, Humains, Insuline, Métabolisme des lipides, Lipogenèse, Foie, Obésité, Transduction du signal, métabolisme, physiologie |
Chez les mammifères, la régulation du métabolisme glucido-lipidique joue un rôle crucial dans le maintien de l’homéostasie de l’organisme et permet de mieux appréhender les fluctuations des apports énergétiques. Les organes métaboliques, comme le foie et le tissu adipeux, participent au maintien de cet équilibre qui, lorsque perturbé, conduit à l’apparition de pathologies métaboliques comme l’obésité ou le diabète de type 2 [1]. Avec le cancer, ces maladies représentent un problème de santé publique majeur à l’échelle mondiale [2, 3] (→).
(→) Voir le Faits et chiffres de C. Franc, m/s n° 8-9, août-septembre 2013, page 711 (numéro thématique Diabète : approches thérapeutiques émergentes)
Elles ont également en commun le fait qu’elles impliquent un dysfonctionnement de l’utilisation de l’énergie par les cellules. En effet, les cellules cancéreuses qui prolifèrent nécessitent un certain métabolisme qui va soutenir leurs capacités à se multiplier, notamment lors du passage d’étapes clefs du cycle cellulaire. Ces modifications du métabolisme énergétique des cellules cancéreuses commencent à être bien documentées [4]. Partant de ce postulat, nous nous sommes interrogés sur le rôle que jouent les facteurs du cycle cellulaire dans le contrôle du métabolisme énergétique, et notamment les protéines de la voie CDK4-Rb-E2F1 (cyclin-dependent kinase 4 - protéine du rétinoblastome - E2F transcription factor 1) [5]. Le facteur de transcription E2F1 et ses régulateurs, la protéine du rétinoblastome Rb1 et la kinase dépendante des cyclines CDK4, sont bien décrits dans la littérature pour leur rôle dans la progression du cycle cellulaire [6, 7]. Néanmoins, l’étude de modèles de souris invalidées pour CDK4 ou E2F1 nous a permis d’identifier récemment leur importance dans le contrôle du métabolisme glucido-lipidique du foie et du tissu adipeux [8, 9]. |
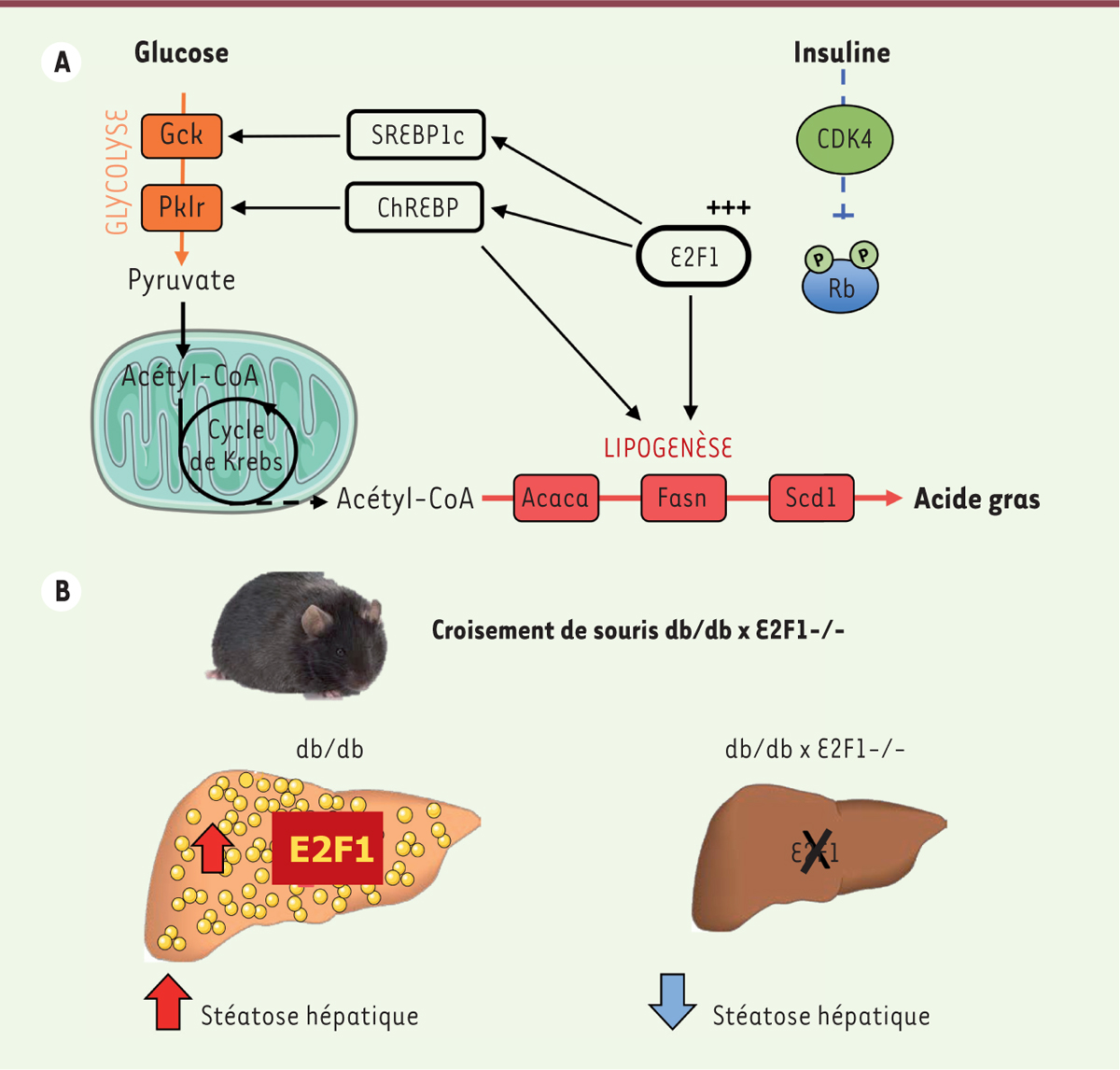
Le facteur de transcription E2F1 et le métabolisme hépatique E2F1 contrôle la glycolyse et la lipogenèse hépatique Au sein de l’organisme, le foie joue un rôle majeur dans le maintien de l’homéostasie énergétique en assurant la synthèse de novo d’acides gras à partir du glucose par la voie de la lipogenèse en période post-prandiale. L’induction de l’expression des enzymes de la glycolyse (glucokinase [Gck] et liver pyruvate kinase [Pklr]) et de la lipogenèse (acétyl-CoA carboxylase [Acaca], fatty acid synthase [Fasn] et stearoyl-CoA desaturase [Scd1]) fait intervenir plusieurs déterminants moléculaires dont les principaux sont les facteurs de transcription ChREBP ( carbohydrate-responsive element-binding protein) et SREBP-1c ( sterol regulatory element-binding transcription factor 1c), médiateurs respectifs de l’action du glucose et de l’insuline [ 10]. L’utilisation de différents modèles de souris transgéniques et d’hépatocytes invalidés pour E2F1 nous a permis de montrer que ce facteur de transcription participe à la régulation de la glycolyse et la lipogenèse hépatique en contrôlant l’expression des gènes impliqués dans ces processus [8]. Des expériences d’immunoprécipitation de chromatine (Chip) ont révélé que les facteurs de transcription ChREBP et SREBP-1c, ainsi que les enzymes de la lipogenèse de novo, sont des cibles directes de E2F1 (Figure 1A). E2F1 fait en effet partie des complexes transcriptionnels nécessaires pour moduler l’expression de ces gènes. Sous l’action de l’insuline, CDK4 phosphoryle Rb1, levant de ce fait son effet répresseur sur E2F1, pour induire la transcription de ses gènes cibles.
 | Figure 1.
E2F1 contrôle le métabolisme glucido-lipidique hépatique. A. Le facteur de transcription E2F1 lie directement les promoteurs de ses gènes cibles (Srebp1c, ChREBP, Acaca, Fasn, Scd1) et contrôle ainsi la voie de la glycolyse et de la lipogenèse dans le foie. Sous l’action de l’insuline, CDK4 phosphoryle Rb et lève ainsi son effet répresseur sur E2F1. B. L’invalidation de E2F1 dans le modèle de stéatose hépatique de souris db/db protège de cette pathologie via une diminution de la synthèse de novo d’acides gras. Srebp1c : sterol regulatory element-binding transcription factor 1c ; ChREBP : carbohydrate-responsive element-binding protein ; Acaca: acétyl-CoA carboxylase ; Fasn : fatty acid synthase ; Scd1 : stearoyl-CoA desaturase ; CDK4 : cyclin-dependent kinase 4 ; Rb : protéine du rétinoblastome ; Gck : glucokinase ; Pklr : liver pyruvate kinase. |
L’invalidation de E2F1 protège de la stéatose hépatique La stéatose hépatique est une maladie du foie très fréquente dans nos pays industrialisés. Elle se caractérise par une augmentation de la synthèse de novo de lipides participant à l’accumulation de triglycérides dans le foie [ 10]. Bien que souvent asymptomatique, cette accumulation de graisses dans les cellules est délétère et peut entraîner une réponse inflammatoire, la stéatohépatite, qui peut par la suite conduire à l’apparition d’une cirrhose et de cancer du foie. Notre laboratoire a pu observer à la fois dans des modèles de souris soumises à un régime riche en graisse, ou génétiquement obèses et diabétiques (souris db/db, déficientes pour le récepteur à la leptine1,), mais également chez l’homme obèse intolérant au glucose, une augmentation de l’activité et de l’expression du facteur E2F1 dans le foie. L’importance de E2F1 dans cette physiopathologie hépatique a été révélée par le croisement des souris invalidées pour E2F1 avec les souris db/db précédemment décrites [8]. L’invalidation ou la diminution de l’expression du gène E2F1 chez ces souris obèses améliore considérablement l’accumulation de triglycérides dans le foie et protège ainsi de la stéatose hépatique (Figure 1B). |
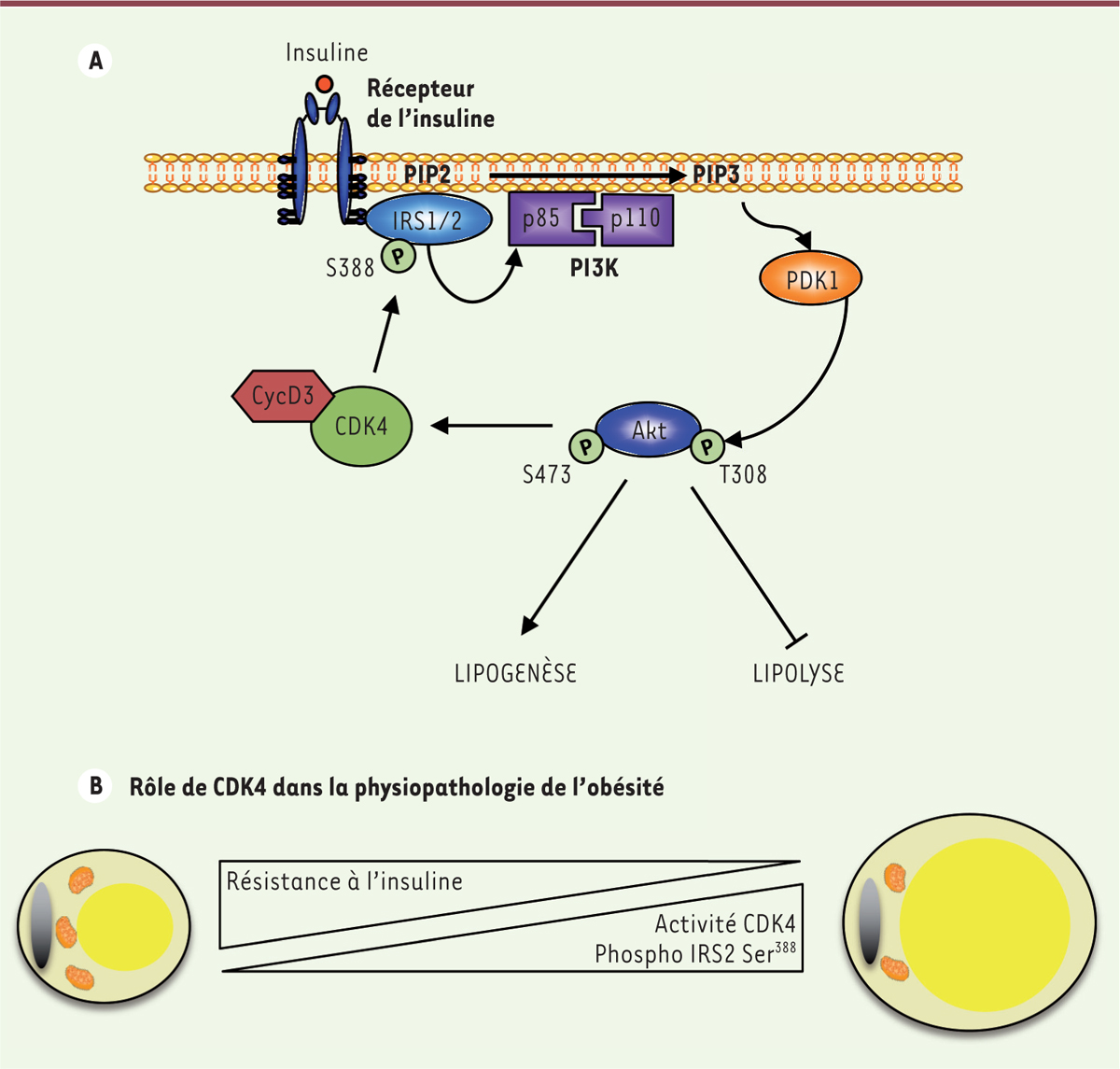
La kinase CDK4 et le métabolisme adipocytaire CDK4 et tissu adipeux La kinase CDK4 ne peut être active que sous la forme d’un complexe formé avec une cycline de type D. CDK4, ainsi que deux de ces partenaires, les cyclines D2 et D3, sont exprimées de façon importante dans le tissu adipeux blanc, un tissu avec un taux de prolifération extrêmement faible. Nous avons pu montrer, en utilisant des expériences d’immunofluorescence et de fractionnement cellulaire, que CDK4 se situe dans le cytoplasme des adipocytes, suggérant ainsi une fonction non transcriptionnelle, indépendante de la phosphorylation de Rb1 et donc de E2F1 [ 9]. Nous avons utilisé trois lignées de souris transgéniques : des souris Cdk4nc/nc, n’exprimant plus la protéine CDK4, des souris Cdk4R24C/R24C, exprimant une forme hyperactive de CDK4, ainsi que des souris Cdk4flox/flox infectées par des vecteurs viraux exprimant la Cre recombinase 2,, qui n’expriment plus CDK4 spécifiquement dans le tissu adipeux. Chez ces animaux, nous avons pu observer que l’activité de la kinase CDK4 dans le tissu adipeux est positivement corrélée à la masse adipeuse. L’absence de CDK4 conduit à un phénotype « maigre » des souris, corrélé à une diminution de la lipogenèse et une augmentation de la lipolyse du tissu adipeux. À l’inverse, l’activation de CDK4 observée dans le modèle Cdk4R24C/R24C conduit à une prise de poids corrélée à une augmentation de la lipogenèse et un blocage de la lipolyse du tissu adipeux [ 9]. CDK4 et signalisation insuline Dans le tissu adipeux, l’insuline va se fixer sur son récepteur, qui a une activité tyrosine kinase, et entraîner l’activation d’une voie de signalisation. Cette activation commence par l’autophosphorylation du récepteur à l’insuline, suivie par le recrutement et la phosphorylation des protéines de la famille IRS ( insulin receptor substrate). Par la suite, l’activation de la voie de l’insuline requiert l’activation successive de trois kinases, la phosphoinositide 3-kinase (PI3K), la phosphoinositide dependent kinase 1 (PDK1) et la protéine kinase B (PKB), plus connue sous le nom d’AKT. Tout comme pour le métabolisme du glucose, les voies de la lipogenèse et la lipolyse sont des voies finement contrôlées par l’insuline dans le tissu adipeux : l’insuline induit la lipogenèse alors qu’elle réprime la lipolyse (Figure 2A).
 | Figure 2.
CDK4 contrôle le métabolisme glucido-lipidique adipocytaire. A. L’insuline active CDK4 qui phosphoryle IRS2 sur la Ser388 et soutient ainsi la signalisation insulinique active. B. L’activité CDK4 dans le tissu adipeux de personnes obèses est positivement corrélée à la masse adipeuse, ainsi qu’à l’activation de la voie insuline, via la phosphorylation de la Ser 388 de l’IRS2. CDK4 : cyclin-dependent kinase 4 ; S388, Ser388 : sérine en position 388 ; S473 : sérine en position 473 ; T308 : tyrosine en position 308 ; IRS1/2 : insulin receptor substrate 1/2 ; CycD3 : cycline D3 ; Akt : protéine kinase B PKB ; PI3K : phosphoinositide 3-kinase ; PDK1 : phosphoinositide dependent kinase 1 ; PIP2 : phosphatidylinositol-4,5-bisphosphate ; PIP3 : phosphatidylinositol-3,4,5-trisphosphate. |
Afin de mieux comprendre la fonction de CDK4 dans le tissu adipeux, nous avons caractérisé le métabolisme du glucose de ces différents modèles de souris [9]. De manière surprenante, les souris Cdk4R24C/R24C, qui ont une prise de poids plus importante, présentent une amélioration de la sensibilité à l’insuline et de la tolérance au glucose, à l’inverse des souris invalidées pour CDK4 dans le tissu adipeux (Cdk4flox/flox) qui présentent une sensibilité à l’insuline diminuée. Nous avons également pu mettre en évidence par des expériences de biologie moléculaire que CDK4 est une protéine clef dans la transmission du signal insulinique. En réponse à l’insuline, l’activité de CDK4 augmente et phosphoryle la sérine en position 388 (Ser388) de la protéine IRS2 (insulin receptor substrate 2) pour soutenir l’activation de la voie (Figure 2B). Activité de CDK4 dans le tissu adipeux de patients obèses Notre étude révèle également que l’activité de l’enzyme CDK4 augmente de façon proportionnelle à l’indice de masse corporelle (IMC) dans le tissu adipeux de sujets humains [ 9]. Même si l’expression de la protéine CDK4 ne change pas entre sujets sains et sujets obèses, l’expression de la cycline D3, ainsi que la phosphorylation de la protéine IRS2 sur la Ser 388, sont augmentées chez les sujets obèses. De façon intéressante, le niveau de phosphorylation de la Ser 388 de l’IRS2 est inversement proportionnel à la glycémie à jeun des sujets étudiés, démontrant ainsi une corrélation positive entre l’activité CDK4 et les effets de la voie de l’insuline dans le tissu adipeux. |
Ces travaux mettent en lumière l’intérêt des approches transdisciplinaires, comme ici pour l’étude du cycle cellulaire/cancer et du métabolisme. Ce type d’approche, effectué dans un contexte non prolifératif, montre en effet que des facteurs clés du cycle cellulaire, ici la voie CDK4-Rb-E2F1, jouent un rôle primordial dans le maintien de l’homéostasie énergétique au niveau du foie et du tissu adipeux [8, 9]. Par conséquent, ces résultats suggèrent que l’utilisation de médicaments développés pour le cancer pourrait également avoir des effets métaboliques et se révéler bénéfiques dans le traitement d’autres pathologies comme l’obésité et le diabète de type 2. ‡ |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
White MF. Insulin signaling in health and disease . Science. 2003; ; 302 : :1710.–1711. 2.
Franc C. Le diabète : des chiffres alarmants . Med Sci (Paris). 2013; ; 29 : :711.–714. 3.
Hanahan D, Weinberg RA. Hallmarks of cancer: the next generation . Cell. 2011; ; 144 : :646.–674. 4.
Escote X, Fajas L. Metabolic adaptation to cancer growth: from the cell to the organism . Cancer Lett. 2015; ; 356 : :171.–175. 5.
Fajas L. Re-thinking cell cycle regulators: the cross-talk with metabolism . Front Oncol. 2013; ; 3 : :4.. 6.
Dimova DK, Dyson NJ. The E2F transcriptional network: old acquaintances with new faces . Oncogene. 2005; ; 24 : :2810.–2826. 7.
Malumbres M, Barbacid M. Mammalian cyclin-dependent kinases . Trends Biochem Sci. 2005; ; 30 : :630.–641. 8.
Denechaud PD, Lopez-Mejia IC, Giralt A, et al. E2F1 mediates sustained lipogenesis and contributes to hepatic steatosis . J Clin Invest. 2016; ; 126 : :137.–150. 9.
Lagarrigue S, Lopez-Mejia IC, Denechaud PD, et al. CDK4 is an essential insulin effector in adipocytes . J Clin Invest. 2016; ; 126 : :335.–348. 10.
Denechaud PD, Dentin R, Girard J, Postic C. Role of ChREBP in hepatic steatosis and insulin resistance . FEBS Lett. 2008; ; 582 : :68.–73. |