| |
| Med Sci (Paris). 32(10): 820–822. doi: 10.1051/medsci/20163210010.Contrôle astroglial de la synchronisation neuronale « mind the GAP » ! Oana Chever,1,1*b Elena Dossi,1* and Nathalie Rouach1a 1Neuroglial interactions in cerebral physiopathology, Center for Interdisciplinary Research in Biology, Collège de France, CNRS UMR 7241, Inserm U1050, Labex Memolife, PSL Research University, 11, place Marcelin Berthelot, 75005Paris, France MeSH keywords: Animaux, Astrocytes, Encéphale, Connexine 43, Connexines, Phénomènes électrophysiologiques, Humains, Souris, Souris transgéniques, Neurones, Périodicité, Transmission synaptique, physiologie, déficit, génétique |
Les rythmes neuronaux sont le reflet de processus physiologiques se produisant dans le tissu cérébral. Les neurones sont connectés entre eux, s’organisent en circuits et forment de larges réseaux fonctionnels spécifiques aux différentes structures cérébrales. Les activités émergeant de ces larges ensembles cellulaires définissent la signature fonctionnelle de chaque structure cérébrale. La coordination d’activités qui s’opère au sein de ces réseaux neuronaux est donc à la base du fonctionnement cérébral. |
Les astrocytes modulent les rythmes biologiques Nul doute que les astrocytes, qui sont les cellules gliales majoritaires du cerveau, interviennent dans la genèse et la maintenance des rythmes biologiques [1, 2]. Décrits initialement comme des cellules étoilées jouant essentiellement un rôle structural et métabolique dans le cerveau, ils sont aujourd’hui considérés comme des partenaires actifs des neurones (Figure 1). Ils interviennent notamment dans le fonctionnement même de la synapse (concept de synapse tripartite) [3] (→).
(→) Voir la Nouvelle de A. Panatier et R. Robitaille, m/s n° 6-7, juin-juillet 2012, page 582
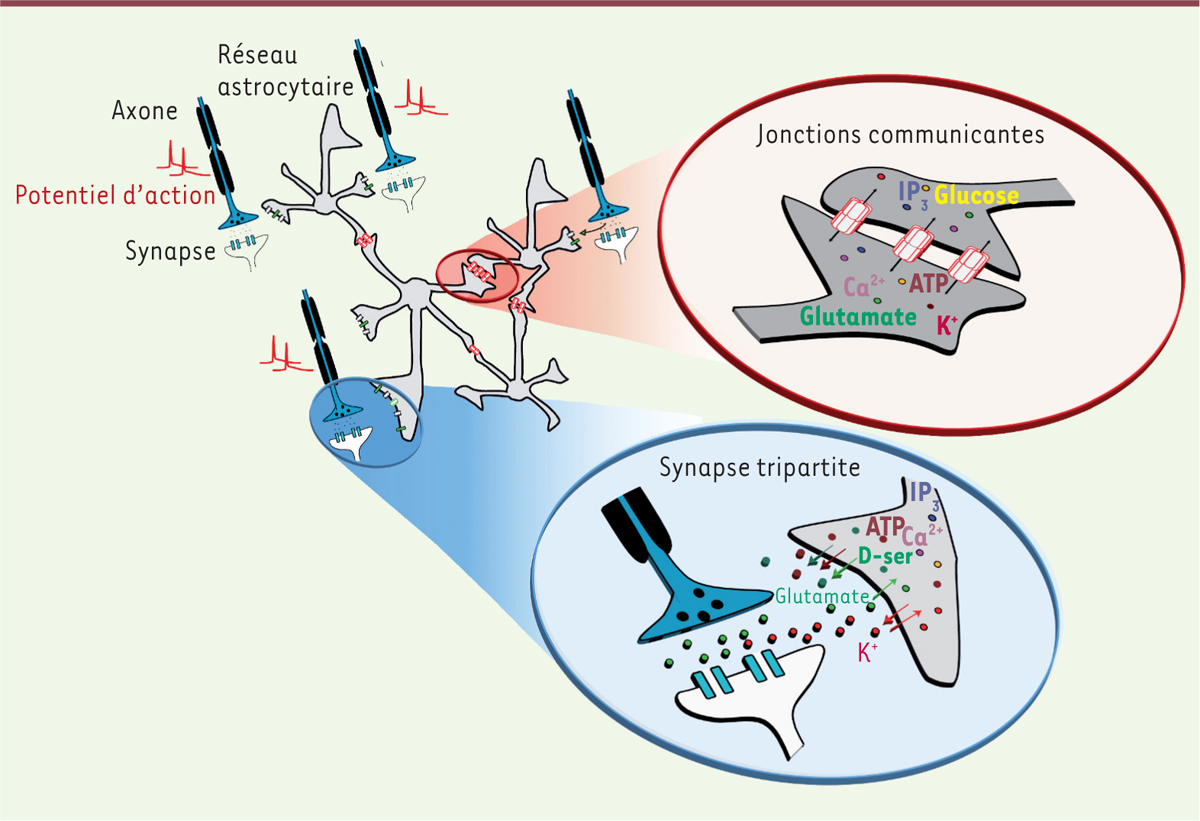
 | Figure 1.
Architecture des réseaux astrocytaires et neuronaux. Schéma illustrant les réseaux astrocytaires et neuronaux sous-tendus par les jonctions communicantes et les synapses tripartites. De nombreuses molécules transitant au sein du réseau astrocytaire sont susceptibles d’influencer la coordination des neurones. Les astrocytes recapturent notamment les ions (K+) et le glutamate dans l’espace périsynaptique, et y libèrent différentes substances neuroactives, comme le glutamate, l’ATP ou la D-Sérine (D-ser). Nombre de ces molécules sont perméables aux jonctions communicantes, et peuvent transiter au sein du réseau pour influencer l’activité de larges ensembles neuronaux. IP3 : inosinol triphosphate. |
Les astrocytes contactent en effet les synapses grâce à de fins prolongements, et y contrôlent de manière dynamique les concentrations de neurotransmetteurs et d’ions tels que le glutamate ou le potassium (K+). Selon les structures, cette couverture membranaire astrocytaire est dynamique et plastique, et donc sujette à moduler de manière différentielle l’efficacité de la transmission nerveuse dans divers contextes physiologiques. Les astrocytes sont aussi dotés d’une excitabilité calcique responsable de la libération de substances neuroactives au niveau synaptique, suffisamment puissantes pour influencer différents rythmes cérébraux. Enfin, les astrocytes présentent également une caractéristique fonctionnelle propice à la modulation de larges ensembles neuronaux. En effet, si les neurones sont organisés en réseaux fonctionnels, les astrocytes le sont aussi, notamment grâce à de fortes connexions intercellulaires sous-tendues par les jonctions communicantes, ensemble de canaux perméables à de nombreuses molécules [4]. Ces canaux, formés par l’assemblage de sous-unités appelées connexines (Cx30 et Cx43 pour 30 et 43 kDa), permettent ainsi aux astrocytes de former des réseaux cellulaires fonctionnels étendus couvrant de larges territoires neuronaux. Préalablement considérés comme un simple syncytium passif, on parle maintenant de réseaux astrocytaires actifs, car chaque structure possède un réseau astrocytaire qui lui est propre, et parce que l’étendue de ces réseaux est dynamiquement régulée par de nombreuses molécules. L’hypothèse selon laquelle le réseau astrocytaire influence la synchronisation de populations neuronales s’appuie sur des travaux pionniers des années 70 relatifs à la redistribution du potassium (ou tamponnage potassique spatial) [5, 6]. Fortement perméables au K+ et couplées électriquement, il a été suggéré que les cellules gliales tamponnent les excès de K+ suite à l’activité neuronale et le redistribuent dans des zones éloignées. Cette redistribution permettrait d’éviter une hyperexcitabilité locale dans la zone d’activité, et pourrait renforcer la synchronisation de populations neuronales, coordonnant ainsi l’activité de neurones distants. Concept d’abord restreint au transfert d’ions K+, l’importance du réseau glial dans la modulation de l’activité neuronale s’est étendue à de nombreuses substances neuroactives telles que des métabolites énergétiques (glucose, lactate), des gliotransmetteurs (ATP, glutamate, D-Sérine) ou des seconds messagers (inositol triphosphate [IP3]). La petite taille de ces neuromodulateurs leur permet de passer rapidement d’un astrocyte à l’autre par les jonctions communicantes (Figure 1) afin d’être libérés à distance et moduler ainsi l’activité de neurones éloignés [4]. Si le réseau astrocytaire joue un rôle dans la synchronisation neuronale, comment en déterminer l’impact fonctionnel ? C’est une question d’autant plus importante que le degré de couplage astrocytaire est dépendant du régime d’activité du tissu nerveux, se renforçant lors d’activités soutenues, et qu’il est fortement altéré dans de nombreuses pathologies et notamment dans les épilepsies [7, 8], affections caractérisées par une hyperexcitabilité des tissus et par des activités paroxystiques1 généralisées à de larges territoires fonctionnels. Quelles sont donc les conséquences fonctionnelles d’une déconnexion astrocytaire? C’est pour répondre à cette question que nous nous sommes intéressés aux connexines astrocytaires et à leur rôle dans la synchronisation neuronale, dans un contexte d’hyperexcitabilité. |
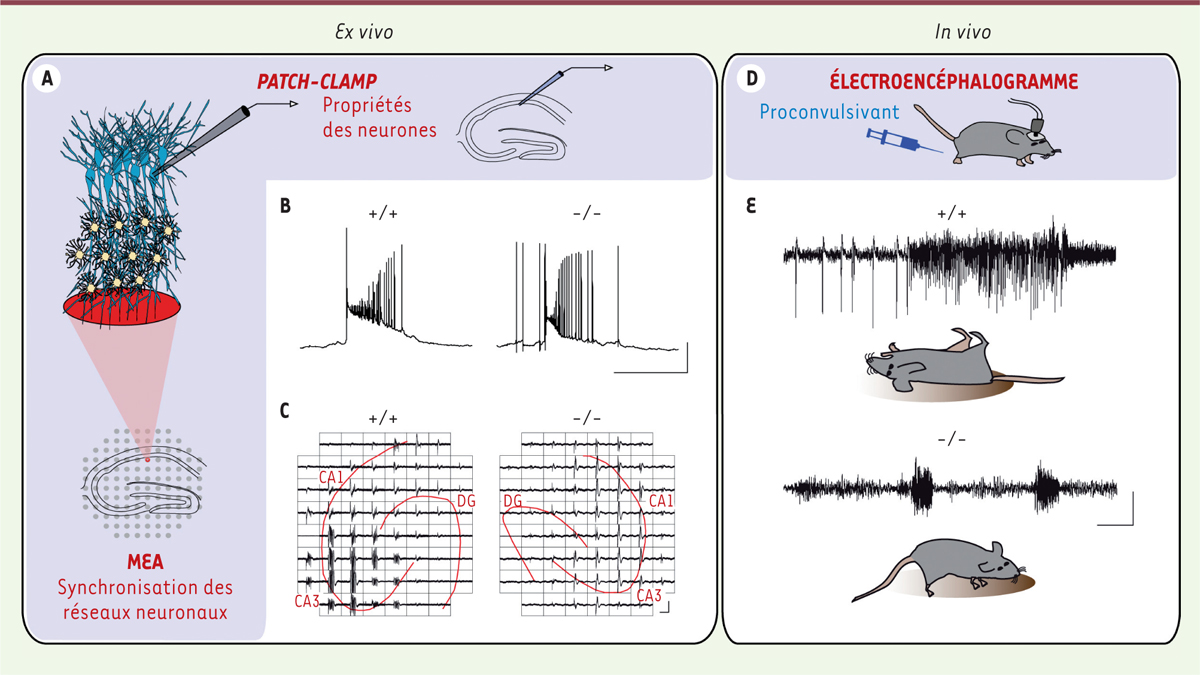
Les réseaux astrocytaires favorisent la coordination des neurones Nous avons étudié la dynamique des réseaux neuronaux par plusieurs approches électrophysiologiques et pharmacologiques (Figure 2A) chez des souris transgéniques présentant une inactivation des gènes codant pour les connexines 43 et 30, les principales sous-unités constitutives des jonctions communicantes astrocytaires [9]. Chez ces souris, les astrocytes sont totalement déconnectés les uns des autres, et fonctionnent donc en éléments isolés [10]. Nous avons d’abord investigué la dynamique des réseaux neuronaux ex vivo dans des tranches aigües2 d’hippocampe présentant une activité épileptiforme induite pharmacologiquement par désinhibition du réseau neuronal (modèle 0 Mg2+-picrotoxine, un antagoniste des récepteurs GABAA). Dans ce modèle, les neurones présentent une activité aberrante, paroxystique, en forme de bouffées récurrentes, se reflétant par des dépolarisations massives, synchronisées au sein du tissu. Dans ce contexte d’hyperexcitabilité, nous avons tout d’abord montré l’importance du réseau astrocytaire pour établir le degré d’activité basale du réseau neuronal : en effet, lorsque les astrocytes n’expriment pas de connexines, les neurones sont dépolarisés et les tissus sont plus excitables du fait d’une activité synaptique basale exacerbée. Cette hyperexcitabilité basale se traduit par une fréquence élevée de bouffées épileptiformes mais, de manière surprenante, ces bouffées sont moins puissantes, leur durée étant fortement diminuée (Figure 2B). Grâce à l’analyse d’enregistrements électrophysiologiques multiples et simultanés sur matrice d’électrodes (Figure 2C), nous avons pu établir que la coordination au sein de la population neuronale initiant ces bouffées n’est pas optimale, ce qui conduit au déclenchement de bouffées aberrantes moins puissantes. Nos résultats indiquent ainsi qu’une déconnexion des astrocytes diminue la coordination d’activité au sein du réseau neuronal conduisant à des bouffées d’activité réduites en durée et en complexité. Nous avons alors investigué in vivo les conséquences de cette diminution de coordination neuronale. Pour ce faire, nous avons évalué les décharges épileptiformes et les convulsions, induites par injection du pro-convulsivant pentylènetetrazole, par surveillance vidéo et enregistrements simultanés d’électro-encéphalogramme (Figure 2D). En accord avec nos données obtenues ex vivo, les souris invalidées pour les connexines astrocytaires présentent des événements épileptiformes associés à des convulsions plus nombreux, mais de bien moindre durée et sévérité.
 | Figure 2.
Les réseaux astrocytaires modulent l’excitabilité et la synchronisation neuronale. Approches ex vivo et in vivo permettant l’étude de la synchronisation neuronale chez des souris contrôles (+/+) et des souris présentant une inactivation des gènes codants pour les connexines astrocytaires 43 et 30 (-/-). A. Enregistrements ex vivo : enregistrements en patch-clamp (B) et matrice de micro-électrodes (C) de bouffées épileptiformes sur tranches d’hippocampe illustrant des événements moins puissants chez les souris (-/-). D. Électroencéphalogramme pendant des activités épileptiformes chez l’animal vigile suite à l’injection d’un proconvulsant. On observe chez les souris (-/-) des événements épileptiformes associés à des convulsions plus nombreux, mais moins longs et sévères par rapport aux souris sauvages (E). Échelles : B : 40 mV, 2 s ; C : 200 µV, 2 s ; D : 1 mV, 5 s. MEA : matrice d’électrodes (multi electrode arrays) ; CA1/3 : aires 1/3 de la corne d’Ammon de l’hippocampe ; DG : gyrus denté de l’hippocampe. |
Cette étude apporte ainsi un nouvel éclairage sur le rôle complexe des connexines et du couplage astrocytaire. Elle met en exergue leur importance pour limiter l’excitabilité des tissus et promouvoir la synchronisation des neurones. Nos travaux remettent en cause l’idée proposée ces dernières années selon laquelle l’absence totale de couplage astrocytaire, qui a été observée dans des tissus issus de patients présentant des épilepsies réfractaires, favoriserait les crises et en serait même la cause comme suggéré récemment [11]. Notre étude moléculaire et biophysique montre au contraire que l’absence de connexines astrocytaires est bénéfique car elle prévient l’émergence d’activités synchrones aberrantes pathologiques. |
Nous avons ici montré l’impact fonctionnel d’une délétion chronique de connexines astrocytaires sur la coordination neuronale, qui peut dans une certaine mesure se rapprocher de modifications chroniques d’expression de connexines astrocytaires dans plusieurs pathologies. Cependant, notre étude suggère aussi que modifier le degré de ce couplage pourrait être une approche thérapeutique pertinente pour moduler efficacement des activités neuronales pathologiques. Il semble donc prometteur de développer des outils spécifiques de manière à moduler en temps réel la dynamique des réseaux astrocytaires sous-tendus par les jonctions communicantes afin de refréner l’apparition d’activités aberrantes résultant d’une synchronisation exacerbée des neurones. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Dallérac G, Rouach N. Astrocytes as new targets to improve cognitive functions . Prog Neurobiol. 2016 ; pii : S0301–0082(15)30076–9. 2.
Araque A, Navarrete M. Glial cells in neuronal network function . Philos Trans R Soc Lond B Biol Sci. 2010; ; 365 : :2375.–2381. 3.
Panatier A, Robitaille R. L’astrocyte, un partenaire clé des neurones au cours de la transmission synaptique de base . Med Sci (Paris). 2012; ; 28 : :582.–584. 4.
Pannasch U, Rouach N. Emerging role for astroglial networks in information processing: from synapse to behavior . Trends Neurosci. 2013; ; 36 : :405.–417. 5.
Orkand RK, Nicholls JG, Kuffler SW. Effect of nerve impulses on the membrane potential of glial cells in the central nervous system of amphibia . J Neurophysiol. 1966; ; 29 : :788.–806. 6.
Kuffler SW, Nicholls JG. The physiology of neuroglial cells . Ergeb Physiol. 1966; ; 57 : :1.–90. 7.
Steinhäuser C, Seifert G, Bedner P. Astrocyte dysfunction in temporal lobe epilepsy: K+ channels and gap junction coupling . Glia. 2012; ; 60 : :1192.–1202. 8.
Giaume C, Koulakoff A, Roux L, et al. Astroglial networks: a step further in neuroglial and gliovascular interactions . Nat Rev Neurosci. 2010; ; 11 : :87.–99. 9.
Chever O, Dossi E, Pannasch U, et al. Astroglial networks promote neuronal coordination . Sci Signal. 2016; ; 9 : :ra6.. 10.
Pannasch U, Vargová L, Reingruber J, et al. Astroglial networks scale synaptic activity and plasticity . Proc Natl Acad Sci USA. 2011; ; 108 : :8467.–8472. 11.
Bedner P, Dupper A, Hüttmann K, et al. Astrocyte uncoupling as a cause of human temporal lobe epilepsy . Brain. 2015; ; 138 : :1208.–1222. |