Notre inconscient collectif est marqué par une longue et riche histoire de lutte contre les pathogènes. Ainsi, les bactéries sont souvent regardées avec un a priori négatif et de nombreux efforts sont dédiés à leur éradication de notre quotidien. Mais la plupart d’entre nous oublient ou ignorent que nous vivons en constante symbiose avec une immense population bactérienne appelée microbiote. Celui-ci peut être composé de plus de 1 000 espèces différentes, pour un nombre de bactéries atteignant celui de nos propres cellules [1, 2]. Malgré ces nombres impressionnants, cette symbiose passe souvent inaperçue, car nous ne souffrons pas de la présence quotidienne de nos milliards d’invités. Mais bien plus que d’être de simples pique-assiettes, ces microorganismes jouent un rôle majeur dans notre équilibre physiologique. En effet, de nombreuses études démontrent que les bactéries symbiotiques supportent de nombreux traits animaux, tels que le développement post-embryonnaire, la fertilité ou le comportement [2, 3]. Cet impact global s’explique notamment par le fait que les symbiontes bactériens participent à la nutrition de leur partenaire animal. La plupart des bactéries possèdent un répertoire génétique leur permettant de produire une multitude de composés à partir de nutriments simples, garantissant leur prolifération malgré des ressources limitées. Ainsi, elles produisent des éléments nécessaires à l’alimentation des animaux tels que des acides aminés ou des vitamines [4, 5]. Elles peuvent également digérer des macronutriments que les animaux ne peuvent utiliser directement comme la cellulose. L’animal, en s’associant avec certaines bactéries, peut donc coopter un patrimoine génétique élargissant ainsi son potentiel métabolique afin d’optimiser l’extraction et l’utilisation des nutriments à partir des aliments qu’il ingère. Ceci contribuerait à son adaptabilité face à un environnement nutritionnel défavorable ou changeant. En retour, le dogme veut que l’animal-hôte offre le « gîte et le couvert » à ses invités, en les abritant et en partageant ses ressources nutritives. De fait, ces symbioses sont qualifiées de mutualisme nutritionnel. Mais la médaille pourrait avoir un revers. Un nombre grandissant d’études soulignent une forte corrélation entre des déséquilibres du microbiote (ou « dysbiose ») et des désordres métaboliques tels que l’obésité ou le diabète [2, 11] (→).
(→) Voir la Synthèse de R. Burcelin et al., page 952 de ce numéro
Le microbiote joue donc un rôle primordial dans notre santé, mais il pourrait également participer à l’établissement de syndromes métaboliques qui siègent parmi les grands problèmes de notre mode de vie occidental. La compréhension des mécanismes moléculaires, aussi bien animaux que bactériens, façonnant ces symbioses représente donc un enjeu de santé publique. Cependant, la complexité de l’interaction liant l’homme à son microbiote rend la tâche délicate, notamment du fait de la diversité des populations bactériennes mais aussi de la difficulté d’étudier ces mécanismes chez l’humain.
La drosophile, ou mouche du vinaigre, a été un atout précieux pour identifier les processus impliqués dans les interactions entre animaux et microbes pathogènes, les mécanismes de l’immunité innée étant hautement conservés dans le vivant [6] (→).
(→) Voir l’article Nobel de E. Jouvin Marche, m/s n° 11, novembre 2011, page 1025
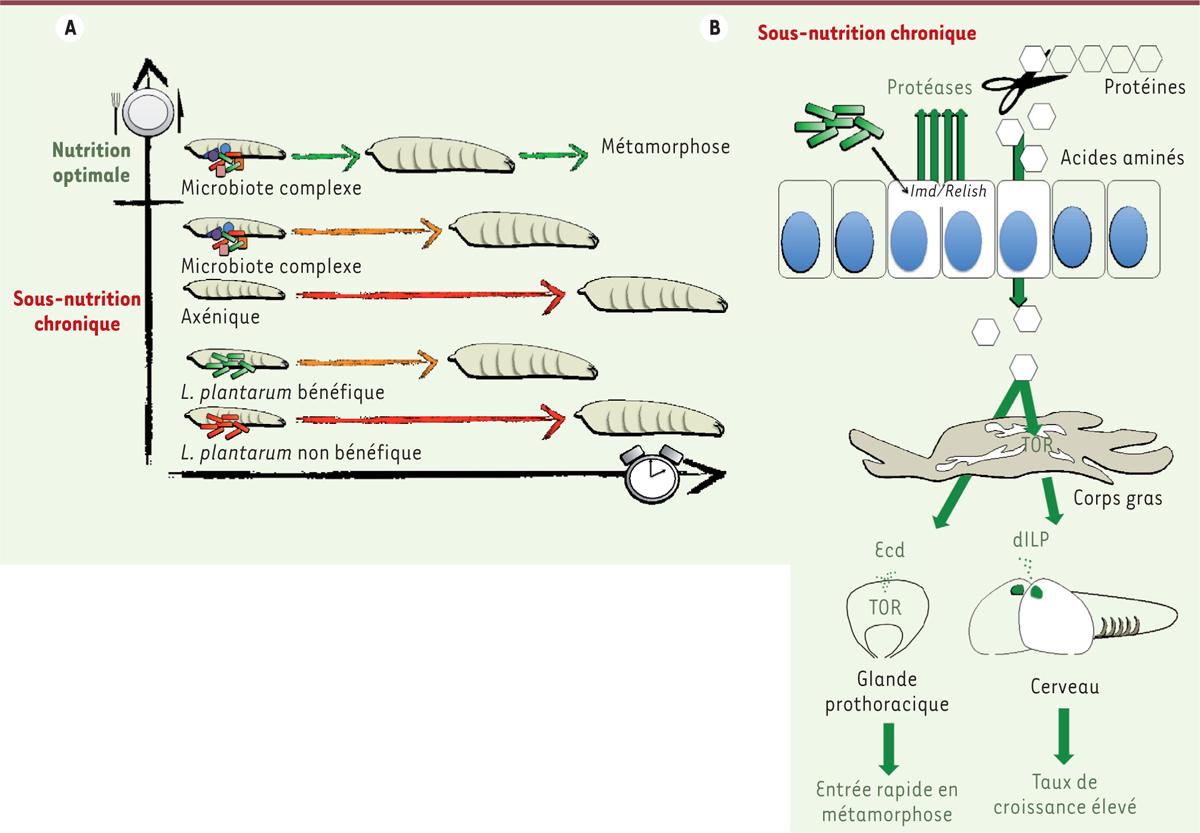
Nous avons donc examiné si cet organisme modèle pouvait permettre d’élucider les mécanismes façonnant le mutualisme animal/bactéries commensales. La drosophile possède un microbiote simple (il est composé d’un maximum d’une dizaine d’espèces) mais qui a un effet marqué sur sa physiologie [7]. Cet effet est particulièrement visible lors de sa phase larvaire, dans un contexte de sous-nutrition. En effet, après le développement embryonnaire, la drosophile passe par une phase larvaire qui est profondément influencée par la nutrition, sa finalité étant la prise de masse et le gain de taille. Cette phase s’interrompt lorsque la larve a acquis une taille et des réserves suffisantes pour entrer en métamorphose et donner un adulte fertile. Une diminution de la teneur en levure de la nourriture des larves (la levure - un microbe ! - étant leur principale source nutritive) réduit la vitesse à laquelle elles croissent et retarde leur métamorphose. De façon surprenante, ce retard est fortement accentué lorsque les larves se développent sans leur microbiote (Figure 1A) et, inversement, la présence des symbiontes bactériens atténue les effets délétères de la sous-nutrition sur la croissance. Cet effet bénéfique du microbiote peut-être mimé par la présence de membres d’une seule espèce de bactérie commensale, Lactobacillus plantarum (Lp). Cette compétence n’est pas universellement représentée dans l’espèce Lp, mais spécifique à certains isolats. En effet seules certaines souches de Lp sont en mesure de stimuler la croissance en dépit de la sous-nutrition [8] (Figure 1A). D’un point de vue plus mécanistique, Lp active l’expression des protéases intestinales de son hôte, cette activation étant suffisante pour soutenir sa croissance. En effet, l’expression forcée des protéases dans l’intestin d’animaux axéniques (dépourvus de symbiontes) permet de maintenir leur croissance en dépit d’une carence alimentaire, récapitulant l’effet observé avec la bactérie. Certaines des protéases activées par Lp sont contrôlées par la voie Imd/Relish qui gouverne également l’immunité innée de la drosophile [9]. Cette voie est centrale dans l’adaptation physiologique de la drosophile en réponse à son environnement bactérien : elle coordonne la réponse immunitaire face aux pathogènes et déclenche les protéases digestives en présence des « bonnes » bactéries. L’activation de l’expression des protéases augmente donc l’activité protéolytique de l’intestin et l’extraction des acides aminés du milieu nutritif pauvre, stimulant ainsi la voie de signalisation impliquant dTOR (drosophilia target of rapamycin) qui est régulée par le statut nutritionnel. En retour, l’activité de la voie dTOR dans le corps gras (l’équivalent fonctionnel du foie et du tissu adipeux blanc chez la drosophile) déclenche à distance la sécrétion de dILP (drosophila insulin-like peptides, les analogues des IGF [insulin-like growth factor]1, chez la drosophile) par les cellules neuro-sécrétrices. L’activation de la voie TOR dans la glande prothoracique permet, quant à elle, la production de l’hormone stéroïde Ecdysone (Figure 1B). dILP et Ecdysone contrôlent respectivement le taux de croissance et l’entrée en métamorphose des drosophiles. Ainsi, dans un contexte de sous-nutrition, Lp induit l’activation des protéases digestives de son partenaire et optimise l’assimilation des acides aminés, ce qui stimule la croissance en maintenant les signaux Insuline et Ecdysone [8, 9].
| Figure 1.
La présence de souches spécifiques de Lactobacillus plantarum (Lp) maintient la croissance de la drosophile en condition de sous-nutrition chronique. A. Vitesse de croissance des larves de drosophiles en fonction des conditions nutritionnelles et de l’environnement bactérien. La sous-nutrition réduit le taux de croissance des drosophiles arborant un microbiote complexe, retardant leur entrée en métamorphose. Ce délai est accentué chez des larves axéniques (c’est-à-dire sans microbiote). La monocolonisation de larves avec certaines souches de Lp (souches « bénéfiques ») reproduit l’effet d’un microbiote complexe et soutient le taux de croissance en condition de sous-nutrition. Cependant, la monocolonisation avec certains isolats (souches « non bénéfiques ») est sans effet. B. La présence de souches bénéfiques de Lp induit l’expression de protéases digestives, notamment par le biais de l’activation de la voie Imd/Relish. L’activation des protéases digestives optimise l’extraction des acides aminés du milieu nutritif pauvre, soutenant l’activité de la voie TOR (target of rapamycin) dans le corps gras (l’analogue fonctionnel du foie et du tissu adipeux blanc chez la drosophile). L’activité de la voie TOR dans le corps gras stimule à distance la sécrétion par les cellules neuro-sécrétrices du cerveau de dILP (drosophila insulin-like peptides) qui contrôlent le taux de croissance. Le maintien de l’activité de la voie TOR dans la glande prothoracique va déclencher une production plus précoce de l’hormone stéroïde Ecdysone (Ecd) qui rythme la fin du développement larvaire et l’entrée en métamorphose. |
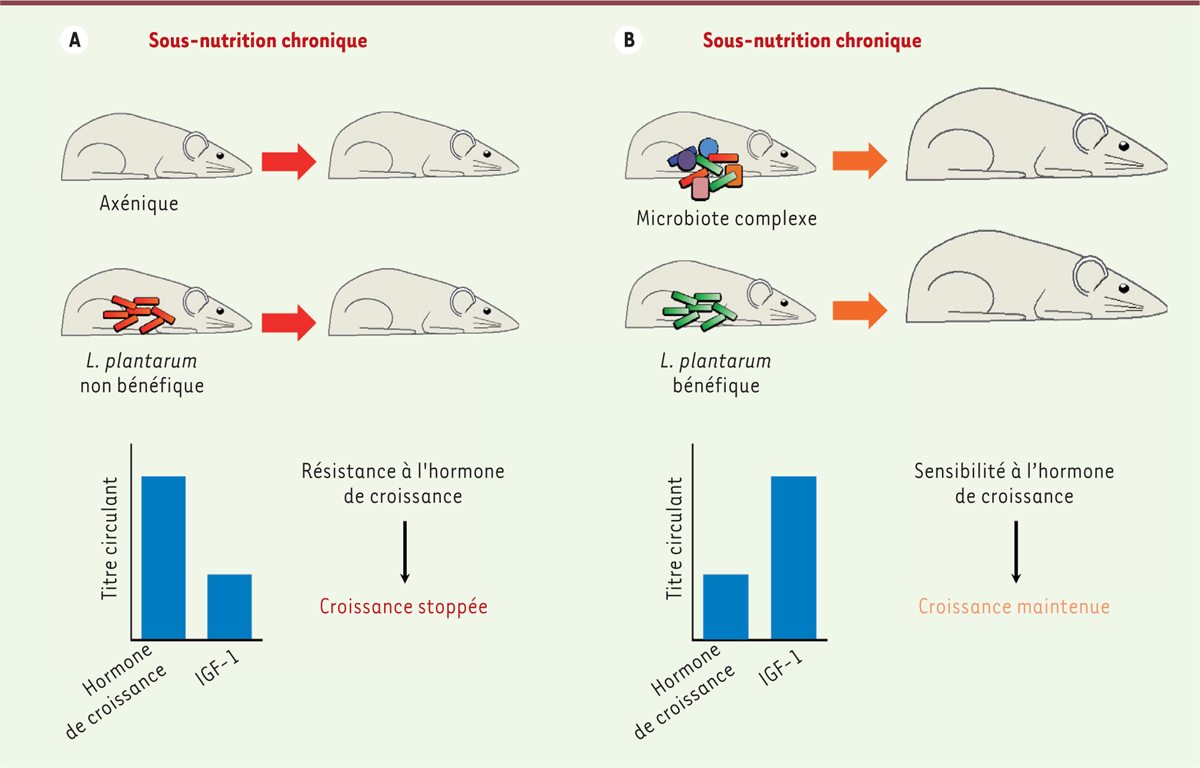
Lp est une espèce bactérienne versatile. Elle est retrouvée dans de nombreuses niches écologiques dont le microbiote gastro-intestinal des mammifères. Nous avons voulu déterminer si la capacité de souches de Lp à promouvoir la croissance, comme nous l’avons observé chez la drosophile, était conservée chez les mammifères. Nous avons étudié la dynamique de croissance après sevrage de jeunes souriceaux [10]. Nous avons observé que lorsqu’ils sont nourris avec un milieu nutritif standard, la croissance des animaux (aussi bien en terme de prise de taille que de poids) était diminuée en l’absence de microbiote intestinal. Cet effet est encore plus marqué lorsque les souriceaux sont soumis à une sous-nutrition chronique. Chez les animaux dotés d’un microbiote, bien que le taux de croissance soit également réduit par la sous-nutrition, leur croissance est maintenue. Dans le cas d’animaux axéniques soumis à une sous-nutrition, la croissance est stoppée (Figure 2). Ainsi, comme on l’observe chez la drosophile, le microbiote est nécessaire pour la croissance des souris juvéniles et atténue les effets délétères de la sous-nutrition. Afin de tester le potentiel fonctionnel chez les mammifères des souches de Lp identifiées chez la drosophile, nous avons étudié la dynamique de croissance de souriceaux après qu’ils aient été colonisés uniquement avec ces souches. Cette monocolonisation des souriceaux avec Lp améliore leur croissance, ce qui correspond en grande partie à l’effet d’un microbiote complexe (Figure 2B). De plus, la spécificité de certaines souches de Lp à promouvoir la croissance est conservée entre la souris et la drosophile : les souriceaux monocolonisés avec une souche de Lp inapte à promouvoir la croissance chez la drosophile ont une croissance fortement réduite comparée à celle des souriceaux monocolonisés avec une souche de Lp promotrice de croissance chez l’insecte (Figure 2). L’IGF-1 (insulin-like growth factor 1) est un des facteurs de croissance les plus importants chez les mammifères. Il promeut la croissance des tissus et des os et sa production est stimulée, dans le foie et les tissus périphériques, par l’hormone de croissance (GH, aussi appelée somatotrophine) sécrétée, chez le juvénile, par l’hypophyse. Lorsque les souriceaux sont soumis à une sous-nutrition chronique, les taux circulants d’IGF-1 s’effondrent. Chez les animaux axéniques, nous avons observé que les taux d’IGF-1 sont réduits comparés à ceux d’animaux arborant un microbiote, ou d’animaux monocolonisés par Lp (Figure 2), et corrélés à leur croissance amoindrie. Étonnamment, et uniquement chez les animaux axéniques, nous avons détecté un taux circulant d’hormone de croissance plus élevé (Figure 2A). Une faible production d’IGF-1 malgré des taux élevés d’hormone de croissance pourrait provenir d’un état de résistance systémique à l’hormone. Ce syndrome bien connu en cas de sous-nutrition n’a encore jamais été associé au microbiote intestinal. Afin de tester l’hypothèse d’une résistance à l’hormone, nous avons examiné l’effet de l’injection de l’hormone, sous forme recombinante, sur le profil de phosphorylation, au niveau du foie d’animaux, de protéines qui sont activées via le récepteur de l’hormone, notamment STAT5 (signal transducer and activator of transcription 5) phosphorylé, lorsque le récepteur lie son ligand. Une sensibilité accrue à l’hormone de croissance est observée dans les tissus de souriceaux porteurs d’un microbiote complexe ou de la souche de Lp promotrice de croissance. En effet, les animaux axéniques montrent une phosphorylation de STAT5 moins marquée que ceux porteurs d’un microbiote ou monocolonisés par la souche de Lp. Ainsi, lors d’une sous-nutrition chronique, un état de résistance à l’hormone de croissance s’installe chez le souriceau axénique. Ceci se traduit par une réduction du taux circulant d’IGF-1 conduisant à une altération de sa croissance. La présence du microbiote ou de souches spécifiques de Lp modère donc cet état de résistance en améliorant les niveaux d’IGF-1 circulant et le taux de croissance des juvéniles, soulignant le rôle de l’axe somatotrope (hormone de croissance/IGF-1) [10]. Le mécanisme sous-jacent à la restauration de l’activité de l’axe somatotrope en réponse au microbiote ou à certaines souches de Lp reste néanmoins à ce jour à déterminer.
| Figure 2.
L’effet promoteur de croissance de L. plantarum en condition de sous-nutrition chronique est conservé chez la souris. A. En condition de sous-nutrition chronique, la croissance des souriceaux axéniques ou monocolonisés avec des souches non bénéfiques de Lp est stoppée (panneau du haut). Cet arrêt de croissance s’explique par un état de résistance à l’hormone de croissance : en dépit d’un taux d’hormone de croissance circulante élevé, le taux d’IGF-1 (insulin-like growth factor-1, dictant le taux de croissance et dont la production dans le foie et les tissus périphériques est stimulée par l’hormone de croissance) reste faible (panneau du bas, représentation graphique). B. La présence d’un microbiote complexe, ou la monocolonisation par des souches bénéfiques de Lp, soutient la croissance des souriceaux en condition de sous-nutrition chronique (panneau du haut). Cet effet s’explique par le maintien de la sensibilité à l’hormone de croissance en dépit de la sous-nutrition (panneau du bas, représentation graphique) : le taux d’hormone de croissance circulante des animaux arborant un microbiote complexe ou monocolonisés avec une souche bénéfique de Lp est plus faible que chez les animaux axéniques ou monolocolonisés avec des souches non bénéfiques de Lp (voir A). Cependant leur taux d’IGF-1 est plus élevé, expliquant le soutien de la croissance en dépit de la sous-nutrition. |
Dans leur ensemble, nos travaux démontrent que le microbiote atténue les effets délétères de la sous-nutrition chronique sur la croissance juvénile. Ils illustrent également le potentiel de certaines souches de Lp à mimer, à elles seules, l’effet d’un microbiote plus complexe sur la croissance lorsqu’elles sont inoculées à des individus axéniques. Cependant, avant d’explorer le potentiel thérapeutique de ces souches chez l’homme, il reste nécessaire de tester leur efficacité sur la croissance de souriceaux en état de sous-nutrition chronique et porteurs d’un microbiote. La conservation de la fonctionnalité de ces souches de bactéries sur la croissance juvénile chez des organismes aussi éloignés dans l’évolution que la drosophile et la souris est néanmoins remarquable. Bien que la similitude des mécanismes moléculaires mis en jeu chez ces deux espèces animales reste encore à déterminer, cette « conservation fonctionnelle » permet d’envisager avec optimisme une analyse du potentiel probiotique (c’est-à-dire bénéfique pour la santé) de ces souches chez l’homme. En utilisant le modèle de monocolonisation de drosophiles axéniques, le criblage d’une large collection de souches de Lactobacilles pour leur effet sur la croissance juvénile en condition de sous-nutrition chronique, nous a permis d’identifier de nombreux isolats n’appartenant pas à l’espèce L. plantarum mais présentant cette même fonctionnalité (données non publiées). Cette caractéristique semble donc partagée par de nombreuses souches bactériennes commensales retrouvées dans l’intestin de différents animaux. Lp représente donc un modèle de choix pour caractériser les mécanismes moléculaires impliqués dans cette fonctionnalité, ceux-ci pouvant s’appliquer à de nombreuses autres souches commensales.
L’utilisation de la drosophile a permis de mettre à jour l’effet promoteur de croissance de certaines souches de Lp, effet qui est conservé chez les mammifères. Ces résultats légitiment donc l’utilisation de tels modèles animaux simples pour étudier la question complexe de l’influence du microbiote intestinal sur la physiologie animale. Cette approche est d’autant plus justifiée que nos travaux ont révélé un nouveau niveau de complexité : au-delà de l’espèce bactérienne, il est en effet important de considérer la spécificité de souche afin d’appréhender les facteurs bactériens façonnant la physiologie animale. Ainsi, l’utilisation de modèles animaux simples à manipuler et peu coûteux comme la drosophile permet de conduire rapidement à de nouvelles avancées scientifiques qui pourraient mener à des innovations thérapeutiques.