| |
| Med Sci (Paris). 32(11): 1026–1029. doi: 10.1051/medsci/20163211022.Le cortex visuel : entre changement et équilibre Lyes Bachatene,1 Vishal Bharmauria,1 Sarah Cattan,1 Nayan Chanauria,1 Faustin Armel Etindele Sosso,1 and Stéphane Molotchnikoff1* 1Laboratoire de neurophysiologie du système visuel, université de Montréal, département de sciences biologiques, CP 6128, succursale centre-ville, H3C 3J7Montréal, QC, Canada MeSH keywords: Animaux, Encéphale, Cartographie cérébrale, Chats, Humains, Reconnaissance visuelle des formes, Cortex visuel, Perception visuelle, physiologie |
Sélectivité des neurones du cortex visuel primaire L’une des propriétés stables des neurones dans le cortex visuel primaire occipital (V1) est la sélectivité à l’orientation. Depuis les travaux majeurs de Hubel et Wiesel [1], nous savons que les neurones de V1 répondent (en émettant des potentiels d’action) de manière maximale lorsqu’un stimulus rectiligne d’une orientation optimale est présenté dans leur champ récepteur1. Les cellules partageant la même sélectivité sont regroupées spatialement en colonnes d’orientation. Deux colonnes voisines correspondent à des sélectivités à l’orientation proches (avec un changement d’environ 10° d’angle visuel), de sorte qu’en parcourant des colonnes adjacentes, on parcourt progressivement toutes les orientations. Une hyper-colonne correspond à l’ensemble des colonnes représentant la même portion du champ visuel, couvrant toutes les orientations (ainsi que d’autres propriétés visuelles dont nous ne discuterons pas ici, la fréquence spatiale et la dominance oculaire). Cette organisation systématique est la conséquence d’une architecture de connexions neuronales très déterminée. Les colonnes d’orientation sont des structures formées au cours d’une période post-natale plus ou moins longue, allant de quelques semaines à plusieurs mois selon l’espèce animale, appelée période critique2. Après la fin de la période critique, cette organisation est considérée comme immuable. Par exemple, les chatons exposés, durant leur période critique, à un environnement visuel privilégiant une orientation donnée, possèdent des cartes visuelles corticales avec une sensibilité dominante pour cette orientation particulière [2]. Cependant, il est désormais admis qu’il est possible d’engendrer un changement de sélectivité à l’orientation, à l’âge adulte, suite à une exposition à une orientation non-optimale des neurones du cortex visuel primaire [3–5]. Cette nouvelle sélectivité acquise par les neurones d’une colonne stimulée, ainsi que les changements conséquents de la connectivité entre neurones, peuvent poser un problème de surreprésentation du nouveau stimulus au sein de la représentation visuelle corticale. Une question fondamentale se pose alors : l’hyper-colonne subit-elle une altération/réorganisation complète avec l’émergence d’un nouvel état de sélectivité et de connectivité du cortex ? |
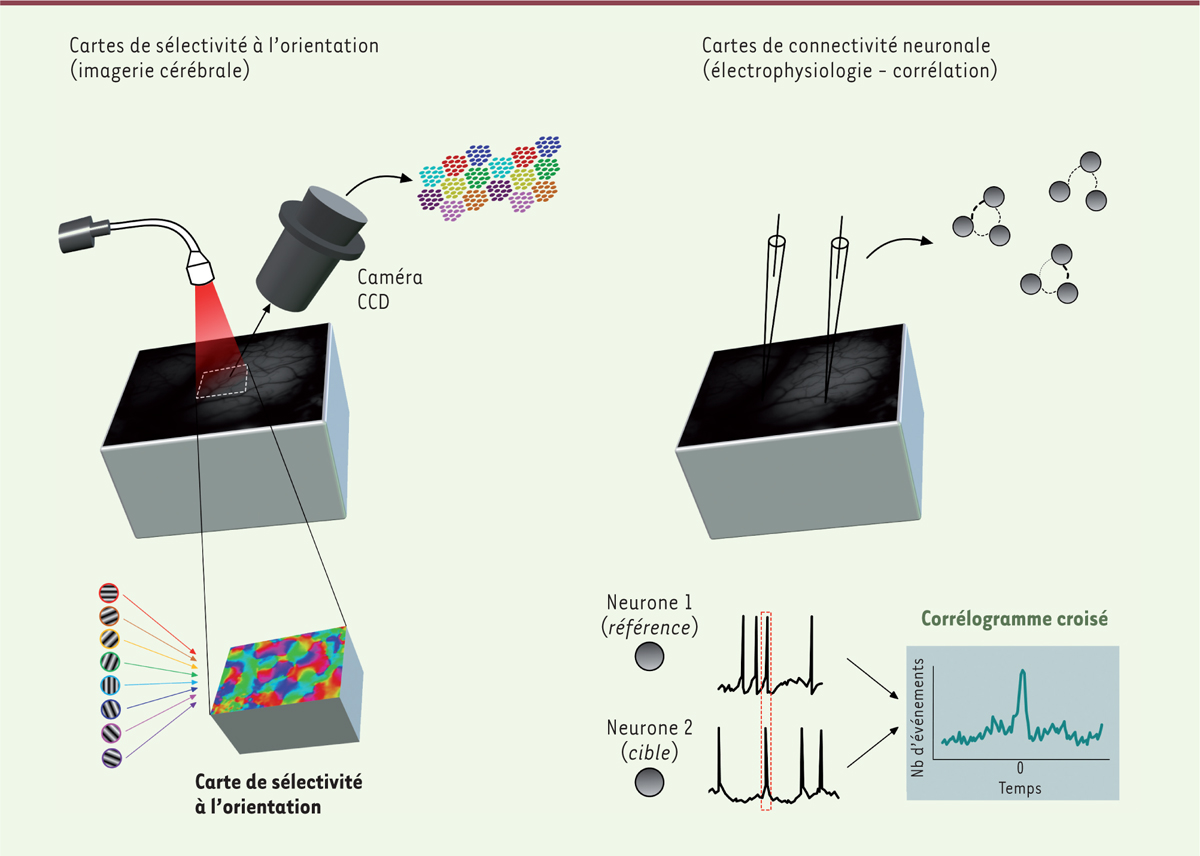
Afin de répondre à cette question, nous avons effectué des expériences combinées d’imagerie cérébrale et d’électrophysiologie dont les résultats ont été récemment publiés [3, 6]. Cette approche nous a permis d’évaluer, chez des chats adultes anesthésiés, les cartes de sélectivité à l’orientation et la connectivité entre les neurones avant et après une procédure d’adaptation visuelle3 (imposition d’un stimulus) induisant un changement de sélectivité à l’orientation. La technique d’imagerie cérébrale optique intrinsèque permet d’enregistrer l’activité de populations de cellules (Figure 1, gauche). C’est une technique non-invasive basée sur les exigences métaboliques dues à l’activité électrique des neurones. Lorsqu’une cellule émet des potentiels d’action, il y a parallèlement une augmentation de la consommation de glucose, couplée à une élévation de la microcirculation sanguine. Nous mesurons ainsi les variations de débits sanguins qui sont quasi-simultanées à l’activation de groupes de neurones. Cette approche nous a permis d’établir la cartographie des colonnes d’orientation dans le cortex visuel.
 | Figure 1.
Stratégies expérimentales. À gauche : les cartes de sélectivité à l’orientation dans le cortex visuel primaire sont générées en utilisant un protocole d’imagerie optique intrinsèque. Chaque plage de couleurs correspond à l’orientation optimale codée par les neurones contenus dans diverses zones du cortex. À droite : les cartes de connectivité fonctionnelle sont générées à partir de corrélations croisées entre les trains de décharge de potentiels d’action des neurones pris comme références (neurone 1) et des neurones pris comme cibles (neurone 2). L’amplitude du pic du corrélogramme croisé (représenté à droite des potentiels d’action des deux neurones) représente la probabilité de décharge du neurone cible lorsque le neurone référence émet une réponse. Cette probabilité révèle la force de connectivité fonctionnelle. CDD : charge coupled device.
|
En parallèle, nous avons réalisé des enregistrements extracellulaires de l’activité de plusieurs neurones du cortex visuel simultanément. En analysant leurs taux de décharge de potentiels d’action, nous avons pu établir leur sélectivité à l’orientation et leur connectivité fonctionnelle (Figure 1, droite). Cette connectivité fonctionnelle est étudiée en calculant la probabilité (probabilité de connexion fonctionnelle PC) que deux neurones soient connectés ensemble et que l’un projette sur l’autre. Ce calcul se base sur l’analyse temporelle des décharges de potentiels d’action : lorsque les liens inter-neuronaux sont relativement directs entre un neurone 1 (la référence) et un neurone 2 (la cible), une analyse de corrélation croisée des décharges des deux neurones fait apparaître un pic de corrélation, reflétant la décharge quasi-simultanée (quelques millisecondes d’écart) des deux neurones. Cette approche permet donc d’estimer la modulation de la connectivité neuronale [7]. |
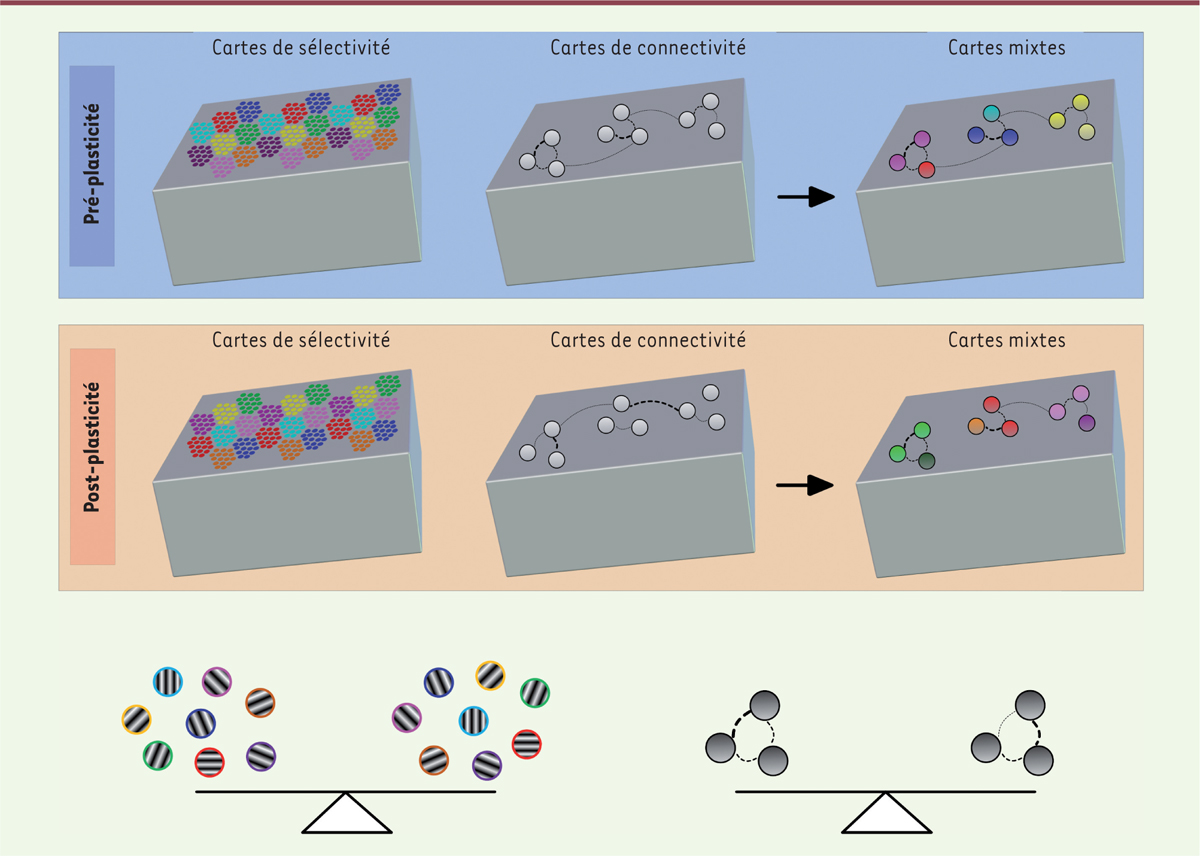
Un mécanisme « homéo-dynamique » ? La procédure d’adaptation visuelle modifie à la fois les cartes de sélectivité à l’orientation et les cartes de connectivité fonctionnelle (Figure 2). Cependant, nous n’observons pas une surreprésentation de l’orientation imposée à l’échelle de la carte de sélectivité. Nous observons plutôt une restructuration étendue des domaines d’orientation aboutissant à un remaniement de la disposition des colonnes d’orientation. Au final, chaque orientation reste représentée de façon égale dans l’hyper-colonne, mais pas dans la même colonne qu’à l’origine. En parallèle avec ces résultats, les cartes de connectivité montrent également une réorganisation massive mais, de façon intéressante, il y a une stabilisation des probabilités de connectivité (PC) totales au sein des groupes neuronaux. La somme des PC est donc maintenue après la phase de plasticité. Ces dynamiques peuvent être reflétées sur des cartes mixtes dans lesquelles les aspects de sélectivité et de connectivité sont combinés.
 | Figure 2.
Homéostasie de la sélectivité à l’orientation et de la connectivité neuronale. Haut : cartes de sélectivité et de connectivité telles que décrites par l’imagerie optique et l’électrophysiologie avant la procédure d’adaptation à une orientation visuelle. Milieu : après plasticité cérébrale, les cartes de sélectivité sont modulées (noter le changement de la disposition des pastilles de couleur, correspondant à un changement des colonnes d’orientation). Le même espace cortical répond maintenant de façon optimale à une autre orientation, cependant la proportion des pixels correspondant à chaque orientation optimale est conservée. Le même phénomène s’observe avec les cartes de connectivité où les pondérations des connexions fonctionnelles se redistribuent mais le poids total est stable. Bas : schéma illustrant la plasticité homéostatique décrite, c’est-à-dire le maintien de l’équilibre. |
Les études sur les changements de propriétés neuronales suggèrent fortement que la sélectivité à l’orientation dans le système visuel est une caractéristique flexible, et qui est ajustée par des neurones spécifiques. Les changements du réseau de neurones global dépendent donc des changements des neurones testés par l’entraînement visuel. Nous montrons que les colonnes d’orientation transcendent l’aspect anatomique et sont des unités fonctionnelles plastiques (ce même principe pourrait sans doute s’appliquer à l’ensemble du cortex sensoriel). L’adaptation visuelle tend à rééquilibrer les forces de connectivité entre différents microcircuits neuronaux mais conserve un « état » global stable, ce qui serait en parfaite concordance avec de récentes recherches stipulant que l’adaptation contribue à une homéostasie des réponses de populations neuronales [8]. Il y aurait ainsi un équilibre entre les habiletés plastiques de ces populations neuronales et leur dynamique d’homéostasie. Par quels mécanismes cette plasticité homéostatique pourrait s’exercer ? Durant les phénomènes de plasticité neuronale, l’impact du stimulus imposé se ferait sur le seuil d’excitabilité et de décharge des neurones, augmentant principalement les efficacités synaptiques4 correspondantes et, par conséquent, permettant l’émergence d’un nouveau stimulus optimal. Il a été démontré, par des enregistrements intracellulaires, qu’un seul neurone cortical reçoit de multiples entrées synaptiques. Les neurones du cortex visuel primaire reçoivent ainsi des entrées poly-synaptiques des cellules avoisinantes mais également de réseaux de neurones de sites corticaux distants. De ce fait, il y a de nombreuses connexions parallèles (feedforward) et rétroactives (feedback) [9, 10] (→).
(→) Voir la Nouvelle de J. Vezoli, m/s n° 10, octobre 2016, page 823
La diversité des combinaisons des entrées synaptiques peut être reflétée par les patrons de connectivité intra-corticaux, et des changements dans cette connectivité permettent l’émergence de nouvelles propriétés neuronales [11]. Le stimulus imposé (orientation dans notre cas lors de l’adaptation visuelle) conduit ainsi à des connexions qui peuvent changer la sélectivité neuronale et redistribuer les poids synaptiques du réseau de neurones en modifiant le rapport excitation-inhibition. Tous ces changements doivent se faire dans un cadre respectant deux contraintes inéluctables : d’une part, il faut ne pas « effacer » les données présentes avant le changement et, d’autre part, les modifications ne peuvent se faire que dans un périmètre physique cerné, défini par l’arborescence des dendrites des neurones. |
Nous avons montré que les cartes d’orientation changeaient d’agencement (avec une redistribution des pixels correspondant à chaque orientation optimale) mais qu’il y avait conservation de la proportion de chaque orientation optimale dans les cartes. De la même manière, les connexions fonctionnelles entre les neurones se répartissent au sein du réseau neuronal avec un maintien de la pondération totale de connectivité. Nous sommes donc en présence d’un couplage « sélectivité-connectivité » qui est en parfaite concordance avec le concept de plasticité homéostatique. En effet, un processus homéostatique est établi dans le but de stabiliser la force globale des connexions initialement mesurée au sein d’un réseau de neurones. Cette activité régulatrice est considérée comme une activité complémentaire à la plasticité Hebbienne5 où l’on observe des changements de poids synaptiques dans le but d’acquérir de nouvelles propriétés. L’impact de nos résultats est double : d’une part ils démontrent que l’organisation du cerveau adulte peut être modifiée quand un protocole approprié est appliqué et, d’autre part, que cette réorganisation se fait de manière à maintenir les acquis sensoriels antérieurs. Par exemple quand, suite à l’adaptation, un groupe de neurone change d’orientation, le système visuel ne devient pas aveugle à l’orientation perdue mais, grâce à un effet domino, les autres neurones, non soumis à l’adaptation, basculent simultanément pour maintenir le spectre entier des sensations aux orientations. Donc rien n’est perdu ! |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Hubel DHWiesel TN. Receptive fields, binocular interaction and functional architecture in the cat’s visual cortex . J Physiol. 1962; ; 160 : :106.–154. 2.
Sengpiel FStawinski PBonhoeffer T. Influence of experience on orientation maps in cat visual cortex . Nat Neurosci. 1999; ; 2 : :727.–732. 3.
Bachatene LBharmauria VCattan S, et al. Reprogramming of orientation columns in visual cortex: a domino effect . Sci Rep. 2015; ; 5 : :9436.. 4.
Dragoi VSharma JSur M. Adaptation-induced plasticity of orientation tuning in adult visual cortex . Neuron. 2000; ; 28 : :287.–298. 5.
Godde BLeonhardt RCords SMDinse HR. Plasticity of orientation preference maps in the visual cortex of adult cats . Proc Natl Acad Sci USA. 2002; ; 99 : :6352.–6357. 6.
Bachatene LBharmauria VCattan S, et al. Summation of connectivity strengths in the visual cortex reveals stability of neuronal microcircuits after plasticity . BMC Neurosci. 2015; ; 16 : :64.. 7.
Reid RC. From functional architecture to functional connectomics . Neuron. 2012; ; 75 : :209.–217. 8.
Benucci ASaleem ABCarandini M. Adaptation maintains population homeostasis in primary visual cortex . Nat Neurosci. 2013; ; 16 : :724.–729. 9.
Ringach DL. Haphazard wiring of simple receptive fields and orientation columns in visual cortex . J Neurophysiol. 2004; ; 92 : :468.–476. 10.
Le Vezoli J. cerveau communique selon différentes bandes de fréquences . Med Sci (Paris). 2016; ; 32 : :823.–826. 11.
Monier CChavane FBaudot P, et al. Orientation and direction selectivity of synaptic inputs in visual cortical neurons: a diversity of combinations produces spike tuning . Neuron. 2003; ; 37 : :663.–680. |