| |
| Med Sci (Paris). 32(12): 1059–1061. doi: 10.1051/medsci/20163212005.Nucléation de l’actine et transfert du VIH des cellules dendritiques aux lymphocytes T Mickaël Ménager1 1Molecular pathogenesis program, The Kimmel center for biology and medicine of the Skirball Institute, New York university school of medicine, 540 1st Ave, SK 2-17, 10016New York, États-Unis MeSH keywords: Actines, Transport biologique, Cellules dendritiques, Infections à VIH, VIH-1 (Virus de l'Immunodéficience Humaine de type 1), Humains, Polymérisation, Multimérisation de protéines, Lymphocytes T, Libération de particules virales, métabolisme, virologie, immunologie, physiologie |
Les cellules dendritiques sont des cellules du système immunitaire inné qui constituent une première barrière de défense contre les pathogènes. Elles permettent de capturer virus et bactéries, afin entre autres de présenter des peptides antigéniques aux lymphocytes T du système immunitaire adaptatif, dans le but de générer une réponse immunitaire optimale et spécifique. Bien que les cellules dendritiques humaines soient capables de capturer le VIH (virus de l’immunodéficience humaine) par l’intermédiaire de multiples récepteurs, la réplication du virus apparaît très faible dans ces cellules en comparaison à la réplication dans les lymphocytes T, principales cibles in vivo du virus [2]. Cette faible réplication repose sur l’existence dans ces cellules d’un facteur de restriction, SAMHD1 (SAM domain and HD domain-containing protein 1), qui, en inhibant la synthèse d’ADN à partir de l’ARN génomique viral, empêche l’intégration du virus et la production de nouvelles particules virales [3]. En revanche, des études in vitro ont montré que les cellules dendritiques peuvent transmettre le virus aux lymphocytes T CD4+ au cours d’un processus d’infection en trans1 appelé « trans-enhancement » ou « trans-infection » [4, 5]. Plusieurs mécanismes moléculaires expliquant cette transmission ont été proposés avec un transfert du VIH soit par la voie des exosomes, après internalisation [6], soit par le biais de protrusions membranaires [7], soit encore par une grande invagination de la membrane plasmique [8]. Bien que l’importance de ce transfert reste à démontrer dans un contexte in vivo, nous pensons que le VIH a pu évoluer pour ne pas se répliquer dans les cellules dendritiques, évitant ainsi la première ligne de défense du système immunitaire, et utiliser ces cellules comme agent de propagation très efficace et rapide aux lymphocytes T. |
TSPAN7, un régulateur positif de la nucléation de l’actine essentiel pour la formation de dendrites, permet un transfert efficace du VIH aux lymphocytes T Afin de mieux comprendre les mécanismes moléculaires associés au transfert du VIH aux lymphocytes T CD4+, nous avons réalisé un crible à ARN interférent (shARN, short hairpin RNA) dans des cellules dendritiques dérivées de monocytes primaires humains isolés du sang de donneurs sains. Nous avons pu ainsi réduire l’expression de 455 gènes impliqués dans le trafic membranaire et vésiculaire. Parmi ces gènes, 135 candidats potentiellement impliqués dans le transfert du virus ont été identifiés dont de nombreux gènes contrôlant la nucléation de l’actine et la formation de protrusions membranaires requis pour la transmission du virus. Des gènes, régulateurs positifs de différentes voies d’endocytose, dont l’expression diminuerait le phénomène de transfert, ont également été identifiés. Par cette approche, nous avons pu valider le rôle positif joué par la tétraspanine 7 (TSPAN7) dans les cellules dendritiques. La TSPAN7 est un membre de la famille des tétraspanines dont des mutations ont été associées à des retards mentaux liés au chromosome X, avec notamment un défaut de formation des dendrites synaptiques neuronales [9]. Par des expériences de localisation de la protéine en microscopies confocale et électronique, nous avons pu montrer que la TSPAN7 était nécessaire pour la formation de dendrites riches en actine. En effet, en l’absence de la TSPAN7, les protrusions membranaires sont remplacées par des blebs2,, des proéminences cellulaires dépourvues d’actine. On observe également une augmentation de la capture du virus, qui se retrouve agrégé dans des vésicules dérivées des voies de macropinocytose3. En utilisant des drogues bloquant la fonction du complexe ARP2/3 (actin-related protein 2/3), nous avons pu reproduire les phénotypes que nous avons observés, en inhibant la nucléation de l’actine [10], sans qu’il n’y ait d’effets additionnels après diminution de l’expression de la TSPAN7. La TSPAN7 joue donc, dans les cellules dendritiques, un rôle de régulateur positif de la nucléation de l’actine. Il en résulte un réseau de filaments d’actine qui est nécessaire pour la formation de dendrites pouvant capturer le VIH et le transférer directement aux cellules T. |
DNM2 stabilise l’actine corticale. Il permet de limiter l’entrée du VIH par macropinocytose et optimise son transfert Un des gènes identifiés par notre crible à ARN interférent, code la protéine dynamine 2 (DNM2) [11]. La diminution de l’expression de DNM2 dans les cellules dendritiques entraîne une diminution du transfert du VIH. Son rôle apparaît cependant ne pas dépendre de sa fonction classique dans la voie d’endocytose associée aux molécules de clathrines [12] (→).
(→) Voir la Nouvelle de E. Boucrot et H.T. McMahon, m/s n° 2, février 2011, page 122
DNM2 ne semble pas jouer de rôle important dans la formation des dendrites riches en actines. Elle permet plutôt une stabilisation de l’actine corticale sous la membrane plasmique, ce qui limite l’internalisation du virus dans les cellules dendritiques par des voies de type macropinocytose. L’inhibition de la nucléation de l’actine ou de TSPAN7 entraîne également une perte de l’actine corticale. |
L’inhibition de l’actomyosine qui restaure la formation des dendrites, permet de compenser les défauts de transfert dus à la perte de la nucléation de l’actine La formation de blebs dépend généralement de l’actomyosine qui génère une force contractile à la membrane plasmique via l’interaction entre les filaments d’actine et de myosine 2 [13]. En inhibant la contraction de l’actomyosine, nous avons pu empêcher l’internalisation du VIH dans des vésicules de type macropinocytose, conséquence de l’inhibition de la nucléation de l’actine ou de la TSPAN7. De façon plus inattendue, en inhibant cette contraction, nous avons aussi pu observer une restauration des dendrites riches en actine, une relocalisation des particules virales à leur surface, et un transfert aux lymphocytes T similaire à celui des cellules contrôles. Inhiber la contraction de l’actomyosine dans des cellules dendritiques possédant une nucléation de l’actine fonctionnelle, entraîne une formation accrue des protrusions membranaires. Ces dernières, plus importantes en nombre et en taille, favorisent le maintien des particules virales à leur surface et une augmentation du transfert du VIH aux lymphocytes T. |
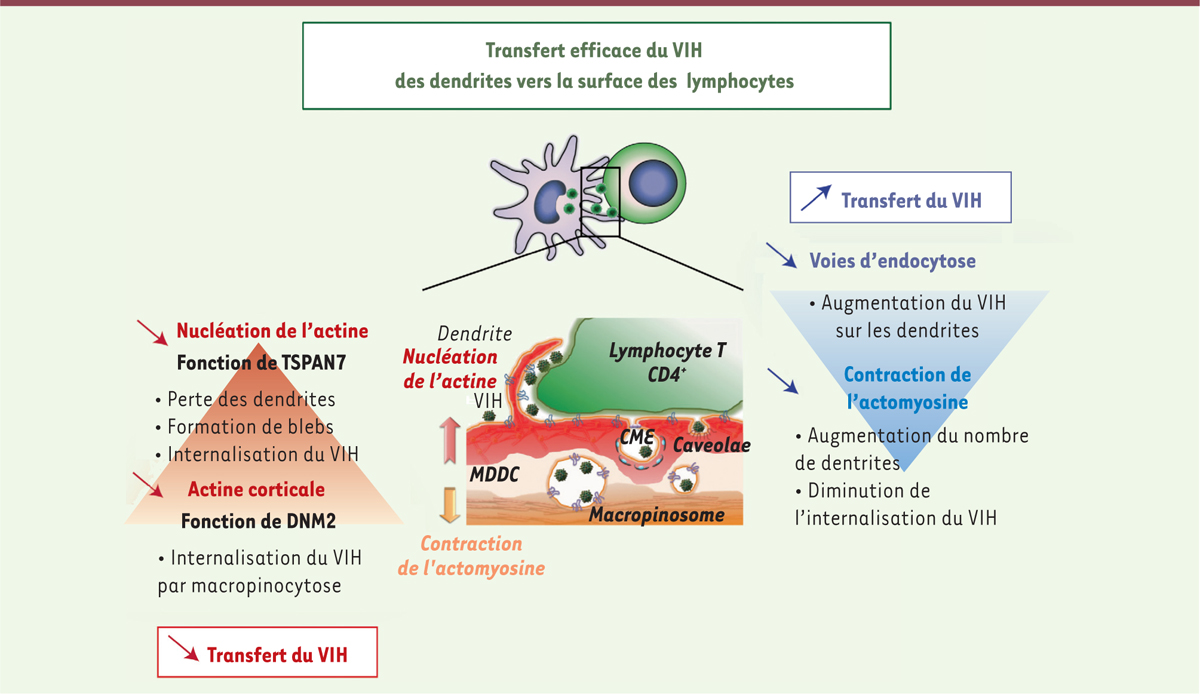
Nos travaux démontrent donc l’importance des effecteurs de la nucléation de l’actine et de la stabilisation de l’actine corticale dans le transfert du VIH des cellules dendritiques aux lymphocytes T. Ces mécanismes permettent de limiter l’entrée du VIH dans les cellules dendritiques. Ils sont à l’origine de la formation des dendrites riches en actine qui peuvent capturer le VIH et le transférer de façon efficace et directe à la surface des lymphocytes T CD4+(Figure 1). Nous avons également mis en évidence l’existence, à la membrane plasmique des cellules dendritiques, de deux forces opposées : (a) la nucléation de l’actine, une force protrusive qui semble contrebalancer (b) la contraction de l’actomyosine. La perturbation de l’équilibre entre ces deux forces favorise donc soit la formation de protrusions membranaires, soit l’internalisation du VIH par des mécanismes de macropinocytose dus à la rétraction de blebs.
 | Figure 1.
Modèle décrivant l’importance de la nucléation de l’actine et des rôles joués par les protéines TSPAN7 et DNM2 pour un transfert efficace du VIH des dendrites vers la surface des lymphocytes T CD4+. VIH : virus de l’immunodéficience humaine ; TSPAN7 : tétraspanine 7 ; DNM2 : dynamine 2 ; CME : endocytose par la voie des clathrines ; MDDC : monocyte-derived dendritic cells. |
|
L’auteur déclare n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Menager MM, Littman DR. Actin dynamics regulates dendritic cell-mediated transfer of HIV-1 to T cells . Cell. 2016; ; 164 : :695.–709. 2.
Wu L, KewalRamani VN. Dendritic-cell interactions with HIV: infection and viral dissemination . Nat Rev Immunol. 2006; ; 6 : :859.–868. 3.
Laguette N, Sobhian B, Casartelli N, et al. SAMHD1 is the dendritic- and myeloid-cell-specific HIV-1 restriction factor counteracted by Vpx . Nature. 2011; ; 474 : :654.–657. 4.
Cameron PU, Freudenthal PS, Barker JM, et al. Dendritic cells exposed to human immunodeficiency virus type-1 transmit a vigorous cytopathic infection to CD4+ T cells . Science. 1992; ; 257 : :383.–387. 5.
Geijtenbeek TB, Kwon DS, Torensma R, et al. DC-SIGN, a dendritic cell-specific HIV-1-binding protein that enhances trans-infection of T cells . Cell. 2000; ; 100 : :587.–597. 6.
Wiley RD, Gummuluru S. Immature dendritic cell-derived exosomes can mediate HIV-1 trans infection . Proc Natl Acad Sci USA. 2006; ; 103 : :738.–743. 7.
Nikolic DS, Lehmann M, Felts R, et al. HIV-1 activates Cdc42 and induces membrane extensions in immature dendritic cells to facilitate cell-to-cell virus propagation . Blood. 2011; ; 118 : :4841.–4852. 8.
Yu HJ, Reuter MA, McDonald D. HIV traffics through a specialized, surface-accessible intracellular compartment during trans-infection of T cells by mature dendritic cells . PLoS Pathog. 2008; ; 4 : :e1000134.. 9.
Bassani S, Cingolani LA, Valnegri P, et al. The X-linked intellectual disability protein TSPAN7 regulates excitatory synapse development and AMPAR trafficking . Neuron. 2012; ; 73 : :1143.–1158. 10.
Goley ED, Welch MD. The ARP2/3 complex: an actin nucleator comes of age . Nat Rev Mol Cell Biol. 2006; ; 7 : :713.–726. 11.
Ferguson SM, De Camilli P. Dynamin, a membrane-remodelling GTPase . Nat Rev Mol Cell Biol. 2012; ; 13 : :75.–88. 12.
Boucrot E, McMahon HT. Initiation de l’endocytose par vésicules de clathrine : des « sculpteurs de membrane » au travail . Med Sci (Paris). 2011; ; 27 : :122.–125. 13.
Ridley AJ. Life at the leading edge . Cell. 2011; ; 145 : :1012.–1022. |