Le virus de l’herpès simplex de type 1 (HSV-1) est à l’origine d’infections lytiques1 dans les cellules épithéliales et d’infections latentes dans les neurones périphériques. Le génome d’HSV-1 peut persister, tout le long de la vie d’une personne, en latence, c’est-à-dire dans un état silencieux, non toxique pour les neurones [1, 2]. Cependant, sous l’action de certains stimulus dont le stress qui est l’un des plus importants, le génome viral latent peut s’éveiller et initier des infections lytiques qui lui permettent de se multiplier et de se transmettre, un phénomène connu sous le nom de réactivation (pour revue, voir [3]) (→).
(→) Voir la Synthèse de A.M. Aranda et A.L. Epstein, m/s n° 5, mai 2015, page 506
Durant la phase de latence, l’expression du génome viral au sein de la cellule hôte se limite à celle du locus LAT (latency associated transcripts) qui contrôle la transcription d’une famille d’ARN non-codants. L’expression des gènes viraux lytiques est alors inhibée par la présence au niveau de leurs promoteurs d’hétérochromatine répressive et aucune protéine virale n’est exprimée [4, 5]. La réactivation virale nécessite donc l’induction de l’expression des gènes viraux lytiques à partir de promoteurs qui sont réprimés et ceci en l’absence de protéines virales.
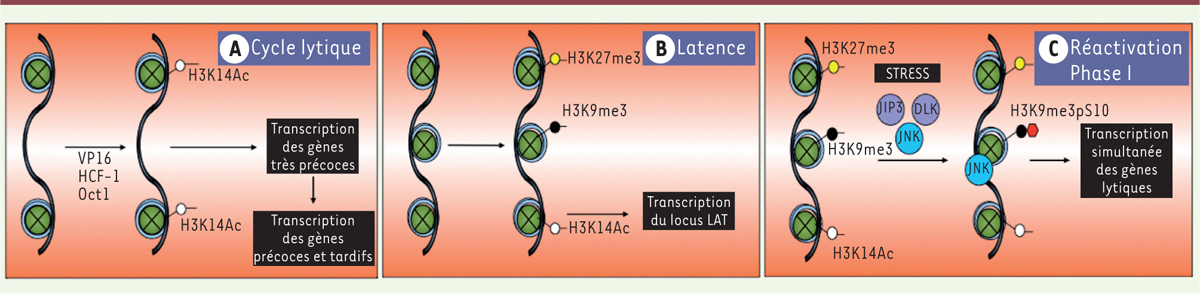
Dans les cellules épithéliales, l’expression des gènes viraux à l’origine de l’infection lytique se réalise de manière séquentielle et ordonnée. Elle débute par la transcription des gènes très précoces dont la plupart codent des protéines de régulation. Elle est suivie de la transcription des gènes précoces qui codent les protéines de réplication de l’ADN viral. Enfin, à la suite de l’initiation de la synthèse d’ADN, les gènes tardifs codant les protéines de la structure virale sont transcrits [2]. Parmi les protéines ayant pour origine les gènes tardifs, la protéine VP16 (virion protein 16), un activateur de la transcription, est introduite dans les cellules lors du cycle infectieux suivant et joue, en association avec des protéines cellulaires, un rôle clef dans l’inhibition de la répression hétérochromatinienne du génome viral et dans la promotion de l’expression des gènes très précoces [2] (Figure 1). Lors de la réactivation, la ré-initiation de l’expression des gènes viraux se produit par un processus différent qui comporte deux étapes successives dont la première (la phase I ou animation) s’effectue en l’absence de VP16 et aboutit à l’expression simultanée de l’ensemble des gènes viraux, incluant VP16. La deuxième étape (la phase II), qui se réalise donc en présence de VP16, aurait lieu de manière séquentielle, comme lors de l’initiation de l’infection lytique dans les cellules épithéliales [6, 7]. L’étape initiale (la phase I) de dé-répression simultanée des gènes viraux qui conduit à l’expression des gènes très précoces de façon indépendante de VP16 et dans laquelle l’expression des gènes tardifs est indépendante de la synthèse d’ADN viral, est très surprenante et très différente de la phase II aboutissant à la formation de particules infectieuses [7]. L’absence de protéines virales lors de l’induction de la phase I avait conduit à envisager que cette étape devait dépendre de l’action exclusive de protéines d’origine cellulaire. Cependant, aucune donnée n’avait confirmé cette hypothèse. Une publication récente [8] a permis de comprendre comment, et par quels intermédiaires, la phase I de la réactivation se réalisait.
| Figure 1.
Les différentes phases du cycle infectieux de l’herpès simplex de type 1 (HSV-1). Suite à la pénétration du génome viral dans les noyaux, les cellules infectées déclenchent des mécanismes de défense visant à réprimer l’expression des gènes viraux, dont l’hétérochromatinisation du génome viral. Cependant, tout se passe différemment selon le type cellulaire infecté. A. Cycle lytique. Dans les cellules épithéliales, la protéine structurale VP16 (virion protein 16), en association avec les protéines cellulaires Oct1 (octamer-binding protein 1) et HCF (host cell factor), va se lier de manière spécifique aux promoteurs des gènes viraux très précoces où, en association à des histone-déméthylases, elle va contribuer à établir une configuration chromatinienne permissive pour l’expression (H3K14me3). Il s’ensuit l’expression des protéines très précoces, en particulier ICP0 (infected cell polypeptide 0) et ICP4, lesquelles vont induire à leur tour l’expression des gènes précoces et, après initiation de la synthèse d’ADN, celle des gènes tardifs. Le génome viral s’exprime donc de manière séquentielle et ordonnée. B. L’infection latente. Dans les neurones périphériques, VP16 n’arrive pas aux noyaux cellulaires et ne peut donc pas empêcher la répression des gènes très précoces et induire leur expression. L’ensemble du génome viral devient alors réprimé par formation de chromatine répressive (H3K9me3, H3K27me3) dans l’ensemble des promoteurs des gènes du cycle lytique. Seul le promoteur du gène LAT (latency associated transcripts) peut s’exprimer en absence de VP16 et ceci seulement dans les neurones périphériques. L’expression des ARN LAT contribue à l’établissement et au maintien du génome viral en latence. C. Phase I de la réactivation. L’étude de Cliffe et collègues [8] montre que, suite à un stress, l’activation de la voie de signalisation JNK (c-Jun N-terminal kinase) provoque la phosphorylation de la sérine S10 adjacente à la lysine K9 dans l’histone H3 (et vraisemblablement aussi dans d’autres histones et dans d’autres sites répressifs). Cette phosphorylation (H3K9me3pS10) induit l’expression simultanée de l’ensemble des gènes viraux, donc l’entrée en phase I de la réactivation, sans déméthylation de H3. D’autres études [6, 7] ont montré que cette dérépression est néanmoins transitoire. Suite à la diminution de l’expression de la phase I, une deuxième vague d’expression (phase II) a lieu, vraisemblablement de manière séquentielle et ordonnée, comme lors de l’initiation de la phase lytique, et faisant participer des histones déméthylases. Cependant, les mécanismes moléculaires liés à la fin de la phase I, ainsi que le rôle de VP16 ou d’autres protéines virales dans l’initiation de la phase II, restent non-élucidés. DLK : dual leucine zipper kinase ; JIP3 : JNK interacting protein 3. |
En effet, afin d’étudier la phase I de la réactivation, Cliffe et ses collègues [8] ont utilisé des cultures primaires de neurones périphériques, sympathiques2, et sensoriels. Ces neurones ont été infectés pendant 6 jours par l’HSV-1 en présence d’interféron et d’acyclovir, une drogue antivirale. Dans ces conditions, une absence d’expression de protéines virales, conjointement à l’expression du locus LAT, est observée dans les cellules neuronales, indiquant que l’infection est effectivement entrée en latence. La réactivation du virus peut être induite de plusieurs façons comme la privation en facteur de croissance nerveuse (NGF, nerve growth factor), l’inhibition de la phosphoinositide 3-kinase (PIK3) par un traitement avec le LY2940023,, ou encore par un choc thermique [7, 9]. Tous ces traitements sont connus pour induire l’activation de JNK (c-Jun N-terminal kinase), un important médiateur du stress. Cliffe et ses collègues ont induit la réactivation du virus en traitant les neurones infectés avec le LY294002. Cette réactivation a été réalisée en présence d’un autre inhibiteur (le WAY 150138) qui bloque la multiplication virale, ce qui permet d’évaluer les événements précoces de la réactivation en l’absence de nouvelles infections lytiques. Dans ces conditions, l’inhibition de la PI3K par le LY294002 conduit bien à la réactivation du génome viral et à l’activation de la voie de signalisation de JNK (identifiée par la phosphorylation de c-Jun). Inversement, l’inhibition de JNK (par les inhibiteurs SP600125 ou AS601245) altère la sortie de latence montrant ainsi que la réactivation du virus induite par l’inhibition de la PIK3 empreinte la voie de signalisation de JNK [8]. Des stress comme la privation en NGF ou l’inhibition de la PIK3 activent JNK via son interaction avec les protéines DLK (dual leucine zipper kinase) et JIP-3 (JNK interacting protein 3). Ces interactions privilégient les réponses aux stress. En utilisant des lentivirus exprimant des shARN (short hairpin RNA) afin d’inhiber la synthèse de DLK ou de JIP-3, il est possible de réprimer l’expression des gènes viraux induits par l’inhibition de la PIK3 [8] montrant que DLK et JIP-3 sont nécessaires pour l’entrée d’HSV-1 en phase I.
Les mécanismes par lesquels la voie de signalisation JNK induit l’expression des gènes viraux pendant la phase I ont ensuite été examinés. Durant la latence, les promoteurs des gènes viraux sont associés à des histones H3 tri-méthylées au niveau des lysines K9 (H3K9me3) et K27 (H3K27me3), ce qui est une caractéristique de l’hétérochromatine répressive [4, 10]. Une première question a donc été de savoir si l’entrée en phase I nécessitait la déméthylation des lysines K9 et K27 de l’histone H3. Le GSK-J4, une molécule qui inhibe UTX (ubiquitously transcribed tetratricopeptide repeat, X chromosome) et JMJD3 (jumonji domain containing 3), deux déméthylases spécifiques de la lysine H3K27me3, ou la trancylpromine (TCP), une molécule qui bloque LSD1 (lysine-specific demethylase 1) et JMJD2, deux déméthylases spécifiques de la lysine H3K9me3 ont été utilisées pour explorer cette question. Les résultats obtenus ont montré que GSK-J4 et TCP inhibaient effectivement la déméthylation de l’histone H3 mais ne bloquaient pas l’entrée en phase I du virus induite par l’inhibition de la PIK3. La phase I de la réactivation ne dépend donc pas de l’activité des histones déméthylases [8]. Mais alors, par quel autre mécanisme JNK peut-il induire la transcription des gènes viraux ? La phosphorylation des histones au niveau de sérines voisines sur les sites de méthylation (H3S10 et H3S28) est un phénomène connu sous le nom de methyl/phospho switch [11, 12]. Il peut induire l’initiation de l’expression génique sans qu’il y ait déméthylation des lysines adjacentes. En utilisant des anticorps spécifiques de l’histone doublement modifiée (H3K9me3/pS10), mais ne reconnaissant pas les modifications individuelles (H3K9me3 ou H3pS10), Cliffe et ses collègues ont montré une augmentation significative de l’histone H3K9m3/pS10 dans les promoteurs d’au moins deux gènes viraux pendant la phase I de la réactivation. L’augmentation de H3K9m3/pS10 au niveau de ces promoteurs est de plus bloquée lorsque l’activité de JNK est elle-même inhibée, ce qui indique que la voie de signalisation JNK est à l’origine de la phosphorylation de l’histone H3 en position S10, tout en gardant la tri-méthylation en K9 [8].
Plusieurs kinases peuvent phosphoryler la sérine S10 dans le contexte de H3K9me3 dont MSK (mitogen and stress-activated kinase) [13], Aurora B kinase [14] et JNK [15]. MSK et Aurore B kinase ne semblent pas intervenir dans la réactivation virale [8]. Pour savoir si JNK pouvait directement phosphoryler l’histone H3 pendant la phase I, des études d’immunoprécipitation de la chromatine (ChIP) utilisant des anticorps anti-JNK ont été réalisées afin d’examiner si JNK était présent au niveau des promoteurs de deux gènes viraux au moment de cette phase. Les résultats obtenus mettent en évidence la présence de JNK dans ces promoteurs pendant la phase I, ce qui suggère que JNK est probablement le responsable direct de la phosphorylation de S10 dans H3K9me3, conduisant à l’induction de l’expression des gènes viraux lors de la phase I (Figure 1).
Le stress neuronal est un puissant inducteur de la réactivation d’HSV-1. Cependant les voies de signalisation induites par ce stress demeurent mal comprises. L’étude de Cliffe et ses collègues montre que la voie de signalisation impliquant JNK joue un rôle fondamental au cours de la première phase de la réactivation. JNK pourrait être le responsable direct du methyl/phospho switch qui phosphoryle la sérine S10 des histones H3K9me3 et ainsi induire la réactivation. Des travaux antérieurs avaient montré que, parmi les génomes viraux initiant la réactivation, seule une sous-population de virus progressait jusqu’à une réactivation complète, suggérant ainsi que la phase I peut être réversible [7]. Le fait de conserver une configuration méthylée qui est répressive au niveau des lysines K9 et K27 de l’histone H3, pourrait s’avérer important afin de revenir à une configuration de latence si le niveau de stress requis pour une réactivation complète du virus n’est pas atteint. Ce travail confirme que l’initiation de l’expression du virus lors de l’infection lytique et le redémarrage de l’expression virale en sortant de la latence sont deux phénomènes bien différents, au moins lors de la phase I. Ce résultat n’est pas surprenant étant donné que l’expression des gènes viraux en sortant de la latence doit se réaliser à partir d’un génome complètement réprimé et en l’absence d’activateurs viraux de la transcription qui, comme VP16, recrutent des protéines cellulaires participant au remodelage de la chromatine.