| |
| Med Sci (Paris). 32: 6–9. doi: 10.1051/medsci/201632s202.Sur la technique des biopsies musculaires (III) L’apport de la microscopie électronique, hier, et à l’heure de la génétique moléculaire : un survol historique Michel Fardeau,1* Andrée Rouche,2 Stéphane Vassilopoulos,3 Norma B. Romero,4 and l’équipe de microscopie électronique de l’Unité Morphologie Neuromusculaire de la Division Risler (G. Brochier, M.T. Bui,
C. Labasse, A. Madelaine)5 1Professeur honoraire au CNAM, Fondateur de la Société Française de Myologie, Paris, France 2Plate-forme Imagerie Cellulaire, GH Pitié-Salpêtrière, U975 Inserm, ICM, Paris, France 3Centre de Recherche/Institut de Myologie, UMRS 974 UPMC-Inserm, FRE 3617 CNRS, Paris, France 4Unité de morphologie Neuromusculaire, Institut de Myologie, UPMC Paris 6, UM74, Inserm UMRS 974, GH Pitié-Salpêtrière, Paris, France 5Institut de Myologie, GH Pitié-Salpêtrière, Paris, France MeSH keywords: Biopsie, Histoire du 20ème siècle, Histoire du 21ème siècle, Humains, Microscopie électronique, Biologie moléculaire, Muscles, Maladies musculaires, histoire, méthodes, anatomopathologie, ultrastructure, génétique |
Même si la technique de la microscopie électronique a été inventée à la veille de la Deuxième Guerre mondiale, son application à la biologie n’est advenue qu’à partir des années 1950. Ses applications à la biologie du tissu musculaire squelettique ont été décisives sur trois points fondamentaux :
-
l’élucidation de la structure filamentaire des sarcomères, avec la proposition d’une théorie du glissement filamentaire pour rendre compte du mécanisme de la contraction musculaire, avec Hugh Huxley (1953) ;
-
la mise en évidence d’un double système de canaux intracellulaires, réticulum sarcoplasmique et système tubulaire transverse, avec Keith R. Porter et George E. Palade (1954) avec une proposition pour le mécanisme du couplage excitation-contraction ;
-
la démonstration de la réalité de l’existence d’un appareil sous-neural à la jonction neuromusculaire par plissement régulier de la membrane post-synaptique, avec Robertson (1953) et Reger (1954).
Ces avancées ont été déterminantes pour une application aux désordres musculaires pathologiques dès que les conditions techniques d’application de la microscopie électronique (ME) aux biopsies musculaires ont été réunies. Ceci a débuté dès 1960 dans quelques laboratoires, celui d’Étienne de Harven à Bruxelles et de Michel Fardeau à Paris. À partir de 1963-1964, la microscopie électronique a été systématiquement associée aux nouvelles techniques de cytochimie et de cytoenzymologie pour élucider morphologiquement les anomalies structurelles des muscles pathologiques humains. |
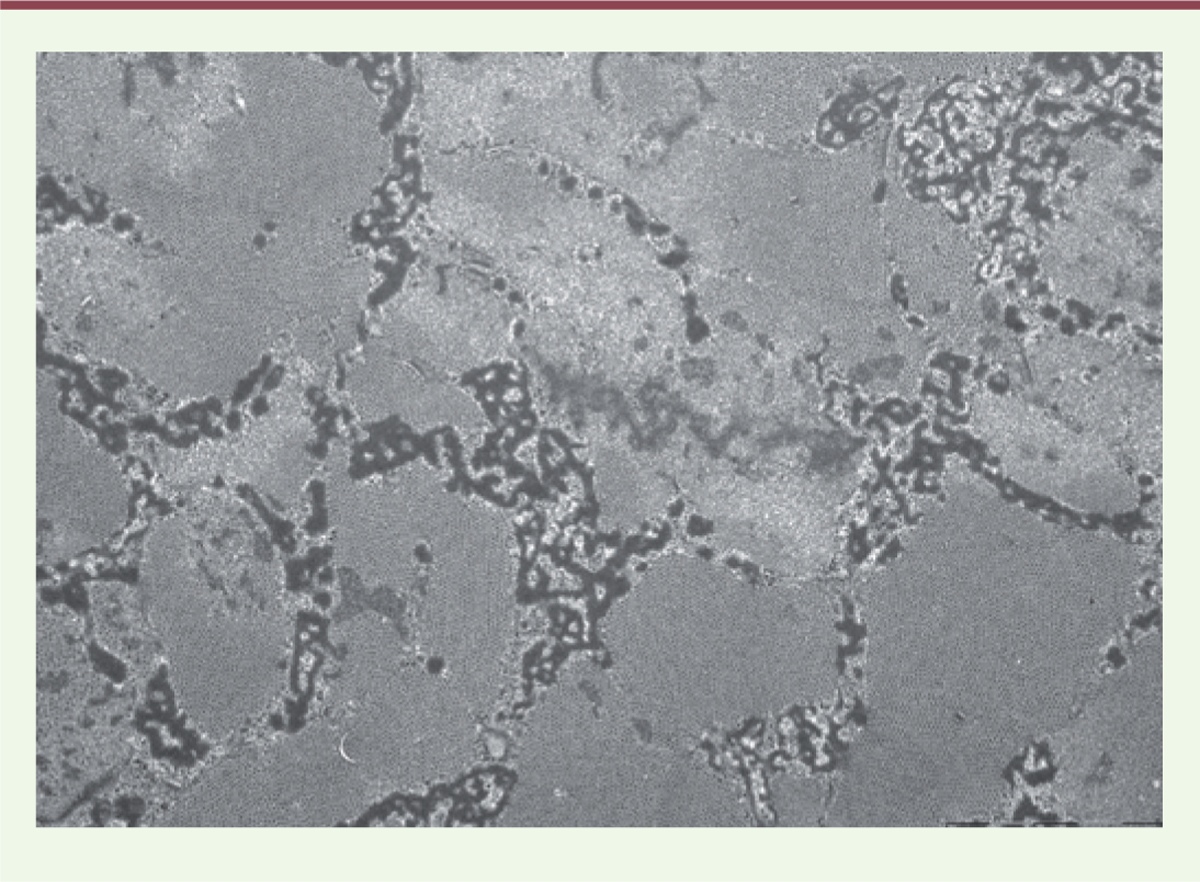
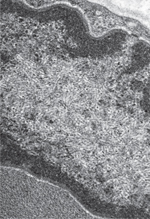
Hier : l’élucidation au niveau ultrastructural des altérations musculaires pathologiques De nombreux types d’altérations avaient été décrits dès l’analyse de fragments fixés par le formaldéhyde et colorées par les techniques histologiques classiques, hématéine éosine et colorations trichromiques : atrophie avec ou sans altération de la striation des fibres musculaires, différents types de nécrose, aspects régénératifs, et anomalies plus complexes comme les fibres annulaires. Leur caractère artéfactuel était souvent mis en cause. L’application à des coupes au cryostat de toute une batterie de nouvelles techniques cytochimiques et cytoenzymologiques allait très rapidement mettre en évidence de nouvelles altérations intracellulaires (Victor Dubowitz et A.G.E. Pearse, 1960 ; W. King Engel, 1962), en particulier dans ces champs pathologiques émergeants qu’étaient les myopathies congénitales « non progressives » et les myopathies métaboliques. Ce furent successivement les « cores » déjà identifiés par G. Milton Shy sur matériel formolé, puis remarquablement mis en évidence sur les coupes au cryostat après mise en évidence d’activités oxydatives : leur analyse ultrastructurale, sur la seconde observation publiée de « Central Core Disease », fut faite à Londres par Hugh Huxley lui-même. Ce furent ensuite les accumulations de « bâtonnets » vivement colorés en rouge sur le trichrome de Gomori, qui définissaient une nouvelle myopathie congénitale, la « nemaline myopathy ». L’analyse ultrastructurale de ces bâtonnets, qui mit en évidence leur parenté avec la structure normale des stries Z, fut faite parallèlement par Andrew Engel et Michel Fardeau. Presque simultanément étaient découvertes les anomalies de structure des mitochondries, accumulées en particulier dans les « ragged-red fibers » décrites par W. King Engel dans des syndromes endocriniens complexes. La microscopie électronique permit de différencier ces agrégats d’autres agrégats également colorés en rouge au trichrome de Gomori, mais formés de tubules développés à partir du réticulum sarcoplasmique, les agrégats tubulaires (Figure 1).
 | Figure 1.
Agrégats tubulaires.
|
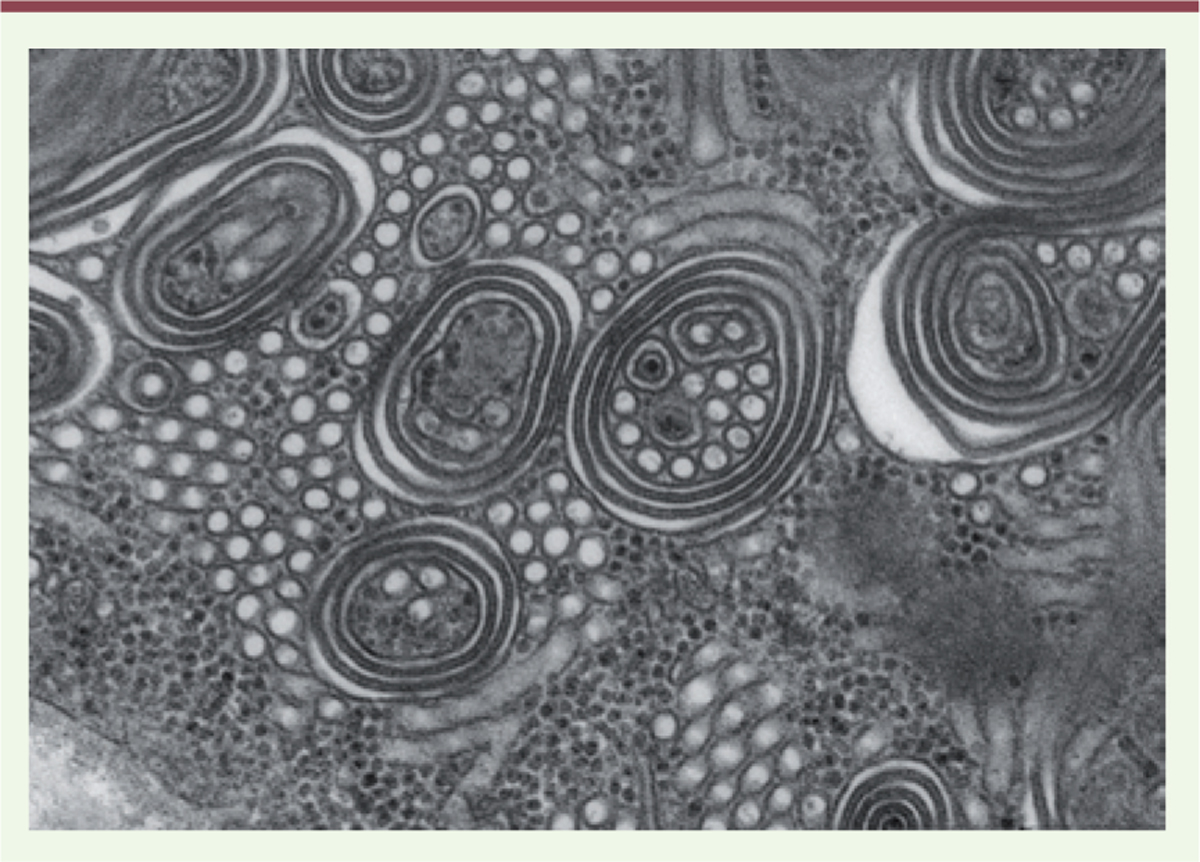
Dans le champ nouvellement ouvert des myopathies congénitales « non évolutives », vinrent très vite la description d’une grande diversité d’inclusions variées, qui donnèrent lieu à leur tour à la proposition d’identification de nouvelles « entités » : « reducing body myopathies » dont les inclusions, visibles en microscopie optique avaient une activité réductrice aisément mise en évidence, puis « cytoplasmic body myopathies » « fingerprint body myopathies », etc., dont le révélation était due à la seule microscopie électronique. Ce fut ensuite la caractérisation d’accumulations intracytoplasmiques denses aux électrons évocatrices de dépôts de desmine (1978) (Figure 2), mais dont la caractérisation biochimique devait prendre bien du temps car nécessitant plusieurs innovations techniques, avant de connaître leur origine exacte grâce à la génétique moléculaire : mutation dans le gène de l’alpha B cristalline.
 | Figure 2.
Dépôts granulofilamentaires denses intermyofibrillaires de desmine.
|
Dans toute cette période, aujourd’hui « classique » de l’histopathologie musculaire, les données de la microscopie optique sur coupes au cryostat et celles de la microscopie sur coupes ultrafines ont été indissociables. Leur combinaison a fondé l’analyse diagnostique actuelle sur biopsie musculaire et forme encore le cœur, ou l’essentiel, des traités de myologie. |
Aujourd’hui, à l’heure de la génétique moléculaire La participation de la microscopie électronique (ME) au diagnostic des affections musculaires a beaucoup décru : la technique est lourde, onéreuse, et surtout sa pratique nécessite une formation spécifique, longue et rigoureuse. En appui des techniques cytoenzymologiques, elle garde cependant un rôle précieux d’orientation. Surtout, l’apport de la ME reste essentiel dans plusieurs domaines :
-
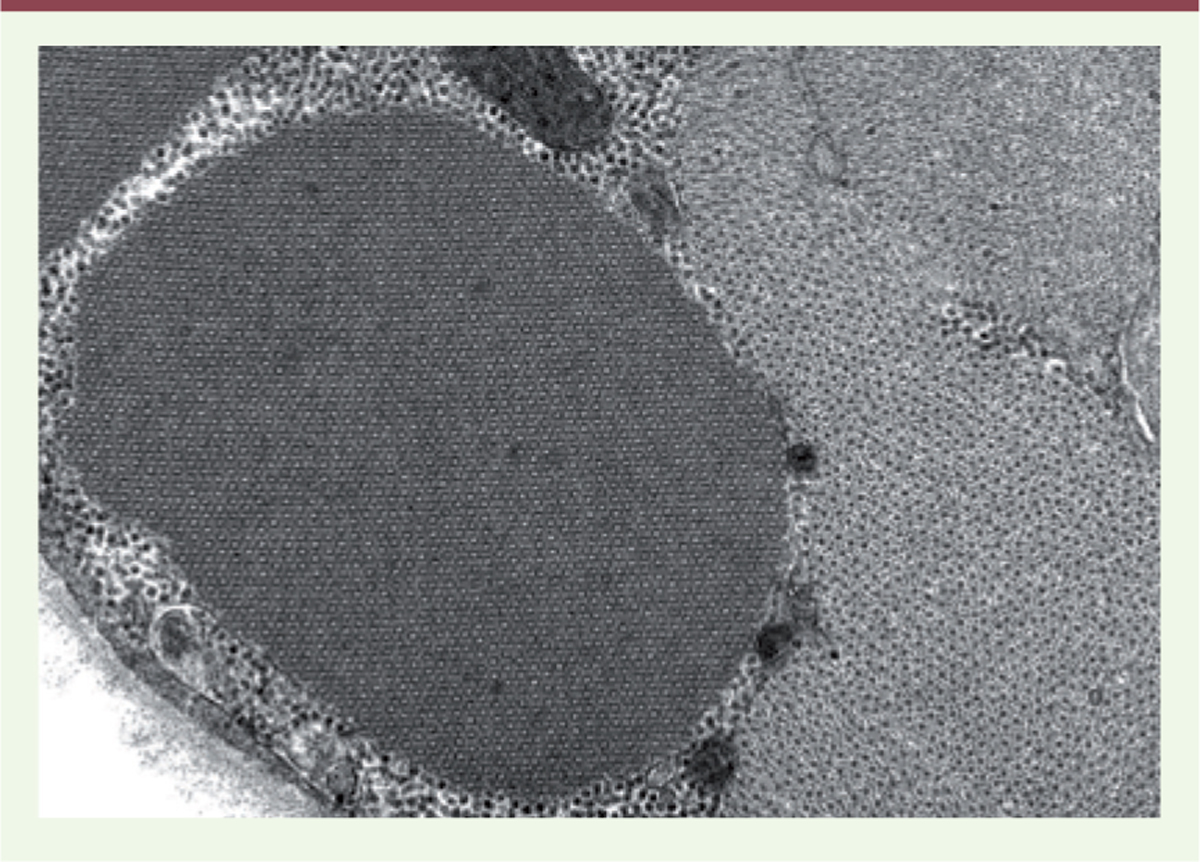
la caractérisation d’inclusions « inhabituelles » dont la définition génétique n’est toujours pas apportée. Deux exemples sont rapportés ici, celui des « cylindrical spirals » (Figure 3) et des inclusions « hexagonal crystalloïdes » (Figure 4) ;
 | Figure 3.
« Cylindrical spirals ».
|
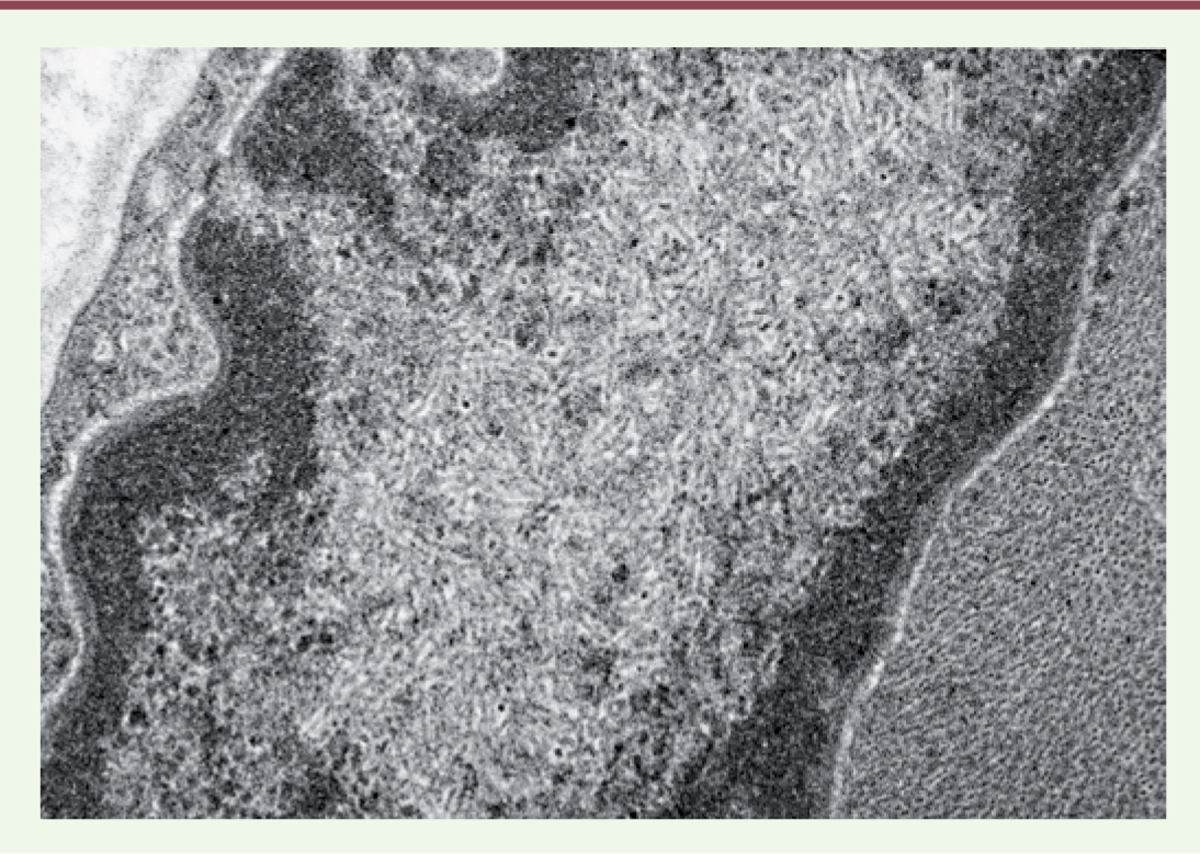
 | Figure 4.
Inclusion « hexagonal crystalloïde ».
|
-
l’analyse des agrégats protéiques denses caractéristiques du groupe aujourd’hui habituellement dénommé « myofibrillar myopathies », ainsi que des inclusions filamentaires intranucléaires (Figure 5) ;
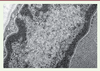 | Figure 5.
Inclusion tubulofilamentaire intranucléaire caractéristique de DMOP.
|
-
l’analyse des altérations membranaires, membrane plasmique et enveloppe nucléaire : par exemple pour déceler les anomalies présentes dans le syndrome de Marinesco-Sjögren ;
-
l’analyse des particules de glycogène dans différentes glycogénoses : le caractère corpusculaire (habituel) ou non ramifié (linéaire) des particules de glycogène, après coloration par la technique de Thiery peut avoir un rôle d’orientation important dans le diagnostic de l’anomalie génétique responsable ;
-
dans de rares cas, l’analyse ultrastructurale joue encore un rôle dans les atteintes mitochondriales (en particulier dans les « megaconial myopathies ») ;
-
elle est la meilleure façon à ce jour de visualiser les défauts d’autophagie et de transport endosomes-lysosomes présents dans de nombreuses myopathies ;
-
enfin, la ME garde un rôle majeur dans l’analyse des désordres congénitaux de la jonction neuromusculaire (→).
(→) Voir Cah Myol 2016 ; 8 : 7–10
Au-delà de tous ces points, la ME reste essentielle pour la validation des modèles expérimentaux, cellulaires ou animaux, des différentes atteintes génétiques, ou acquises, neuromusculaires. |
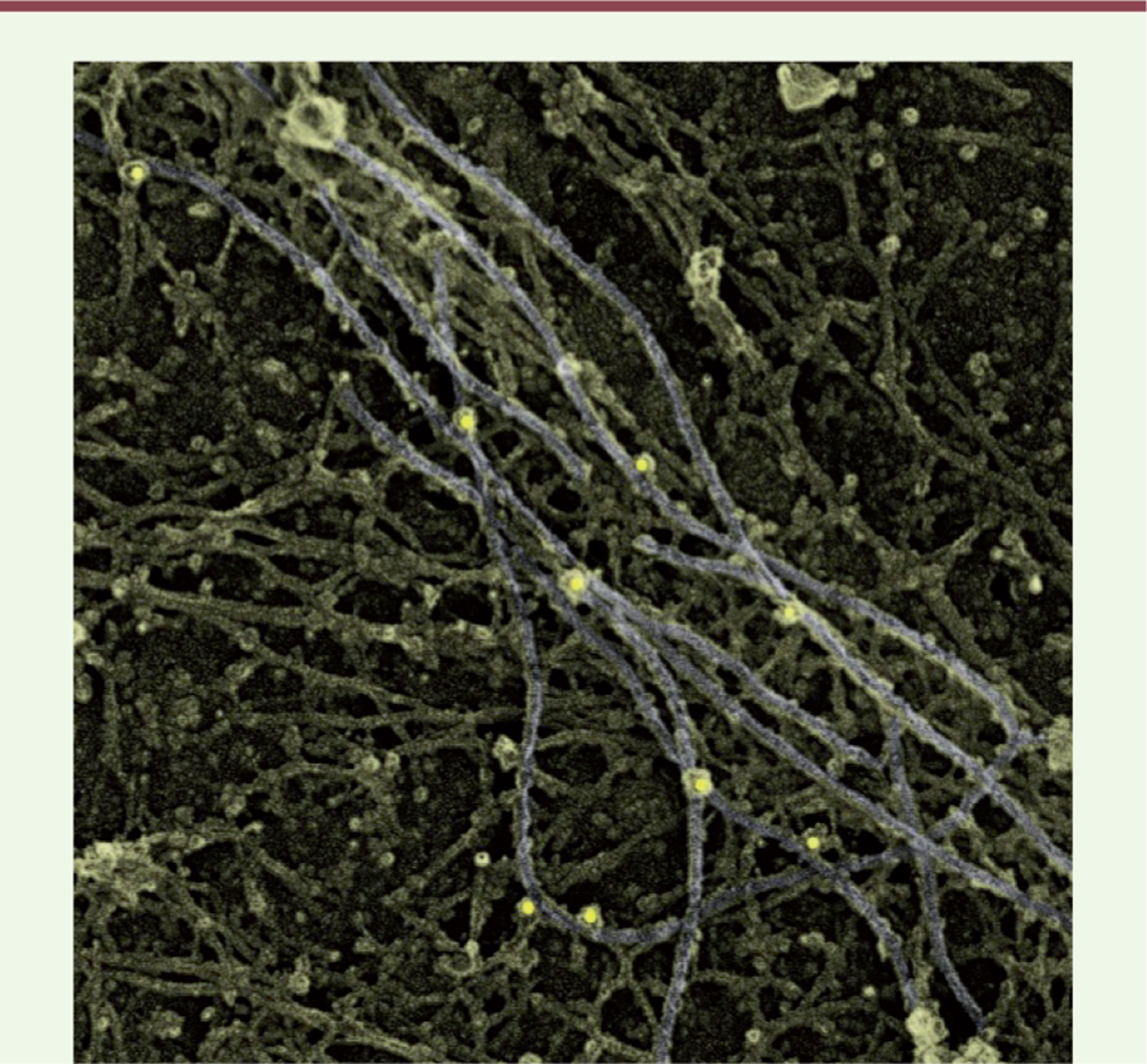
Il est hautement probable que les mêmes indications d’aide au diagnostic persisteront, en particulier dans les biopsies d’interprétation délicate en microscopie optique comme les biopsies effectuées dans la période néonatale. La place des techniques utilisées jusqu’ici essentiellement en biologie fondamentale sera sans aucun doute amenée à se renforcer. On pense en particulier aux techniques d’analyse ultrastructurale des membranes (« freeze etching ») et en immunothérapie avec couplage à des ions métalliques (Figure 6).
 | Figure 6.
Détection des filaments intermédiaires de desmine par immunomarquage.
|
Le freeze etching qui signifie la sublimation de l’eau à froid et la cryo-fracture est une technique qui préserve l’ultrastructure au plus proche des conditions natives et qui permet d’observer les tissus biologiques avec une résolution et un contraste inégalables. Les deux étapes clés, la cryo-fixation et la métallisation ainsi que les microscopes eux-mêmes se sont considérablement modernisés pour l’observation d’objets au niveau moléculaire. Ces approches peuvent en théorie être combinées à la microscopie photonique dite de « super-résolution » pour corréler la localisation de protéines fluorescentes avec l’ultrastructure sur une même image. La prochaine étape étant évidemment l’analyse des biopsies ou des cellules de patients en culture au niveau moléculaire. Il sera ainsi possible de cartographier les protéines et les réseaux de protéines à l’échelle nanométrique et in situ dans des cellules musculaires de patients afin de mieux comprendre les mécanismes sous-jacents de chaque pathologie. |
La vraie question concernant l’analyse des désordres musculaires pathologiques comme de leurs modèles cellulaires ou animaux en microscopie électronique reste la suivante : pourra-t-on jamais se passer d’une analyse structurale de ces désordres capables de descendre au niveau moléculaire ou atomique ? La réponse est sans doute contenue dans la question. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article. |
Les références citées dans ce « survol historique » sont pour l’essentiel d’entre elles « classiques » et n’ont pas à être reprises ici. Quelques-unes sont récentes.
1.
Goebel HH, Stjenzel W. Ultrastructural myopathology in the molecular era . Ultrastruct Pathol. 2013; ; 37 : :328.–331. 2.
Goebel HH, Stenzel W. Practical application of electron microscopy to neuromuscular diseases . Ultrastruct Pathol. 2013; ; 37 : :15.–18. 3.
Romero NB, Sandaradura SA, Clarke NF. Recent advances in nemaline myopathy . Curr Opin Neurol. 2013; ; 26 : :519.–526. 4.
Claeys K. G, Fardeau M, Schröder R, Electron microscopy in myofibrillar myopathies reveals clues to the mutated gene . Neuromuscular Disord. 2008; ; 18 : :656.–666. 5.
Malfatti E, Olive M, Taratuto AL, et al. Skeletal muscle biopsy analysis in reducing body myopathy and other FHL1 related disorders . J Neuropath Exp Neurol. 2013; ; 72 : :833.–845. 6.
Hantaï D, Nicole S, Eymard B. Congenital myasthenic syndromes : an update . Curr Opin Neurol. 2013; ; 26 : :561.–558. |