| |
| Med Sci (Paris). 33(1): 18–24. doi: 10.1051/medsci/20173301004.Agents de contraste pour l’imagerie médicale Les exemples de l’IRM et de l’ultrasonographie Nicolas Tsapis1* 1Institut Galien Paris-Sud, CNRS, Université Paris-Sud, Université Paris-Saclay, Faculté de Pharmacie, 5, rue Jean-Baptiste Clément, 92296Châtenay-Malabry, France |
Aujourd’hui, l’apport de l’imagerie médicale à l’établissement du diagnostic est incontestable et incontournable. Outre la délimitation des différents organes ou la discrimination des différents tissus, l’imagerie médicale permet également un suivi très précis de l’évolution d’une maladie en offrant la possibilité d’un examen comparatif quantitatif. Elle est aussi utilisée pour aider ou assister une intervention (imagerie interventionnelle) qu’il s’agisse d’un examen complémentaire requis pour un diagnostic, comme une biopsie, ou d’une intervention nécessaire pour un traitement. L’imagerie médicale repose sur la différence de comportement que présentent différents tissus qui sont exposés à un stimulus physique : les rayons X, les ondes ultrasonores, le champ magnétique ou la lumière. Souvent le stimulus seul permet de recueillir suffisamment de signal pour obtenir une image de bonne qualité. Parfois, en plus de l’application du stimulus, il peut être nécessaire d’administrer un agent dit « de contraste » afin d’augmenter la quantité de signal recueilli et ainsi, la qualité de l’image. Ces agents de contraste doivent donc répondre à deux critères principaux : (1) interagir avec le stimulus physique de sorte que le signal recueilli soit le plus intense possible. Cette propriété dépend bien entendu de la technique d’imagerie choisie pour réaliser l’examen ; (2) présenter une toxicité nulle ou du moins faible vis-à-vis du service médical rendu. Afin de satisfaire conjointement ces deux critères, différents types de matériaux biodégradables/biocompatibles ont été développés afin de formuler différents agents de contraste selon la technique d’imagerie utilisée. Dans cette revue, nous nous intéresserons à la formulation des agents de contraste pour deux techniques d’imagerie très usitées dans la pratique clinique : l’imagerie par résonance magnétique (IRM) et l’ultrasonographie (aussi nommée échographie). |
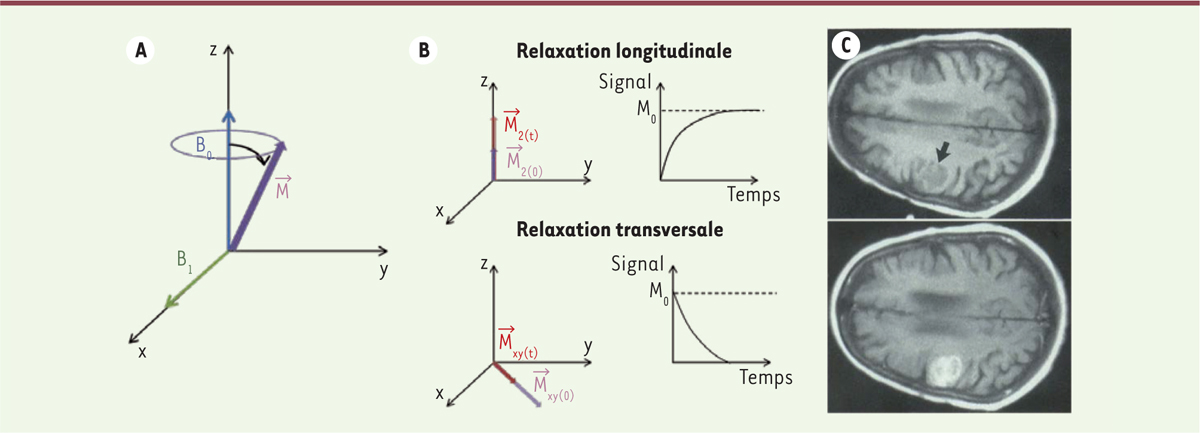
Agents de contraste pour l’imagerie par résonance magnétique Le principe de l’imagerie par résonance magnétique (IRM) repose sur un phénomène quantique observé pour certains noyaux atomiques à spin nucléaire non nuls, comme le proton 1H de l’eau, caractérisés par un moment magnétique (voir Encadré). En l’absence de champ magnétique externe, l’orientation des moments magnétiques au sein d’un échantillon est aléatoire et isotrope1. Il en résulte une aimantation nulle à l’échelle macroscopique. Après application d’un champ magnétique (d’amplitude B0), les moments magnétiques s’orientent dans les directions parallèle ou antiparallèle au champ, ce qui correspond aux états énergétiques excité et fondamental. La répartition des moments magnétiques sur les deux niveaux d’énergie n’étant pas symétrique, il en résulte une aimantation totale non nulle. Un champ magnétique variable (B1), perpendiculaire à B0, est ensuite appliqué de façon transitoire au système sous la forme d’une impulsion électromagnétique radio fréquence. L’aimantation est alors écartée de sa position d’équilibre pour entrer dans un mouvement de précession autour de B0. À la fin de l’impulsion radio fréquence, le retour de l’aimantation à sa position d’équilibre, appelé relaxation, se réalise selon deux temps caractéristiques, T1 (relaxation longitudinale) et T2 (relaxation transversale) (Figure 1).
 | Figure 1.
A.Bascule de l’aimantation après application d’un champ magnétique B 1. B. Relaxation de l’aimantation selon z : longitudinale, et dans le plan xy : transversale. C.Image pondérée en T1 du cerveau avant (haut) et après administration d’un agent de contraste (Gadoteridol 0,3 mmol Gd/kg). Le contraste augmente dans la tumeur (indiquée par une flèche) après injection (d’après [ 1]). |
|
Principe de l’imagerie par résonance magnétique (IRM) L’IRM, comme la RMN (résonance magnétique nucléaire), ont pour base le même effet physique : la possibilité pour certains noyaux atomiques d’interagir avec un champ magnétique. Pour que cette interaction soit observée, le noyau doit avoir un spin nucléaire non-nul. Le spin nucléaire est une caractéristique quantique intrinsèque du noyau comme sa masse et sa charge, il peut prendre des valeurs entières ou demi-entières : 0, 1/2, 1 et 3/2 pour les noyaux les plus courants. En présence d’un champ magnétique B0, le spin nucléaire donne naissance à un moment magnétique de spin μ dont l’amplitude est proportionnelle à la valeur du spin. Cet effet n’est donc observable que si le spin est non nul. Le moment μ est animé d’un mouvement de précession autour de l’axe de B0, tel une toupie autour de la verticale, avec une pulsation propre ω0 proportionnelle à l’intensité B0. Le principe de la mesure de résonance magnétique nucléaire est de mettre le moment μ en mouvement de précession autour d’un champ B0 puis de perturber ce mouvement à l’aide d’un deuxième champ magnétique B1 appliqué pendant un court instant. Cela dévie la trajectoire de μ, mais une fois B1 disparu, il retrouve son mouvement initial en présence de B0 seul. Ce retour à l’équilibre s’accompagne d’une émission d’ondes électromagnétiques que l’on peut détecter : c’est le signal mesuré en RMN et IRM.
|
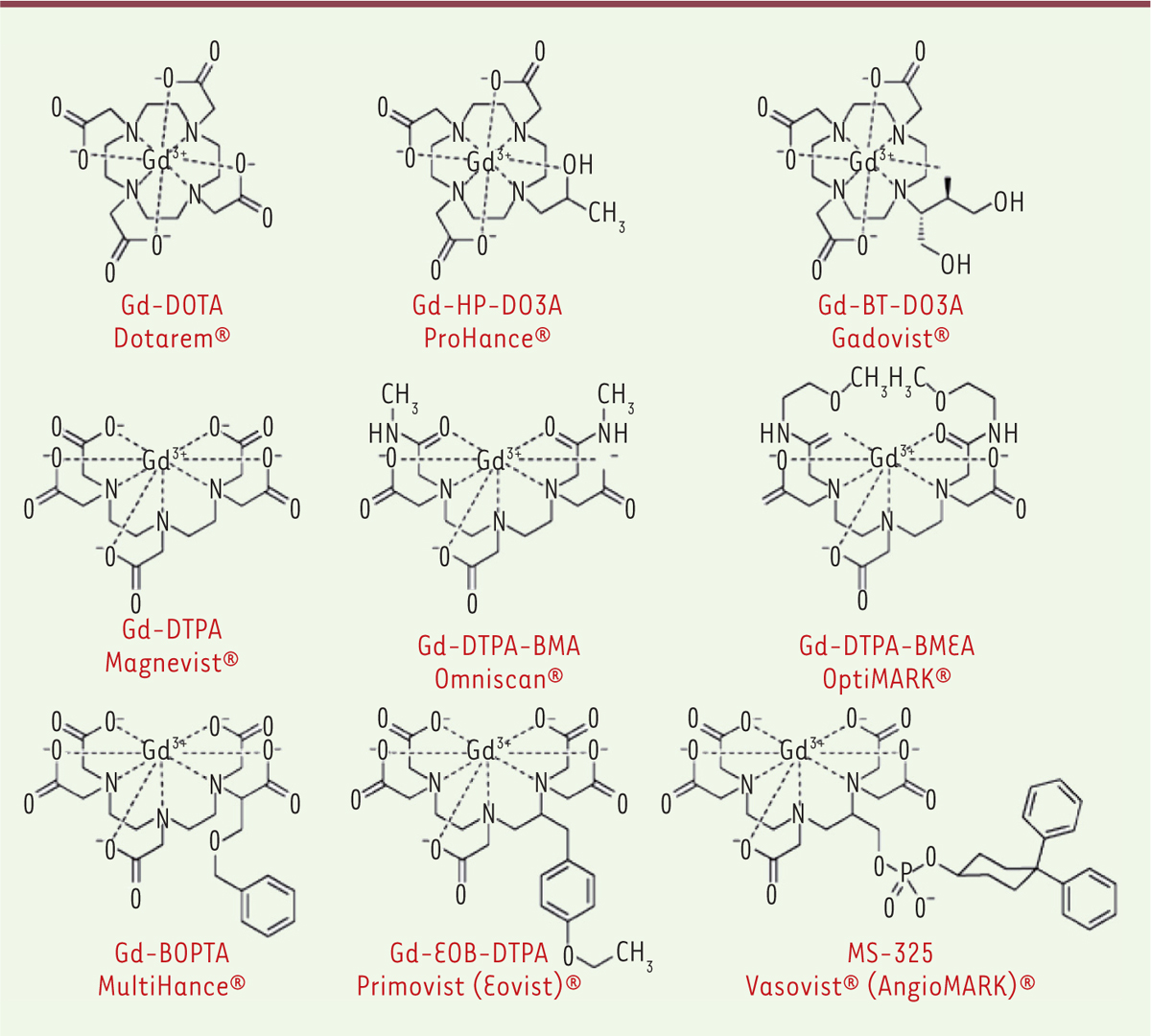
Les temps de relaxation varient en fonction des interactions entre le proton et les molécules qui l’environnent. L’IRM est fondée sur le codage en niveaux de gris du temps de relaxation des protons de l’eau. On peut obtenir des images complémentaires codées/pondérées en T1 et T2. Le codage des images en T1 implique que plus le temps de relaxation est court, plus l’image est claire. Le codage T2 implique que plus le temps de relaxation est court, plus l’image est sombre [1]. Il existe donc deux grandes familles d’agents de contraste : les agents de contraste positifs ou agents T1, et les agents de contraste négatifs ou T2. Les agents de contraste positifs Ils ont pour effet de raccourcir le temps de relaxation T1 du proton (quantifié par leur relaxivité). Plus leur concentration et leur relaxivité sont importantes, plus les zones où se retrouvent ces agents apparaissent claires en imagerie T1. Du fait de ses propriétés paramagnétiques, l’ion gadolinium (Gd 3+) a été retenu depuis les années 1980 pour la conception d’agents de contraste T1 [ 2]. Il ne peut cependant pas être utilisé sous sa forme ionique libre (Gd 3+) du fait d’une forte toxicité due à sa compétition avec l’ion calcium (Ca 2+) qui est essentiel dans de nombreux processus biologiques. La toxicité du Gd 3+ peut cependant être considérablement diminuée en le piégeant dans des molécules ligands : les polyaminocarboxylates linéaires et macrocycliques. On obtient ainsi des chélates (pièges) de gadolinium dont de nombreux ont été commercialisés ( Tableau I et Figure 2). Ces produits injectables ont reçu l’autorisation de mise sur le marché (AMM) même si des doutes sur leur stabilité dans l’organisme ont été soulevés ces dernières années et que des risques de fibrose néphrogénique systémique ont été recensés chez les patients souffrant d’insuffisance rénale. D’autres métaux sont en cours d’évaluation afin de remplacer le gadolinium [ 3]. Un agent à base de manganèse, le Teslascan®, a obtenu une AMM pour la détection de lésions focales hépatiques [ 4].
Tableau I.
| Nom chimique |
Nom |
Nom commercial |
Fabricant |
Relaxivité (3T, plasma, 37° C) en L/(mmol.s) |
Excrétion |
Risque de fibrose néphrogénique systémique* |
| Gd(DTPA-BMA)(H2O) |
Gadodiamide |
Ominscan® |
GE |
4,0 |
Rénale |
Important |
|
| Gd(DTPA-BMEA)(H2O) |
Gadoversetamide |
OptimarkTM
|
Mallinckrodt |
4,5 |
Rénale |
Important |
|
| Gd(DTPA)(H2O)2-
|
Gadopentetate dimeglumine |
Magnevist® |
Bayer |
3,7 |
Rénale |
Important |
|
| Gd(BOPTA)(H2O)2-
|
Gadobenate dimeglumine |
Multihance® |
Bracco |
5,5 |
Rénale, 4-5 % hépatobiliaire |
Moyen |
|
| Gd(EOB-DTPA)(H2O)2-
|
Gadoxetate disodium |
Primovist®/Eovist® |
Bayer |
6,2 |
50 % Rénale, 50 % hépatobiliaire |
Moyen |
|
| Gd(DTPA-diphénylcyclohexylphosphate) (H2O)3-
|
Gadofosveset trisodium |
Ablavar®/Vasovist® |
Lantheus Medical Imaging |
9,9 |
Rénale, 4-5 % hépatobiliaire |
Moyen |
|
| Gd(DO3A-butrol)(H2O) |
Gadobutrol |
Gadovist®/Gadavist® |
Bayer |
5,0 |
Rénale |
Faible |
|
| Gd(HP-DO3A)(H2O) |
Gadoteridol |
Prohance® |
Bracco |
3,7 |
Rénale |
Faible |
|
| Gd(DOTA)(H2O)-
|
Gadoterate meglumine |
Dotarem® |
Guerbet |
3,5 |
Rénale |
Faible |
Agents de contraste à base de gadolinium sur le marché [ 2]. *La fibrose néphrogénique systémique induite par le gadolinium apparaît surtout chez les patients ayant une fonction rénale diminuée ou atteints d’une pathologie rénale. |
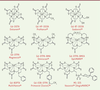 | Figure 2.
Structure chimique des principaux agents de contraste T1 commercialisés (d’après [ 2]). |
Agents de contraste négatifs Il s’agit de nanoparticules d’oxyde de fer sous forme de nanocristaux de magnétite (Fe 3O 4) obtenus par précipitation de chlorure ferreux (FeCl 2) et de chlorure ferrique (FeCl 3) à pH basique, ou de maghémite (γFe 2O 3) provenant de l’oxydation de la magnétite dans l’acide nitrique en présence d’ions nitrates. Après synthèse, les nanoparticules sont dispersées dans une solution tampon à pH physiologique en présence d’un agent stabilisant. Ces agents stabilisants sont adsorbés à la surface des nanoparticules et assurent soit une stabilisation stérique (c’est le cas pour le dextran, l’aminosilane, la gélatine, les phospholipides) soit une stabilisation électrostatique (en présence d’ions citrate). Cette stabilisation est essentielle pour conserver les propriétés super-paramagnétiques des nanoparticules, celles-ci s’agrégeant et n’étant plus libres de s’orienter dans la direction du champ magnétique appliqué en l’absence de cette stabilité. On peut classer les nanoparticules d’oxyde de fer en deux catégories : (1) les SPIO (super-paramagnetic iron oxides) qui possèdent une taille comprise entre 50 nm et 3,5 µm et (2) les USPIO (ultrasmall super-paramanetic iron oxides) qui mesurent entre 3 et 50 nm. Dans la famille des SPIO, deux composés dont la taille moyenne est d’environ 60 nm sont commercialisés : les Ferumoxides (Endorem® [Guerbet], Feridex® [Berlex]), stabilisés par du dextran, et le Ferucarbotran® (Resovist® [Schering]), stabilisé par du carboxydextran. Les applications cliniques de ces produits concernent la détection de tumeurs hépatiques. Dans la famille des USPIO, on trouve des nanoparticules stabilisées par du dextran (Ferumoxtran®/Sinerem®/Combidex®) pour l’imagerie du système lymphatique, par de l’amidon PEGylé2 (Feruglose®) pour l’angiographie coronarienne (imagerie des vaisseaux et artères entourant le cœur) ou par du carboxydextran (SHU555C, Bayer) pour l’angiographie (imagerie des vaisseaux). Ces nanoparticules sont acceptées pour un usage diagnostique ponctuel, la toxicité du fer qu’elles contiennent étant considérée comme négligeable car celui-ci est éliminé via le cycle normal du fer endogène [5]. Néanmoins, la plupart des sociétés ont abandonné la commercialisation des produits cités ci-dessus, vraisemblablement en raison d’une combinaison de risques de toxicité et d’échec commercial. Seul le Feraheme©, un produit prescrit aux États-Unis pour les déficiences en fer, semble être évalué comme un agent de contraste pour des images de lésions vasculaires, de tumeurs et de ganglions lymphatiques [6]. Des protocoles précliniques sont mis en place afin de marquer des cellules avec des nanoparticules d’oxyde de fer et ainsi suivre leur devenir après leur injection in vivo [7]. Afin d’améliorer les agents de contraste IRM positifs ou négatifs, les travaux de recherche portent sur la capacité de ces agents à diminuer les temps de relaxation des protons, soit en les concentrant dans des nano-objets, soit en intervenant sur l’accessibilité des molécules d’eau à proximité du piégeur (chélate) ou de la nanoparticule d’oxyde de fer. Des lipides portant des chélates de gadolinium sur leur tête polaire ont par exemple été synthétisés afin d’être ensuite formulés en liposomes [8]. On peut aussi citer les magnétoliposomes qui encapsulent des cristaux de maghémite [9]. D’autres travaux portent sur la fonctionnalisation des chélates ou des nanoparticules avec des ligands permettant de détecter la présence de certains récepteurs [10] : on parle alors d’imagerie moléculaire. Outre l’IRM du proton, d’autres noyaux peuvent être détectés. Le cas du fluor est intéressant. Ses propriétés de résonance magnétique sont très proches de celles du proton et il est présent à l’état de traces au sein des organismes vivants. Ainsi la détection d’un agent de contraste fluoré ne sera pas associée à un bruit de fond et sa concentration sera ainsi directement proportionnelle à l’intensité totale du signal. Le repérage anatomique des agents fluorés est obtenu en superposant l’image en IRM du proton avec celle réalisée en IRM du fluor. Des agents de contraste fluorés, fondés sur des émulsions ou des capsules de perfluorocarbures, sont en cours de développement pour les études précliniques [11]. Ces agents sont particulièrement intéressants pour le marquage de cellules souches et leur suivi après leur administration. C’est l’application principale des nanoémulsions de perfluorocarbures, commercialisées par la société Celsense3,. Toutefois, l’accumulation de l’agent de contraste fluoré dans les tissus d’intérêt est souvent faible, la méthode requiert une bonne résolution et des temps d’acquisition longs. La construction d’antennes, accordées sur la fréquence de Larmor4 du fluor, doit être adaptée et pouvoir être facilement intégrée aux IRM cliniques. L’IRM du 19F (ou plus simplement IRM du fluor) reste encore marginale mais elle offre des opportunités intéressantes en termes d’imagerie moléculaire et quantitative. |
Agents de contraste pour l’ultrasonographie (ou échographie) L’ultrasonographie, aussi appelée échographie, est actuellement la deuxième méthode d’imagerie médicale la plus utilisée dans le monde après l’imagerie par rayons X. Les signaux ultrasonores émis par un transducteur sont réfléchis et atténués par les tissus, la quantité de signal réfléchi, détectée par le transducteur, est codée et transformée en image. L’examen échographique est flexible, peu coûteux par rapport à l’IRM. Il permet d’obtenir des images en temps réel et peut être effectué chez le patient sans qu’il y ait besoin d’hospitalisation. Néanmoins, la méthode est dépendante de l’opérateur et certaines images d’organes restent difficiles à obtenir, notamment le cerveau (à cause de la réflexion importante des os du crâne), le pancréas et les poumons qui contiennent une trop grande quantité de gaz. Dans le domaine du cancer, afin de visualiser des vaisseaux d’un diamètre inférieur à 200 µm, l’utilisation d’agents de contraste ultrasonores (ACU) s’est révélée fondamentale pour observer la néovascularisation tumorale, au moins qualitativement [12, 13]. L’histoire des produits de contraste a débuté au milieu des années 1960. En 1968, Gramiak et Shah montrent que l’injection de solution saline dans l’aorte ascendante est associée à la production de minuscules bulles d’air (microbulles) qui permettent de délimiter l’aorte par ultrasonographie [14]. Le développement commercial des agents de contraste a commencé dans les années 1980, avec les observations qui ont conduit à la stabilisation et à la miniaturisation des microbulles. Les agents de contraste ultrasonores commerciaux sont en général composés de microbulles de gaz stabilisées par des matériaux biocompatibles (protéines, lipides, polymères). En effet, il est primordial que l’interface entre le gaz et la phase aqueuse soit recouverte d’un composé permettant d’éviter la coalescence des bulles (c’est-à-dire leur fusion) afin d’éviter une embolie après injection. C’est ce rôle de stabilisant que jouent les phospholipides, les protéines ou les polymères que l’on retrouve principalement dans les microbulles ayant obtenu l’AMM (Tableau II) [15].
Tableau II.
| Agent |
Compagnie |
Composition |
État de developpement |
| Enveloppe |
Gaz |
| Echovist®
|
Bayer |
galactose |
Air |
Autorisé pour échocardiogramme et hystérosalpingographie dans quelques pays européens |
|
| Levovist®
|
Bayer |
galactose, acide palmitique |
Air |
Autorisé dans 70 pays européens et asiatiques |
|
| Albunex®
|
Mallinckrodt |
Albumine humaine |
Air |
- |
|
| Optison®
|
Mallinckrodt |
Albumine humaine |
Octafluoropropane C3F8
|
Autorisé pour échocardiogramme en Europe et Amérique du Nord |
|
| Cardiosphere®
|
Point Biomedical Corp. |
PLGA/Albumine |
azote |
Développement clinique |
|
| AI-700 |
Acusphere Inc. |
PLGA |
Decafluorobutane C4F10
|
Développement clinique |
|
| Sonovist®
|
Bayer |
Cyanoacrylate |
Air |
Développement clinique arrêté |
|
| Sonazoid®
|
Amersham Health |
Lipides stabilisés par des surfactants |
Decafluorobutane C4F10
|
Développement clinique au Japon |
|
| Imagent®
|
IMCOR Pharmaceuticals Inc. |
Lipide: DMPC |
Perfluorohexane C6F14, gaz physiologiques |
Approuvé par la FDA en 2001 |
|
| Definity®
|
Bristol-Myers Squibb Medical Imaging Inc. |
Lipides: DPPA, DPPC, MPEG5000 DPPE |
Octafluoropropane C3F8
|
Approuvé par la FDA en 2002 |
|
| Sonovue®
|
Bracco |
Lipides: Macrogol 4000, DSPC, DPPG, acide palmitique |
Hexafluorure de soufre SF6
|
Autorisé en Europe et plusieurs pays asiatiques, mais pas au Japon et aux états-Unis |
|
| BR14 |
Bracco |
Lipides |
Decafluorobutane C4F10
|
Développement clinique |
|
| Echogen®
|
Sonus Pharmaceuticals |
émulsion PFC/eau |
Dodecafluoropentane C5F12
|
Autorisé en Europe, non commercialisé |
Les différents types de produits de contraste échographiques à base de bulles de gaz. PLGA : poly(lactide-co-glycolide) ; DMPC : dimyristoylphosphatidylcholine ; DPPC : dipalmitoylphosphatidylcholine ; DSPC : distéaroylphosphatidylcholine ; PFC : perfluorocarbure ; FDA : Food and drug administration (d’après [15]). |
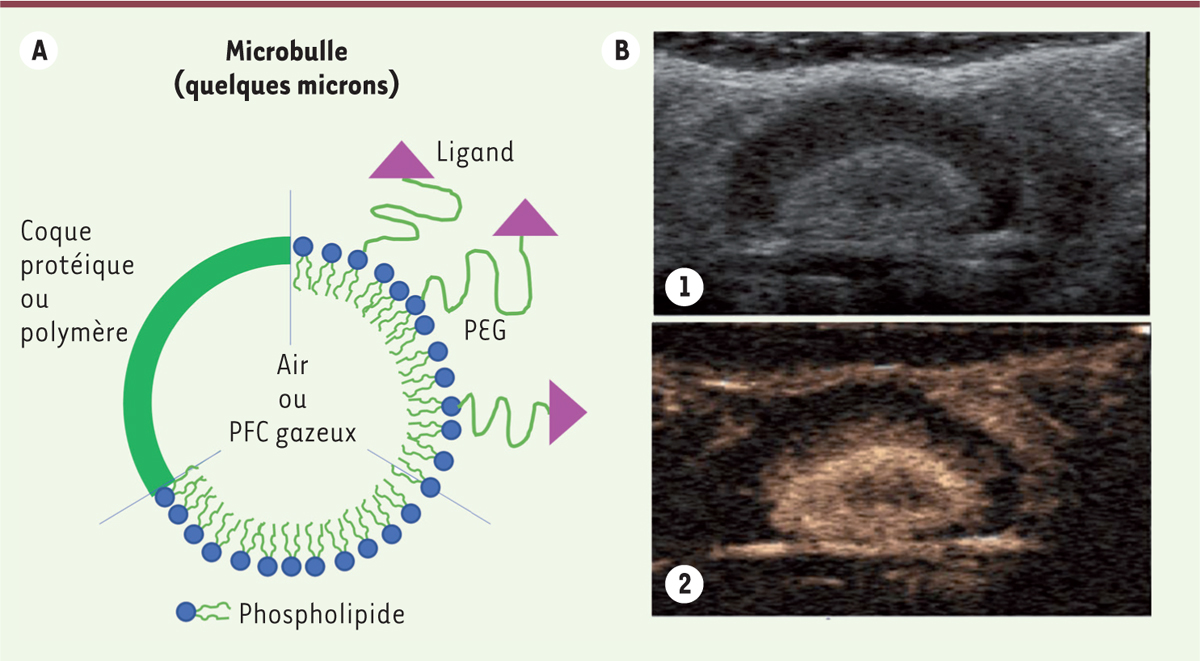
Ces bulles mesurant entre 1 à 10 µm de diamètre sont injectables par voie intraveineuse. Elles peuvent traverser le lit capillaire pulmonaire et circuler dans le versant artériel. Leur demi-vie plasmatique est assez courte, à peine supérieure à 5 minutes [12, 16]. La présence de ces bulles entraîne l’augmentation du signal réfléchi vers le transducteur. L’échogénicité (c’est-à-dire la capacité à réfléchir les ultrasons) d’un agent de contraste est d’autant meilleure que son diamètre est élevé et que ses propriétés physiques diffèrent de celles du tissu environnant. Néanmoins la taille des agents de contraste est limitée par leur mode d’administration. Un diamètre maximum de 6 à 8 µm sera ainsi admis s’ils sont injectés par voie intraveineuse. Afin d’améliorer l’efficacité des premières microbulles, l’air a été remplacé par des perfluorocarbures gazeux (Figure 3). Leur densité, plus importante que celle de l’air, les rend légèrement plus échogènes et leur plus faible solubilité dans le sang permet d’augmenter leur stabilité de quelques minutes après l’injection [12, 16]. Le Tableau II reprend les différents gaz utilisés et matériaux permettant de stabiliser les microbulles. Ces produits sont caractérisés par une faible stabilité après injection, du fait de la solubilité du gaz dans le sang, mais aussi des interactions avec les ultrasons eux-mêmes. Sous l’effet des ondes mécaniques que sont les ultrasons, les microbulles subissent des cycles de compression-expansion entraînant leur oscillation à la fréquence des ultrasons appliqués (fréquence fondamentale), voire au double de cette fréquence (1e harmonique) selon la puissance apportée par ces ultrasons [17, 18]. Ce sont ces oscillations harmoniques qui permettent d’observer les microbulles par ultrasonographie en limitant le signal venant des tissus environnants : on parle d’imagerie harmonique (Figure 3) [19], utilisée en pratique clinique [20]. Si la puissance ultrasonore est plus importante, les microbulles peuvent exploser par effet de cavitation inertielle. Cette propriété est mise à profit pour évaluer la cinétique de perfusion d’organes ou de tumeurs : les microbulles sont injectées, traduites en images à faible puissance ultrasonore, détruites localement dans une région d’intérêt grâce aux ultrasons, puis l’arrivée de nouvelles bulles non détruites est mise en image et quantifiée [21]. Certains travaux actuels portent sur la décoration des microbulles à l’aide de ligands spécifiques de récepteurs afin de réaliser de l’imagerie moléculaire [22]. En général le ligand est greffé sur des phospholipides par l’intermédiaire d’un espaceur constitué de polyéthylène glycol (PEG) pour favoriser l’accessibilité (Figure 3).
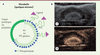 | Figure 3.
A. Représentation schématique d’une microbulle. Les agents de contraste ultrasonores (ACU) nanométriques ont la même structure si ce n’est que leur cœur est un liquide perfluoré. B.Image fondamentale (1) et harmonique (2) d’une tumeur rénale après injection de microbulles [ 19]. PEG : polyéthylène glycol ; PFC : perfluorocarbures. |
Une autre voie de recherche consiste à réduire la taille des agents de contraste ultrasonores (ACU) afin de pouvoir visualiser d’autres éléments que le réseau vasculaire. Une attention est particulièrement apportée à la possibilité d’accumuler des ACU dans des tumeurs solides, ce qui ouvrirait la voie au diagnostic tumoral par ultrasonographie. Pour cela, les ACU doivent être de l’ordre de 100 à 200 nm pour pouvoir bénéficier de l’effet de perméabilité et de rétention accrues dû aux porosités des vaisseaux tumoraux (effet EPR [enhanced permeability and retention effect]5) [23]. Le signal réfléchi par les ACU étant proportionnel à leur rayon à la puissance 6, la réduction de taille d’un micron à 100 nm diminue le signal d’un facteur 106. C’est pourquoi beaucoup de travaux ont porté sur des ACU nanométriques encapsulant un liquide pouvant être vaporisé sous l’effet des ultrasons, générant ainsi un signal important [24]. De tels agents sont obtenus principalement avec des perfluorocarbures tels que le perfluoropentane ou le perfluorohexane qui sont liquides à température ambiante mais dont le point d’ébullition est inférieur à 100˚C. Ces liquides ont été encapsulés au moyen de lipides ou de polymères acceptés pour les applications pharmaceutiques : le chitosan, les polyesters, les phospholipides, etc. La sécurité de la vaporisation locale de tels systèmes doit être vérifiée de manière approfondie dans le futur. |
L’association des avancées récentes en synthèse de matériaux biodégradables/biocompatibles, des techniques de formulation et de la connaissance de la réponse des nouveaux matériaux aux stimulus physiques utilisés pour l’imagerie, ont permis de développer des agents de contraste pour l’imagerie par résonance magnétique ou l’ultrasonographie. Si certains ont reçu les autorisations réglementaires, beaucoup sont encore en cours de développement. D’autres systèmes ont été retirés du marché soit à cause d’effets secondaires, soit pour des raisons commerciales. Une grande tendance à l’heure actuelle est de combiner ces agents de contraste avec un principe actif encapsulé pour des applications théranostiques6 permettant de suivre le principe actif via le signal renvoyé par le vecteur dans lequel il est encapsulé. |
L’auteur déclare n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Nous remercions l’Agence Nationale de la Recherche, la Ligue contre le cancer et la Fondation ARC pour la recherche sur le cancer pour leur soutien financier.
|
Footnotes |
1.
Yuh WTC, Engelken JD, Muhonen MG, et al. Experience with high-dose gadolinium mr imaging in the evaluation of brain metastases . Am J Neuroradiol. 1992; ; 13 : :335.–345. 2.
Hermann P, Kotek J, Kubícek V, Lukes I. Gadolinium(III) complexes as MRI contrast agents: ligand design and properties of the complexes . Dalton Trans. 2008; ; 23 : :3027.–3047. 3.
Bonnet CS, Toth E. Smart contrast agents for magnetic resonance imaging . Chimia (Aarau). 2016; ; 70 : :102.–108. 4.
Burke C, Alexander Grant L, Goh V, Griffin N. The role of hepatocyte-specific contrast agents in hepatobiliary magnetic resonance imaging . Semin Ultrasound CT MRI. 2013; ; 34 : :44.–53. 5.
Boldt DH. New perspectives on iron: an introduction . Am J Med Sci. 1999; ; 318 : :207.–212. 6.
Bashir MR, Bhatti L, Marin D, Nelson RC. Emerging applications for ferumoxytol as a contrast agent in MRI . J Magn Reson Imaging. 2015; ; 41 : :884.–898. 7.
Kolosnjaj-Tabi J, Wilhelm C, Clement O, Gazeau F. Cell labeling with magnetic nanoparticles: opportunity for magnetic cell imaging and cell manipulation . J Nanobiotechnology. 2013; ; 11 ((suppl 1)) : :S7.. 8.
Kamaly N, Kalber T, Ahmad A, et al. Bimodal paramagnetic and fluorescent liposomes for cellular and tumor magnetic resonance imaging . Bioconjugate Chem. 2008; ; 19 : :118.–129. 9.
Martina MS, Fortin JP, Menager C, et al. Generation of superparamagnetic liposomes revealed as highly efficient MRI contrast agents for in vivo imaging . J Am Chem Soc. 2005; ; 127 : :10676.–10685. 10.
Pais A, Gunanathan C, Margalit R, et al. In vivo magnetic resonance imaging of the estrogen receptor in an orthotopic model of human breast cancer . Cancer Res. 2011; ; 71 : :7387.–7397. 11.
Cosco D, Fattal E, Fresta M, Tsapis N. Perfluorocarbon-loaded micro and nanosystems for medical imaging: a state of the art . J Fluorine Chem. 2015; ; 171 : :18.–26. 12.
Schutt EG, Klein DH, Mattrey RM, Riess JG. Injectable microbubbles as contrast agents for diagnostic ultrasound imaging: the key role of perfluorochemicals . Angew Chem Int Ed Engl. 2003; ; 42 : :3218.–3235. 13.
Tranquart F, Correas JM, Bouakaz A (eds). Échographie de contraste . Paris: : Springer-Verlag; , 2007 : :318. p. 14.
Gramiak R, Shah PM. Echocardiography of the aortic root . Invest Radiol. 1968; ; 3 : :356.–366. 15.
Pisani E. Conception et caractérisation de capsules polymériques comme produits de contraste pour l’imagerie médicale. Thèse de doctorat en Pharmacie: : Faculté de Pharmacie, Châtenay-Malabry, Université Paris-Sud; , 2006. 16.
Lindner JR. Microbubbles in medical imaging: current applications and future directions . Nat Rev Drug Discov. 2004; ; 3 : :527.–533. 17.
Brennen CE. Cavitation and bubble dynamics. New York: : Oxford University Press; , 1995, :282. p. 18.
Ahmadi F, McLoughlin IV, Chauhan S, Ter-Haar G. Bio-effects and safety of low-intensity, low-frequency ultrasonic exposure . Prog Biophys Mol Biol. 2012; ; 108 : :119.–138. 19.
Guibal A, Taillade L, Mule S, et al. Noninvasive contrast-enhanced US quantitative assessment of tumor microcirculation in a murine model: effect of discontinuing anti-VEGF therapy . Radiology. 2010; ; 254 : :420.–429. 20.
Lang RM, Mor-Avi V. Clinical utility of contrast-enhanced echocardiography . Clin Cardiol. 2006; ; 29 : :I15.–I25. 21.
Quaia E. Assessment of tissue perfusion by contrast-enhanced ultrasound . Eur Radiol. 2011; ; 21 : :604.–615. 22.
Klibanov AL. Ultrasound contrast materials in cardiovascular medicine: from perfusion assessment to molecular imaging . J Cardiovasc Transl Res. 2013; ; 6 : :729.–739. 23.
Maeda H. Toward a full understanding of the EPR effect in primary and metastatic tumors as well as issues related to its heterogeneity . Adv Drug Deliv Rev. 2015; ; 91 : :3.–6. 24.
Matsunaga TO, Sheeran PS, Luois S, et al. Phase-change nanoparticles using highly volatile perfluorocarbons: toward a platform for extravascular ultrasound imaging . Theranostics. 2012; ; 2 : :1185.–1198. |