| |
| Med Sci (Paris). 33(1): 92–95. doi: 10.1051/medsci/20173301017.Analyse des événements virologiques intrahépatiques d’une infection chronique par le virus de l’hépatite B Maëlle Locatelli1,2,3 and Barbara Testoni1,2,3* 1Inserm U1052, 151, cours Albert Thomas, 69003Lyon, France 2Centre de recherche en cancérologie de Lyon (CRCL), 151, cours Albert Thomas, 69003Lyon, France 3Université de Lyon, UMR-S1052, UCBL, 151, cours Albert Thomas, 69003Lyon, France MeSH keywords: Antigènes viraux, ADN viral, Évolution de la maladie, Virus de l'hépatite B, Hépatite B chronique, Humains, Foie, Virologie, analyse, physiologie, diagnostic, anatomopathologie, virologie, métabolisme, méthodes |
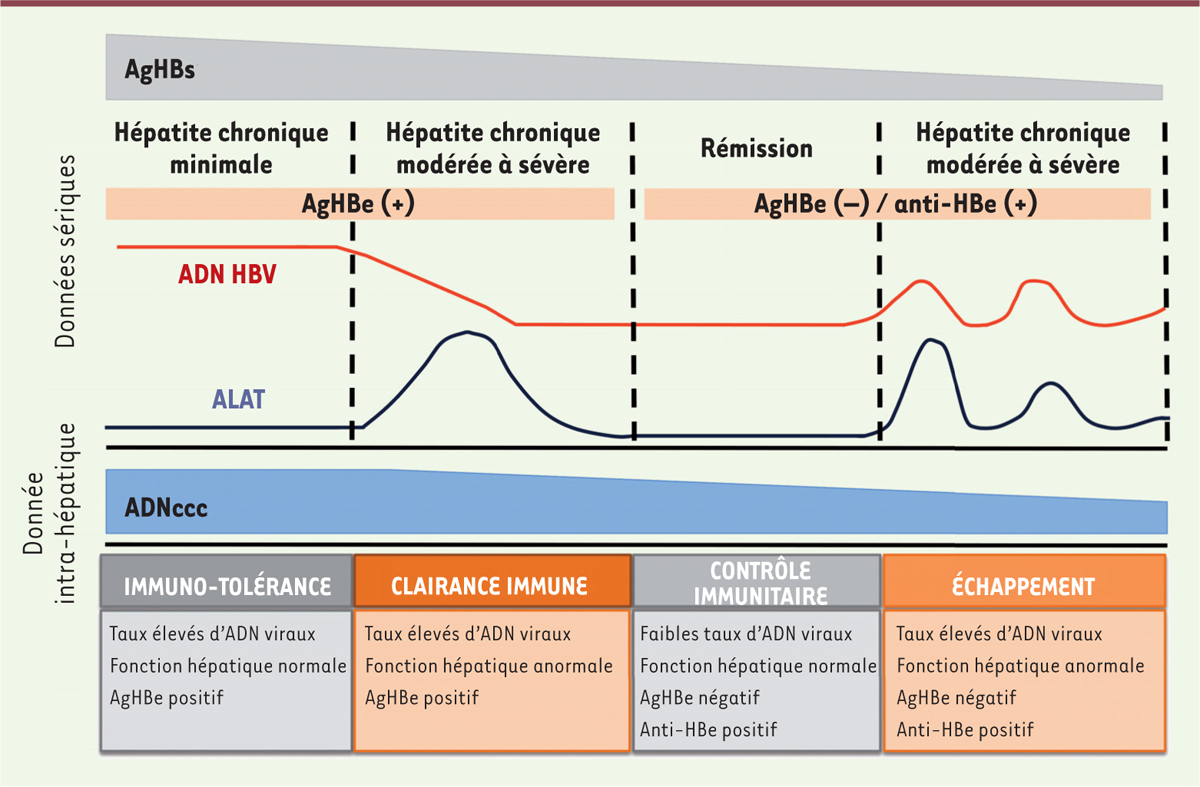
Le virus de l’hépatite B (VHB) est un virus à ADN hépatotropique. Malgré l’existence d’un vaccin, plus de 240 millions de personnes dans le monde sont, aujourd’hui, chroniquement infectées par le VHB et présentent un risque accru de développer un carcinome hépatocellulaire lié à cette infection [1]. Les traitements actuels contre l’hépatite B chronique (CHB) ne permettent pas d’éliminer complétement l’infection du fait de la persistance de l’ADNccc (ADN circulaire clos covalent). L’ADNccc est la forme moléculaire essentielle de l’ADN viral. Il forme un mini-chromosome viral responsable de la persistance de l’infection au niveau du seul hépatocyte. L’histoire naturelle de la CHB passe par plusieurs phases qui reflètent l’interaction entre le virus et le système immunitaire de l’hôte [2] (Figure 1). De nombreux facteurs viraux ou de l’hôte régulent l’abondance et la demi-vie de l’ADNccc dans le foie des patients infectés aux différents stades de la maladie. L’étude de ces facteurs est cependant entravée par un manque de techniques appropriées.
 | Figure 1.
Caractéristiques des phases d’une infection chronique par le virus de l’hépatite B. VHB : virus de l’hépatite B ; ADNccc : ADN circulaire clos covalent ; ALAT : alanine aminotransférase ; AgHBs : antigène s du VHB ; AgHBe : antigène e du VHB. |
Une étude récente de Zhang et al. du Shanghai Public Health Clinical Center [3] s’est fixée l’objectif d’étudier de manière approfondie, avec une résolution unicellulaire, la distribution des antigènes viraux et des acides nucléiques dans le foie des patients atteints de CHB. Cette caractérisation a permis d’améliorer notre compréhension de la biologie de ce virus et de la maladie. Ce groupe de chercheurs a mis au point une technique innovante d’hybridation in situ, spécifique de tous les intermédiaires nucléiques (ARN, ADN et ADNccc) du virus de l’hépatite B. En effet, lors de son cycle viral, l’ADN encapsidé (ADNrc, ADN circulaire relâché) va être complété pour former l’ADNccc. Cet ADN servira de matrice aux différents ARN viraux que sont l’ARN prégénomique (ARNpg) [4] et les ARN codant les différentes protéines virales (Figure 2). Les auteurs ont ainsi pu analyser la distribution de l’ADNccc ainsi que des différents intermédiaires nucléiques du VHB, mais aussi des antigènes viraux de surface (HBs, hepatitis B surface antigen) et de core (HBc, hepatitis B core antigen) au sein de patients atteints de CHB à différents stades de la maladie et ce, avec ou sans traitement.
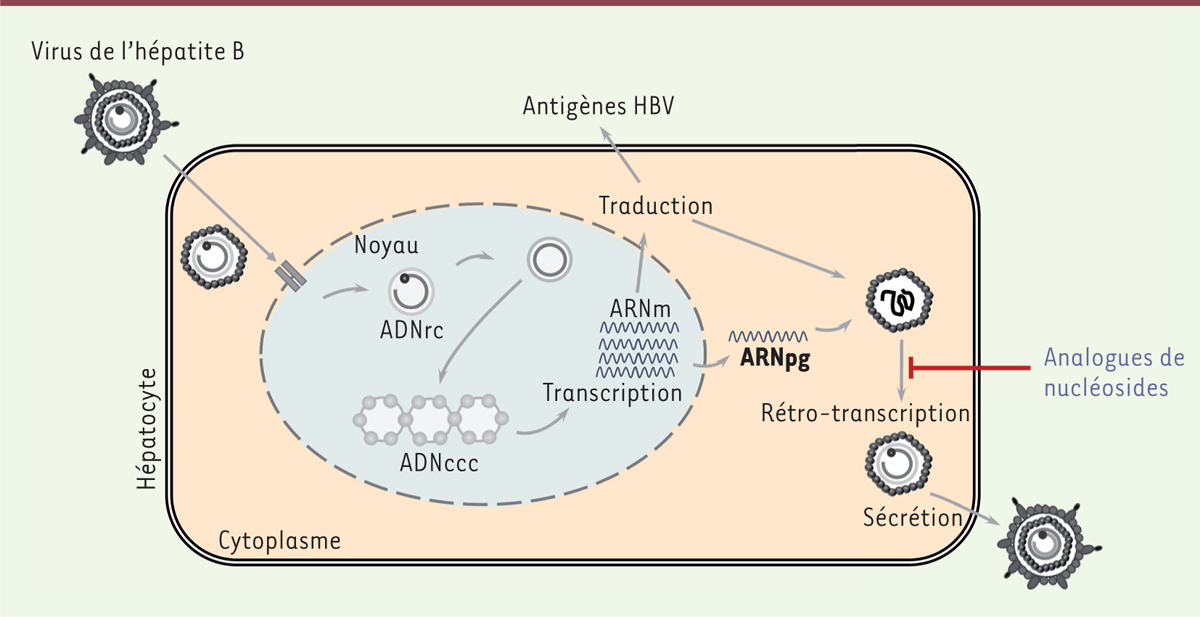
 | Figure 2.
Cycle de réplication du virus de l’hépatite B. Après internalisation par endocytose, les virus libèrent leurs nucléocapsides dans le cytoplasme. Les nucléocapsides migrent ensuite vers le noyau de l’hôte dans lequel elles libèrent l’ADNrc (relâché circulaire) à travers les pores nucléaires. Cet ADNrc est complété et converti en ADNccc (ADN circulaire clos covalent), organisé en mini-chromosome, qui servira de matrice pour la synthèse des 4 ARN viraux dont l’ARNpg (ARN prégénomique). Les ARN viraux transcrits sont alors exportés dans le cytoplasme où ils sont traduits pour produire les différentes protéines virales. L’originalité de ce cycle réside dans le fait qu’une étape de transcription inverse est nécessaire à partir de l’ARNpg pour synthétiser de l’ADNrc [ 3]. En effet, l’ARNpg est encapsidé et rétro-transcrit par la polymérase virale formant un intermédiaire de réplication de type ADN de polarité négative (-). La polymérase virale assure ensuite l’initiation de la synthèse du second brin (+). Les nucléocapsides nouvellement formées peuvent alors acquérir une enveloppe virale afin de former de nouveaux virions qui seront ensuite sécrétés hors de la cellule. |
|
Technique d’observation des intermédiaires nucléiques viraux La technique mise au point [3] consiste en une méthode d’hybridation in situ permettant d’observer les différents intermédiaires nucléiques viraux grâce à l’utilisation de 3 sondes : (a) une première sonde permettant l’observation de l’ARNpg ainsi que de l’ADN viral total ; (b) une deuxième permettant l’observation de l’ADN viral total ; et (c) une dernière permettant l’observation de l’ADNccc, ainsi que de l’ARNpg et des ARN subgénomiques. Le virus de l’hépatite B possède 4 ORF (open reading frame, cadre ouvert de lecture) chevauchants et de même direction [5]. Il est donc impossible d’observer spécifiquement les différents intermédiaires sans digestion enzymatique préalable. Afin de permettre l’observation spécifique de l’ADNccc, les échantillons ont donc subi deux traitements : un utilisant les ribonucléases A et H, afin d’éliminer les différents ARN viraux, ainsi qu’un traitement avec une désoxyribonucléase (Plasmid-SafeTM), permettant la dégradation des ADN non circulaires. Un dernier traitement à la désoxyribonucléase I (DNAseI), enzyme dégradant tous les types d’ADN, a été effectué avant toute observation des ARN viraux. Afin de valider cette technique, Zhang et al. [3] ont utilisé des biopsies réalisées chez des témoins sains et chez des patients atteints de CHB. Une lignée cellulaire d’hépatocytes transformés, permettant l’observation d’un intermédiaire de réplication appelé ADNrc déprotéiné, le précurseur de l’ADNccc [6], a également été utilisée pour comparer la spécificité des sondes ciblant les ADN totaux et l’ADNccc. Dans cette lignée cellulaire, l’ADNrc est en effet en excès majoritaire par rapport à l’ADNccc. La spécificité de la sonde ADNccc a, quant à elle, été démontrée par un signal strictement intranucléaire, ainsi que par de nombreuses analyses de Southern blot1. Après validation, les chercheurs ont pu utiliser cette méthode chez 164 individus, incluant 160 patients atteints d’hépatite B chronique, et 4 contrôles. Les chercheurs ont également pu tester l’effet d’un traitement puisque certains de ces patients (n = 9) ont été traités pendant un an à l’adéfovir, un analogue de nucléosides. |
Relation entre les ADN et les antigènes viraux in vivo L’ADNccc joue un rôle central dans l’établissement mais aussi dans le maintien d’une infection chronique par le virus de l’hépatite B [7]. Malgré des études approfondies, sa biogénèse est relativement peu connue. Grâce à l’application de leur technique, Zhang et al. [3] ont mis en évidence un fait intrigant : la présence de l’ADN viral, ou d’ADNccc, est inversement corrélée à celle de l’antigène HBs. L’absence de cette protéine de surface est en effet liée à l’augmentation considérable du nombre de copies par noyau d’ADNccc, suggérant la mise en œuvre d’un rétrocontrôle négatif par le virus. Cependant ce rétrocontrôle, étudié auparavant [8], ne semble pas intervenir de manière uniforme mais il est cellule-spécifique. Une phase riche en antigènes HBs, observée lors des premiers stades de la chronicité de l’infection, précéderait donc une phase d’accumulation des ADN viraux. Il faut cependant noter, dans cette étude, la présence d’une quantité plus importante d’ADNccc que d’ADNrc déprotéiné, son précurseur, chez les patients atteints de CHB, indiquant une faible réplication. Il serait donc intéressant d’élargir cette étude à une plus grande échelle, de comparer les ratios d’ADNccc et d’ADNrc dans des patients chroniques actifs ou inactifs, développant un carcinome hépatocellulaire ou non. |
Application à l’analyse des patients sous traitement Cette étude s’est particulièrement intéressée à la distribution de l’ADNccc dans les cellules au cours d’un traitement antiviral. Cet ADNccc est le constituant moléculaire de la persistance du virus de l’hépatite B, et est, encore de nos jours, un problème central dans la recherche clinique visant l’éradication du HBV. En effet, il n’existe pas aujourd’hui de traitement permettant de cibler ce mini-chromosome viral, semblable dans son organisation à un chromosome cellulaire [9] (→). De nombreuses études ont déjà mis à jour une diminution d’environ 1 log10 de copies d’ADNccc par cellule, 48 semaines après un traitement par un analogue de nucléosides [10]. Dans l’étude de Zhang et al. [3], chez 9 patients infectés de manière chronique et traités à l’adéfovir, une diminution de l’ADN intrahépatique du virus a été observée. Cependant, après 1 an de traitement, l’élimination de l’ADNccc n’a pu être observée dans aucune cellule, démontrant bien une résistance de celui-ci aux traitements couramment utilisés. Il serait néanmoins intéressant de pouvoir obtenir des données similaires chez des patients traités par d’autres analogues de nucléosides, et ce, dans une cohorte plus conséquente que celle observée ici, afin de pouvoir se dédouaner de la très grande variabilité inter-patients. |
Une nouvelle vision de l’évolution de l’hépatite B chronique à l’échelle de la cellule Dans leur ensemble, les résultats de Zhang et al. [3] ont montré que trois phases distinctes étaient observables, à un niveau cellulaire, dans la progression du CHB (Tableau I), au lieu des quatre habituellement décrites (Figure 1) : une première phase riche en antigènes, avec la présence de forts taux d’antigènes HBs et HBc, accompagnée de très faibles taux d’ADNccc ; une seconde phase, cette fois riche en ADN, avec de larges quantités d’intermédiaires de réplication accumulés dans le cytoplasme, et pas ou peu d’antigènes viraux détectables ; enfin, une dernière phase de latence pendant laquelle les antigènes viraux et les intermédiaires de réplication sont indétectables tandis que l’ADN viral persiste dans le noyau sous forme d’ADNccc ou d’ADN viral intégré, avec pas ou peu de réplication. Ces observations permettent de suggérer une régulation différentielle de la production protéique lors des différentes phases de la maladie, très probablement due à l’activité sélective des promoteurs de l’ADNccc. Cette étude ne relatant principalement que des observations, la question des mécanismes mis en place dans cette régulation reste entière. Elle offre cependant de nouvelles possibilités. Le développement de cette technique en routine pourrait en effet permettre d’obtenir des données viro-histologiques plus complètes concernant les patients. Plus précises, elles pourraient ainsi permettre le développement de traitements plus en adéquation avec l’évolution de la maladie chez chaque patient.
Tableau I.
|
Phase riche en antigènes |
Phase riche en ADN |
Phase de latence |
| Antigènes HBc/HBs |
+++ |
+ |
- |
| Production de virions |
+++ |
+ |
- |
| ADNccc |
- |
+++ |
+ |
Récapitulatif des phases de l’hépatite B au niveau cellulaire. ADNccc : ADN circulaire clos covalent ; HBs : antigènes du virus de l’hépatite B (VHB) ; HBc : antigène core du VHB. |
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Lavanchy D. Worldwide epidemiology of HBV infection, disease burden, and vaccine prevention . J Clin Virol. 2005; ; 34 ((suppl 1)) : :S1.–S3. 2.
Fattovich G. Natural history and prognosis of hepatitis B . Semin Liver Dis. 2003; ; 23 : :47.–58. 3.
Zhang X, Lu W, Zheng Y, et al. In situ analysis of intrahepatic virological events in chronic hepatitis B virus infection . J Clin Invest. 2016; ; 126 : :1079.–1092. 4.
Nassal M. Hepatitis B viruses: reverse transcription a different way . Virus Res. 2008; ; 134 : :235.–249. 5.
Ganem D, Schneider RJ, Knipe DM, Howley PM, Griffin DE, et al. Hepadnaviridae and their replication . Fields virology. (4th ed.) , 4th ed. . Philadelphia, PA: : Lippincott-Raven Publishers; , 2001 : :2923.–2969. 6.
Gao W, Hu J Formation of hepatitis B virus covalently closed circular DNA: removal of genome-linked protein . J Virol. 2007; ; 81 : :6164.–6174. 7.
Yang HC, Kao JH Persistence of hepatitis B virus covalently closed circular DNA in hepatocytes: molecular mechanisms and clinical significance . Emerg Microbes Infect. 2014; ; 3 : :e64.. 8.
Lentz TB, Loeb DD Roles of the envelope proteins in the amplification of covalently closed circular DNA and completion of synthesis of the plus-strand DNA in hepatitis B virus . J Virol. 2011; ; 85 : :11916.–11927. 9.
Lucifora J, Xia Y, Reisinger F, et al. Dégradation spécifique de l’ADN nucléaire responsable de la persistance du virus de l’hépatite B . Med Sci (Paris). 2014; ; 30 : :724.–726. 10.
Werle-Lapostolle B, Bowden S, Locarnini S, et al. Persistence of cccDNA during the natural history of chronic hepatitis B and decline during adefovir dipivoxil therapy . Gastroenterology. 2004; ; 126 : :1750.–1758. 11.
Levrero M, Zucman-Rossi J Mechanisms of HBV-induced hepatocellular carcinoma . J Hepatol. 2016; ; 64 ((suppl 1)) : :S84.–101. |