| |
| Med Sci (Paris). 33(3): 224–226. doi: 10.1051/medsci/20173303006.Implications de l’autophagie dans les pathologies pulmonaires et la réponse aux nanoparticules Sophie Lanone1* 1Inserm U955, Institut Mondor de Recherche Biomédicale, faculté de médecine, 8, rue du général Sarrail, 94010Créteil, France |
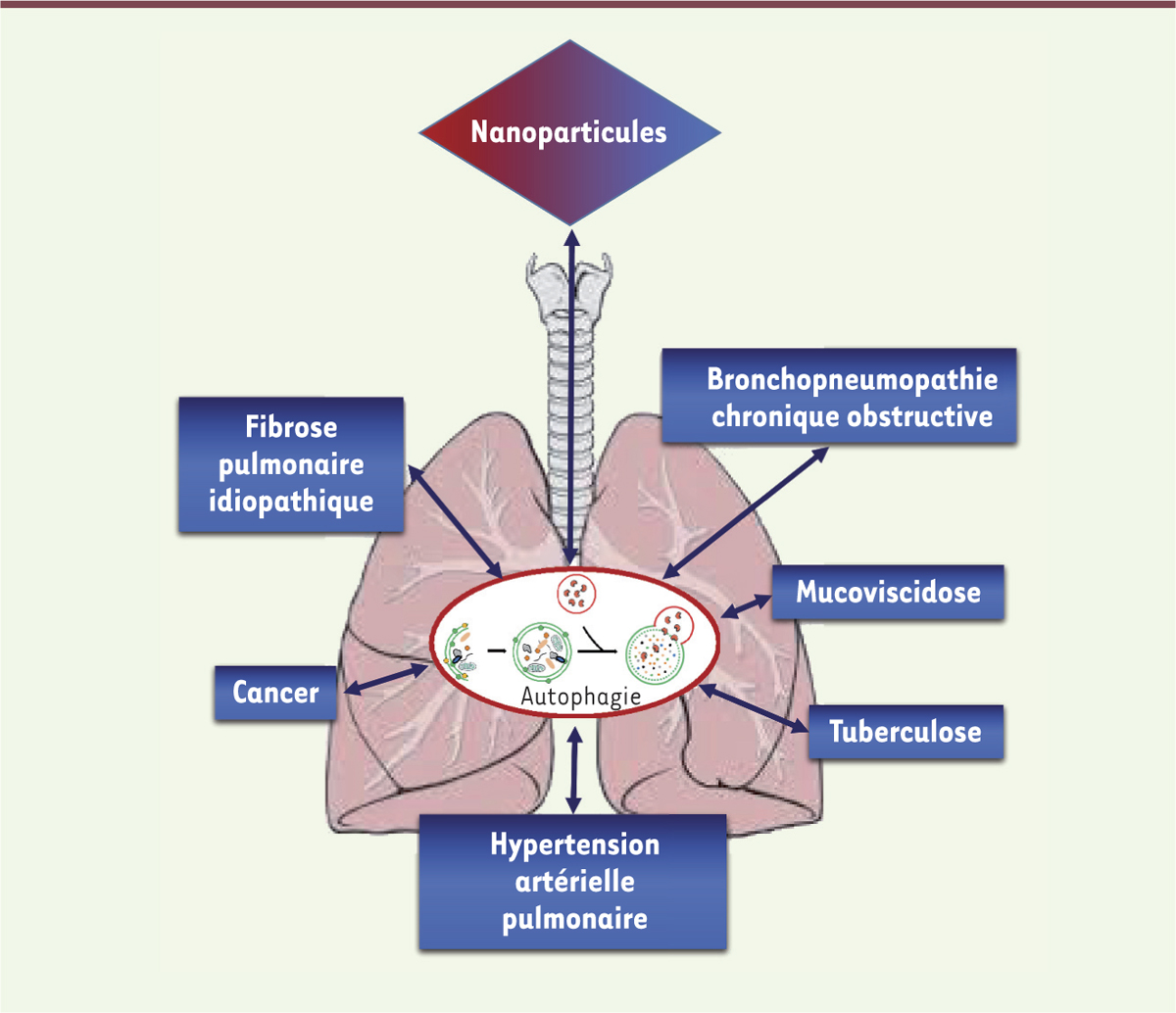
Depuis les premières évidences de la formation d’autophagosomes dans les cellules de mammifères dans les années 1950, l’existence du processus autophagique a été largement rapportée dans de nombreux types cellulaires et tissus, notamment au niveau pulmonaire. En marge de son importance dans les conditions physiologiques, la première prise de conscience d’une potentielle implication de l’autophagie dans les pathologies pulmonaires est apparue lorsque des vacuoles autophagiques ont été observées dans des prélèvements de foie isolés d’un patient porteur d’une déficience en α1-antitrypsine, due à une mutation génétique associée au développement d’un emphysème caractérisé par la destruction des parois alvéolaires [1]. Depuis, de nombreuses études suggèrent que l’autophagie est régulée dans différentes conditions physiopathologiques et qu’elle pourrait être impliquée dans la pathogenèse et le développement de certaines pathologies pulmonaires comme la bronchopneumopathie chronique obstructive (BPCO), la fibrose pulmonaire idiopathique (FPI), la mucoviscidose, la tuberculose, l’hypertension artérielle pulmonaire ou encore, bien que plus récemment, dans la réponse aux agressions environnementales telles que celles causées par les nanoparticules (NP) [2, 3]. Nous nous intéresserons ici plus spécifiquement à décrire la réponse autophagique pulmonaire dans le contexte de deux pathologies pulmonaires représentatives (la BPCO et la FPI), ainsi qu’en réponse aux NP. |
Autophagie et pathologies pulmonaires La bronchopneumopathie chronique obstructive (BPCO) est une pathologie complexe caractérisée par une obstruction lente et progressive des voies aériennes pulmonaires, associée à un emphysème, dont la cause principale est l’exposition à la fumée de cigarette [4]. La pathogenèse de la BPCO reste incomplètement élucidée, mais l’autophagie semble y avoir un rôle. En effet, plusieurs études montrent une accumulation de vacuoles autophagiques (autophagosomes/autolysosomes), une augmentation de l’expression de marqueurs autophagiques (LC3-II, forme membranaire de la LC3, [microtubule-associated protein 1A/1B-light chain 3], Beclin-1, ou encore des protéines autophagique [ATG] Atg4, Atg5 ou Atg7) dans des prélèvements pulmonaires de patients BPCO [5]. Des études expérimentales réalisées sur des souris déficientes pour LC3, fondamentale dans le processus autophagique, montrent que ces animaux sont résistants à l’emphysème induit par une exposition à la fumée de cigarette, ce qui suggère une implication délétère de l’autophagie dans la pathogenèse de l’emphysème. Des études plus récentes s’intéressant à différentes formes d’autophagie sélective, montrent qu’une déficience ciblée de la mitophagie (élimination spécifique par autophagie des mitochondries endommagées ou dépolarisées) [11] (→) ou de la ciliophagie (voie de signalisation dépendant de l’autophagie qui régule la longueur des cils épithéliaux) protège contre le développement d’un phénotype de type BPCO, en réponse à une exposition à la fumée de cigarette. A contrario, la xénophagie (ou digestion des pathogènes intracellulaires à travers la machinerie autophagique) apparaît ne plus être fonctionnelle dans les macrophages des patients atteints de BPCO, ce qui pourrait contribuer aux infections à répétition chez ces sujets [5]. Un autre rôle pour l’autophagie dans la physiopathologie de la BPCO pourrait reposer sur sa capacité à réguler la sénescence cellulaire. Les voies de signalisation conduisant à la sénescence constituent en effet l’une de celles impliquées dans la BPCO. Même si d’autres études sont nécessaires pour élucider le(s) rôle(s) exact(s) de l’autophagie dans la physiopathologie de la BPCO, elle semble être impliquée dans sa pathogenèse d’une façon plutôt délétère.
(→) Voir la Synthèse de P. Vigié et N. Camougrand, page 231 de ce numéro
La fibrose pulmonaire idiopathique (FPI) représente une autre pathologie largement invalidante et pour laquelle aucun traitement curatif n’existe actuellement [6]. Au contraire de la BPCO, une régulation négative de l’autophagie chez ces patients est observée : l’expression de LC3 est en effet diminuée dans des biopsies pulmonaires de patients porteurs de FPI, en parallèle d’une activation de mTOR (mammalian target of rapamycin) dans les foyers fibroblastiques caractéristiques de cette pathologie. Des études expérimentales réalisées chez l’animal confirment ces observations : le traitement par la rapamycine (qui active mTOR) inhibe le développement de la fibrose induite par la bléomycine. De même, la déficience en autophagie (résultat de mutations de LC3, de Beclin-1 ou d’Atg5) entraîne une exacerbation de l’activation de fibroblastes pulmonaires en réponse au TGF-β (transforming growth factor-beta) conduisant à une aggravation du phénotype pro-fibrosant [3, 5]. L’ensemble de ces résultats suggère donc un rôle de l’autophagie qui soit plutôt bénéfique dans la physiopathologie de la fibrose pulmonaire. Ainsi, bien que l’autophagie ait été considérée initialement comme un mécanisme cytoprotecteur en réponse à une agression, des études récentes suggèrent qu’elle peut être délétère dans certains états physiopathologiques. Cependant, la contribution des différentes voies de l’autophagie sélective (mitophagie, ciliophagie, aggréphagie, xénophagie, etc.) reste à élucider, la connaissance plus fine de ces processus et leur implication pouvant permettre le développement de nouvelles thérapies qui soient plus ciblées. |
Autophagie et nanoparticules Le rôle de l’autophagie dans la réponse pulmonaire aux agressions environnementales telles que celles liées à une exposition aux nanoparticules (NP) a été examiné récemment. Les NP sont des particules dont l’une au moins des dimensions est inférieure à 100 nm. Leurs origines dans l’atmosphère peuvent être naturelles ou anthropiques (générées de façon intentionnelle, ou non, par l’activité humaine). Depuis ces dernières années, l’utilisation industrielle des NP manufacturées connaît un essor très important. Il s’accompagne d’une exposition humaine croissante, et de la crainte de leur éventuelle toxicité, notamment au niveau respiratoire [7, 8]. Il est maintenant accepté (dans la limite de la pertinence des protocoles expérimentaux utilisés par rapport à une exposition réelle) qu’une exposition pulmonaire aux NP peut être à l’origine d’une inflammation, d’un stress oxydant, et s’accompagner d’un remodelage pulmonaire, le plus souvent caractérisé par le développement d’une fibrose. Si les caractéristiques physico-chimiques représentent des déterminants de la toxicité potentielle des NP, les mécanismes moléculaires impliqués dans la réponse cellulaire ne sont pas complètement élucidés. Du fait de son rôle dans la régulation de l’inflammation ou du stress oxydant, l’implication de l’autophagie au cours de la réponse aux nanoparticules a été examinée [9]. La littérature sur le sujet reste encore parcellaire (les premières études ne datent que de 2010). Elle a largement souffert, dans un premier temps, de conclusions hâtives quant à l’activation supposée de l’autophagie dans le processus. En effet, les premières études consacrées à ce sujet consistaient le plus souvent à décrire une accumulation de vacuoles autophagiques (autophagosomes/autolysosmes) considérée comme une « preuve » de l’activation du processus autophagique. Ceci a été montré dans différents types cellulaires pulmonaires (cellules épithéliales, fibroblastes, macrophages) de même qu’après exposition pulmonaire de souris, ou de rats, à des NP, d’oxydes métalliques ou carbonées (noir de carbone, nanotubes de carbone), majoritairement, mais aussi à des dendrimères ou encore des nano-oxydes de terre rare [9]. Cependant, de plus en plus d’études plus récentes, fondées sur une analyse détaillée de l’autophagie, montrent en fait que l’accumulation des vacuoles autophagiques observée pourrait être liée, au moins pour certaines NP, à une altération du processus autophagique probablement du fait de l’interaction des NP avec les lysosomes qui entraîne leur dysfonctionnement et une altération de leur fusion avec les autophagosomes. Il est clair que le rôle exact de l’autophagie dans la réponse pulmonaire aux NP reste à être élucidé, mais les données actuelles suggèrent que certaines de ces NP pourraient être utilisées dans le contexte de la nanomédecine, afin de moduler l’autophagie. Les NP représentent ainsi un outil thérapeutique particulièrement novateur et prometteur [10]. L’autophagie semble être impliquée dans la pathogenèse de nombreux modèles pré-cliniques de pathologies pulmonaires. Elle semble potentiellement régulée dans différentes réponses pathologiques pulmonaires (Figure 1). Cependant, une meilleure compréhension de la dualité du rôle de l’autophagie (sélective) permettrait la mise en évidence de mécanismes physiopathologiques représentant potentiellement de nouvelles cibles thérapeutiques.
 | Figure 1.
Implication potentielle de l’autophagie dans les pathologies pulmonaires et la réponse aux nanoparticules.
|
|
L’auteur déclare n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Eriksson S. Pulmonary emphysema and alpha1-antitrypsin deficiency . Acta Med Scand. 1964; ; 175 : :197.–205. 2.
Mizumura K, Cloonan S, Choi ME, et al. Autophagy: friend or foe in lung disease? Ann Am Thorac Soc. 2016; ; 13 ((suppl 1)) : :S40.–S47. 3.
Haspel JA, Choi AM Autophagy: a core cellular process with emerging links to pulmonary disease . Am J Respir Crit Care Med. 2011; ; 184 : :1237.–1246. 4.
Lange P, Halpin DM, O’Donnell DE, MacNee W. Diagnosis, assessment, and phenotyping of COPD: beyond FEV1 . Int J Chron Obstruct Pulmon Dis. 2016; ; 11 ((special issue)) : :3.–12. 5.
Nakahira K Pabon Porras MA, Choi AMK. Autophagy in Pulmonary Diseases . Am J Respir Crit Care Med. 2016; ; 194 : :1196.–1207. 6.
Kulkarni T, O’Reilly P, Antony VB, et al. Matrix remodeling in pulmonary fibrosis and emphysema . Am J Respir Cell Mol Biol. 2016; ; 54 : :751.–760. 7.
Boczkowski J, Lanone S Respiratory toxicities of nanomaterials: a focus on carbon nanotubes . Adv Drug Deliv Rev. 2012; ; 64 : :1694.–1699. 8.
Lanone S, Andujar P, Kermanizadeh A, Boczkowski J Determinants of carbon nanotube toxicity . Adv Drug Deliv Rev. 2013; ; 65 : :2063.–2069. 9.
Cohignac V, Landry MJ, Boczkowski J, Lanone S Autophagy as a possible underlying mechanism of nanomaterial toxicity . Nanomaterials. 2014; ; 4 : :548.–582. 10.
Peynshaert K, Manshian BB, Joris F, et al. Exploiting intrinsic nanoparticle toxicity: the pros and cons of nanoparticle-induced autophagy in biomedical research . Chem Rev. 2014; ; 114 : :7581.–7609. 11.
Vigié P, Camougrand N Mitophagie et contrôle qualité des mitochondries . Med Sci (Paris). 2017; ; 33 : :231.–237. |