| |
| Med Sci (Paris). 33(3): 268–274. doi: 10.1051/medsci/20173303013.Autophagie et cerveau Le cas des maladies neurodégénératives Mathieu Bourdenx1,2 and Benjamin Dehay1,2* 1Université de Bordeaux, Institut des maladies neurodégénératives, UMR 5293, F-33000Bordeaux, France 2CNRS, Institut des maladies neurodégénératives, UMR 5293, F-33000Bordeaux, France |
Vignette (Photo © Sébastien Granier). La cellule est composée de millions de protéines différentes réparties dans des compartiments distincts, tant fonctionnellement que spatialement [1]. Pour exercer leur(s) fonction(s), les protéines doivent adopter un repliement tridimensionnel appelé conformation. Lorsqu’une protéine n’est plus fonctionnelle, altérée ou non nécessaire, celle-ci doit être dégradée et ses constituants (les acides aminés) réutilisés pour la synthèse de nouvelles protéines. La dégradation des protéines est donc un élément central du réseau protéostasique (ensemble des fonctions contrôlant le devenir des protéines). On peut distinguer deux grandes voies dans les systèmes de dégradation : le système de l’ubiquitine-protéasome et le système autophagie-lysosome. Alors que le premier prend majoritairement en charge la dégradation des protéines de durée de vie courte, le second est notamment impliqué dans la dégradation des protéines à durée de vie longue, des complexes protéiques et des organites (mitochondries, peroxysomes, réticulum endoplasmique, par exemple) [2]. L’autophagie, du grec « soi-même » et « manger », est un mécanisme très conservé au cours de l’évolution permettant la dégradation et le recyclage des composants cellulaires [3]. Le dysfonctionnement de ce processus (impliquant plus de 1 000 protéines) peut induire une rupture de réseau protéostasique conduisant à un état pathologique décrit dans de nombreuses maladies qu’elles soient métaboliques, cardio-vasculaires, oncologiques ou encore neurodégénératives. Classiquement, trois types d’autophagie sont distingués : la microautophagie, la macroautophagie et l’autophagie relayée par les protéines chaperonnes [3–5]. La microautophagie implique la séquestration d’une partie du cytoplasme par invagination de la membrane lysosomale. La macroautophagie comporte une voie non sélective, associée avec la séquestration d’une portion entière du cytoplasme par une double membrane formant ainsi l’autophagosome, et une voie sélective permettant la dégradation, par exemple des mitochondries, après reconnaissance d’un marqueur spécifique. Enfin, l’autophagie impliquant les protéines chaperonnes est une forme d’autophagie sélective fondée sur la reconnaissance d’un penta-peptide (KFERQ) et l’import par un transporteur présent à la membrane du lysosome (LAMP2a - lysosomal associated-membrane protein 2a) avec l’intervention de protéines chaperonnes (Hsc70) et de différentes protéines co-chaperonnes. Dans la suite de cet article, nous ne nous focaliserons que sur la voie de l’autophagie relayée par les protéines chaperonnes et la macroautophagie. Le cerveau, notamment en raison de ses populations cellulaires multiples, possède des caractéristiques uniques qui seront décrites dans une première partie. Ensuite, nous discuterons les maladies du cerveau associées avec un dysfonctionnement du système de dégradation des protéines avec un intérêt particulier, ici, pour les maladies neurodégénératives. Enfin, nous verrons les possibilités de traitement impliquant une modulation de l’autophagie. |
Autophagie dans le cerveau Le cerveau et les cellules qui le composent présentent des caractéristiques uniques. En effet, malgré l’existence d’une neurogénèse dans quelques régions spécifiques, les neurones sont considérés comme des cellules post-mitotiques avec une durée de vie importante pouvant d’ailleurs probablement excéder la durée de vie de l’organisme hôte [6]. Ainsi, les neurones ne peuvent diluer ou réduire la quantité totale de protéines altérées au cours de la division cellulaire comme le font d’autres types cellulaires. Cette durée de vie importante nécessite un processus de contrôle qualité des protéines et organites qui soit particulièrement efficace. Un grand nombre de sous-types de cellules existe dans le cerveau. On peut distinguer différentes populations neuronales selon leur spécialisation (sécrétion d’un neurotransmetteur spécifique par exemple) ou la longueur de leur(s) projection(s) (différence entre les interneurones dont les prolongements sont limités à une structure donnée par rapport aux neurones à longues projections). Il existe également une autre famille de cellules, les cellules gliales, qui représente, en réalité, la majorité des cellules du cerveau [7]. Bien que leur rôle ait été longtemps sous-estimé et limité à une fonction de soutien, de nombreuses études montrent aujourd’hui leur implication dans beaucoup de processus essentiels au fonctionnement du système nerveux central [8] (→).
(→) Voir la Nouvelle de F.W. Pfrieger et M. Reber, m/s n° 2, février 2013, page 142
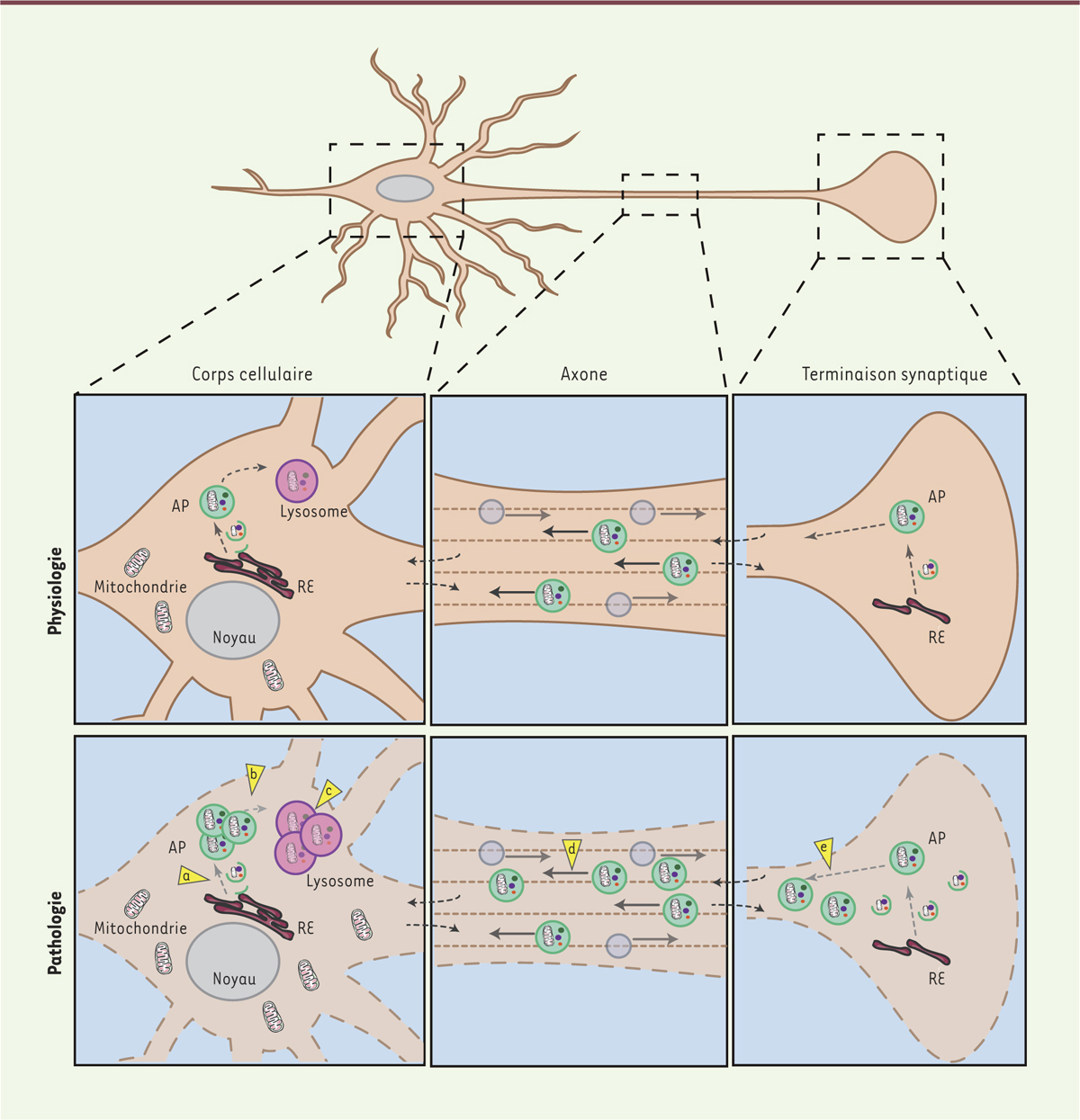
Au sein de cette large famille de cellules, on peut distinguer des sous-familles en fonction de spécificités fonctionnelles. Cette importante hétérogénéité de neurones et de cellules gliales suggère ainsi l’existence de différences fonctionnelles notamment en ce qui concerne l’autophagie. La distance parfois importante entre le corps cellulaire et la terminaison axonale nécessite une régulation locale du protéome. La formation des autophagosomes - les vésicules permettant la séquestration d’une portion du cytoplasme avant sa dégradation par fusion avec le lysosome (ce qui correspond à la voie de la macroautophagie) - a été observée au niveau du corps cellulaire mais aussi de la terminaison axonale, dans des cas de lésions axonales [5, 9]. Ces données ont ensuite été confortées par l’observation du réticulum endoplasmique à partir duquel des autophagosomes peuvent effectivement émerger, au niveau des terminaisons axonales [10]. Bien que les autophagosomes puissent être formés à distance des corps cellulaires, la dégradation, par fusion avec les lysosomes, se réalise au niveau du corps cellulaire en raison de la présence des lysosomes qui se localisent préférentiellement au niveau somatique [5], montrant l’importance des systèmes de transport axonaux pour qu’une dégradation efficace soit réalisée (Figure 1).
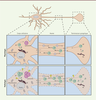 | Figure 1.
Représentation schématique d’un neurone dans un état physiologique ou pathologique impliquant des perturbations du flux axonal. La morphologie d’un neurone comporte différents compartiments, le corps cellulaire et la terminaison synaptique, eux-mêmes connectés par un axone pouvant être de taille et de complexité différente selon les types neuronaux. Cette morphologie particulière nécessite une régulation locale du protéome, en particulier du système autophagie-lysosome. La formation des autophagosomes, des vésicules spécialisées permettant la séquestration d’une portion du cytoplasme avant sa dégradation par fusion avec le lysosome, a été montrée au niveau du corps cellulaire mais aussi dans la partie distale de l’axone dans des cas de lésions ou de dysfonctions axonales. La localisation préférentielle des lysosomes au niveau du corps cellulaire nécessite un transport axonal rétrograde efficace des autophagosomes pour leur dégradation. Ce modèle montre l’importance des systèmes de transport axonaux pour la régulation des acteurs de la voie autophagique. Les pointes des flèches jaunes illustrent les différentes dysfonctions observées en condition pathologique : (a) déficit de l’induction de l’autophagie ; (b) défaut de fusion entre les autophagosomes et les lysosomes ; (c) dysfonction lysosomale induite notamment par le blocage de l’autophagie relayée par les protéines chaperonnes ; (d, e) déficit du transport axonal induisant une accumulation de vésicules autophagiques non dégradées aux niveaux des terminaisons synaptiques et des prolongements axonaux. AP : autophagosome ; RE : réticulum endoplasmique. |
Au niveau des terminaisons synaptiques, des rôles spécifiques de l’autophagie ont pu être déterminés. En effet, la délétion spécifique du gène Atg7 (autophagy-related gene 7) dans les neurones dopaminergiques se traduit par une altération fonctionnelle de la libération de dopamine avant l’apparition d’une dégénérescence de ces mêmes neurones, suggérant un rôle de l’autophagie dans la libération des vésicules synaptiques [11]. De même, des données récentes mettent en évidence l’activation de l’autophagie après dépolarisation ou activation des récepteurs glutamatergiques de type NMDA (N-méthyl-D-aspartate), celle-ci étant associée à une dégradation accrue des récepteurs glutamatergiques de type AMPA (α-amino-3-hydroxy-5-méthylisoazol-4-propionate) [12]. Bien qu’encore peu compris, ces résultats suggèrent néanmoins une implication de l’autophagie dans la plasticité synaptique. Du fait d’une vision souvent neuro-centrée, les autres cellules du cerveau que sont les cellules gliales n’ont été que trop peu étudiées. Cependant, plusieurs études ont montré une activation de l’autophagie dans ces cellules à la suite de différents stimulus, comme l’inhibition du protéasome dans les astrocytes (une catégorie de cellules gliales) [13]. Les astrocytes présentent un système ubiquitine-protéasome plus actif que celui des neurones [14], suggérant ainsi de profondes différences fonctionnelles entre les types cellulaires. Ces quelques données renforcent donc l’importance de la nécessité d’étudier l’autophagie en situation physiologique afin de mieux comprendre les similarités et les particularités que présente ce processus dans ces différentes cellules. Historiquement, la majorité des connaissances concernant la mécanistique de l’autophagie a émergé d’études utilisant un activateur classique du mécanisme : la privation en nutriments. Dans la plupart des organes périphériques, et notamment dans le foie, la privation en nutriments entraîne une inhibition du complexe protéique appelé mTORC1 (mammalian target of rapamycin complex 1). En effet, en condition de privation de nutriments, les hépatocytes peuvent induire une autophagie importante qui se traduit par une diminution de la masse hépatique, ce que le cerveau ne fait pas, ou peu [5], suggérant ainsi l’existence de voie(s) de signalisation spécifique(s) au cerveau [42] (→).
(→) Voir la Synthèse de P. Gual et al., page 252 de ce numéro
Même si nous ne le détaillerons pas ici, l’autophagie présente également un rôle essentiel lors du développement du système nerveux [15] (→).
(→) Voir la Synthèse de J. Puyal et al., m/s n° 4, avril 2009, page 383
|
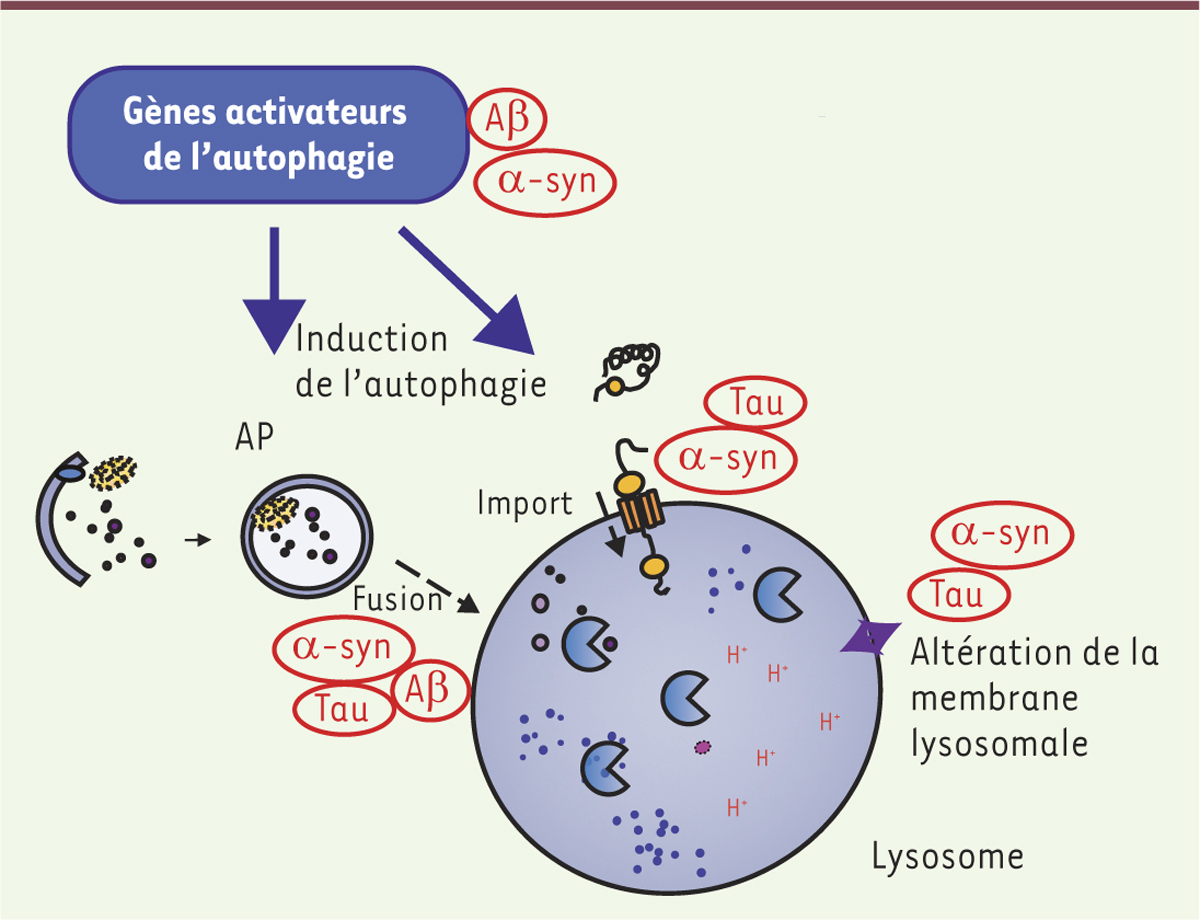
Dysfonctions de l’autophagie dans les maladies du cerveau Les maladies neurodégénératives L’ensemble des maladies neurodégénératives (maladie d’Alzheimer, maladie de Parkinson, maladie d’Huntington, sclérose latérale amyotrophique, ou encore les affections à prions) se caractérise par l’accumulation, dans le tissu cérébral, de protéines qui sont anormalement repliées [ 16]. Cette caractéristique commune à ces maladies conduit souvent à les désigner sous le terme « protéinopathies ». Les agrégats protéiques décrits peuvent être intracellulaires, neuronaux (comme les corps de Lewy, dans la maladie de Parkinson, et les enchevêtrements neurofibrillaires, dans la maladie d’Alzheimer) ou oligodendrogliaux (comme les inclusions oligodendrogliales cytoplasmiques dans l’atrophie multi-systématisée), ou extracellulaire (comme les plaques séniles dans la maladie d’Alzheimer) [ 16]. L’observation de ces agrégats qui ne sont pas dégradés est à l’origine de l’hypothèse d’un dysfonctionnement, dans ces pathologies, des systèmes de dégradation des protéines. La mise en évidence récente de l’accumulation de composants des voies autophagiques dans les agrégats observés chez des patients atteints de maladies neurodégénératives (que ce soit la protéine adaptatrice de la macroautophagie p62 ou la protéine LC3 [microtubule-associated protein 1 light chain 3], par exemple) a permis de proposer l’hypothèse que l’autophagie pourrait être impliquée dans le développement de ces différentes maladies [17] (Figure 2). Bien que la signification de leur présence au sein des neurites dystrophiques soit encore incomprise, l’accumulation de vacuoles autophagiques et de lysosomes en est une illustration [18, 19]. Chez les patients atteints de la maladie d’Alzheimer, des études génétiques ont montré en particulier la diminution de la protéine Beclin-1 et l’hyperactivation du complexe mTORC1, suggérant une atteinte de l’activation de l’autophagie dans la pathologie [20, 21]. Chez les patients parkinsoniens, une déplétion lysosomale associée à une accumulation d’autophagosomes non dégradés, a pu être également identifiée [19].
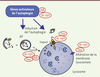 | Figure 2.
Perturbation de l’autophagie par les protéines associées aux maladies neurodégénératives. Ce diagramme montre comment les protéines mutées, mal-repliées ou agrégées impliquées dans les maladies neurodégénératives, ici le peptide Aβ et Tau pour la maladie d’Alzheimer ou l’α-synucléine pour la maladie de Parkinson, interviennent dans la perturbation de la voie autophagie-lysosomale. α-syn : α-synucléine ; Aβ : peptide Aβ 40-42 ; AP : autophagosome. |
La présence excessive d’autophagosomes dans le cerveau de patients atteints de maladies neurodégénératives peut avoir plusieurs interprétations. Tout d’abord, la présence accrue d’autophagosomes peut être considérée comme étant, en fait, un mécanisme d’induction de la macroautophagie à des fins de protection cellulaire afin d’éliminer les protéines anormales qui composent les agrégats. Les vacuoles, qui ne peuvent plus être dégradées par les lysosomes du fait d’un pool diminué ou d’une altération fonctionnelle, peuvent également représenter une source de cette accumulation. Il semblerait en fait que la réponse soit double. Ainsi, dans le cas de la maladie de Parkinson, une déplétion lysosomale a pu être caractérisée. Ceci pourrait donc induire une accumulation des vacuoles autophagiques [19]. Dans la maladie d’Alzheimer, il pourrait, au contraire, s’agir d’un défaut de la fusion entre les vacuoles autophagiques et les lysosomes, à l’origine de cette accumulation [22]. Des études génétiques récentes ont renforcé le lien entre maladies neurodégénératives et dysfonctions du système autophagie-lysosome. Ainsi, dans le contexte de la maladie de Parkinson, une petite protéine présynaptique est particulièrement étudiée : l’α-synucléine (pour une revue voir [23]). Cette protéine est notamment l’un des composants majeurs des corps de Lewy. Présentant le penta-peptide KFERQ, elle est dégradée spécifiquement par l’autophagie impliquant les protéines chaperonnes. Cependant, lorsque la protéine est en quantité anormalement élevée, ou lorsqu’elle présente une mutation associée à des formes héréditaires de la maladie de Parkinson, elle bloque la fusion du lysosome avec l’autophagosome provoquant le dysfonctionnement d’une voie de l’autophagie [24]. La protéine Tau possède également deux motifs de reconnaissance pour l’autophagie relayée par les protéines chaperonnes [25]. Dix-huit locus ont clairement été associés avec des formes héréditaires de la maladie de Parkinson. Au moins 11 d’entre eux ont des connexions directes avec le système autophagie-lysosome [4]. Ceci montre l’existence d’une relation étroite entre dysfonction du système autophagie-lysosome et maladies neurodégénératives. Le rôle du vieillissement Au cours du vieillissement, les capacités du réseau protéostasique déclinent progressivement [ 43] ( →).
(→) Voir la Synthèse de L. Galluzzi L et al., page 246 de ce numéro
Ce déclin de la gestion cellulaire des protéines explique, en partie, la raison pour laquelle le vieillissement est considéré, aujourd’hui, comme le facteur de risque, non génétique, qui semble fondamental pour le développement des maladies neurodégénératives [26]. Chez le vers nématode Caenorhabditis elegans, le dysfonctionnement du réseau protéostasique apparaît comme un événement précoce au cours du vieillissement, les cellules sénescentes étant dans l’incapacité de maintenir les protéines dans un état de repliement correct [27]. De manière similaire, chez les mammifères âgés, une diminution significative de LAMP2a, une protéine essentielle à un type d’autophagie, ainsi qu’une perte générale des niveaux d’autophagie au niveau hépatique ont été identifiées [28]. Au niveau cérébral, une diminution de la protéine Beclin-1 a également été montrée [29]. La modulation de l’autophagie, par restriction calorique, qui induit le mécanisme, pourrait permettre de ralentir le processus de vieillissement. Chez les animaux, l’espérance de vie pourrait être allongée par une augmentation de l’autophagie, par modulation génétique ou pharmacologique [30]. Chez le primate non humain, une restriction calorique prolongée est en effet à l’origine d’un retard d’apparition des maladies liées au vieillissement [31]. Alors que le vieillissement est un processus inexorable pour tout être vivant, seule une minorité de personnes développeront des maladies liées à l’âge telles que la maladie d’Alzheimer ou la maladie de Parkinson. Le rôle de l’âge dans l’apparition des maladies neurodégénératives reste donc contradictoire. En effet, alors que certaines études ont montré une susceptibilité accrue des neurones âgés à la dégénérescence [26, 32], d’autres études n’ont, au contraire, pu conclure à un effet important lié à l’âge [33]. L’augmentation de l’espérance de vie dans la population générale, la compréhension des phénomènes de vieillissement et de leur rôle dans l’apparition et dans la progression des pathologies présentent donc des intérêts scientifiques et sociétaux majeurs. |
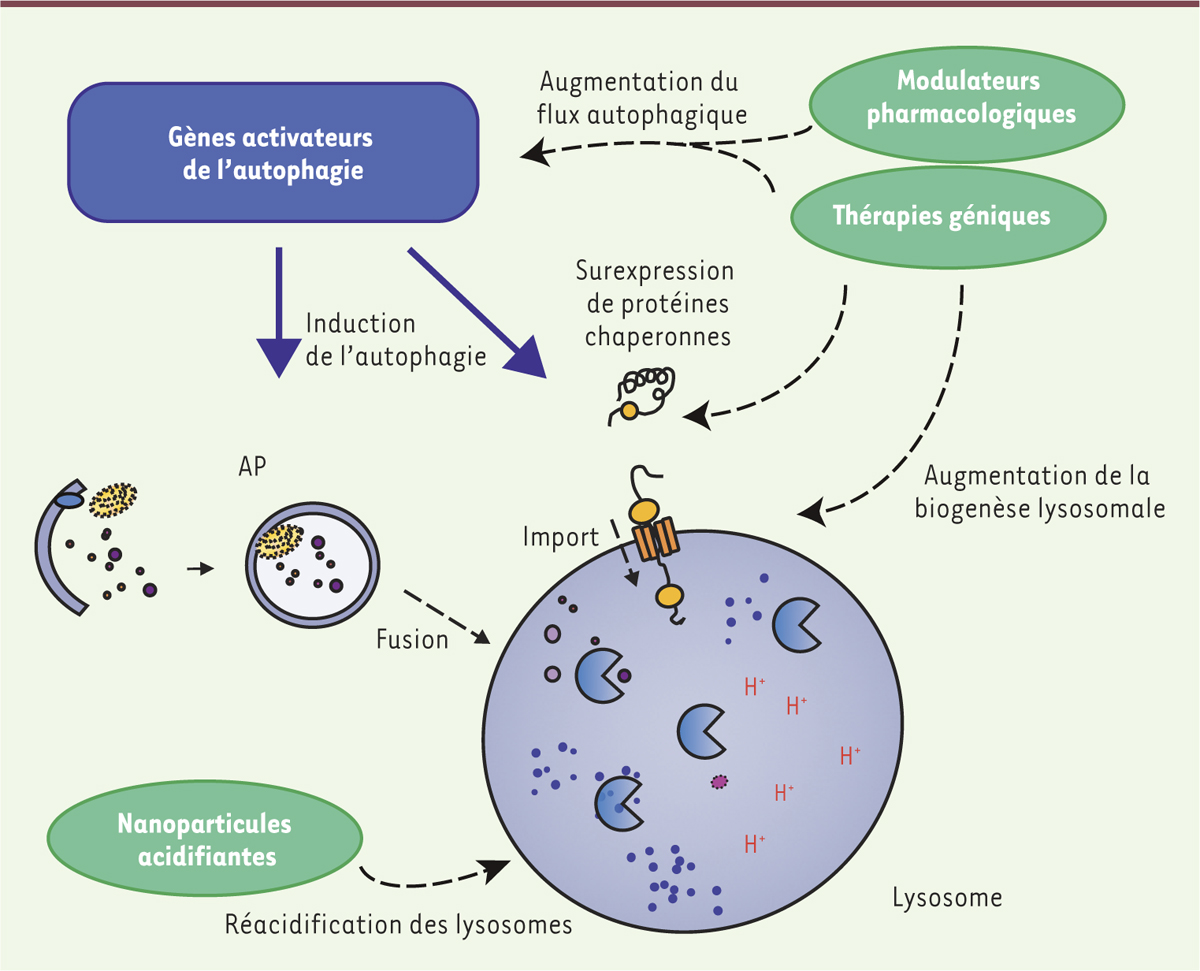
La modulation de l’autophagie comme stratégie thérapeutique Comme nous l’avons vu, les maladies liées au vieillissement comme les maladies neurodégénératives sont associées à un déclin des systèmes de dégradation, notamment le système autophagie-lysosome. La modulation de l’autophagie apparaît donc être une stratégie thérapeutique particulièrement prometteuse (Figure 3). Chez des animaux transgéniques exprimant fortement l’α-synucléine humaine (impliquée dans la maladie de Parkinson), l’augmentation du flux autophagique, ou du flux autophagique combiné à la biogénèse lysosomale, apparaît bénéfique en éliminant les agrégats d’α-synucléine et en protégeant les neurones dopaminergiques [34, 35]. Dans un modèle murin de la maladie de Huntington, la modulation d’une voie particulière de l’autophagie, permettant la dégradation de la protéine huntingtine, s’est avérée bénéfique [36]. L’autophagie possède deux visages : elle permet de déterminer le devenir cellulaire entre survie et mort cellulaire [15, 37]. Dans des modèles d’excitotoxicité, l’inhibition de l’autophagie peut, dans ce contexte particulier, s’avérer bénéfique, suggérant son rôle délétère [15]. Dans un modèle toxique de la maladie de Parkinson, la délétion du gène Atg7 permet de réduire la mort neuronale [38]. Même si ces données suggèrent une possible implication de l’autophagie dans le processus de dégénérescence, il n’existe cependant aujourd’hui pas de preuve d’effets délétères qui soient associés à la modulation de l’autophagie, laissant ouverte la mise sur pied de stratégies thérapeutiques fondées sur cette modulation.
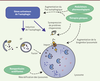 | Figure 3.
Stratégies thérapeutiques fondées sur la modulation de l’autophagie. La modulation du système autophagie-lysosome peut s’exercer à plusieurs niveaux, en régulant l’initiation de l’autophagie, le flux autophagique, l’import de protéines contenant le motif KFERQ aux lysosomes, la fusion des autophagosomes avec le lysosome et la dégradation des composants cellulaires adressés au sein du lysosome en fonction de chaque contexte pathologique. Différentes approches thérapeutiques et méthodologiques peuvent être envisagées, que ce soit sous forme pharmacologique ou par des outils de thérapie génique ou biotechnologiques pour moduler ce processus cellulaire. La surexpression de protéines chaperonnes (e.g. Hsc70), d’acteurs centraux (e.g. TFEB, transcription factor EB), ou l’utilisation d’outils permettant la réacidification de lysosomes déficients (e.g. nanoparticules acidifiantes) ont par exemple validé la pertinence et l’intérêt de cette cible thérapeutique dans le cadre des maladies neurodégénératives. AP : autophagosome. |
Une solution pourrait être de réparer les lysosomes lorsqu’ils sont dysfonctionnels sans moduler les cascades de signalisation complexes impliquées dans l’autophagie. Nous avons récemment démontré l’intérêt d’une approche nano-technologique afin de « soigner » les lysosomes. Dans des cellules isolées de patients atteints de la maladie de Parkinson ou dans un modèle développé chez le rongeur, nous avons montré que des nanoparticules acides avaient la capacité de rétablir le pH acide au sein du lumen de lysosomes dysfonctionnels, une propriété essentielle à leur fonction [39]. Parallèlement, une autre équipe a montré l’intérêt de l’utilisation de ce même type de nanoparticules dans des modèles de maladie d’Alzheimer [40]. La seule restauration de l’activité des lysosomes serait donc suffisante pour limiter le phénomène de dégénérescence dans ces deux pathologies. Les dysfonctions du système autophagie-lysosome peuvent en fonction de chaque contexte pathologique se situer à différents niveaux du processus : un défaut dans l’initiation de l’autophagie, la formation des autophagosomes, la fusion des autophagosomes avec le lysosome, ou le lysosome directement (Figure 2). Ainsi, une stratégie thérapeutique impliquant la modulation de l’autophagie ne sera probablement pas unique pour une maladie. Elle devra tenir compte des types de dysfonctions au cas par cas (Figure 3). L’absence de composés spécifiques à l’autophagie constitue le principal obstacle à la manipulation des processus cellulaires pour le bénéfice des patients. Il y a donc un besoin urgent de développer une nouvelle génération de modulateurs qui soient spécifiques des différentes voies de l’autophagie. Plusieurs composés sont en cours de développement pour des applications contre les maladies neurodégénératives ou les effets du vieillissement [41]. |
L’autophagie est un mécanisme physiologique central permettant la dégradation des protéines et autres constituants cellulaires, qui présente des caractéristiques uniques au système nerveux du fait des propriétés intrinsèques de ce tissu. Le dysfonctionnement de ce processus indispensable a été caractérisé dans l’ensemble des maladies neurodégénératives. Depuis une dizaine d’années, de nombreuses stratégies thérapeutiques fondées sur une modulation de l’autophagie sont apparues dans la recherche préclinique sur les maladies neurodégénératives. Une meilleure compréhension des mécanismes impliqués dans le développement de ces pathologies permettra de comprendre comment moduler finement l’autophagie afin de lutter contre ces maladies. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Cambridge SB, Gnad F, Nguyen C, et al. Systems-wide proteomic analysis in mammalian cells reveals conserved, functional protein turnover . J Proteome Res. 2011; ; 10 : :5275.–5284. 2.
Martinez-Vicente M, Vila M. Alpha-synuclein and protein degradation pathways in Parkinson’s disease: a pathological feed-back loop . Exp Neurol. 2013; ; 247 : :308.–313. 3.
Wong E, Cuervo AM. Autophagy gone awry in neurodegenerative diseases . Nat Neurosci. 2010; ; 13 : :805.–811. 4.
Bourdenx M, Dehay B. What lysosomes actually tell us about Parkinson’s disease? Ageing Res Rev. 2016; ; 32 : :140.–149. 5.
Yamamoto A, Yue Z. Autophagy and its normal and pathogenic states in the brain . Annu Rev Neurosci. 2014; ; 37 : :55.–78. 6.
Magrassi L, Leto K, Rossi F. Lifespan of neurons is uncoupled from organismal lifespan . Proc Natl Acad Sci USA. 2013; ; 110 : :4374.–4379. 7.
Allen NJ, Barres BA. Neuroscience. Glia: more than just brain glue . Nature. 2009; ; 457 : :675.–677. 8.
Pfrieger FW, Reber M. Un nouvel aperçu des mécanismes de la communication neurone-glie . Med Sci (Paris). 2013; ; 29 : :142.–144. 9.
Matthews MR, Raisman G. A light and electron microscopic study of the cellular response to axonal injury in the superior cervical ganglion of the rat . Proc R Soc Lond B Biol Sci. 1972; ; 181 : :43.–79. 10.
Broadwell RD, Cataldo AM. The neuronal endoplasmic reticulum: its cytochemistry and contribution to the endomembrane system. II. Axons and terminals . J Comp Neurol. 1984; ; 230 : :231.–248. 11.
Hernandez D, Torres CA, Setlik W, et al. Regulation of presynaptic neurotransmission by macroautophagy . Neuron. 2012; ; 74 : :277.–284. 12.
Shehata M, Matsumura H, Okubo-Suzuki R, et al. Neuronal stimulation induces autophagy in hippocampal neurons that is involved in AMPA receptor degradation after chemical long-term depression . J Neurosci. 2012; ; 32 : :10413.–10422. 13.
Janen SB, Chaachouay H, Richter-Landsberg C. Autophagy is activated by proteasomal inhibition and involved in aggresome clearance in cultured astrocytes . Glia. 2010; ; 58 : :1766.–1774. 14.
Tydlacka S, Wang CE, Wang X, et al. Differential activities of the ubiquitin-proteasome system in neurons versus glia may account for the preferential accumulation of misfolded proteins in neurons . J Neurosci. 2008; ; 28 : :13285.–13295. 15.
Puyal J, Ginet V, Vaslin A, et al. Les deux visages de l’autophagie dans le système nerveux . Med Sci (Paris). 2009; ; 25 : :383.–390. 16.
Jellinger KA. Recent advances in our understanding of neurodegeneration . J Neural Transm (Vienna). 2009; ; 116 : :1111.–1162. 17.
Levine B, Kroemer G. Autophagy in the pathogenesis of disease . Cell. 2008; ; 132 : :27.–42. 18.
Nixon RA, Wegiel J, Kumar A, et al. Extensive involvement of autophagy in Alzheimer disease: an immuno-electron microscopy study . J Neuropathol Exp Neurol. 2005; ; 64 : :113.–122. 19.
Dehay B, Bove J, Rodriguez-Muela N, et al. Pathogenic lysosomal depletion in Parkinson’s disease . J Neurosci. 2010; ; 30 : :12535.–12544. 20.
Li X, Alafuzoff I, Soininen H, et al. Levels of mTOR and its downstream targets 4E-BP1, eEF2, and eEF2 kinase in relationships with tau in Alzheimer’s disease brain . FEBS J. 2005; ; 272 : :4211.–4220. 21.
Pickford F, Masliah E, Britschgi M, et al. The autophagy-related protein beclin 1 shows reduced expression in early Alzheimer disease and regulates amyloid beta accumulation in mice . J Clin Invest. 2008; ; 118 : :2190.–2199. 22.
Nixon RA. Autophagy, amyloidogenesis and Alzheimer disease . J Cell Sci. 2007; ; 120 : :4081.–4091. 23.
Dehay B, Bourdenx M, Gorry P, et al. Targeting alpha-synuclein for treatment of Parkinson’s disease: mechanistic and therapeutic considerations . Lancet Neurol. 2015; ; 14 : :855.–866. 24.
Cuervo AM, Stefanis L, Fredenburg R, et al. Impaired degradation of mutant alpha-synuclein by chaperone-mediated autophagy . Science. 2004; ; 305 : :1292.–1295. 25.
Wang Y, Martinez-Vicente M, Kruger U, et al. Tau fragmentation, aggregation and clearance: the dual role of lysosomal processing . Hum Mol Genet. 2009; ; 18 : :4153.–4170. 26.
Mattson MP, Magnus T. Ageing and neuronal vulnerability . Nat Rev Neurosci. 2006; ; 7 : :278.–294. 27.
Ben-Zvi A, Miller EA, Morimoto RI. Collapse of proteostasis represents an early molecular event in Caenorhabditis elegans aging . Proc Natl Acad Sci USA. 2009; ; 106 : :14914.–14919. 28.
Cuervo AM, Dice JF. Age-related decline in chaperone-mediated autophagy . J Biol Chem. 2000; ; 275 : :31505.–31513. 29.
Shibata M, Lu T, Furuya T, et al. Regulation of intracellular accumulation of mutant Huntingtin by Beclin 1 . J Biol Chem. 2006; ; 281 : :14474.–14485. 30.
Kaushik S, Cuervo AM. Proteostasis and aging . Nat Med. 2015; ; 21 : :1406.–1415. 31.
Colman RJ, Anderson RM, Johnson SC, et al. Caloric restriction delays disease onset and mortality in rhesus monkeys . Science. 2009; ; 325 : :201.–204. 32.
Collier TJ, Kanaan NM, Kordower JH. Ageing as a primary risk factor for Parkinson’s disease: evidence from studies of non-human primates . Nat Rev Neurosci. 2011; ; 12 : :359.–366. 33.
Bourdenx M, Dovero S, Engeln M, et al. Lack of additive role of ageing in nigrostriatal neurodegeneration triggered by alpha-synuclein overexpression . Acta Neuropathol Commun. 2015; ; 3 : :46.. 34.
Spencer B, Potkar R, Trejo M, et al. Beclin 1 gene transfer activates autophagy and ameliorates the neurodegenerative pathology in alpha-synuclein models of Parkinson’s and Lewy body diseases . J Neurosci. 2009; ; 29 : :13578.–13588. 35.
Decressac M, Mattsson B, Weikop P, et al. TFEB-mediated autophagy rescues midbrain dopamine neurons from alpha-synuclein toxicity . Proc Natl Acad Sci USA. 2013; ; 110 : :E1817.–E1826. 36.
Bauer PO, Goswami A, Wong HK, et al. Harnessing chaperone-mediated autophagy for the selective degradation of mutant huntingtin protein . Nat Biotechnol. 2010; ; 28 : :256.–263. 37.
Eskelinen EL. Doctor Jekyll and Mister Hyde: autophagy can promote both cell survival and cell death . Cell Death Differ. 2005; ; 12 ((suppl 2)) : :1468.–1472. 38.
Niu XY, Huang HJ, Zhang JB, et al. Deletion of autophagy-related gene 7 in dopaminergic neurons prevents their loss induced by MPTP . Neuroscience. 2016; ; 339 : :22.–31. 39.
Bourdenx M, Daniel J, Genin E, et al. Nanoparticles restore lysosomal acidification defects: Implications for Parkinson and other lysosomal-related diseases . Autophagy. 2016; ; 12 : :472.–483. 40.
Lee JH, McBrayer MK, Wolfe DM, et al. Presenilin 1 maintains lysosomal Ca2+ homeostasis via TRPML1 by regulating vATPase-mediated lysosome acidification . Cell Rep. 2015; ; 12 : :1430.–1444. 41.
Ha J, Kim J. Novel pharmacological modulators of autophagy: an updated patent review (2012–2015) . Expert Opin Ther Pat. 2016; ; 26 : :1273.–1289. 42.
Gual P, Gilgenkrantz H, Lotersztajn S. L’autophagie dans les maladies chroniques du foie : un ami qui vous veut (presque) toujours du bien ! . Med Sci (Paris). 2017; ; 33 : :252.–259. 43.
Galluzzi L. Bravo-San Pedro JM, Kroemer G. Autophagie, forme et longévité . Med Sci (Paris). 2017; ; 33 : :246.–251. |