| |
| Med Sci (Paris). 33(3): 305–311. doi: 10.1051/medsci/20173303018.L’autophagie garante de l’immunité et de l’inflammation « Tout est bien, tout va bien, tout va pour le mieux qu’il soit possible * » Pierre Lapaquette,1c Hang Thi Thu Nguyen,2b and Mathias Faure, Contribution équivalente des trois auteurs3a 1Univ. Bourgogne Franche-Comté, AgroSup Dijon, PAM UMR A 02.102, F-21000Dijon, France 2Université Clermont Auvergne, M2iSH, UMR 1071 Inserm/Université d’Auvergne, Clermont-Ferrand, France 3CIRI, Centre international de recherche en infectiologie, équipe autophagie infection immunité, Inserm, U1111, Université Claude Bernard Lyon 1, CNRS, UMR5308, École Normale Supérieure de Lyon, Univ Lyon, 21, avenue Tony Garnier, F-69007, Lyon, France |
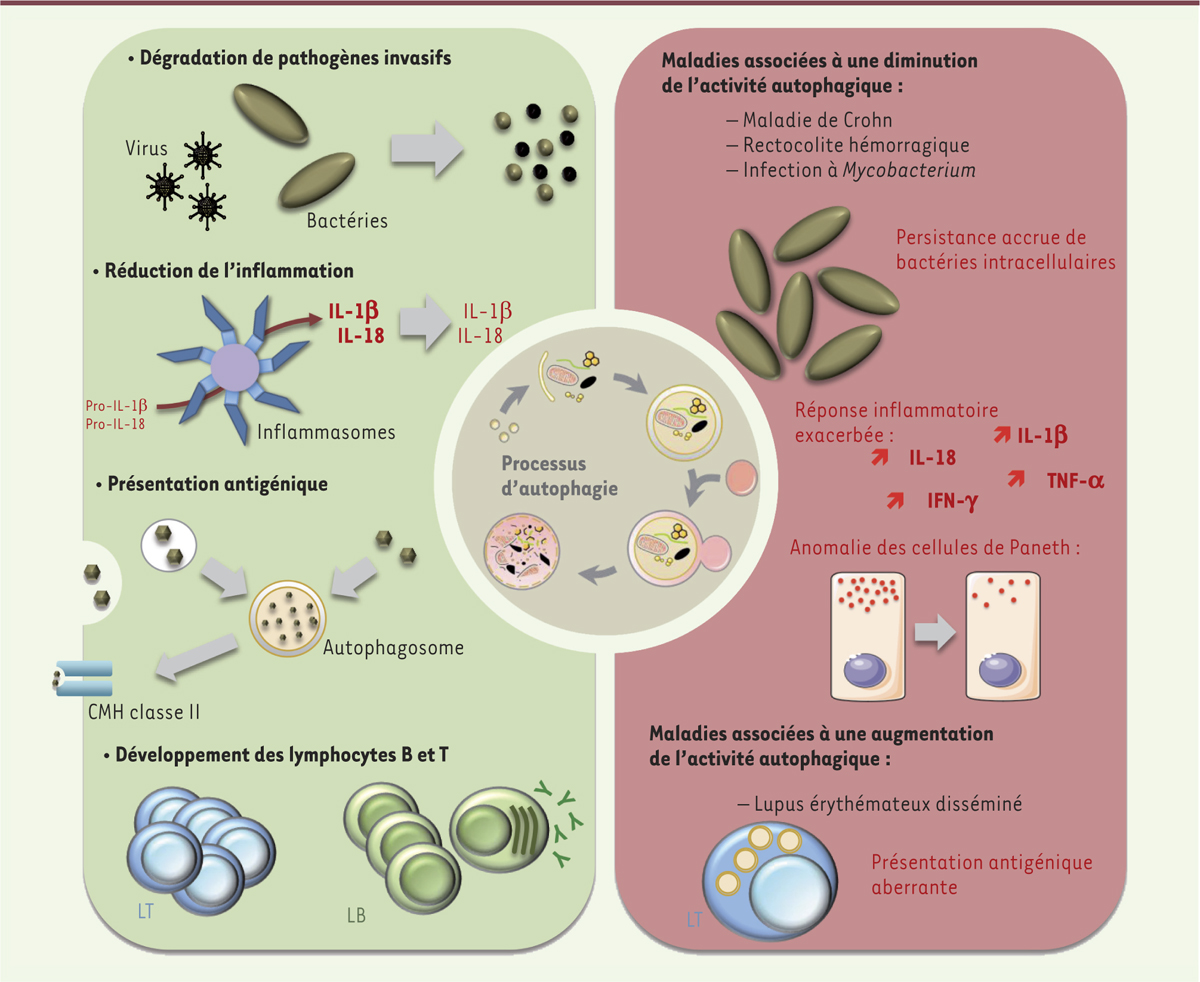
L’immunité innée est une réponse rapide des cellules lorsque l’intégrité de l’organisme est menacée. Les cellules phagocytaires éliminent des éléments délétères ; les cellules infectées produisent des interférons antiviraux de type I (IFN-I) protégeant les cellules voisines ; la réponse inflammatoire (via l’activation du facteur de transcription NF-κB [nuclear factor-kappa B] ou de l’inflammasome) recrute des cellules et des composants solubles protecteurs aux sites altérés. L’immunité adaptative, qui concerne les lymphocytes B et T exprimant un récepteur issu d’un mécanisme de recombinaison génique (respectivement le BCR [B cell receptor] et le TCR [T cell receptor]), est initiée afin de parfaire la réponse innée. Le BCR reconnaît des antigènes natifs, le TCR des peptides présentés par le complexe majeur d’histocompatibilité (CMH). Les peptides présentés par les molécules du CMH de classe I (présentes sur toutes les cellules nucléées) donnent un premier signal aux lymphocytes T CD8 (cytotoxiques), indispensable à leur activation. Ceux présentés par les molécules de classe II (exprimées sur les cellules présentatrices d’antigènes et les cellules épithéliales thymiques) donnent un premier signal aux lymphocytes T CD4 (auxiliaires ou helper). La mémoire de l’immunité adaptative protège l’organisme face à de nouvelles expositions à des éléments déjà rencontrés. L’autophagie, qui est elle-même une réponse cellulaire contre des altérations cytosoliques, joue un rôle majeur dans l’immunité (Figure 1). Il est dès lors peu surprenant que des dysfonctionnements de ce processus mènent à des pathologies liées à des défauts ou des excès d’immunité.
 | Figure 1.
Rôle de l’autophagie dans l’immunité et conséquences physiopathologiques. L’autophagie assure de nombreux rôles dans l’immunité (cadre vert). Ce processus permet notamment la dégradation des pathogènes invasifs (bactéries et virus), la modulation des réponses inflammatoires, la présentation antigénique, ou bien encore la différenciation, la prolifération et la survie des lymphocytes. Des altérations de l’autophagie contribuent à la survenue et la progression de pathologies en lien avec l’immunité (cadre rouge). Une diminution de l’activité autophagique des cellules conduit à une persistance accrue de pathogènes invasifs, une réponse inflammatoire exacerbée en réponse à des composants microbiens ou bien encore une anomalie de granulation des cellules de Paneth, responsables de la sécrétion de peptides antimicrobiens. À l’inverse, une activité autophagie non contrôlée peut conduire à une présentation antigénique aberrante, contribuant au développement de maladies auto-immunes. CMH : complexe majeur d’histocompatibilité ; LB/LT : lymphocyte B/T ; IL : interleukine ; IFN-γ : interféron gamma ; TNF-α : tumor necrosis factor alpha. |
|
« Tout est bien » : l’autophagie, rhéostat de l’immunité et de l’inflammation L’autophagie, un mécanisme de protection intrinsèque à la cellule Dans les cellules, l’autophagie joue un rôle protecteur direct contre les microorganismes (MO) pathogènes invasifs. Au même titre que des organites endommagés de la cellule, des virus, des bactéries, des eucaryotes unicellulaires pathogènes, ou des composants microbiens (toxines bactériennes par exemple) peuvent être capturés dans des autophagosomes puis dégradés par fusion avec les lysosomes [ 1] ( →).
(→) Voir la Synthèse de P.E. Joubert et al., m/s n° 1, janvier 2011, page 41
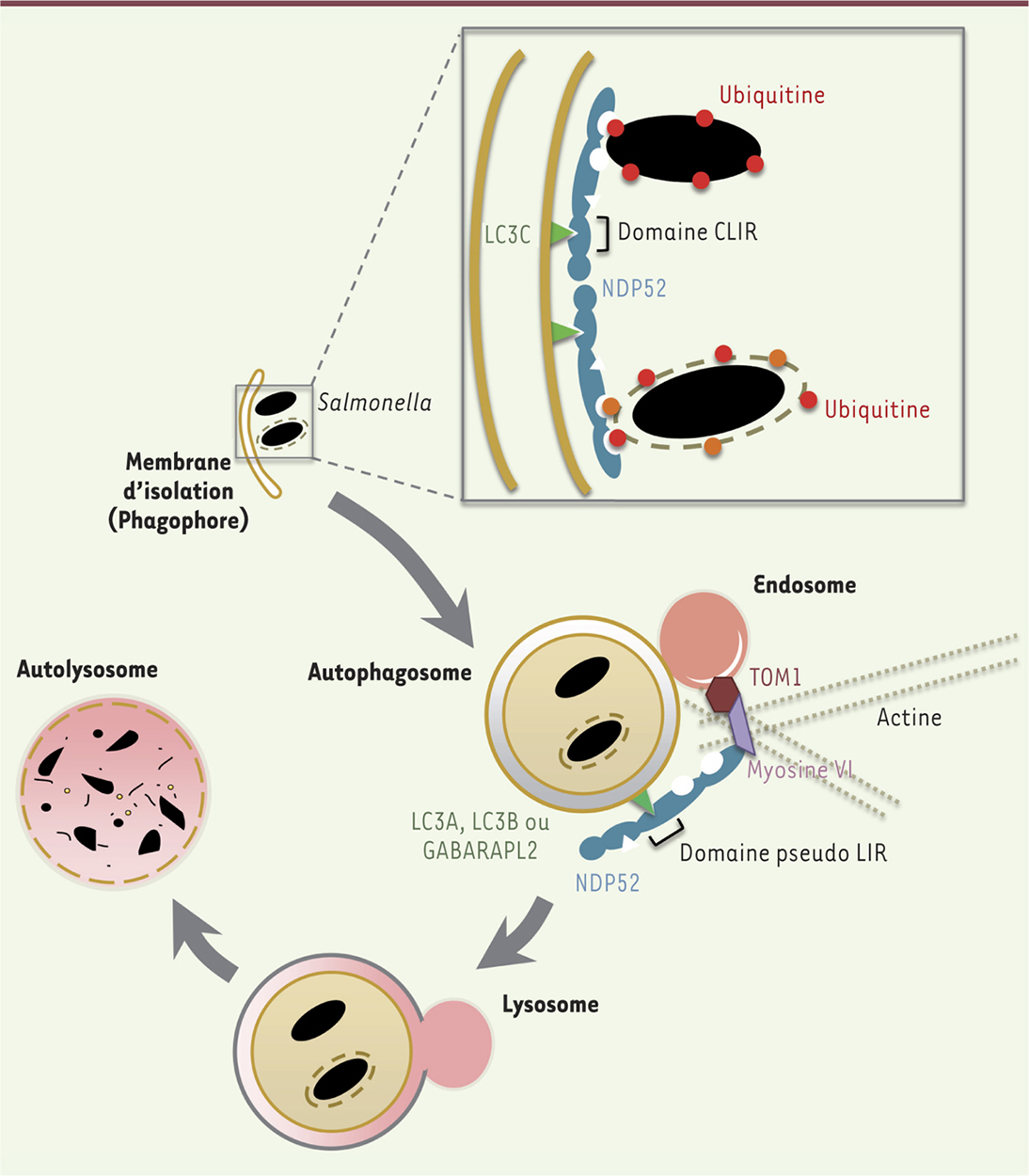
Cette forme d’autophagie sélective est appelée xénophagie. Afin de capturer le MO dans un autophagosome, la cellule doit acheminer, au contact de celui-ci, une structure pré-autophagosomale. Ce ciblage fait intervenir des protéines adaptatrices capables d’une part de détecter le MO et d’autre part de recruter la machinerie d’autophagie [2]. Différents mécanismes de détection existent selon le pathogène considéré. Le principal repose sur l’accumulation d’ubiquitine à la surface des bactéries, des virus, ou des vacuoles d’endocytose qui les contiennent. Des enzymes à activité ubiquitine E3 ligase, comme LRSAM1 (leucine-rich repeat and sterile alpha motif containing 1), Parkin et SMURF1 (Smad ubiquitination regulatory factor-1) [3], sont responsables de la liaison des peptides ubiquitine à la surface du pathogène. La présence d’ubiquitine permet ensuite le recrutement de protéines adaptatrices, aussi appelées récepteurs d’autophagie, qui se lient à l’ubiquitine via des domaines UBA (ubiquitin-associated) ou UBZ (ubiquitin-binding zinc finger), et recrutent la machinerie d’autophagie via des domaines LIR (LC3 [microtubule-associated protein 1A/1B-light chain 3 ]-interacting region). À ce jour, 4 protéines adaptatrices, dédiées à la xénophagie, ont été décrites : p62, Optineurine, NDP52 (nuclear domain 10 protein 52) et T6BP (TRAF6-binding protein) [2]. Des mécanismes de ciblage indépendants de la présence d’ubiquitine existent également. Un système fait intervenir les protéines NOD(nucleotide-binding oligomerization domain-containing protein)1 et NOD2 qui détectent le peptidoglycane de la paroi des bactéries et sont capables de recruter la machinerie d’autophagie via la protéine ATG16L1 [4]. Un autre système implique la galectine 8 qui reconnaît les vacuoles d’endocytose endommagées par des bactéries pathogènes (Salmonella) et recrute le récepteur d’autophagie NDP52 [5] qui, en plus de cibler les bactéries vers l’autophagosome, facilite leur dégradation en régulant l’étape de fusion de l’autophagosome avec la voie endo-lysosomale (Figure 2) [2]. Le DAG (diacylglycérol) peut également s’accumuler à la surface de vacuoles contenant la bactérie Salmonella et conduire au ciblage par la xénophagie [3].
 | Figure 2.
Régulation de la xénophagie par NDP52. Le récepteur autophagique NDP52 ( nuclear domain 10 protein 52) peut lier des bactéries intracellulaires soit via la reconnaissance d’ubiquitine les recouvrant, soit via la galectine 8 liant elle-même des vésicules endommagées par la bactérie. NDP52 cible alors le pathogène vers un autophagosome en formation grâce à sa liaison à un membre unique de la famille des protéines LC3 ( microtubule-associated protein 1A/1B-light chain 3), LC3C. Afin de faciliter la dégradation du microorganisme, NDP52 régule ensuite l’étape de fusion entre l’autophagosome et le lysosome en liant d’une part la myosine VI associée à la voie endolysosomale, et d’autre part d’autres membres de la famille des protéines LC3, comme LC3A et LC3B (d’après [ 2, 51]). CLIR : LC3C [ microtubule-associated protein 1A/1B-light chain 3C] interacting region ; LIR : LC3 [ microtubule-associated protein 1A/1B-light chain 3]- interacting region ; TOM1 : target of myb1 ; GABARAPL2 : GABA type A receptor-associated protein-like 2. |
En amont du ciblage des MO pathogènes par un phagophore [52] (→), il est nécessaire que le processus d’autophagie soit induit dans la cellule infectée afin de générer les membranes pré-autophagosomales. Les réseaux de régulation contrôlant l’activation de l’autophagie sont capables d’intégrer de nombreux signaux en lien avec l’infection, que ce soit les MO eux-mêmes, ou des messagers de l’inflammation qui sont générés durant l’infection [6]. Chaque type cellulaire exprime un répertoire différent de récepteurs aptes à détecter les motifs microbiens. Parmi ceux-ci, les Toll-like receptors (TLR) initient l’autophagie après fixation de ligands microbiens comme le lipopolysaccharide (LPS) des bactéries qui se lie au TLR4, ou des composants de la paroi des champignons, comme le zymosan, reconnus par TLR2 ou la Dectin-1, un CLR (C-type lectin receptor) spécifique des motifs glycaniques [6]. Des acides nucléiques viraux induisent également l’autophagie par leur liaison aux TLR7 et 9. L’autophagie peut être également directement initiée par les MO par le stress qu’ils génèrent dans la cellule infectée. C’est le cas des bactéries Salmonella et Shigella qui induisent un stress métabolique (privation en acide aminé) lors de l’infection, avec pour conséquence une inhibition de la kinase mTOR (mammalian target of rapamycin), une protéine inhibitrice majeure de l’autophagie [7]. L’infection des cellules peut également être à l’origine d’un stress oxydant, d’un stress du réticulum endoplasmique ou encore de dommages membranaires, l’ensemble de ces stress contribuant à l’induction de la réponse autophagique dans les cellules. Enfin, des cytokines pro-inflammatoires produites lors de l’infection (IL[interleukine]-6, TNF[tumor necrosis factor]-α) ont un effet stimulant sur l’autophagie [6].
(→) Voir la Nouvelle de E. Morel, page 217 de ce numéro
Régulation mutuelle entre autophagie et immunité innée, inflammasomes, IFN-I et NF-kB Les inflammasomes sont des complexes multiprotéiques qui activent la caspase-1 nécessaire à la maturation des cytokines pro-inflammatoires IL-1β et IL-18. Une étude pionnière faisant appel à un modèle murin d’inflammation intestinale a montré que l’autophagie limitait l’activation des inflammasomes [ 8]. En contrôlant la production de dérivés oxygénés mitochondriaux et d’ADN mitochondrial cytosolique, l’autophagie empêche en effet une activation exacerbée de l’inflammasome NLRP3 ( NOD-like receptor [NLR] family, pyrin domain containing 3) qui pourrait être à l’origine de dommages cellulaires [ 9]. La machinerie autophagique peut également dégrader directement certains composants de l’inflammasome, comme NLRP3 et AIM2 ( absent in melanoma 2) [ 10, 11]. Inversement, l’inflammasome régule l’autophagie. En effet, l’infection par Shigella flexneri active l’inflammasome NLRC4 ( NLR family card domain containing 4) supprimant ainsi la formation d’autophagosomes de novo [ 12]. Une exception à l’effet suppresseur de l’inflammasome concerne la stimulation de l’autophagie dans les cellules épithéliales intestinales caliciformes par l’inflammasome NLRP6 qui favorise l’exocytose de mucus [ 13]. Plusieurs études rapportent une relation étroite et mutuelle entre autophagie et IFN-I, des cytokines aux fonctions antivirales puissantes. Ainsi, l’autophagie promeut la production d’IFN-I par les cellules dendritiques (CD) plasmacytoïdes à la suite d’infections virales [14]. Mais elle peut également inhiber la production d’IFN-I. Ainsi, dans des cellules déficientes en ATG5 (donc défectueuses en autophagie), l’accumulation d’espèces oxygénées réactives résultant de mitochondries défectueuses amplifie la signalisation du récepteur RIG-I1 (retinoic acid-inducible gene I), augmentant la production d’IFN-I et la résistance à l’infection virale [15]. Certains facteurs autophagiques inhibent directement l’activation de production d’IFN-I comme le complexe ATG5-ATG12 via son interaction directe avec RIG-I et son adaptateur IPS-I (interferon-beta promoter stimulator I) [16]. De même, ATG9 bloque l’assemblage de STING (stimulator of IFN genes) avec TBK1 (TANK-binding kinase 1)2 empêchant ainsi la production d’IFN-I en réponse à la présence d’ADN double brin dans le cytosol de la cellule [17]. Enfin, en interagissant avec la cGAMP (cyclic guanosine monophosphate- adenosine monophosphate) synthase cGAS, Beclin-1 (ou ATG6) inhibe l’IFN-I en réponse à de l’ADN viral [18]. L’autophagie régule également l’activation du facteur de transcription NF-κB responsable de la synthèse de plusieurs cytokines inflammatoires. Ainsi Rubicon, un régulateur négatif de Beclin-1, dissocie le complexe signalosome CARD (caspase recruitment domain family)/BCL10 (B-cell lymphoma/leukemia 10)/MALT1(mucosa-associated lymphoid tissue 1), qui transmet la signalisation entre les récepteurs couplés aux protéines G et NF-κB, sans que cela n’affecte la répression qu’il exerce sur la maturation des autophagosomes [19]. L’autophagie peut également dégrader sélectivement BCL10 et ainsi diminuer l’activation de NF-κB, comme cela fut montré dans le cadre de l’activation de lymphocytes T [20]. Des mécanismes similaires ont été également rapportés au cours d’infections virales avec la dégradation ciblée, par l’autophagie, de NEMO (NF-kB essential modifier), la sous-unité régulatrice du complexe IKK (IkB kinase) [21]. Enfin, le récepteur autophagique NDP52 contribue à la dégradation sélective des adaptateurs des TLR, TRAF6 (TNF receptor-associated factor 6) et TRIF (TIR-domain-containing adapter-inducing interferon-β), atténuant ainsi l’activation de NF-κB induite par ces récepteurs [22]. La littérature nous montre donc qu’il existe une relation mutuelle entre autophagie et immunité innée qui peut être spécifique de tissus, de types cellulaires, et dépendre du contexte environnemental. Cette régulation pourrait représenter une boucle de rétrocontrôle par laquelle l’autophagie empêcherait l’installation d’une réponse immunitaire chronique exacerbée, délétère pour l’intégrité de l’organisme. Régulation de l’immunité adaptative par l’autophagie Les expériences fondées sur des modèles de déficiences génétiques en autophagie ont permis de démontrer l’importance de ce processus dans l’homéostasie des lymphocytes B et T : bien que la différenciation des lymphocytes T CD4 et T CD8, ainsi que leur rapport T4/T8, ne soient pas modifiés par ces altérations, leur survie et leur nombre dans le thymus et en périphérie sont fortement diminués, tout comme celui du nombre de lymphocytes B périphériques [ 23]. L’élimination d’organites et/ou de certaines protéines pro-apototiques via l’autophagie semble nécessaire au développement des lymphocytes T, probablement en limitant leur mort prématurée [ 23]. Un défaut de développement de ces compartiments lymphocytaires est par ailleurs possible, en particulier pour les lymphocytes B, dans la moelle osseuse [ 24]. La nature des cargos ciblés et dégradés par l’autophagie semble directement liée à l’état d’activation du lymphocyte, ce qui permet à la cellule d’adapter son métabolisme à ses besoins [25]. Pour les lymphocytes T CD8, la régulation du métabolisme est nécessaire au développement d’une réponse mémoire efficace. In vivo, l’induction d’autophagie apparaît en effet importante lors de la phase de contraction de la réponse immune, c’est-à-dire lorsque les cellules T CD8 cessent de se diviser et que l’agent infectieux est éliminé ; cette autophagie nécessaire à la survie cellulaire permet la génération d’un pool optimal de cellules mémoire, en adaptant le métabolisme cellulaire [26]. L’autophagie est également fondamentale pour la survie des plasmocytes (les cellules B différenciées effectrices) et leur sécrétion efficace d’anticorps [27], ainsi que pour l’établissement d’un pool de cellules B mémoires via des mécanismes qui pourraient rejoindre ceux liés à la mémoire T [28]. L’activation même des cellules T matures, via le TCR, ou la présence de cytokines sont également des facteurs d’induction d’autophagie contribuant à l’activation de la cellule [25]. Dans les cellules B, la signalisation liée à l’engagement du BCR peut conduire ce récepteur vers la machinerie autophagique, optimisant ainsi l’activation de la cellule [29]. Cependant, le rôle de l’autophagie dans la cellule B lors de son activation reste peu documenté, avec des données parfois contradictoires. L’autophagie apparaît aussi essentielle à la fonction des cellules T régulatrices, garantes de l’homéostasie immunitaire [30]. De plus, une autre forme d’autophagie impliquant des protéines chaperonnes, la CMA (chaperone-mediated autophagy), pourrait également contribuer à l’activation et aux fonctions des lymphocytes T [31]. Une voie par laquelle l’autophagie peut moduler conjointement les lymphocytes B et T est liée à sa contribution dans la présentation antigénique par le CMH. Les cellules B présentent en effet elles-mêmes des complexes CMH-peptide pour l’activation des cellules T CD4 qui, en retour, activent la prolifération et la différenciation des cellules B. Or, la sélection et l’activation des cellules T dépend de leur capacité de reconnaître, via leurs TCR, des complexes CMH-peptide dont la composition est partiellement sous le contrôle du catabolisme autophagique. L’autophagie contribue ainsi à échantillonner des peptides appartenant à des protéines de l’organisme hôte (peptide du soi) sur les molécules du CMH-II [32]. L’importance de ce processus impliquant des peptides du soi en périphérie reste à clarifier. Cependant, cette fonction semble essentielle lors de l’éducation thymique, durant laquelle les thymocytes (précurseurs des lymphocytes T) sont testés pour leurs capacités à (1) reconnaître le CMH de l’hôte (c’est la restriction au CMH lors de la sélection positive), tout en (2) éliminant les cellules avec un TCR de trop forte affinité pour un complexe CMH-peptide du soi (limitant le passage en périphérie de lymphocytes T autoréactifs, lors de la sélection négative). L’autophagie joue là un rôle essentiel en favorisant la présentation de complexes CMH-II-peptide du soi sur les cellules épithéliales thymiques, permettant d’accroître le répertoire lymphocytaire T [33]. La place de l’autophagie dans la présentation d’antigène est importante lors d’infections. Elle contribue à la présentation des peptides microbiens, ce qui permet d’envisager l’amélioration de vaccins par accentuation de l’autophagie [34]. L’autophagie pourrait également contribuer à la présentation d’antigènes particuliers, comme les antigènes citrunilés, augmentant encore le répertoire antigénique pour le CMH [35]. Il est à souligner que la voie autophagique peut également être sollicitée pour la présentation de peptides d’origine exogène par le CMH-II [36]. D’autres formes d’autophagie pourraient aussi participer à la présentation d’antigènes peptidiques comme c’est possiblement le cas pour la CMA [37] et des processus impliquant des protéines autophagiques, indépendamment de la formation d’autophagosomes, comme la phagocytose LAP (LC3-associated phagocytosis), qui favorisent la présentation d’antigènes microbiens [38]. Enfin, l’autophagie pourrait indirectement orienter la présentation croisée d’antigènes, c’est-à-dire la présentation d’antigènes exogènes sur le CMH-I [39]. |
« Tout (n’)est (pas si) bien » : du défaut d’autophagie aux pathologies inflammatoires L’autophagie jouant un rôle essentiel dans le maintien de l’homéostasie cellulaire et la modulation de réponses inflammatoires, son dysfonctionnement est associé à de nombreuses maladies inflammatoires (Figure 1) dont la mieux documentée est la maladie de Crohn (MC). L’implication de l’autophagie dans cette pathologie a été mise en avant par des études de séquençage à haut débit du génome de patients, montrant un risque exacerbé de développer la maladie chez les sujets présentant des polymorphismes ponctuels (SNP, pour single nucleotide polymorphism) au sein de régions codantes pour des gènes autophagiques, en particulier ATG16L1, IRGM (immunity-related GTPase M), PTPN2 (protein tyrosine phosphatase, non-receptor type 2), LRRK2 (leucine-rich repeat kinase 2) et ULK1 (unc-51-like autophagy activating kinase 1). Depuis, d’autres gènes ont été ajoutés à cette liste, comme NDP52, renforçant l’idée d’un rôle de l’autophagie dans le développement de la MC [6, 40, 53] (→).
(→) Voir la Synthèse de C. Trentesaux et al., page 290 de ce numéro
Les principaux travaux ont porté sur le variant à risque de MC T300A d’ATG16L1 (ATG16L1/T300A) qui résulte en une autophagie défectueuse à l’encontre de MO et un déséquilibre important de production de cytokines. Dans les cellules épithéliales humaines, ce variant conduit à un défaut d’élimination par autophagie de bactéries comme les Escherichia coli adhérentes et invasives associées à la MC (AIEC pour adherent-invasive E. coli) [41]. Les cellules de Paneth des patients porteurs de ce polymorphisme présentent une persistance accrue de ces bactéries [42]. Leurs cellules dendritiques ont également un défaut d’autophagie conduisant à une perte d’activité bactéricide et une altération de la présentation d’antigènes [43]. Des lymphoblastes humains immortalisés de donneurs homozygotes pour ce variant montrent également un défaut d’induction d’autophagie en réponse à des composants bactériens comme le muramyl dipeptide (MDP) ou le peptidoglycane de bactéries à Gram positif [4]. Des défauts similaires, dont la présence de structures aberrantes dans les cellules de Paneth, ont été retrouvés chez des souris hypomorphes pour l’expression d’ATG16L1 (Atg16l1HM) [44] et dans un modèle murin exprimant le variant ATG16L1/T300A [45]. Les macrophages déficients en ATG16L1 produisent de forts taux d’IL1-β et d’IL-18, après stimulation avec du lipopolysaccharide [8], ce que l’on retrouve également à partir de cellules de Paneth de souris Atg16l1HM [44]. Enfin, les cellules dendritiques de patients jeunes atteints de MC et porteurs du variant T300A présentent un défaut d’échantillonnage bactérien, de présentation antigénique et d’interaction avec l’épithélium intestinal [46]. La mutation T300A apporte à la protéine ATG16L1 un site de clivage pour la caspase 3. Lors de différents stress cellulaires, comme une carence nutritive, l’activation de récepteurs de mort par le TNF-α (tumor necrosis factor alpha), ou une infection par la bactérie intestinale Yersinia enterocolitica, la protéine variante est dégradée et sa fonction autophagique abolie [47]. En augmentant les niveaux des microARN 30c et 130a qui ciblent l’ARNm d’ATG16L1, les AIEC peuvent également altérer l’expression de la protéine inhibant ainsi la xénophagie [48]. L’autophagie pourrait ainsi être altérée par ce mécanisme chez des patients qui ne présentent pas le variant à risque. Le premier facteur génétique identifié à risque dans la MC, NOD2, induit l’autophagie en réponse à son ligand, le MDP [4, 43]. La mutation de NOD2 associée à la MC (L1007fsinsC) empêche le recrutement d’ATG16L1 à la membrane plasmique au lieu de l’entrée bactérienne entraînant un défaut de formation des autophagosomes et une perte de l’effet bactéricide lié à l’autophagie [4]. L’activation de NOD2 par le MDP induit l’autophagie favorisant ainsi une présentation d’antigène par les molécules du CMH-II qui est défectueuse chez les patients porteurs des variants ATG16L1/T300A ou NOD2/L1007fsinsC [43]. L’interaction entre ces 2 gènes de susceptibilité à la MC, NOD2 et ATG16L1, renforce la démonstration de l’importance de l’autophagie dans la pathogenèse de cette maladie. La mutation silencieuse du gène d’autophagie IRGM (c.313C>T) abolit la reconnaissance de l’ARNm d’IRGM par la famille des microARN-196, ce qui perturbe son expression et affecte le contrôle de la réplication intracellulaire des AIEC par autophagie [49]. L’association entre granulomes, l’une des caractéristiques macroscopiques de la MC, et variants des gènes autophagiques ATG4A, ATG2A, FNBP1L (forming-binding protein 1 like), et ATG4D a aussi été décrite [50]. Toutefois, la pertinence fonctionnelle de ces variants et d’autres variants autophagiques (ULK1, LRRK2, PTPN2 et NDP52) reste à caractérisrer. De nombreux individus sains sont porteurs de variants autophagiques associés à la MC. Ils ne développent pas pour autant la pathologie suggérant que ces seules mutations ne sont pas suffisantes pour induire la maladie. L’implication d’autres facteurs de risques, et leur association aux variants, nécessitent d’être appréhendées, de même que celles d’autres facteurs étiologiques de la MC comme le microbiote intestinal, la réponse immunitaire et certains contextes environnementaux fondamentaux pour comprendre les conditions requises au développement de la maladie. D’autres pathologies inflammatoires sont également associées à des altérations du contrôle de l’autophagie notamment dans le cadre de maladies auto-immunes comme le lupus érythémateux systémique [54] (→).
(→) Voir la Synthèse de S. Muller, page 319 de ce numéro
|
L’autophagie est un mécanisme essentiel de l’homéostasie à l’échelle cellulaire. L’immunité est un processus fondamental de l’homéostasie à l’échelle de l’organisme. La régulation de l’un par l’autre fait régulièrement l’objet de démonstrations scientifiques et l’on peut rester optimiste sur les découvertes futures contribuant à renforcer nos connaissances sur les mécanismes de régulation sous-jacents. Nous pouvons également être optimiste sur le potentiel à moduler/réparer des défaillances autophagiques afin de rétablir des équilibres immunitaires satisfaisants dans le cadre notamment d’immunopathologies chroniques. Mais le chemin est encore long, l’immunité étant une réponse complexe, intégrée et dynamique : l’étude et la manipulation possible de l’autophagie dans ces réponses doit donc s’intégrer dans cette dynamique. Aux lumières de Voltaire, il faut plus que jamais cultiver notre connaissance pour jouir un jour prochain du potentiel de l’autophagie pour le mieux qu’il soit possible. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Joubert PE, Pombo Gregoire I, et al. Autophagie et pathogènes : « Bon appétit Messieurs ! » . Med Sci (Paris). 2011; ; 27 : :41.–47. 2.
Verlhac P, Gregoire IP, Azocar O, et al. Autophagy receptor NDP52 regulates pathogen-containing autophagosome maturation . Cell Host Microbe. 2015; ; 17 : :515.–525. 3.
Sorbara MT, Girardin SE. Emerging themes in bacterial autophagy . Curr Opin Microbiol. 2015; ; 23 : :163.–170. 4.
Travassos LH, Carneiro LA, Ramjeet M, et al. Nod1 and Nod2 direct autophagy by recruiting ATG16L1 to the plasma membrane at the site of bacterial entry . Nat Immunol. 2010; ; 11 : :55.–62. 5.
Thurston TL, Wandel MP, von Muhlinen N, et al. Galectin 8 targets damaged vesicles for autophagy to defend cells against bacterial invasion . Nature. 2012; ; 482 : :414.–418. 6.
Lapaquette P, Guzzo J, Bretillon L, Bringer MA. Cellular and molecular connections between autophagy and inflammation . Mediators Inflamm. 2015; ; 2015 : :398483.. 7.
Tattoli I, Sorbara MT, Vuckovic D, et al. Amino acid starvation induced by invasive bacterial pathogens triggers an innate host defense program . Cell Host Microbe. 2012; ; 11 : :563.–575. 8.
Saitoh T, Fujita N, Jang MH, et al. Loss of the autophagy protein Atg16L1 enhances endotoxin-induced IL-1beta production . Nature. 2008; ; 456 : :264.–268. 9.
Nakahira K, Haspel JA, Rathinam VA, et al. Autophagy proteins regulate innate immune responses by inhibiting the release of mitochondrial DNA mediated by the NALP3 inflammasome . Nat Immunol. 2011; ; 12 : :222.–230. 10.
Chuang SY, Yang CH, Chou CC, et al. TLR-induced PAI-2 expression suppresses IL-1beta processing via increasing autophagy and NLRP3 degradation . Proc Natl Acad Sci USA. 2013; ; 110 : :16079.–16084. 11.
Shi CS, Shenderov K, Huang NN, et al. Activation of autophagy by inflammatory signals limits IL-1beta production by targeting ubiquitinated inflammasomes for destruction . Nat Immunol. 2012; ; 13 : :255.–263. 12.
Suzuki T, Franchi L, Toma C, et al. Differential regulation of caspase-1 activation, pyroptosis, and autophagy via Ipaf and ASC in Shigella-infected macrophages . PLoS Pathog. 2007; ; 3 : :e111.. 13.
Wlodarska M, Thaiss CA, Nowarski R, et al. NLRP6 inflammasome orchestrates the colonic host-microbial interface by regulating goblet cell mucus secretion . Cell. 2014; ; 156 : :1045.–1059. 14.
Zhou D, Kang KH, Spector SA. Production of interferon alpha by human immunodeficiency virus type 1 in human plasmacytoid dendritic cells is dependent on induction of autophagy . J Infect dis. 2012; ; 205 : :1258.–1267. 15.
Tal MC, Sasai M, Lee HK, et al. Absence of autophagy results in reactive oxygen species-dependent amplification of RLR signaling . Proc Natl Acad Sci USA. 2009; ; 106 : :2770.–2775. 16.
Jounai N, Takeshita F, Kobiyama K, et al. The Atg5 Atg12 conjugate associates with innate antiviral immune responses . Proc Natl Acad Sci USA. 2007; ; 104 : :14050.–14055. 17.
Saitoh T, Fujita N, Hayashi T, et al. Atg9a controls dsDNA-driven dynamic translocation of STING and the innate immune response . Proc Natl Acad Sci USA. 2009; ; 106 : :20842.–20846. 18.
Liang Q, Seo GJ, Choi YJ, et al. Crosstalk between the cGAS DNA sensor and Beclin-1 autophagy protein shapes innate antimicrobial immune responses . Cell Host Microbe. 2014; ; 15 : :228.–238. 19.
Yang CS, Rodgers M, Min CK, et al. The autophagy regulator Rubicon is a feedback inhibitor of CARD9-mediated host innate immunity . Cell Host Microbe. 2012; ; 11 : :277.–289. 20.
Paul S, Kashyap AK, Jia W, et al. Selective autophagy of the adaptor protein Bcl10 modulates T cell receptor activation of NF-kappaB . Immunity. 2012; ; 36 : :947.–958. 21.
Fliss PM, Jowers TP, Brinkmann MM, et al. Viral mediated redirection of NEMO/IKKgamma to autophagosomes curtails the inflammatory cascade . PLoS Pathog. 2012; ; 8 : :e1002517.. 22.
Inomata M, Niida S, Shibata K, Into T. Regulation of Toll-like receptor signaling by NDP52-mediated selective autophagy is normally inactivated by A20 . Cell Mol Life Sci. 2012; ; 69 : :963.–979. 23.
Kovacs JR, Li C, Yang Q, et al. Autophagy promotes T-cell survival through degradation of proteins of the cell death machinery . Cell Death Differ. 2012; ; 19 : :144.–152. 24.
Miller BC, Zhao Z, Stephenson LM, et al. The autophagy gene ATG5 plays an essential role in B lymphocyte development . Autophagy. 2008; ; 4 : :309.–314. 25.
Hubbard VM, Valdor R, Patel B, et al. Macroautophagy regulates energy metabolism during effector T cell activation . J Immunol. 2010; ; 185 : :7349.–7357. 26.
Xu X, Araki K, Li S, et al. Autophagy is essential for effector CD8+ T cell survival and memory formation . Nat Immunol. 2014; ; 15 : :1152.–1161. 27.
Pengo N, Scolari M, Oliva L, et al. Plasma cells require autophagy for sustainable immunoglobulin production . Nat Immunol. 2013; ; 14 : :298.–305. 28.
Chen M, Hong MJ, Sun H, et al. Essential role for autophagy in the maintenance of immunological memory against influenza infection . Nat Med. 2014; ; 20 : :503.–510. 29.
Chaturvedi A, Dorward D, Pierce SK. The B cell receptor governs the subcellular location of Toll-like receptor 9 leading to hyperresponses to DNA-containing antigens . Immunity. 2008; ; 28 : :799.–809. 30.
Wei J, Long L, Yang K, et al. Autophagy enforces functional integrity of regulatory T cells by coupling environmental cues and metabolic homeostasis . Nat Immunol. 2016; ; 17 : :277.–285. 31.
Valdor R, Mocholi E, Botbol Y, et al. Chaperone-mediated autophagy regulates T cell responses through targeted degradation of negative regulators of T cell activation . Nat Immunol. 2014; ; 15 : :1046.–1054. 32.
Dengjel J, Schoor O, Fischer R, et al. Autophagy promotes MHC class II presentation of peptides from intracellular source proteins . Proc Natl Acad Sci USA. 2005; ; 102 : :7922.–7927. 33.
Nedjic J, Aichinger M, Emmerich J, et al. Autophagy in thymic epithelium shapes the T-cell repertoire and is essential for tolerance . Nature. 2008; ; 455 : :396.–400. 34.
Jagannath C, Lindsey DR, Dhandayuthapani S, et al. Autophagy enhances the efficacy of BCG vaccine by increasing peptide presentation in mouse dendritic cells . Nat Med. 2009; ; 15 : :267.–276. 35.
Ireland JM, Unanue ER. Autophagy in antigen-presenting cells results in presentation of citrullinated peptides to CD4 T cells . J Exp Med. 2011; ; 208 : :2625.–2632. 36.
Brooks CR, Yeung MY, Brooks YS, et al. KIM-1-/TIM-1-mediated phagocytosis links ATG5-/ULK1-dependent clearance of apoptotic cells to antigen presentation . EMBO J. 2015; ; 34 : :2441.–2464. 37.
Zhou D, Li P, Lin Y, et al. Lamp-2a facilitates MHC class II presentation of cytoplasmic antigens . Immunity. 2005; ; 22 : :571.–581. 38.
Romao S, Gasser N, Becker AC, et al. Autophagy proteins stabilize pathogen-containing phagosomes for prolonged MHC II antigen processing . J Cell Biol. 2013; ; 203 : :757.–766. 39.
Uhl M, Kepp O, Jusforgues-Saklani H, et al. Autophagy within the antigen donor cell facilitates efficient antigen cross-priming of virus-specific CD8+ T cells . Cell Death Differ. 2009; ; 16 : :991.–1005. 40.
Nguyen HT, Lapaquette P, Bringer MA, Darfeuille-Michaud A. Autophagy and Crohn’s disease . J Innate Immun. 2013; ; 5 : :434.–443. 41.
Lapaquette P, Glasser AL, Huett A, et al. Crohn’s disease-associated adherent-invasive E. coli are selectively favoured by impaired autophagy to replicate intracellularly . Cell Microb. 2010; ; 12 : :99.–113. 42.
Deuring JJ, Fuhler GM, Konstantinov SR, et al. Genomic ATG16L1 risk allele-restricted Paneth cell ER stress in quiescent Crohn’s disease . Gut. 2013; ; 63 : :1081.–1091. 43.
Cooney R, Baker J, Brain O, et al. NOD2 stimulation induces autophagy in dendritic cells influencing bacterial handling and antigen presentation . Nat Med. 2010; ; 16 : :90.–97. 44.
Cadwell K, Patel KK, Maloney NS, et al. Virus-plus-susceptibility gene interaction determines Crohn’s disease gene Atg16L1 phenotypes in intestine . Cell. 2010; ; 141 : :1135.–1145. 45.
Lassen KG, Kuballa P, Conway KL, et al. Atg16L1 T300A variant decreases selective autophagy resulting in altered cytokine signaling and decreased antibacterial defense . Proc Natl Acad Sci USA. 2014; ; 111 : :7741.–7746. 46.
Strisciuglio C, Miele E, Wildenberg ME, et al. T300A variant of autophagy ATG16L1 gene is associated with decreased antigen sampling and processing by dendritic cells in pediatric Crohn’s disease . Inflamm Bowel Dis. 2013; ; 19 : :2339.–2348. 47.
Murthy A, Li Y, Peng I, et al. A Crohn’s disease variant in Atg16l1 enhances its degradation by caspase 3 . Nature. 2014; ; 506 : :456.–462. 48.
Nguyen HT, Dalmasso G, Muller S, et al. Crohn’s disease-associated adherent invasive Escherichia coli modulate levels of microRNAs in intestinal epithelial cells to reduce autophagy . Gastroenterology. 2014; ; 146 : :508.–519. 49.
Brest P, Lapaquette P, Souidi M, et al. A synonymous variant in IRGM alters a binding site for miR-196 and causes deregulation of IRGM-dependent xenophagy in Crohn’s disease . Nat Genet. 2011; ; 43 : :242.–245. 50.
Brinar M, Vermeire S, Cleynen I, et al. Genetic variants in autophagy-related genes and granuloma formation in a cohort of surgically treated Crohn’s disease patients . J Crohns Colitis. 2012; ; 6 : :43.–50. 51.
Verlhac P, Viret C, Faure M. NDP52, autophagie et pathogènes. Et le combat cessa faute de combattants . Med Sci (Paris). 2015; ; 31 : :594.–597. 52.
La Morel E. formation de l’autophagosome : un nouveau défi pour le biologiste cellulaire . Med Sci (Paris). 2017; ; 33 : :217.–220. 53.
Trentesaux C, Fraudeau M, Romagnolo B. L’autophagie, l’homéostasie intestinale et ses pathologies . Med Sci (Paris). 2017; ; 33 : :290.–296. 54.
Muller S. Autophagie, autoimmunité et maladies autoimmunes . Med Sci (Paris). 2017; ; 33 : :319.–327. |