| |
| Med Sci (Paris). 33(3): 312–318. doi: 10.1051/medsci/20173303019.Autophagie, protéines ATG et maladies infectieuses Isabelle Vergne,1 Frank Lafont,2 Lucile Espert,3 Audrey Esclatine,4 and Martine Biard-Piechaczyk3* 1IPBS, UMR 5089 CNRS - Université de Toulouse III, 205, route de NarbonneBP 64182, 31077Toulouse, France 2CMPI-CIIL, CNRS UMR 8204 - Inserm U 1019 - Institut Pasteur de Lille - CHRU de Lille - Université de Lille, 1, rue du Pr Calmette, 59019Lille, France 3IRIM (ex-CPBS)-UMR9004, Université de Montpellier, CNRS, 1919, route de Mende, 34293Montpellier Cedex 5, Montpellier, France 4Institut de Biologie Intégrative de la Cellule (I2BC), CEA, CNRS, Universités Paris-Sud et Paris-Saclay, 91198, Gif-sur-Yvette cedex, France |
La macroautophagie, appelée généralement autophagie, est un mécanisme de dégradation ubiquitaire, orchestrée par plus de 30 protéines spécifiques appelées ATG (pour autophagy-related gene). C’est un processus membranaire dynamique qui débute par la formation de novo de vacuoles appelées autophagosomes englobant des fractions de cytoplasme. La dégradation du matériel séquestré se produit après fusion des autophagosomes avec les lysosomes, dans des vacuoles appelées autolysosomes. L’autophagie possède de multiples fonctions au sein de la cellule. C’est en particulier un processus fondamental de la réponse de l’hôte à l’infection par des agents pathogènes, intervenant à la fois dans les réponses immunitaires innée et adaptative. L’autophagie, alors appelée « xénophagie », a aussi la capacité de dégrader directement les agents pathogènes (entiers ou certains de leurs composants) après leur reconnaissance et leur prise en charge dans les autophagosomes. Ce mécanisme de défense peut être contré ou utilisé par les micro-organismes intracellulaires pour leur propre multiplication. Plusieurs ATG ont aussi des fonctions dans le développement de certaines pathologies infectieuses, indépendamment de leur rôle dans l’autophagie. La compréhension de la relation entre ce processus et l’agent pathogène est essentielle pour améliorer les stratégies thérapeutiques et vaccinales. Cependant, la complexité de ce sujet est immense car cette relation dépend de l’agent pathogène, qui a le plus souvent mis en jeu plusieurs stratégies différentes, de la cellule hôte, et du potentiel génétique de chaque individu. Cette revue ne peut donc être exhaustive et seuls quelques exemples seront cités pour illustrer le sujet. |
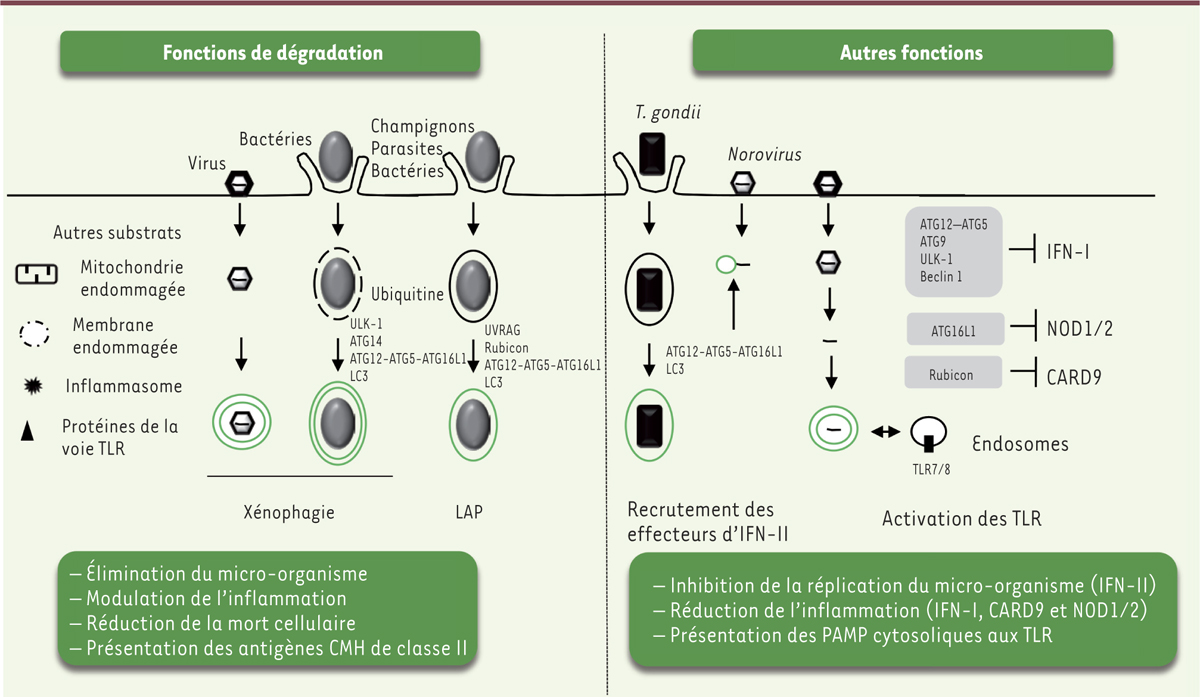
Fonctions de l’autophagie et des ATG dans les défenses de l’hôte L’autophagie, et la xénophagie en particulier, est l’une des premières lignes de défense contre les infections qu’elles soient virales, bactériennes, parasitaires ou fongiques [1–3]. Initialement étudiée au cours de l’infection par des bactéries comme Streptococcus pyogenes et Mycobacterium tuberculosis (MTB) [1], la xénophagie est maintenant décrite dans un grand nombre d’infections bactériennes (comme Listeria monocytogenes, Shigella flexneri et Salmonella enterica sérotype Typhimurium [ou Salmonella Typhimurium]), parasitaires (Toxoplasma gondii) et virales (virus Sindbis, virus de l’Herpes Simplex de type 1 [HSV-1], virus Chikungunya [CHIKV] et virus de l’immunodéficience humaine de type 1 [VIH-1]). Il est important de noter que la xénophagie peut dégrader des protéines virales ou bactériennes ainsi que des micro-organismes entiers [4–7] (Figure 1).
 | Figure 1.
Schéma synthétique des fonctions des ATG dans les défenses de la cellule hôte infectée. Les ATG (autophagy related gene) peuvent avoir des fonctions de dégradation en participant à l’autophagie sélective des micro-organismes intracellulaires (xénophagie) et à la LAP (phagocytose associée à LC3 [microtubule-associated protein 1A/1B-light chain 3]). Ces fonctions permettent d’éliminer le micro-organisme et de présenter des antigènes via le complexe majeur d’histocompatibilité (CMH) de classe II. Lors de l’infection, d’autres substrats peuvent être sélectivement dégradés afin de moduler l’inflammation et maintenir l’homéostasie cellulaire. Par ailleurs, il existe d’autres fonctions des ATG qui sont impliquées dans le recrutement membranaire d’effecteurs de l’IFN (interféron)-II, importants pour limiter l’infection de certains virus et parasites. D’autres sont impliquées dans la réduction de l’inflammation. Enfin, en fusionnant avec les endosomes, l’autophagosome, ayant capturé un ARN simple brin, permet l’activation de certains TLR (Toll-like receptors). CARD9 : caspase recruitment domain-containing protein 9 ; NOD1/2 : nucleotide-binding oligomerization domain-containing protein 1/2 ; PAMP : pathogen-associated molecular pattern ; ULK-1 : Unc-51-like kinase 1 ; UVRAG : UV radiation resistance-associated gene protein. |
Au-delà de l’autophagie canonique, des formes non conventionnelles de ce processus ont également été mises en évidence. En particulier, des agents pathogènes, capturés par la cellule par phagocytose, peuvent être observés dans des vacuoles présentant la protéine autophagique LC3 (microtubule-associated protein 1A/1B-light chain 3), où ils seront dégradés après fusion de cette vacuole avec le lysosome. Ce processus appelé LAP (pour LC3-associated phagocytosis) [8] fait intervenir plusieurs composants de la machinerie autophagique, comme le complexe contenant la phospho-inositide 3-kinase de classe III (class III PI3K) et la protéine Beclin-1, ainsi que des systèmes de conjugaison conduisant à la lipidation de LC3. Cependant, des différences notables de fonction de ces différents composants autophagiques permettent de les distinguer. Par exemple, la protéine Rubicon, qui module négativement la signalisation du complexe class III PI3K/Beclin-1 dans l’autophagie, joue un rôle activateur dans la LAP. La signalisation via le complexe ULK1/2 (Unc-51-like kinase 1/2), important pour l’initiation du processus autophagique, n’est pas requise pour la LAP. Au niveau structural, les vacuoles formées au cours de la LAP, les LAPosomes, sont composées d’une simple membrane lipidique, contrairement aux autophagosomes qui possèdent une double membrane. La LAP joue également un rôle important au cours des infections virales, puisqu’elle intervient dans la maturation des antigènes pour leur présentation par le CMH (complexe majeur d’histocompatibilité) de classe II [9]. Plusieurs ATG jouent un rôle dans les défenses de l’hôte, indépendamment du processus autophagique [10]. Ainsi, au cours de l’inhibition de la réplication du parasite T. gondii induite par l’interféron γ (IFNγ), les parasites sont emprisonnés dans des vacuoles recouvertes d’ubiquitine et ayant recruté LC3 et les récepteurs autophagiques p62/SQSTM1 (séquestosome 1) et NDP52 (nuclear domain 10 protein 52) [11]. Le processus de xénophagie n’intervient cependant pas dans cette inhibition puisqu’aucune fusion avec le lysosome n’est observée. La formation des vacuoles requiert les systèmes de conjugaison de LC3 mais elle est indépendante du complexe class III PI3K/Beclin-1 [12]. Similairement, plusieurs ATG sont impliquées dans la restriction de la multiplication du norovirus murin (MNV) en réponse à l’IFNγ via un processus qui, là aussi, ne conduit pas à la dégradation lysosomale [13]. Les principales fonctions des ATG dans les réponses de la cellule infectée sont illustrées dans la
Figure 1
. |
Mécanismes d’activation de l’autophagie lors des infections De nombreux micro-organismes intracellulaires induisent l’autophagie, que ce soit des bactéries, des parasites ou encore des virus. Cette activation constitue l’un des systèmes de défense cellulaire contre une agression extérieure. Les micro-organismes pathogènes ont donc évolué afin de s’adapter en bloquant le processus dès son initiation, ou à l’étape de dégradation, voire même en le détournant à leur profit (voir paragraphe suivant) [4]. Les constituants des agents pathogènes peuvent être détectés à l’extérieur de la cellule ou juste après leur entrée. L’autophagie peut alors être induite directement par la reconnaissance par les PRR (pattern recognition receptor) de motifs spécifiques aux micro-organismes, les PAMP (pathogen-associated molecular pattern). Les principaux PRR comprennent les Toll-like receptors (TLR), présents à la membrane plasmique ou sur les vésicules endosomales et une lectine de type C (la dectine-1), elle aussi à la membrane, et les PRR cytosoliques (nucleotide oligomerization domain [NOD]-like receptors, ou NLR). Tous ces PRR enclenchent une cascade de signalisation permettant l’activation de l’autophagie afin d’éliminer les « intrus ». La relation entre autophagie et immunité innée est décrite en détail par P. Lapaquette et al. dans ce numéro de médecine/sciences [43] (→).
(→) Voir la Synthèse de P. Lapaquette et al., page 305 de ce numéro
Parmi les exemples de PAMP activant l’autophagie via les TLR présents à la membrane plasmique, citons certains composants exposés à la surface ou sécrétés par les micro-organismes : les lipopolysaccharides (LPS) des bactéries à Gram négatif, ou les β-glucanes de la paroi de la levure Candida albicans. Certains virus, comme le Rift Valley Fever Virus, un virus transmis par les piqûres de moustique, active aussi l’autophagie via un TLR qui est présent sur les endosomes des cellules humaines, murines et d’insectes [14]. L’autophagie peut également permettre de mettre en contact des TLR endosomaux avec des ARN viraux, présents dans le cytosol après infection, qui sont séquestrés dans la vacuole autophagique et présentés après fusion avec les endosomes. Les protéines d’enveloppe des virus peuvent également activer l’autophagie via le contact avec leur récepteur cellulaire, soit par activation directe d’un signal aboutissant à l’autophagie, comme pour le virus de la rougeole [15], soit par l’intermédiaire d’un stress membranaire, comme celui induit par la fusion des membranes lors de l’entrée du VIH-1 [16]. Les NLR quant à eux peuvent activer ou inhiber l’autophagie en fonction des agents pathogènes et des types cellulaires [1, 3]. La présence des bactéries et des virus peut être détectée dans la cellule, par l’intermédiaire de leur génome, ou leurs transcrits, souvent différents des acides nucléiques de la cellule comme par exemple l’ARN double brin (ARNdb), ou l’ADN libre cytosolique. Différents senseurs dont l’activation entraîne la stimulation de l’autophagie sont présents dans le cytoplasme, comme cGAS (cyclic GMP-AMP [cGAMP] synthase) ou IFI16 (interferon gamma-inducible protein 16) pour l’ADN libre, ou la kinase dépendante de l’ARN bicatenaire, PKR, pour l’ARNdb. Localisé sur le réticulum endoplasmique (RE), STING (stimulator of IFN genes) est activé par les dinucléotides cycliques (CDN) produits par cGAS (cGAMP, cyclic GMP-AMP synthase) mais également directement par certaines bactéries (via le cyclic di-adenosine monophosphate [cyclic di-AMP] pour L. monocytogenes et Chlamydia trachomatis). La signalisation initiée par STING provoque l’ubiquitination et le recrutement de récepteurs autophagiques, comme p62/SQSTM1 et NDP52, qui orientent les bactéries vers la dégradation. L’ubiquitination directe des bactéries qui se répliquent dans le cytosol peut également induire l’autophagie [17]. Certaines protéines virales non structurales, présentes dans le cytoplasme au cours de l’infection, peuvent déclencher l’autophagie directement, notamment lorsque le processus est détourné par le virus à son profit. C’est le cas, par exemple, des virus de la poliomyélite (protéines 2BC et 3A), de l’hépatite C (protéines NS4B, NS5A, NS5B) ou encore de la rougeole (protéine C) [18]. Les infections peuvent également induire l’autophagie indirectement, en activant les mécanismes de réponse aux stress cellulaires. Les plus connus sont l’activation du système UPR (unfolded protein response) ou la production d’espèces réactives de l’oxygène (ROS). Un cas intéressant est la rupture, dans le cytoplasme, de vacuoles contenant des bactéries qui entraîne l’exposition des résidus glycosylés de protéines membranaires capables de recruter les galectines, des protéines à activité lectinique. Les galectines sont des signaux de danger qui interagissent avec des adaptateurs capables d’activer l’autophagie, en particulier la xénophagie [1, 19]. L’autophagie peut également être induite par certaines toxines. Dans ce cas, elle a une fonction cytoprotectrice [20]. Enfin, plusieurs cytokines impliquées dans les défenses de l’hôte, comme les IFN de type I et de type II, l’interleukine 1β et le TNF (tumor necrosis factor)α sont également des inducteurs d’autophagie [1]. |
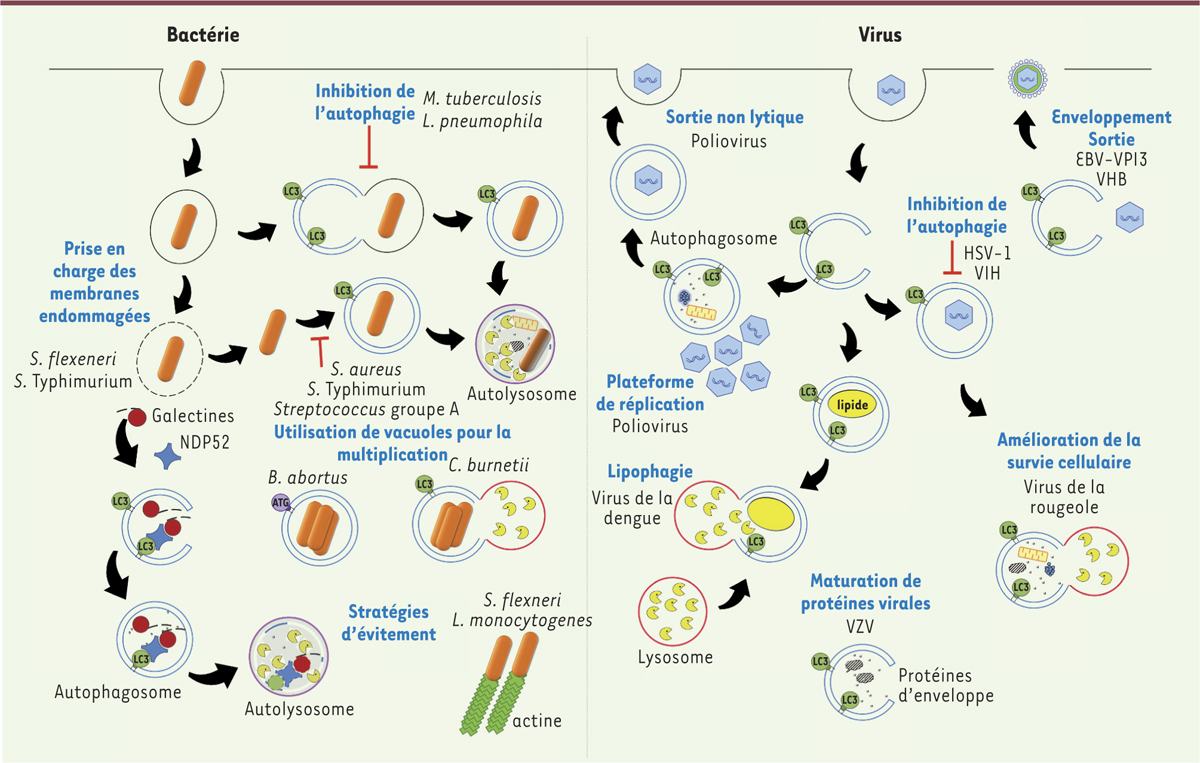
Manipulation de l’autophagie par les agents pathogènes Face à son rôle dans la défense contre les invasions microbiennes, tout ou partie du processus autophagique peut être bloqué, ou détourné, par les micro-organismes afin de se multiplier plus efficacement, de persister plus longtemps, ou de moduler la réponse immunitaire à leur profit [4, 21]. Ceci a été décrit aussi bien pour les bactéries, les virus que les parasites et les champignons. Blocage et échappement de l’autophagie Certaines bactéries peuvent moduler les voies de signalisation impliquées dans le contrôle de l’autophagie, d’autres empêchent leur reconnaissance par la machinerie autophagique, certaines, enfin, bloquent différentes étapes du mécanisme comme son initiation ou la fusion avec les lysosomes [ 4]. Ainsi, S. Typhimurium , Staphylococcus aureus, Streptococcus de groupe A, MTB et Legionella pneumophila bloquent l’autophagie afin d’éviter leur dégradation (Figure 2). D’autres bactéries vont fuir les autophagosomes grâce, par exemple, à une queue d’actine pour L. monocytogenes ou S. flexneri.
 | Figure 2.
Exemples de manipulation de l’autophagie par les bactéries et les virus à leur profit. La relation entre l’autophagie et les micro-organismes est très complexe et cette figure illustre certaines stratégies des bactéries et des virus pour contrer ou utiliser l’autophagie pour leur propre réplication. Bactérie. Certaines bactéries, présentes dans les phagosomes, vont bloquer l’autophagie pour échapper à la dégradation (Mycobacterium tuberculosis et Legionella pneumophila). D’autres bactéries, qui se sont échappées du phagosome, vont bloquer l’autophagie grâce à des facteurs bactériens comme Staphylococcus aureus, Salmonella Typhimurium ou Streptococcus du groupe A. D’autres vont détourner une partie de la machinerie autophagique pour se multiplier à l’abri dans des vacuoles qui recrutent notamment LC3 (microtubule-associated protein 1A/1B-light chain 3), comme Brucella abortus ou Coxiella burnetii. La dégradation par autophagie via la reconnaissance par les galectines des membranes endommagées du phagosome inhibe le signal d’alarme cellulaire et donc permet à des bactéries, comme Shigella flexneri ou Salmonella Typhimurium, de poursuivre leur cycle infectieux. Enfin, certaines bactéries, comme Listeria ou Shigella flexneri vont fuir les autophagosomes grâce à une queue d’actine. Virus. Certains virus vont bloquer l’autophagie pour échapper à la dégradation, tels HSV-1 ou le VIH. Les autophagosomes peuvent être utilisés comme plateformes de réplication pour certains virus à ARN comme le poliovirus. Ce virus nu utilise aussi la vacuole autophagique pour sortir de la cellule sans la lyser. Une partie de la machinerie autophagique peut être utilisée pour participer à l’assemblage et l’exocytose des virus enveloppés (EBV ; VPI3 ; VHB). L’autophagie sélective des gouttelettes lipidiques (lipophagie) permet de générer de l’énergie qui sera utilisée par le virus de la dengue. Une autophagie fonctionnelle, qui contribue à la survie cellulaire, améliore la production du virus de la rougeole et l’autophagie favoriserait aussi la maturation de protéines virales (VZV). ATG : autophagy-related protein ; HSV-1 : Herpes simplex virus de type 1 ; VIH : virus de l’immunodéficience humaine ; EBV : virus d’Epstein-Barr ; VHB : virus de l’hépatite B ; VPI3 : virus para-influenza de type 3 ; VZV : virus de la varicelle et du zona. |
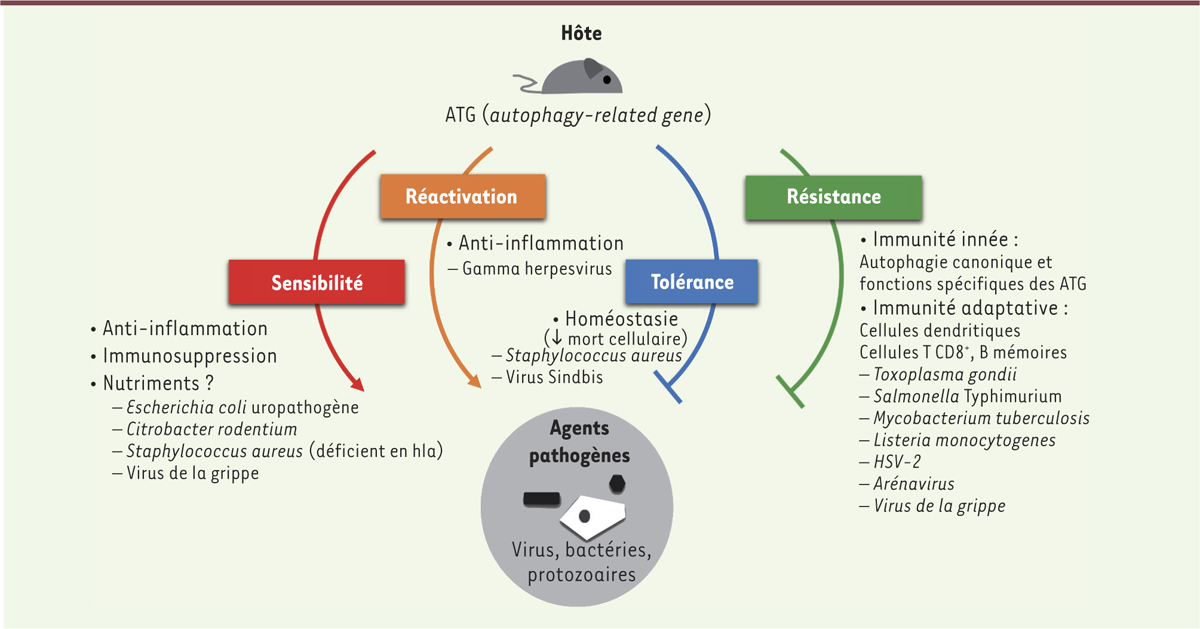
Plusieurs virus, notamment le VIH-1 [22, 23] et certains herpesvirus [24, 25], ont aussi développé des stratégies d’échappement à l’autophagie par la synthèse d’une ou plusieurs protéines virales qui interagissent directement avec la machinerie autophagique. Un même virus peut également utiliser plusieurs stratégies complémentaires à différentes étapes de son cycle pour bloquer l’initiation et/ou la maturation de l’autophagie. Aucun détournement de la LAP par les virus n’a jusqu’ici été rapporté. En revanche, Leishmania major et Aspergillus fumigatus (un champignon responsable des aspergilloses) sont capables d’inhiber la LAP [26, 27]. Utilisation de l’autophagie L’autophagie peut favoriser la réplication des agents pathogènes pour plusieurs raisons. Tout d’abord, l’apport de membranes via l’autophagie est très souvent bénéfique, à la fois pour les bactéries et les virus. Du fait de leur incapacité à se répliquer en milieu acide, ces micro-organismes bloquent, au moins partiellement, l’étape de maturation des autophagosomes. Comme exemple bactérien, nous pouvons citer Brucella abortus dont la prolifération dans les vacuoles nécessite le recrutement d’ATG impliquées dans l’initiation de l’autophagie. Coxiella burnetii est un cas particulier, car elle se développe à pH acide et utilise l’autophagie pour un développement optimal de sa vacuole réplicative (Figure 2). Plusieurs virus à ARN, comme le virus de la poliomyélite, induisent l’accumulation d’autophagosomes qui servent de plateforme de réplication. Ces vacuoles autophagiques semblent également être détournées par les virus enveloppés pour la formation de leur enveloppe, comme dans le cas du virus de l’hépatite B ou du virus Epstein-Barr, ou pour améliorer leur production extracellulaire comme pour le virus parainfluenza 3. Les autophagosomes peuvent aussi servir de cargo et permettre la sortie non lytique de virus nus (comme le virus de la poliomyélite), qui habituellement doivent détruire la membrane plasmique pour être libérés (Figure 2). L’autophagie est aussi bénéfique pour les agents pathogènes par ses fonctions pro-survie, réparatrices et d’apport énergétique. Ainsi, lors de la rupture des vacuoles, l’adressage des vestiges membranaires vers la dégradation par autophagie, via les galectines, peut favoriser le cycle de réplication de certaines bactéries comme S. flexneri ou S. Typhimurium. Cette réponse cellulaire est amplifiée lors des ruptures vacuolaires importantes induites par les micro-organismes qui s’échappent dans le cytoplasme. Dans ce cas, l’autophagie peut être un mécanisme réparateur [28] (Figure 2). L’activation de l’autophagie permet d’accroître la survie cellulaire et, par la même, la production virale, comme pour le virus de la rougeole. Le virus de la varicelle et du zona (VZV, varicella-zoster virus) semble utiliser l’autophagie pour la maturation de certaines de ses protéines d’enveloppe. Enfin, la dégradation sélective de gouttelettes lipidiques par lipophagie permet au virus de la dengue de produire des acides gras libres qui, transformés en ATP par la mitochondrie, produiront l’énergie nécessaire à la production virale (Figure 2). Rôles des ATG in vivo : le modèle murin La génération de souris mutantes, hypomorphiques ou invalidées pour différents gènes Atg, a permis de mettre en évidence la complexité du rôle des ATG au cours des infections bactériennes ou virales. En effet, en fonction du micro-organisme et du tissu étudié, les ATG peuvent avoir des fonctions diverses, dépendantes ou indépendantes de l’autophagie, qui peuvent aboutir au contrôle de l’infection ou à la mort de l’animal (Figure 3).
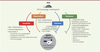 | Figure 3.
Schéma synthétique du rôle des ATG (autophagy-related gene) dans des modèles murins d’infections (souris déficientes en certains ATG). En fonction de l’agent pathogène et du type cellulaire, l’autophagie ou certains ATG (fonctions indépendantes de l’autophagie) peuvent jouer un rôle bénéfique pour l’hôte dans l’élimination du micro-organisme (résistance) ou dans la prévention de dommages à l’hôte (tolérance), mais aussi un rôle néfaste en limitant l’inflammation nécessaire au contrôle du pathogène (infection aiguë ou chronique). Ici ne sont représentés que les principaux rôles des ATG in vivo (liste non exhaustive). hla : alpha-hemolysin ou alpha-toxin ; HSV-2 : Herpes simplex virus de type 2. |
Les ATG participent aux mécanismes de défense de la souris, et ATG5, en particulier, joue un rôle majeur. Dans les cellules épithéliales de l’intestin, l’autophagie canonique semble importante pour limiter la prolifération et la dissémination de S. Typhimurium [3]. La déficience en ATG5, dans les cellules myéloïdes, rend les souris plus sensibles à l’infection par MTB, T. gondii ou L. monocytogenes [12, 24, 29]. Lors de l’infection par MTB, ATG5 semble jouer un rôle unique en limitant l’inflammation exacerbée des poumons. ATG5 est aussi indispensable pour limiter la réplication de HSV-1 dans les neurones, alors qu’elle n’est pas requise dans les cellules épithéliales [1]. Un rôle pour ATG5 et/ou ATG7 a été aussi observé dans les cellules impliquées dans l’immunité adaptative. Dans les cellules dendritiques, ATG5, probablement via la LAP, stimule la réponse Th1 nécessaire au contrôle de l’infection par HSV-2 [24]. Ces ATG participent aussi à la survie, in vivo, des lymphocytes T et B lors de l’infection par un arénavirus ou par le virus de la grippe [30, 31]. Outre leurs rôles dans la résistance à l’infection, les ATG peuvent aussi participer à la tolérance, c’est-à-dire limiter la mort de l’hôte, en réduisant les dommages cellulaires induits sans affecter la charge bactérienne ou virale. Ainsi, la mortalité des souris infectées par le virus Sindbis est accentuée en l’absence d’ATG5 dans les neurones [24]. L’autophagie est importante, dans ce cas, pour l’élimination des antigènes viraux cytotoxiques comme les protéines de capside. Les souris hypomorphes pour le gène Atg16L1 (Atg16L1HM) et celles déficientes en LC3B (LC3B-/-) sont également plus sensibles à l’α-toxine de S. aureus, l’autophagie réduisant l’expression du récepteur à l’α-toxine et donc la mort cellulaire [32]. À l’opposé, l’expression des ATG peut être nuisible pour l’hôte. Des souris ayant des macrophages déficients en autophagie sont ainsi plus résistantes à l’infection par le virus de la grippe. Dans ce cas, l’autophagie, en diminuant l’inflammation des poumons, a une fonction extrinsèque pro-pathogène [33]. Le gène Atg16L1 participe aussi à la sensibilité des souris aux infections par les Escherichia coli uropathogènes (UPEC), Citrobacter rodentium ou S. aureus Dhla (dépourvu d’α-hémolysine) [1, 32, 34]. Les UPEC pourraient utiliser la ferritinophagie (dégradation sélective de la ferritine liée au fer par l’autophagie) pour se multiplier à l’intérieur des cellules épithéliales [35, 44] (→). Dans le cas de C. rodentium, en revanche, ATG16L1 jouerait plutôt un rôle extrinsèque et immunosuppressif. Enfin, récemment, le groupe de H.W. Virgin a mis en évidence une nouvelle fonction de l’autophagie dans la réactivation d’une infection latente par un gammaherpesvirus murin dans les macrophages via la réduction de l’inflammation [36].
(→) Voir la Synthèse de A. Hamaï et M. Mehrpour, page 260 de ce numéro
Les modèles non-mammifères incluant Dictyostelium discoideum, Caenorhabditis elegans et Drosophila melanogaster ont été très utiles pour démontrer le rôle de l’autophagie dans l’immunité innée lors d’infections virales ou bactériennes [24]. L’embryon du poisson zèbre (Danio rerio) transgénique, exprimant GFP-LC3 (LC3 couplée à la GFP [green fluorescent protein]), est aussi un modèle intéressant qui permet de visualiser la dynamique de la réponse autophagique et l’association de LC3 avec la bactérie, in situ [37]. |
Applications thérapeutiques et vaccinales de l’autophagie Thérapies Au vu des résultats sur le rôle clé de l’autophagie dans l’élimination de nombreux micro-organismes intracellulaires, la manipulation de l’autophagie est devenue une alternative attractive, ou tout du moins un complément potentiellement intéressant aux antimicrobiens classiques, notamment dans le contexte de résistance [ 38]. Plusieurs travaux ont déjà mis en évidence l’effet protecteur d’inducteurs d’autophagie dans différents modèles animaux. Cependant, même si ces drogues induisent l’autophagie in vitro, le rôle de l’autophagie dans le contrôle de l’infection , in vivo, reste à démontrer. Une autre approche, plus spécifique, consiste en la recherche de peptides capables d’activer certains ATG [ 39]. L’équipe de B. Levine a ainsi généré un peptide Tat-Beclin-1 (formé de la fusion entre un fragment de Beclin-1 et un segment de la protéine tat du VIH-1), qui permet d’induire l’autophagie [ 39]. L’administration de ce peptide réduit la mortalité de souris infectées par le CHIKV ou le virus West Nile. Vaccins Un autre champ d’application possible pour la manipulation de l’autophagie est l’amélioration ou l’élaboration de vaccins. En effet, l’autophagie stimule les fonctions présentatrices d’antigènes des cellules dendritiques et augmente la survie ou la formation des lymphocytes B et T CD8 + mémoires chez la souris [ 30, 31, 40, 41]. Ainsi, la rapamycine, un inducteur classique de l’autophagie, est capable d’améliorer l’efficacité vaccinale du BCG (bacille de Calmette et Guérin) chez la souris [ 40]. Il est intéressant de noter que le BCG peut aussi améliorer la mémoire non spécifique des cellules de l’immunité innée via un mécanisme associé à l’autophagie [ 42]. |
L’autophagie joue un rôle essentiel dans le contrôle des infections, qu’elles soient bactériennes, virales ou parasitaires. La relation entre ce processus et les agents pathogènes est très complexe, et beaucoup de chemin reste à parcourir pour mieux définir cette interconnexion. L’enjeu est néanmoins très important car de nouvelles stratégies thérapeutiques et/ou vaccinales pourraient émerger de ces travaux. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Deretic V, Saitoh T, Akira S. Autophagy in infection, inflammation and immunity . Nat Rev Immunol. 2013; ; 13 : :722.–737. 2.
Kanayama M, Shinohara ML. Roles of autophagy and autophagy-related proteins in antifungal immunity . Front Immunol. 2016; ; 7 : :47.. 3.
Shibutani ST, Saitoh T, Nowag H, et al. Autophagy and autophagy-related proteins in the immune system . Nat Immunol. 2015; ; 16 : :1014.–1024. 4.
Huang J, Brumell JH. Bacteria-autophagy interplay: a battle for survival . Nat Rev Microbiol. 2014; ; 12 : :101.–114. 5.
Judith D, Mostowy S, Bourai M, et al. Species-specific impact of the autophagy machinery on Chikungunya virus infection . EMBO Rep. 2013; ; 14 : :534.–544. 6.
Orvedahl A, MacPherson S, Sumpter R, Jr, et al. Autophagy protects against Sindbis virus infection of the central nervous system . Cell Host Microbe. 2010; ; 7 : :115.–127. 7.
Sagnier S, Daussy CF, Borel S, et al. Autophagy restricts HIV-1 infection by selectively degrading Tat in CD4+ T lymphocytes . J Virol. 2015; ; 89 : :615.–625. 8.
Martinez J, Malireddi RK, Lu Q, et al. Molecular characterization of LC3-associated phagocytosis reveals distinct roles for Rubicon, NOX2 and autophagy proteins . Nat Cell Biol. 2015; ; 17 : :893.–906. 9.
Romao S, Munz C. LC3-associated phagocytosis . Autophagy. 2014; ; 10 : :526.–528. 10.
Bestebroer J, V’Kovski P, Mauthe M, Reggiori F. Hidden behind autophagy: the unconventional roles of ATG proteins . Traffic. 2013; ; 14 : :1029.–1041. 11.
Selleck EM, Orchard RC, Lassen KG, et al. A noncanonical autophagy pathway restricts Toxoplasma gondii growth in a strain-specific manner in IFN-gamma-activated human cells . mBio. 2015; ; 6 : :e01157.–15. 12.
Choi J, Park S, Biering SB, et al. The parasitophorous vacuole membrane of Toxoplasma gondii is targeted for disruption by ubiquitin-like conjugation systems of autophagy . Immunity. 2014; ; 40 : :924.–935. 13.
Hwang S, Maloney NS, Bruinsma MW, et al. Nondegradative role of Atg5-Atg12/ Atg16L1 autophagy protein complex in antiviral activity of interferon gamma . Cell Host Microbe. 2012; ; 11 : :397.–409. 14.
Moy RH, Gold B, Molleston JM, et al. Antiviral autophagy restrictsRift Valley fever virus infection and is conserved from flies to mammals . Immunity. 2014; ; 40 : :51.–65. 15.
Joubert PE, Meiffren G, Gregoire IP, et al. Autophagy induction by the pathogen receptor CD46 . Cell Host Microbe. 2009; ; 6 : :354.–366. 16.
Espert L, Denizot M, Grimaldi M, et al. Autophagy is involved in T cell death after binding of HIV-1 envelope proteins to CXCR4 . J Clin Invest. 2006; ; 116 : :2161.–2172. 17.
Ligeon LA, Temime-Smaali N, Lafont F. Ubiquitylation and autophagy in the control of bacterial infections and related inflammatory responses . Cell Microbiol. 2011; ; 13 : :1303.–1311. 18.
Paul P, Munz C. Autophagy and mammalian viruses: roles in immune response, viral replication, and beyond . Adv Virus Res. 2016; ; 95 : :149.–195. 19.
Thurston TL, Wandel MP, von Muhlinen N, et al. Galectin 8 targets damaged vesicles for autophagy to defend cells against bacterial invasion . Nature. 2012; ; 482 : :414.–418. 20.
Mestre MB, Colombo MI. Autophagy and toxins: a matter of life or death . Curr Mol Med. 2013; ; 13 : :241.–251. 21.
Dong X, Levine B. Autophagy and viruses: adversaries or allies? J Innate Immun. 2013; ; 5 : :480.–493. 22.
Borel S, Robert-Hebmann V, Alfaisal J, et al. HIV-1 viral infectivity factor interacts with microtubule-associated protein light chain 3 and inhibits autophagy . AIDS. 2015; ; 29 : :275.–286. 23.
Kyei GB, Dinkins C, Davis AS, et al. Autophagy pathway intersects with HIV-1 biosynthesis and regulates viral yields in macrophages . J Cell Biol. 2009; ; 186 : :255.–268. 24.
Levine B, Mizushima N, Virgin HW. Autophagy in immunity and inflammation . Nature. 2011; ; 469 : :323.–335. 25.
Mouna L, Hernandez E, Bonte D, et al. Analysis of the role of autophagy inhibition by two complementary human cytomegalovirus BECN1/Beclin 1-binding proteins . Autophagy. 2016; ; 12 : :327.–342. 26.
Akoumianaki T, Kyrmizi I, Valsecchi I, et al. Aspergillus cell wall melanin blocks LC3-associated phagocytosis to promote pathogenicity . Cell Host Microbe. 2016; ; 19 : :79.–90. 27.
Matte C, Casgrain PA, Seguin O, et al. Leishmania major promastigotes evade LC3-associated phagocytosis through the action of GP63 . PLoS Pathog. 2016; ; 12 : :e1005690.. 28.
Kreibich S, Emmenlauer M, Fredlund J, et al. Autophagy proteins promote repair of endosomal membranes damaged by the Salmonella type three secretion system 1 . Cell Host Microbe. 2015; ; 18 : :527.–537. 29.
Kimmey JM, Huynh JP, Weiss LA, et al. Unique role for ATG5 in neutrophil-mediated immunopathology during M. tuberculosis infection . Nature. 2015; ; 528 : :565.–569. 30.
Chen M, Hong MJ, Sun H, et al. Essential role for autophagy in the maintenance of immunological memory against influenza infection . Nat Med. 2014; ; 20 : :503.–510. 31.
Xu X, Araki K, Li S, et al. Autophagy is essential for effector CD8+ T cell survival and memory formation . Nat Immunol. 2014; ; 15 : :1152.–1161. 32.
Maurer K, Reyes-Robles T, Alonzo F, 3rd, et al. Autophagy mediates tolerance to Staphylococcus aureus alpha-toxin . Cell Host Microbe. 2015; ; 17 : :429.–440. 33.
Lu Q, Yokoyama CC, Williams JW, et al. Homeostatic control of innate lung inflammation by vici syndrome gene Epg5 and additional autophagy genes promotes influenza pathogenesis . Cell Host Microbe. 2016; ; 19 : :102.–113. 34.
Marchiando AM, Ramanan D, Ding Y, et al. A deficiency in the autophagy gene Atg16L1 enhances resistance to enteric bacterial infection . Cell Host Microbe. 2013; ; 14 : :216.–224. 35.
Bauckman KA, Mysorekar IU. Ferritinophagy drives uropathogenic Escherichia coli persistence in bladder epithelial cells . Autophagy. 2016; ; 12 : :850.–863. 36.
Park S, Buck MD, Desai C, et al. Autophagy genes enhance murine gammaherpesvirus 68 reactivation from latency by preventing virus-induced systemic inflammation . Cell Host Microbe. 2016; ; 19 : :91.–101. 37.
Mostowy S, Boucontet L, Mazon Moya MJ, et al. The zebrafish as a new model for the in vivo study of Shigella flexneri interaction with phagocytes and bacterial autophagy . PLoS Pathog. 2013; ; 9 : :e1003588.. 38.
Zumla A, Rao M, Wallis RS, et al. Host-directed therapies for infectious diseases: current status, recent progress, and future prospects . Lancet Infect Dis. 2016; ; 16 : :e47.–e63. 39.
Shoji-Kawata S, Sumpter R, Leveno M, et al. Identification of a candidate therapeutic autophagy-inducing peptide . Nature. 2013; ; 494 : :201.–206. 40.
Jagannath C, Lindsey DR, Dhandayuthapani S, et al. Autophagy enhances the efficacy of BCG vaccine by increasing peptide presentation in mouse dendritic cells . Nat Med. 2009; ; 15 : :267.–276. 41.
Ravindran R, Khan N, Nakaya HI, et al. Vaccine activation of the nutrient sensor GCN2 in dendritic cells enhances antigen presentation . Science. 2014; ; 343 : :313.–317. 42.
Buffen K, Oosting M, Quintin J, et al. Autophagy controls BCG-induced trained immunity and the response to intravesical BCG therapy for bladder cancer . PLoS Pathog. 2014; ; 10 : :e1004485.. 43.
Lapaquette P, Nguyen HTT, Faure M. L’autophagie garante de l’immunité et de l’inflammation. « Tout est bien, tout va bien, tout va pour le mieux qu’il soit possible » . MedSci (Paris). 2017; ; 33 : :305.–311. 44.
Hamaï A, Mehrpour M. Homéostasie du fer et autophagie . Med Sci (Paris). 2017; ; 33 : :260.–267. |