| |
| Med Sci (Paris). 33(4): 373–375. doi: 10.1051/medsci/20173304002.Akkermansia muciniphila, une bactérie pour lutter contre le syndrome métabolique Optimisation des effets bénéfiques et évaluation de la sûreté chez l’homme Hubert Plovier1 and Patrice D. Cani1* 1Université catholique de Louvain, Louvain drug research institute LDRI, WELBIO (Walloon excellence in lifesciences and biotechnology), groupe de recherche en métabolisme et nutrition, avenue E. Mounier, 73 B1.73.11, B-1200Bruxelles, Belgique |
Le surpoids et l’obésité atteignent des proportions épidémiques, avec plus de 10 % de la population mondiale souffrant d’obésité. En France, les derniers chiffres indiquent que près d’un individu sur deux est en surpoids ou obèse [1]. L’obésité prédispose au développement du diabète de type 2 et des maladies cardiovasculaires. Ces pathologies, constituant le syndrome métabolique [2] (→) sont donc une problématique majeure en santé publique [1].
(→) Voir la Synthèse de D. Junquero et Y. Rival, m/s n° 12, décembre 2005, page 1045
Les bactéries du microbiote intestinal jouent un rôle important dans la régulation du métabolisme et de l’inflammation. La perturbation de ce microbiote, appelée dysbiose, intervient dans l’émergence du syndrome métabolique [3]. L’une des bactéries les plus abondantes du microbiote intestinal humain est Akkermansia muciniphila. Or son abondance est diminuée chez les individus souffrant du syndrome métabolique [4]. À l’inverse, les effets de la metformine1 ou de la chirurgie bariatrique, deux traitements visant respectivement à réguler la glycémie et lutter contre l’obésité, sont associés à une augmentation de l’abondance de cette bactérie [5, 6]. Nous avons montré que l’administration d’A. muciniphila diminue le développement de l’obésité causée par un régime hyperlipidique chez la souris [7]. Ces résultats ont été confirmés par d’autres équipes et un effet protecteur d’A. muciniphila a également été montré pour d’autres pathologies comme l’athérosclérose [8]. A. muciniphila présente donc un intérêt important dans le développement de stratégies visant à diminuer l’incidence du syndrome métabolique. |
Sérendipité : l’avantage inattendu de la pasteurisation L’évaluation des effets de l’administration d’A. muciniphila à l’homme est compliquée par ses conditions de culture et sa sensibilité à l’oxygène, contraignant les perspectives thérapeutiques. En effet, jusqu’il y a peu, A. muciniphila n’était cultivable qu’en présence de mucus, son substrat favori. Ceci rendait dès lors son administration chez l’homme impossible. Afin de résoudre ce problème, un milieu synthétique a été développé, permettant un rendement de culture d’A. muciniphila similaire à cel ui obtenu en milieu originel tout en étant dépourvu de composés incompatibles à une administration chez l’homme. En comparant les effets de la bactérie cultivée sur son milieu originel et sur ce nouveau milieu synthétique, nous avons montré qu’A. muciniphila conserve son efficacité indépendamment du milieu utilisé : les souris traitées avec la bactérie gagnent deux fois moins de poids sous régime hyperlipidique. Leur tolérance au glucose et leur résistance à l’insuline sont également améliorées [9]. Nos premiers résultats ont montré que les effets protecteurs d’A. muciniphila disparaissent quand la bactérie est détruite par autoclavage, un traitement thermique dégradant l’ensemble des constituants de la bactérie. Cependant, plusieurs études suggèrent que des bactéries probiotiques inactivées par pasteurisation2, un traitement limitant la dégradation de leurs constituants, conservent tout ou partie de leurs effets bénéfiques [10]. Nous avons donc pasteurisé A. muciniphila et l’avons administré à des souris. Nous avons observé de manière surprenante que cette méthode d’inactivation augmente les effets de la bactérie. Plus précisément, le gain de poids et de masse grasse des souris recevant la diète hyperlipidique et traitées avec la bactérie pasteurisée est similaire à celui observé chez des souris nourries avec une diète contrôle. Ces effets sont indépendants de la prise alimentaire des souris. Par contre, l’administration d’A. muciniphila pasteurisée augmente le contenu calorique présent dans les selles des souris traitées, indiquant qu’une diminution de l’absorption énergétique pourrait participer à ces effets. Les effets de la bactérie sur la tolérance au glucose et la résistance à l’insuline sont également améliorés grâce à la pasteurisation. Ce résultat pourrait s’expliquer par un impact spécifique d’A. muciniphila pasteurisée sur la taille des adipocytes et les taux de plusieurs adipokines3,, telles que la leptine4, et la résistine5, impliquées dans le développement de la résistance au glucose. |
Akkermansia muciniphila, TLR2 et barrière intestinale Les Toll-like receptors (TLR) interviennent dans la reconnaissance des constituants bactériens par le système immunitaire. Ils participent ainsi aux interactions entre l’hôte et son microbiote, et peuvent également moduler l’homéostasie intestinale et le métabolisme de l’hôte [11]. Nous avons évalué le potentiel d’A. muciniphila à activer différents TLR, et avons montré que la bactérie pouvait spécifiquement interagir avec le TLR2. Pour mieux caractériser l’interaction entre A. muciniphila et ce récepteur, nous avons tiré parti d’analyses génomiques et protéomiques de la membrane externe de la bactérie afin d’identifier les protéines membranaires susceptibles d’entrer en contact avec les récepteurs de l’hôte. Parmi ces protéines, l’une des plus abondantes était Amuc_1100. Son rôle dans la formation de pilus6 par A. muciniphila suggère qu’elle pourrait participer à l’interaction entre la bactérie et TLR2, comme cela a déjà été montré avec le pilus de la bactérie probiotique Lactobacillus rhamnosus GG [12]. Nous avons confirmé cette hypothèse en montrant qu’une version de la protéine appelée Amuc_1100*, obtenue par génie génétique, peut effectivement activer TLR2 à elle seule, de la même manière qu’A. muciniphila. En outre, Amuc_1100* reste stable à la température utilisée lors de la pasteurisation, et pourrait donc contribuer aux effets de la bactérie pasteurisée. Nous avons ensuite comparé les effets d’A. muciniphila, vivante ou pasteurisée, à ceux d’Amuc_1100* chez des souris soumises à un régime hyperlipidique. De la même manière que la bactérie pasteurisée, Amuc_1100* diminue le gain de poids et de masse grasse indépendamment de la prise alimentaire. A. muciniphila, qu’elle soit vivante ou pasteurisée, et Amuc_1100* diminuent également l’hypercholestérolémie induite par le régime riche en graisses. La bactérie pasteurisée réduit quant à elle spécifiquement la triglycéridémie des souris traitées, renforçant l’idée que la pasteurisation d’A. muciniphila renforce ses effets protecteurs. Tout comme la bactérie, Amuc_1100* peut corriger l’intolérance au glucose chez les souris traitées. Cet effet est lié à une amélioration de la sensibilité hépatique à l’insuline chez les souris traitées par A. muciniphila ou la protéine. De nombreux résultats montrent que l’activation du TLR2 au niveau intestinal permet de renforcer la fonction de barrière de l’intestin, en modulant des protéines de jonction serrée [10]. Nous avons pu observer qu’A. muciniphila et Amuc_1100* augmentent l’expression de plusieurs de ces protéines, telles que l’occludine et la claudine 3, indiquant ainsi une nouvelle voie contribuant au renforcement de la barrière intestinale par la bactérie. |
Premières indications de sûreté chez l’homme Nous avons évalué la toxicité et l’émergence d’éventuels effets secondaires liés à l’administration d’A. muciniphila vivante ou pasteurisée chez l’homme, dans le cadre d’une étude en cours sur des individus souffrant du syndrome métabolique. Dans ce but, nous avons analysé plusieurs paramètres utilisés pour tester la sûreté de probiotiques en contexte clinique, chez des individus ayant reçu A. muciniphila quotidiennement durant les deux premières semaines de l’étude. Ces paramètres étaient liés aux fonctions musculaire, hépatique et rénale, ainsi qu’à l’immunité et l’inflammation. Quelle que soit la formulation d’A. muciniphila (vivante ou pasteurisée), aucune modification n’a été observée pour l’ensemble des marqueurs testés. La fréquence des effets secondaires rapportés par les patients est également similaire dans les différents groupes. Ces premières données ont été obtenues sur un nombre de sujets limités et sont donc préliminaires. Elles indiquent néanmoins qu’A. muciniphila, qu’elle soit active ou pasteurisée, est bien tolérée chez les individus souffrant de syndrome métabolique, et qu’elle ne présente pas de toxicité particulière. Ces résultats montrent donc l’innocuité de l’administration des différentes formes d’A. muciniphila. Par contre, en ce qui concerne la potentielle efficacité d’A. muciniphila sur le syndrome métabolique chez l’homme, précisons que l’investigation est actuellement en cours et se poursuivra jusqu’à la fin de l’année 2017. Nous devrions donc connaître les premiers résultats, très attendus, au début de l’année 2018. |
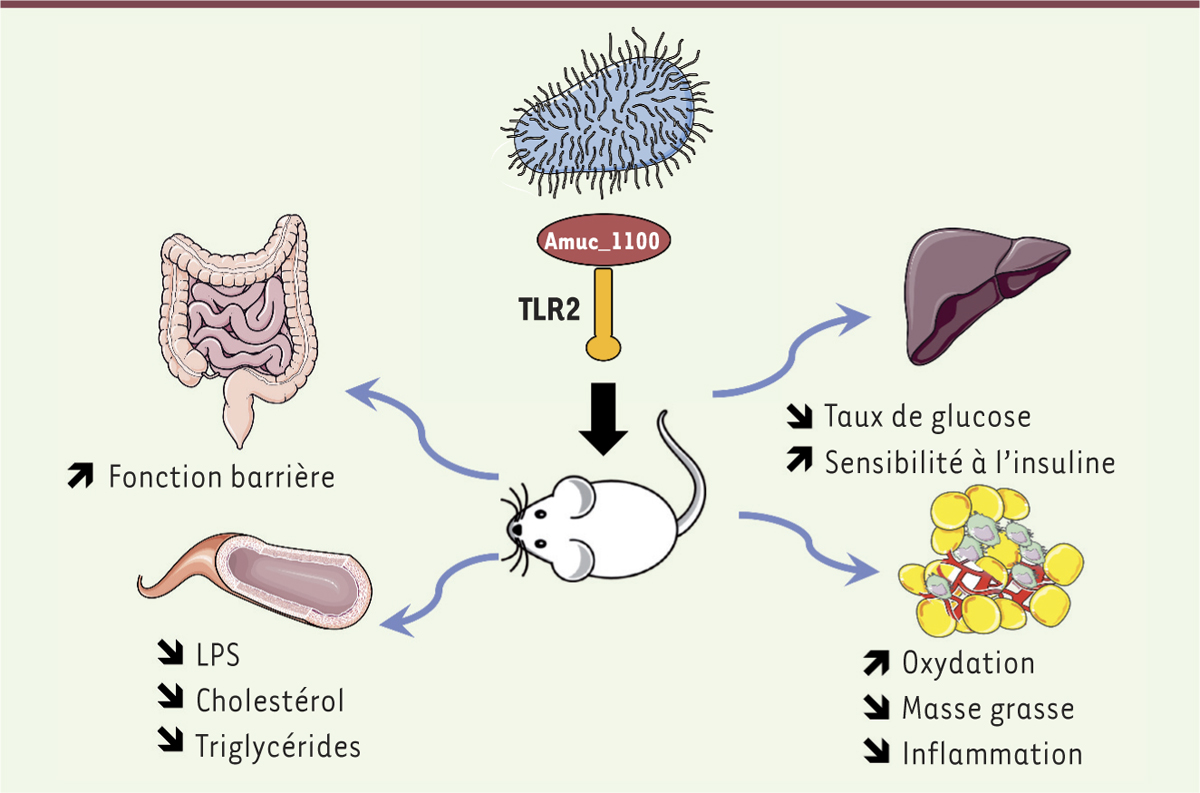
Conclusion et perspectives Nos résultats suggèrent qu’Akkermansia muciniphila est un candidat potentiel dans le traitement de l’obésité et du syndrome métabolique (Figure 1). Son administration diminue en effet le développement de l’obésité, ainsi que du diabète de type 2 et des perturbations de la barrière intestinale, chez la souris [7]. D’autres études menées chez la souris indiquent qu’A. muciniphila inhibe également le développement de l’athérosclérose [8]. Les résultats que nous venons de résumer montrent que (a) A. muciniphila reste efficace en étant cultivée sur un milieu synthétique compatible avec une administration chez l’homme ; (b) l’inactivation de la bactérie par pasteurisation améliore ses effets sur de nombreux paramètres de l’obésité ; et (c) un axe Amuc_1100 – TLR2 est impliqué dans les effets de la bactérie [9].
 | Figure 1.
Effets protecteurs d’Akkermansia muciniphila contre le développement de l’obésité et du syndrome métabolique à travers divers organes. L’effet protecteur d’A. muciniphila repose notamment sur la reconnaissance de la protéine Amuc_1100 par le récepteur TLR2 (Toll-like receptor 2). Plusieurs études montrent qu’A. muciniphila peut renforcer la barrière intestinale en augmentant la production de mucus et de peptides antimicrobiens, ainsi que l’expression de protéines de jonctions serrées. Ceci se traduit par une diminution de la translocation des lipopolysaccharides (LPS) depuis l’intestin vers la circulation sanguine, diminuant ainsi l’inflammation associée à l’obésité. L’administration d’A. muciniphila permet également de corriger la dyslipidémie induite par un régime riche en graisses. Au niveau hépatique, la sensibilité à l’insuline des animaux traités est améliorée, et l’expression d’enzymes impliquées dans la gluconéogénèse est diminuée, contribuant à l’amélioration de la tolérance au glucose. Enfin, l’augmentation du potentiel oxydatif et la diminution du tonus inflammatoire du tissu adipeux contribuent à la diminution de la masse grasse chez les animaux traités. |
Les mécanismes spécifiques expliquant l’amélioration des effets d’A. muciniphila suite à sa pasteurisation devront encore être étudiés. Ils semblent impliquer la protéine Amuc_1100, puisque celle-ci est toujours stable après pasteurisation. La pasteurisation pourrait par exemple augmenter l’accessibilité de la protéine pour les récepteurs de l’hôte, et ainsi en renforcer les effets. Par ailleurs, l’identification et l’isolement d’un constituant bactérien tel que Amuc_1100, reproduisant les effets de la bactérie, pourrait s’avérer utile dans la lutte contre des pathologies telles que les maladies inflammatoires de l’intestin, qui s’accompagnent également d’une diminution de la fonction barrière intestinale. Enfin, des données préliminaires suggèrent que l’administration d’A. muciniphila vivante ou pasteurisée ne s’accompagne pas d’effets indésirables chez des patients souffrant du syndrome métabolique. Ces résultats permettent d’envisager des investigations plus poussées du potentiel thérapeutique d’A. muciniphila chez l’homme. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Nous remercions particulièrement le Prof. Willem de Vos et l’ensemble des co-auteurs de l’étude originelle. Hubert Plovier est aspirant FRS-FNRS (Fonds de la Recherche Scientifique), Belgique. Patrice D. Cani est chercheur qualifié du FRS-FNRS. PDC est récipiendaire de différentes subventions de recherches FRFS-WELBIO under grant : WELBIO-CR-2012S-02R, le Fonds Baillet Latour (Grant for Medical Research 2015), un FIRST Spin-Off grant (FSO) (convention 1410053), un POC ERC grant 2016 (European Research Council, Microbes4U_713547) et un ERC Starting Grant 2013 (Starting grant 336452-ENIGMO).
|
Footnotes |
1.
Matta J, Zins M, Feral-Pierssens AL, et al. Prévalence du surpoids, de l’obésité et des facteurs de risque cardio-métaboliques dans la cohorte Constances . Bull Epidemiol Hebd. 2016; ; 35–36 : :640.–646. 2.
Junquero D, Rival Y. Syndrome métabolique : quelle définition pour quel(s) traitement(s) ? Med Sci (Paris). 2005; ; 21 : :1045.–1053. 3.
Cani PD, Plovier H, Van Hul M, et al. Endocannabinoids - at the crossroads between the gut microbiota and host metabolism . Nat Rev Endocrinol. 2016; ; 12 : :133.–143. 4.
Derrien M, Belzer C, de Vos WM. Akkermansia muciniphila and its role in regulating host functions . Microb Pathog. 2016. doi: 10.1016/j.micpath.2016.02.005.
5.
Forslund K, Hildebrand F, Nielsen T, et al. Disentangling type 2 diabetes and metformin treatment signatures in the human gut microbiota . Nature. 2015; ; 528 : :262.–266. 6.
Zhang H, DiBaise JK, Zuccolo A, et al. Human gut microbiota in obesity and after gastric bypass . Proc Natl Acad Sci USA. 2009; ; 106 : :2365.–2370. 7.
Everard A, Belzer C, Geurts L, et al. Cross-talk between Akkermansia muciniphila and intestinal epithelium controls diet-induced obesity . Proc Natl Acad Sci USA. 2013; ; 110 : :9066.–9071. 8.
Li J, Lin S, Vanhoutte PM, et al. Akkermansia muciniphila protects against atherosclerosis by preventing metabolic endotoxemia-induced inflammation in Apoe-/- mice . Circulation. 2016; ; 33 : :2434.–2446. 9.
Plovier H, Everard A, Druart C, et al. A purified membrane protein from Akkermansia muciniphila or the pasteurized bacterium improves metabolism in obese and diabetic mice . Nat Med. 2017; ; 23 : :107.–113. 10.
Sakai T, Taki T, Nakamoto A, et al. Lactobacillus plantarum OLL2712 regulates glucose metabolism in C57BL/6 mice fed a high-fat diet . J Nutr Sci Vitaminol. 2013; ; 59 : :144.–147. 11.
Abreu MT. Toll-like receptor signalling in the intestinal epithelium: how bacterial recognition shapes intestinal function . Nat Rev Immunol. 2010; ; 10 : :131.–144. 12.
von Ossowski I, Pietilä TE, Rintahaka J, et al. Using recombinant Lactococci as an approach to dissect the immunomodulating capacity of surface piliation in probiotic Lactobacillus rhamnosus GG . PLoS One. 2013; ; 8 : :e64416.. |