| |
| Med Sci (Paris). 33(4): 417–422. doi: 10.1051/medsci/20173304012.Ostéocalcine et métabolisme du glucose Les leçons des études chez l’homme Valérie Le Doan1 and Valérie Marcil1* 1Centre de recherche, CHU Sainte-Justine et Département de Nutrition, Université de Montréal, 3175 Côte Sainte-Catherine, Montréal, Québec, H3T 1C5Canada |
Vignette (Photo © Inserm - Jean-Paul Roux). L’os est un organe auquel on attribue depuis longtemps des fonctions dans la mobilité et le stockage du calcium [1]. Plusieurs de ses protéines sont responsables de son activité dont l’ostéocalcine (OC) qui est utilisée comme biomarqueur de la minéralisation osseuse. Pourtant, des études réalisées chez l’animal ont révélé une relation importante entre l’OC et le métabolisme du glucose. Elles ont ainsi suggéré l’existence chez l’homme d’une régulation coordonnée, de nature endocrine, des métabolismes osseux et énergétique [2] (→).
(→) Voir la Synthèse de C.B. Confavreux et M. Ferron, m/s n° 1, janvier 2008, page 21
Cette hypothèse est soutenue en particulier par les importants besoins énergétiques que requiert l’os pour son fonctionnement [3]. Au cours de la dernière décennie, plusieurs études ont porté sur cette relation entre l’OC et le métabolisme du glucose chez l’homme. |
L’ostéocalcine, une protéine de l’os L’OC, initialement appelée GLA-protéine osseuse (en anglais, BGP pour bone GLA [gamma-carboxyglutamic acid-rich] protein), est l’une des protéines non collagéniques les plus abondantes de l’os. Il s’agit d’un peptide constitué de 49 acides aminés, synthétisé et sécrété par les ostéoblastes, les cellules responsables de la formation de l’os via la minéralisation de la matrice [4]. Les ostéoblastes synthétisent plusieurs autres protéines matricielles parmi lesquelles la fibronectine, l’ostéopontine, l’ostéonectine et la sialoprotéine, dont les rôles ne sont pas encore complètement élucidés [5] (→).
(→) Voir la Synthèse de P. Marie, m/s n° 12, décembre 2001, page 1252
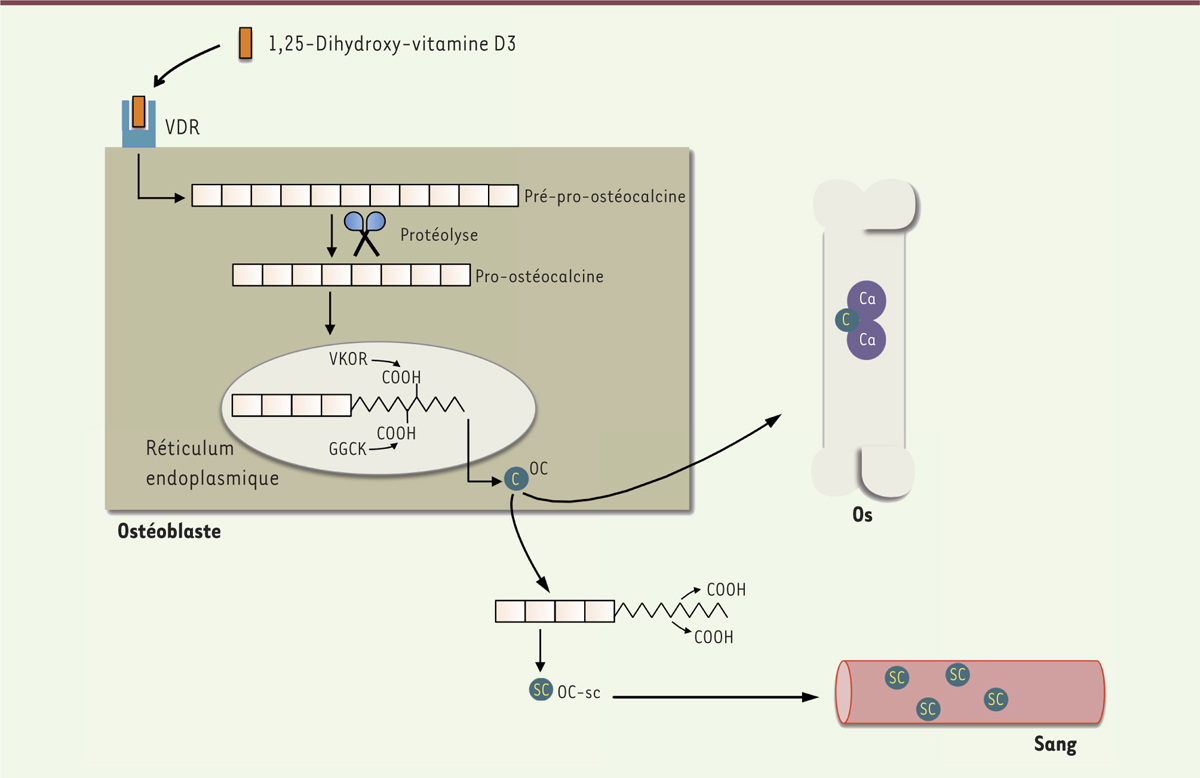
La synthèse de l’OC débute par la transcription de son gène (bone gamma-carboxyglutamic acid-containing protein, BGLAP), qui est modulée, entre autres, par la 1,25-dihydroxy-vitamine D3, la forme active de la vitamine D qui se lie à son récepteur présent sur les ostéoblastes. L’OC est synthétisée sous forme de pré-pro-ostéocalcine, protéine mature mais non active constituée de 98 acides aminés dont 49 forment le pro-peptide. Une étape de protéolyse libère le pro-peptide pour former la pro-ostéocalcine qui est ensuite carboxylée (par l’ajout de groupements carboxyles, COOH) dans le réticulum endoplasmique, au niveau de trois résidus glutamiques (d’abord les Glu21 et Glu24, puis le Glu17) par deux enzymes, la gamma-glutamyl carboxylase et la vitamine K époxyde réductase [6]. Cette étape permet de former l’OC carboxylée. Elle est majoritairement stockée au niveau de la matrice minérale osseuse sous la forme de cristaux d’hydroxyapatite. Les groupements acides de l’OC carboxylée se lient au calcium osseux avec une forte affinité [4]. L’OC peut subir une décarboxylation, c’est-à-dire une perte de résidus glutamiques carboxylés, pour former l’OC sous-carboxylée. Sous cette forme, son affinité pour l’os est grandement diminuée, ce qui entraîne sa libération de la matrice osseuse dans la circulation sanguine (Figure 1). Ainsi, la concentration d’OC sous-carboxylée dans le sang ne dépend pas directement de la synthèse ostéoblastique mais plus de sa décarboxylation et de son détachement de l’os. L’OC sous-carboxylée circulante constituerait ainsi la forme possédant une fonction endocrinienne qui participerait au métabolisme du glucose.
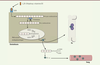 | Figure 1.
Synthèse, carboxylation et décarboxylation de l’ostéocalcine. La synthèse de l’ostéocalcine est activée par la 1,25-dihydroxy-vitamine D3 qui se lie au récepteur de la vitamine D au niveau des ostéoblastes. La pré-pro-ostéocalcine est synthétisée. S’en suit une étape de protéolyse pour libérer le pro-peptide et former la pro-ostéocalcine qui est à son tour carboxylée dans le réticulum endoplasmique par la gamma-glutamyl carboxylase et la vitamine K époxyde réductase. Cette étape permet de former l’ostéocalcine carboxylée dont les groupements acides se lient au calcium osseux avec une forte affinité. L’ostéocalcine peut subir une décarboxylation et former l’ostéocalcine sous-carboxylée qui est libérée de la matrice osseuse dans la circulation sanguine. VDR : récepteur de la vitamine D ; VKOR : vitamine K époxyde réductase ; GGCK : gamma-glutamyl carboxylase ; OC : ostéocalcine ; OC-sc : ostéocalcine sous-carboxylée ; Ca : calcium. |
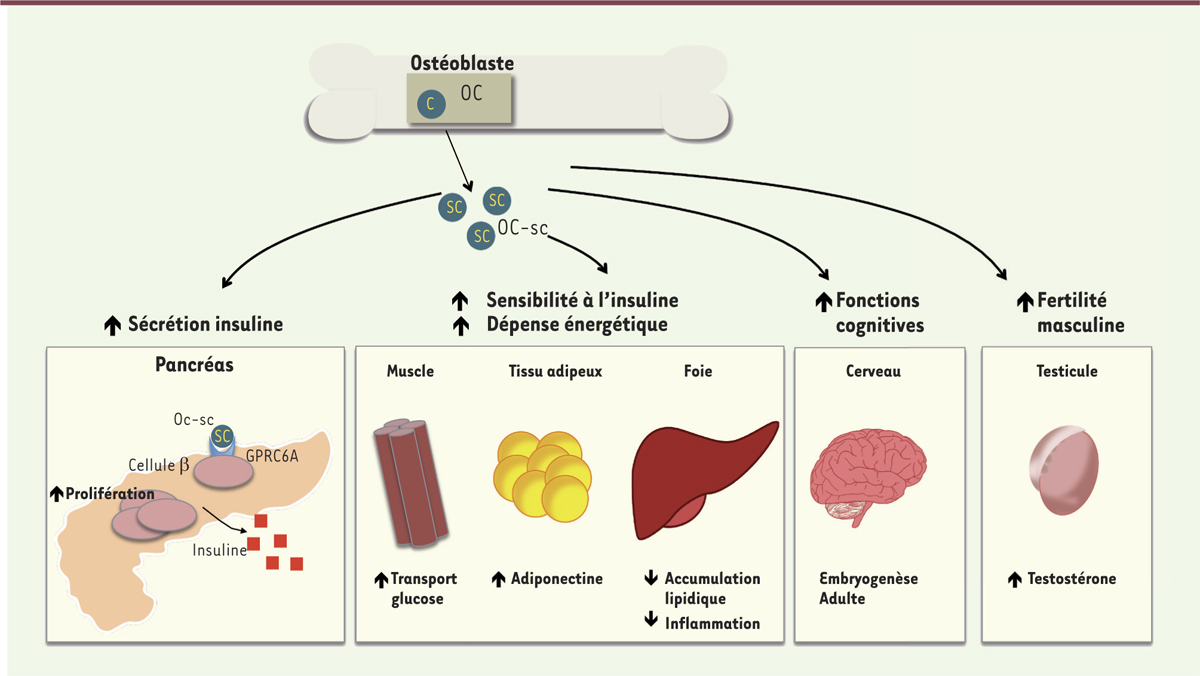
Le rôle de l’OC dans le remodelage osseux demeure controversé, en particulier depuis qu’il a été découvert que la délétion du gène chez la souris n’affecte que très peu le phénotype osseux [7]. En revanche, l’OC circulante présente d’autres fonctions qui ne sont pas liées à l’homéostasie osseuse. Elle peut en effet avoir un impact positif sur la production de testostérone et la fertilité de l’homme en agissant sur les cellules testiculaires [8, 9]. Elle exerce également une influence positive sur le développement des fonctions cognitives et le système nerveux central, au cours de l’embryogenèse en traversant la barrière placentaire, ainsi qu’à l’âge adulte en traversant la barrière hémato-encéphalique [10]. Les études portant sur l’OC et le métabolisme glucidique ont montré qu’elle favorisait de plus la sensibilité à l’insuline des organes cibles. L’OC stimule en effet la captation du glucose par les muscles, augmente la production d’adiponectine par le tissu adipeux et réduit l’accumulation lipidique et l’inflammation au niveau du foie. Elle promeut également la sécrétion d’insuline par le pancréas [11–14] (Figure 2).
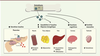 | Figure 2.
Fonctions de l’ostéocalcine au niveau systémique. L’ostéocalcine circulante présente différentes activités systémiques non liées à l’os : (1) elle favorise la sensibilité à l’insuline des organes périphériques tels que le muscle, le tissu adipeux et le foie ; (2) elle augmente la production d’insuline par le pancréas ; (3) elle favorise la production de testostérone et la fertilité de l’homme en agissant sur les cellules testiculaires ; et (4) elle pourrait aussi contribuer au développement cognitif du fœtus et de l’adulte. OC : ostéocalcine ; OC-sc : ostéocalcine sous-carboxylée ; GPRC6A : G protein-coupled receptor, class C, groupe 6, subtype A. |
|
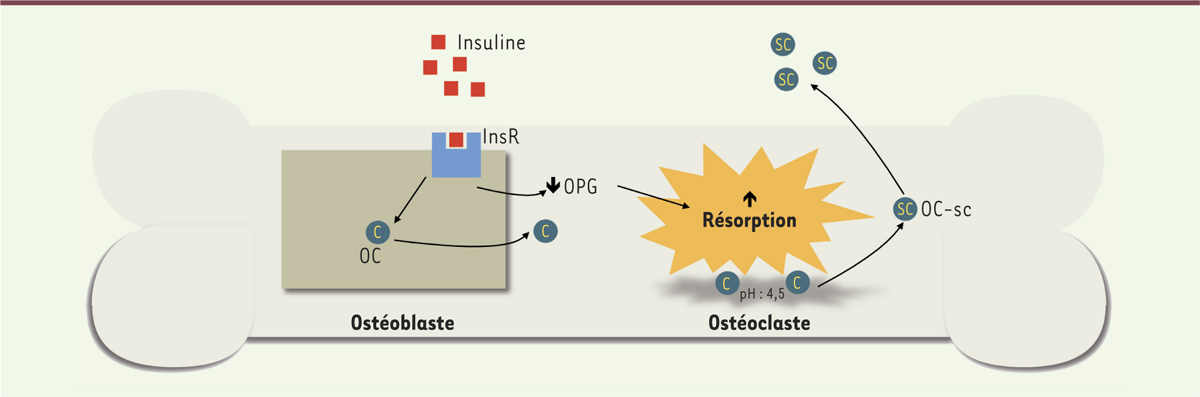
L’ostéocalcine, une hormone importante pour le métabolisme du glucose Les études chez l’animal L’hypothèse d’un lien entre l’OC et le métabolisme du glucose a émergé à la suite de travaux réalisés par Lee et al. sur le gène Esp ( embryonic stem cells phosphatase) [ 14]. Ces études, effectuées chez la souris, ont montré que les animaux qui n’exprimaient pas ce gène présentaient des taux d’OC sous-carboxylée plus élevés et, parallèlement, un nombre accru de cellules β pancréatiques ainsi qu’une augmentation de la sécrétion et de la sensibilité à l’insuline [ 14]. Les études qui ont suivi, menées par l’équipe de Karsenty et al., ont permis d’établir que la forme sous-carboxylée de l’OC agissait sur le métabolisme du glucose comme une hormone. L’OC sous-carboxylée est en effet reconnue au niveau des cellules β pancréatiques par un récepteur, le GPRC6A ( G protein-coupled receptor, class C, group 6, subtype A), qui, lorsqu’il est activé, induit la phosphorylation de protéines impliquées dans la sécrétion de l’insuline [ 15]. La liaison de l’OC sous-carboxylée au GPR6CA favorise également la prolifération des cellules β contribuant ainsi à augmenter davantage la sécrétion de l’insuline. L’OC stimule donc la production d’insuline par le pancréas. Comme nous l’avons vu, elle augmente également la sensibilité à l’insuline des organes cibles en favorisant la captation du glucose par les muscles, le foie et le tissu adipeux [ 13]. L’insuline peut, quant à elle, stimuler la sécrétion d’OC. Les ostéoblastes qui produisent la protéine expriment en effet un récepteur de l’insuline [16]. À la suite de sa liaison à son récepteur, l’insuline induit non seulement la formation osseuse mais elle diminue également l’expression de l’ostéoprotégérine, une protéine inhibitrice de la différenciation et de l’activation des ostéoclastes [16], les cellules responsables de la résorption de la matrice osseuse, ce qui a pour conséquence l’acidification de la matrice minérale osseuse et donc la décarboxylation de l’OC. L’insuline permet ainsi, en stimulant la résorption osseuse, d’augmenter la production et la biodisponibilié de l’OC sous-carboxylée (Figure 3).
 | Figure 3.
Régulation de la production d’ostéocalcine par l’insuline dans les ostéoblastes. La liaison de l’insuline à son récepteur sur les ostéoblastes induit la formation osseuse et la production d’ostéocalcine ainsi qu’une diminution de l’expression d’ostéoprotégérine, une protéine inhibitrice de la résorption osseuse par les ostéoclastes. L’augmentation de la résorption induit une acidification de la matrice osseuse. Cet environnement acide favorise la décarboxylation de l’ostéocalcine. Sous cette forme, l’affinité de l’ostéocalcine pour la matrice osseuse est diminuée, entraînant sa libération dans la circulation sanguine. InsR : récepteur de l’insuline ; OC : ostéocalcine ; OC-sc : ostéocalcine sous-carboxylée ; OPG : ostéoprotégérine. |
Les études chez l’homme Ostéocalcine et diabète Plusieurs études réalisées chez l’homme ont évalué les relations entre l’OC, les paramètres métaboliques et le diabète (Tableau I). Des corrélations ont ainsi été observées entre l’OC sous-carboxylée, les niveaux de glucose sanguin et la masse grasse chez des hommes et chez des femmes ménopausées atteints du diabète de type 2 [ 17]. Chez les hommes, le pourcentage de gras viscéral et sous-cutané, la glycémie et l’hémoglobine glyquée (HbA1c), qui reflète l’équilibre glycémique sur une longue période, sont inversement proportionnels aux taux d’OC sous-carboxylée mesurés dans le sang, et cela indépendamment de l’âge, de la durée du diabète, de la fonction rénale, de la proportion de masse grasse et du taux d’adiponectine sérique [ 17]. Ces associations ne se sont, en revanche, pas avérées significatives chez les femmes ménopausées et diabétiques de type 2 ayant participé à l’étude. La petite taille de l’échantillon pourrait expliquer l’absence de corrélations chez les sujets féminins. En effet, dans une étude impliquant une cohorte plus importante, regroupant 339 femmes ménopausées diabétiques et non diabétiques, une corrélation inverse a pu être observée entre les taux sériques d’OC totale et l’indice de résistance à l’insuline HOMA-IR ( homeostasis model assessment of insulin resistance), la glycémie à jeun et l’HbA1c [ 18]. Les niveaux d’OC des femmes diabétiques étaient par ailleurs plus faibles que ceux des femmes non diabétiques [ 18]. Il faut toutefois noter que cette étude a porté sur l’OC totale et non sur l’OC sous-carboxylée. Chez des enfants atteints du diabète de type 2, les taux d’OC sous-carboxylée sont également inversement corrélés à ceux de glucose sanguin et de HbA1c et les enfants diabétiques présentent des niveaux d’OC sous-carboxylée qui sont, comme chez les adultes diabétiques, inférieurs à ceux des sujets sains [ 19]. Chez des hommes atteints de diabète de type 1, les niveaux d’OC totale et sous-carboxylée sont abaissés par rapport à ceux mesurés chez des hommes sains [ 20], mais cette différence ne s’est pas avérée significative chez les femmes diabétiques. Dans cette étude, l’élévation de l’OC totale et sous-carboxylée était associée à des niveaux bas de HbA1c [ 20].
Tableau I.
| Corrélation positive |
Corrélation négative |
| Activité des cellules β
Sensibilité à l’insuline
Taux sanguin d’insuline
Taux sanguin d’adiponectine
HDL-cholestérol |
Pourcentage de gras corporel
Taux de glucose à jeun
HbA1c
Indice HOMA-IR
Poids et indice de masse corporelle
Triglycérides
LDL-cholestérol
Stéatose hépatique non-alcoolique |
Corrélations avec les variables métaboliques dans les études humaines. HbA1c : hémoglobine glyquée ; HDL : high-density lipoprotein ; HOMA-IR : homeostasis model assessment of insulin resistance ; LDL : low-density lipoprotein. |
En somme, l’OC favorise un meilleur contrôle glycémique chez les sujets diabétiques de type 1 et 2. L’impact du sexe sur les niveaux sériques d’OC reste cependant à valider. À ce jour, les études réalisées chez l’homme ne sont qu’observationnelles. Elles ne confirment pas encore l’existence d’un lien direct de causalité entre OC et contrôle de la glycémie. Ostéocalcine, obésité et syndrome métabolique Les relations entre l’OC (totale et sous-carboxylée), la sensibilité à l’insuline et l’activité des cellules β pancréatiques ont été examinées dans une étude impliquant des adultes en surpoids ou obèses (indice de masse corporelle [IMC] moyen de 33) [ 21]. Chez ces patients, une élévation des taux d’OC a été associée à une meilleure sensibilité à l’insuline au niveau des muscles, mais pas au niveau du foie. Parmi ces sujets, chez les obèses intolérants au glucose, l’OC sous-carboxylée était également corrélée à une plus grande activité des cellules β en situation postprandiale. Il semble donc que, dans l’obésité, des niveaux plus élevés d’OC permettraient une augmentation de la production d’insuline par les cellules β et de la sensibilité à l’insuline des tissus. D’autres études ont évalué les effets possibles de la perte de poids sur les taux d’OC circulante. Chez des femmes obèses ayant suivi une diète hypocalorique durant une période de 16 semaines, aucun changement des taux sériques d’OC n’a été observé, en dépit d’une perte de poids significative (en moyenne une perte de 7,3 % par rapport au poids initial) et d’une amélioration de la sensibilité à l’insuline [ 22]. Les femmes ayant combiné cette diète hypocalorique à une activité physique (entraînement de résistance) ont montré, quant à elles, en plus de la perte de poids (en moyenne de 8,7 % par rapport au poids initial) et de la meilleure sensibilité à l’insuline, une élévation des taux d’OC sanguins. La réduction du poids combinée à l’activité physique semble donc associée à une amélioration de la sensibilité à l’insuline liée à l’augmentation des niveaux d’OC circulante [ 22]. L’OC sous-carboxylée n’a toutefois pas été mesurée dans cette étude. Chez les adolescents, des niveaux d’OC significativement plus bas ont été observés chez les sujets obèses (n = 60) par rapport aux sujets non obèses (n = 19) [ 23]. Après un an de suivi visant une perte de poids, une élévation des concentrations d’OC et une réduction de la résistance à l’insuline ont été observées chez les 29 adolescents ayant perdu du poids. Chez les 31 sujets obèses n’ayant pas enregistré de perte de poids, les taux d’OC et la résistance à l’insuline sont demeurés inchangés [ 23]. L’effet de l’activité physique et de la perte de poids a également été examiné dans une autre étude portant sur 27 enfants obèses âgés de 12 à 15 ans. Une augmentation de la densité minérale osseuse, de l’OC totale et sous-carboxylée et du niveau d’insuline a été constatée chez les enfants ayant suivi un programme d’entraînement d’une durée de 6 mois. Aucune modification n’a été observée chez les enfants obèses qui n’ont pas suivi ce programme [ 24]. Cette étude d’intervention montre donc qu’une augmentation de la densité minérale osseuse induite par l’exercice aurait un effet favorable sur la production d’OC qui, à son tour, stimulerait la sécrétion de l’insuline. Dans l’ensemble, les études portant sur l’obésité démontrent que les niveaux d’OC sont abaissés chez les individus en surpoids. Son augmentation résultant d’une perte de poids est corrélée à une meilleure sécrétion et sensibilité à l’insuline. L’activité physique, pour sa part, semble favoriser l’élévation des niveaux d’OC chez les personnes obèses. L’amélioration du métabolisme du glucose par l’OC a également pu être constatée dans le syndrome métabolique pour lequel l’obésité et la résistance à l’insuline sont des composantes centrales. Avec l’hypertension et la dyslipidémie, l’obésité et la résistance à l’insuline définissent ce syndrome qui accroît le risque de maladies cardiovasculaires, d’accident vasculaire cérébral et de diabète [25]. Dans une étude portant sur 135 femmes post-ménopausées dont 52 présentaient un syndrome métabolique, les niveaux d’OC sous-carboxylée dans le sang se sont avérés être inversement proportionnels aux taux sanguins de triglycérides et de leptine1, à l’indice HOMA-IR, mais associés positivement à l’adiponectine [26]. Les taux de leptine et l’indice HOMA-IR constituaient dans cette étude, les variables indépendantes de prédiction les plus importantes de l’OC sérique [26]. En d’autres termes, dans le syndrome métabolique, le taux d’OC sanguin est inversement associé à certains marqueurs de l’obésité et de la résistance à l’insuline. Des résultats similaires ont été retrouvés dans une autre cohorte associant hommes et femmes atteints du syndrome métabolique. Comme précédemment, l’OC sérique était inversement corrélée à l’IMC, à la glycémie à jeun, aux taux de triglycérides et de leptine, et positivement associée aux niveaux d’adiponectine [27]. De même, dans une cohorte composée de 1 290 hommes âgés entre 40 et 78 ans, une corrélation inverse a été observée entre les taux d’OC totale et le syndrome métabolique et plusieurs facteurs de risque cardiovasculaires tels l’IMC, le pourcentage de gras corporel, le glucose à jeun, l’indice HOMA-IR, les triglycérides sanguins et le LDL-cholestérol (low-density lipoprotein) [28]. En revanche, l’OC totale s’est avérée positivement liée aux niveaux de HDL-cholestérol (high-density lipoprotein). L’OC ne semble donc pas associée au développement des maladies cardiovasculaires [28]. Un certain nombre de travaux ont exploré le lien possible entre l’OC et la stéatose hépatique non alcoolique (SHNA), une affection du foie dans laquelle le métabolisme du glucose et la sensibilité à l’insuline sont fortement perturbés. En particulier, chez des sujets atteints de coronopathies et présentant ou non une stéatose, les niveaux d’OC sérique apparaissent inversement proportionnels à la survenue d’une SHNA, au taux de glucose sanguin et de HbA1c. Ils se sont ainsi révélés être un prédicteur indépendant de la SHNA [29]. De telles corrélations négatives entre l’OC et la SHNA ont également été observées dans différentes populations : hommes coréens [30], femmes chinoises ménopausées [31] et femmes ne présentant pas d’ostéopénie ou d’ostéoporose, indépendamment de leur statut ménopausal [32]. Malgré les limites de l’interprétation des études de corrélation, les travaux réalisés chez l’homme semblent montrer un effet protecteur de l’OC contre l’obésité, le syndrome métabolique et la SHNA, en favorisant les paramètres glycémiques et lipidiques, soutenant en cela l’hypothèse selon laquelle l’os constituerait un organe endocrine. |
L’ostéocalcine, un traitement potentiel pour les maladies endocriniennes ? L’ensemble des études menées au cours de la dernière décennie tend à reconnaître l’OC comme une protéine osseuse capable de moduler certains processus impliqués dans le métabolisme énergétique. Cependant, ces études présentent quelques limites. Alors que peu d’investigations concernant l’homme ont en fait évalué l’OC sous sa forme sous-carboxylée, l’essentiel des analyses portant sur l’OC totale, dans la majorité des études animales, l’OC sous-carboxylée a été identifiée comme étant la forme active de l’OC au niveau périphérique [33–35]. L’évaluation du lien potentiel existant entre l’OC et le métabolisme du glucose chez l’homme a porté jusqu’à présent sur des populations hétérogènes, notamment en ce qui concerne l’état de santé, l’âge et le sexe. Il est finalement important de considérer que les résultats obtenus proviennent, pour la plupart, d’études transversales et observationnelles qui ne permettent que d’établir des corrélations entre l’OC et le métabolisme du glucose, les relations de cause à effet restant à établir. Des études d’intervention sur de grands échantillons populationnels homogènes seront nécessaires pour confirmer l’existence de ce lien entre l’OC et la régulation du métabolisme du glucose et pour identifier la forme active de la protéine chez l’homme. La recherche dans le domaine est prometteuse et pourrait permettre l’élaboration de nouvelles stratégies pharmacologiques pour le traitement des maladies endocriniennes. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Veldhuis-Vlug AG, Fliers E, Bisschop PH. Bone as a regulator of glucose metabolism . Neth J Med. 2013; ; 71 : :396.–400. 2.
Confavreux CB, Ferron M. Le diabète est tombé sur un os…. Med Sci (Paris). 2008; ; 24 : :21.–23. 3.
Ferron M, Lacombe J. Regulation of energy metabolism by the skeleton: osteocalcin and beyond . Arch Biochem Biophys. 2014; ; 561 : :137.–146. 4.
Shao J, Wang Z, Yang T, et al. Bone regulates glucose metabolism as an endocrine organ through osteocalcin . Int J Endocrinol. 2015; ; 2015 : :967673.. 5.
Marie P. Différenciation, fonction et contrôle de l’ostéoblaste . Med Sci (Paris). 2001; ; 17 : :1252.–1259. 6.
Booth SL, Centi A, Smith SR, Gundberg C. The role of osteocalcin in human glucose metabolism: marker or mediator? Nat Rev Endocrinol. 2013; ; 9 : :43.–55. 7.
Ducy P, Desbois C, Boyce B, et al. Increased bone formation in osteocalcin-deficient mice . Nature. 1996; ; 382 : :448.–452. 8.
Oury F, Sumara G, Sumara O, et al. Endocrine regulation of male fertility by the skeleton . Cell. 2011; ; 144 : :796.–809. 9.
Oury F, Ferron M, Huizhen W, et al. Osteocalcin regulates murine and human fertility through a pancreas-bone-testis axis . J Clin Invest. 2013; ; 123 : :2421.–2433. 10.
Oury F, Khrimian L, Denny CA, et al. Maternal and offspring pools of osteocalcin influence brain development and functions . Cell. 2013; ; 155 : :228.–241. 11.
Brennan-Speranza TC, Henneicke H, Gasparini SJ, et al. Osteoblasts mediate the adverse effects of glucocorticoids on fuel metabolism . J Clin Invest. 2012; ; 122 : :4172.–4189. 12.
Levinger I, Jerums G, Stepto NK, et al. The effect of acute exercise on undercarboxylated osteocalcin and insulin sensitivity in obese men . J Bone Miner Res. 2014; ; 29 : :2571.–2576. 13.
Hill HS, Grams J, Walton RG, et al. Carboxylated and uncarboxylated forms of osteocalcin directly modulate the glucose transport system and inflammation in adipocytes . Horm Metab Res. 2014; ; 46 : :341.–347. 14.
Lee NK, Sowa H, Hinoi E, et al. Endocrine regulation of energy metabolism by the skeleton . Cell. 2007; ; 130 : :456.–469. 15.
Wei J, Karsenty G. An overview of the metabolic functions of osteocalcin . Rev Endocr Metab Disord. 2015; ; 16 : :93.–98. 16.
Ferron M, Wei J, Yoshizawa T, et al. Insulin signaling in osteoblasts integrates bone remodeling and energy metabolism . Cell. 2010; ; 142 : :296.–308. 17.
Kanazawa I, Yamaguchi T, Yamauchi M, et al. Serum undercarboxylated osteocalcin was inversely associated with plasma glucose level and fat mass in type 2 diabetes mellitus . Osteoporos Int. 2011; ; 22 : :187.–194. 18.
Im JA, Yu BP, Jeon JY, Kim SH. Relationship between osteocalcin and glucose metabolism in postmenopausal women . Clin Chim Acta. 2008; ; 396 : :66.–69. 19.
Takaya J, Tanabe Y, Kuroyanagi Y, Kaneko K. Decreased undercarboxylated osteocalcin in children with type 2 diabetes mellitus . J Pediatr Endocrinol Metab. 2016; ; 29 : :879.–884. 20.
Neumann T, Lodes S, Kastner B, et al. Osteocalcin, adipokines and their associations with glucose metabolism in type 1 diabetes . Bone. 2016; ; 82 : :50.–55. 21.
Gower BA, Pollock NK, Casazza K, et al. Associations of total and undercarboxylated osteocalcin with peripheral and hepatic insulin sensitivity and beta-cell function in overweight adults . J Clin Endocrinol Metab. 2013; ; 98 : :E1173.–E1180. 22.
Fernandez-Real JM, Izquierdo M, Ortega F, et al. The relationship of serum osteocalcin concentration to insulin secretion, sensitivity, and disposal with hypocaloric diet and resistance training . J Clin Endocrinol Metab. 2009; ; 94 : :237.–245. 23.
Reinehr T, Roth CL. A new link between skeleton, obesity and insulin resistance: relationships between osteocalcin, leptin and insulin resistance in obese children before and after weight loss . Int J Obes (Lond). 2010; ; 34 : :852.–858. 24.
Rochefort GY, Rocher E, Aveline PC, et al. Osteocalcin-insulin relationship in obese children: a role for the skeleton in energy metabolism . Clin Endocrinol (Oxf). 2011; ; 75 : :265.–270. 25.
Alberti KG, Zimmet P, Shaw J. Group IDFETFC. The metabolic syndrome: a new worldwide definition . Lancet. 2005; ; 366 : :1059.–1062. 26.
Lee SW, Jo HH, Kim MR, et al. Association between osteocalcin and metabolic syndrome in postmenopausal women . Arch Gynecol Obstet. 2015; ; 292 : :673.–681. 27.
Saleem U, Mosley TH, Jr, Kullo IJ. Serum osteocalcin is associated with measures of insulin resistance, adipokine levels, and the presence of metabolic syndrome . Arterioscler Thromb Vasc Biol. 2010; ; 30 : :1474.–1478. 28.
Hwang YC, Kang M, Cho IJ, et al. Association between the circulating total osteocalcin level and the development of cardiovascular disease in middle-aged men: a mean 8.7-year longitudinal follow-up study . J Atheroscler Thromb. 2015; ; 22 : :136.–143. 29.
Du J, Pan X, Lu Z, et al. Serum osteocalcin levels are inversely associated with the presence of nonalcoholic fatty liver disease in patients with coronary artery disease . Int J Clin Exp Med. 2015; ; 8 : :21435.–21441. 30.
Yang HJ, Shim SG, Ma BO, Kwak JY. Association of nonalcoholic fatty liver disease with bone mineral density and serum osteocalcin levels in Korean men . Eur J Gastroenterol Hepatol. 2016; ; 28 : :338.–344. 31.
Luo YQ, Ma XJ, Hao YP, et al. Inverse relationship between serum osteocalcin levels and nonalcoholic fatty liver disease in postmenopausal Chinese women with normal blood glucose levels . Acta Pharmacol Sin. 2015; ; 36 : :1497.–1502. 32.
Sinn DH, Gwak GY, Rhee SY, et al. Association between serum osteocalcin levels and non-alcoholic fatty liver disease in women . Digestion. 2015; ; 91 : :150.–157. 33.
Ferron M, Hinoi E, Karsenty G, Ducy P. Osteocalcin differentially regulates beta cell and adipocyte gene expression and affects the development of metabolic diseases in wild-type mice . Proc Natl Acad Sci USA. 2008; ; 105 : :5266.–5270. 34.
Ferron M, McKee MD, Levine RL, et al. Intermittent injections of osteocalcin improve glucose metabolism and prevent type 2 diabetes in mice . Bone. 2012; ; 50 : :568.–575. 35.
Mizokami A, Yasutake Y, Gao J, et al. Osteocalcin induces release of glucagon-like peptide-1 and thereby stimulates insulin secretion in mice . PLoS One. 2013; ; 8 : :e57375.. |