Préservation et reperfusion de l’organe greffé
2009
7-
Syndrome d’ischémie/reperfusion et préservation en transplantation rénale
En transplantation rénale, seulement un tiers des patients inscrits sur liste d’attente sont greffés chaque année. Ce constat amène à rechercher de nouvelles sources de greffons pour tenter de remédier à cette pénurie. Le prélèvement des organes provenant des donneurs à cœur arrêté est une piste actuellement suivie par plusieurs équipes. Ces considérations amènent à repenser les moyens de conservation et leur pertinence pour ce genre de donneurs. Actuellement, les reins provenant de donneurs en état de mort encéphalique sont soumis obligatoirement à une période de conservation à 4 °C (ischémie froide) en attendant d’être attribués à un receveur compatible, puis transplantés.
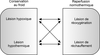
Tous les organes en transplantation sont exposés aux lésions du syndrome d’ischémie/reperfusion. Ce syndrome regroupe actuellement un ensemble de processus physiopathologiques responsable de lésions au niveau du greffon. Ces lésions sont liées à l’hypothermie
per se et à l’hypoxie contemporaines de la conservation, mais également au réchauffement associé à la réoxygénation de l’organe au cours de la reperfusion (Rauen et de Groot, 2004

et figure 7.1

).
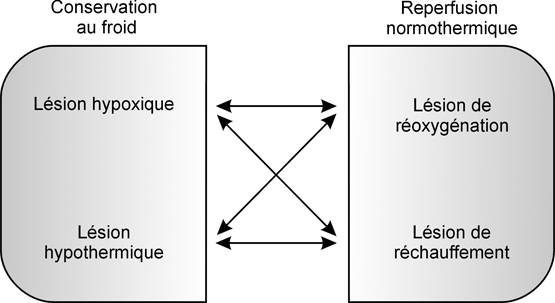
En réalité, l’ischémie/reperfusion (I/R) s’intègre dans un processus plus large incluant les lésions de l’organe associées à la phase de réanimation du donneur, à la mort encéphalique, aux difficultés du prélèvement et aux conditions de la transplantation chez le receveur, ainsi que les lésions cérébrales. Il faut également ajouter les facteurs de risque du receveur qui peuvent contribuer au développement des lésions du greffon (Pratschke et coll., 2004

; Bos et coll., 2007

; tableau 7.I

).
Tableau 7.I Principales étapes pouvant influencer le développement de lésions au niveau du greffon
|
Étape
|
Facteur
|
|
Donneur
|
Causes de la mort
Morbidités associées (hypertension artérielle, dyslipidémie...)
Traitements utilisés
Mort encéphalique
|
|
Phase de réanimation
|
Instabilité hémodynamique
Problèmes d’oxygénation adaptée
Orage végétatif
Administration de vasoconstricteurs
|
|
Prélèvement
Conservation
|
Difficultés techniques
Saignement
Refroidissement difficile
Conservation de mauvaise qualité
Durée d’ischémie froide prolongée
|
|
Reperfusion
Devenir à long terme
|
Durée d’anastomose
Facteurs immunologiques
Traitement immunosuppresseur
|
Impacts de l’ischémie/reperfusion sur la survie du greffon et conséquences cliniques
L’I/R est un des facteurs majeurs à l’origine de la reprise retardée de fonction qui entraîne un surcoût de la transplantation par l’hospitalisation prolongée et la nécessité de recourir à des séances de dialyse, et surtout un risque accru de rejet aigu et une réduction de la survie des greffons à long terme. La fréquence des reprises retardées de fonction varie entre 2 et 50 % en fonction des équipes, du type de donneur, de la durée de conservation et des difficultés techniques (Perico et coll., 2004

). Dans le contexte actuel de manque d’organes, les lésions d’I/R sont prépondérantes avec des facteurs favorisants comme l’âge du donneur supérieur à 60 ans, une ischémie froide
1
L’ischémie froide correspond au délai qui s’écoule entre le clampage définitif de l’aorte chez le donneur au moment du prélèvement et la reperfusion de l’organe chez le receveur.
de durée supérieure à 24 h, une ischémie chaude
2
L’ischémie chaude correspond au délai pendant lequel l’organe est encore dans l’organisme, in situ, non ou mal perfusé.
associée et prolongée, et la cause de la mort encéphalique (accident vasculaire) (figure 7.2

). Les lésions préexistantes au niveau des reins chez le donneur sont également à prendre en compte comme les lésions de glomérusclérose avec atrophie tubulaire ou les lésions de fibrose interstitielle et vasculaires (Schwarz et Oberbauer, 2003

; Opelz et Döhler, 2007

). Les facteurs impliqués dans la non-fonction primaire
3
La non-fonction primaire du greffon est une reprise insuffisante de la fonction du greffon, incompatible avec la survie du receveur. Le seul traitement est la retransplantation.
du greffon semblent liés aux complications chirurgicales, à l’âge du donneur et du receveur supérieur à 60 ans, à un mauvais appariement HLA donneur/receveur et à une durée prolongée sur liste d’attente (Weiss-Salz et coll., 2004

). D’autres facteurs peuvent intervenir parmi lesquels les complications vasculaires (thromboses ou sténoses), les infections, les effets secondaires des agents immunosuppresseurs et la non observance du traitement (Pratschke et coll., 2008

). À l’ensemble de ces facteurs non immunologiques peuvent se surajouter des facteurs immunologiques qui vont conditionner le devenir du greffon. L’I/R est lui-même un facteur non immunologique influençant de façon précoce le devenir du greffon pour différents organes (Shaw et coll., 1985

; Vacanti et coll., 1987

; Greig et coll., 1989

; Ploeg et coll., 1993

; Sheridan et Bonventre, 2000

; Weiss et coll., 2007

).
Le phénomène d’I/R, initialement considéré comme un événement entourant le prélèvement, la conservation et la reperfusion, inclut aujourd’hui plus largement l’état du donneur, avec la période de la mort encéphalique ou celle de l’ischémie chaude dans le cas des donneurs à cœur arrêté.
La mort encéphalique entraîne des modifications hormonales avec une diminution de l’ADH (hormone anti-diurétique), de l’ACTH (
Adreno CorticoTropic Hormone), des hormones thyroïdiennes et de la TSH (
Thyroid Stimulating Hormone). Ces anomalies s’associent à une instabilité hémodynamique, à une production de catécholamines et de cytokines, à une réaction inflammatoire et à l’activation du complément (Bos et coll., 2007

). Il s’ensuit des modifications de la volémie
4
Volémie : volume sanguin total
, l’installation d’un diabète insipide
5
Diabète insipide : maladie se caractérisant par une incapacité des reins à concentrer les urines
, pouvant s’accompagner d’une hypoperfusion du rein. L’endothélium est activé par un afflux de cellules inflammatoires et une activation de la coagulation qui vont avoir des conséquences sur le devenir de l’organe. Dans ce contexte, des moyens de protection vont se mettre en place et concernent l’hème-oxygénase 1 (HO-1), les
Heat Shock Proteins (HSP 70) et la manganèse superoxyde dismutase (MnSOD) (Nijboer et coll., 2004

; Schuurs et coll., 2004

; Bos et coll., 2005

). Dans le cas d’une transplantation à partir de donneur vivant, l’expression de HO-1 peut être le témoin de la mise en place de moyens de protection tandis que dans celui d’un donneur en mort encéphalique, il peut au contraire être le marqueur des lésions (Bos et coll., 2007

).
À ce jour, le mode de conservation le plus utilisé pour les greffons après leur prélèvement reste la conservation statique dans une solution à 4 °C, après que l’organe ait été correctement lavé, le plus souvent par la même solution de conservation. Le but principal est de maintenir la viabilité des différents organes
ex vivo pendant une période de temps suffisante pour leur transport éventuel du centre préleveur vers les centres transplanteurs, leur attribution selon le degré d’urgence, de priorité ou de meilleure compatibilité tissulaire et l’utilisation de tous les organes prélevés. La durée de conservation peut aller jusqu’à 48 heures (d’après les modèles théoriques thermodynamiques et d’après des données expérimentales). La gestion des organes est très différente selon qu’il s’agit d’un organe vital comme le cœur, le foie et le poumon, ou le rein pour lequel un retard à la reprise de fonction du greffon est tolérable grâce au recours à l’hémodialyse. Il est admis que la durée de la conservation représente un des facteurs prépondérants de reprise différée de fonction des greffons, avec une limite idéalement pour le rein se situant aux environs de 18 h (Opelz et Döhler, 2007

).
Il apparaît que les solutions de conservation ne peuvent prévenir de façon exhaustive les lésions liées à l’I/R (Rauen et De Groot, 2004

; Salahudeen, 2004

; Jamieson et Friend, 2008

). Les avancées récentes sur les mécanismes physiopathologiques impliqués dans l’I/R ont permis de mettre en évidence les composants importants de ce processus (Salahudeen, 2004

).
Les conséquences des lésions d’I/R concernent tous les organes et l’effet le plus tangible est la reprise différée de fonction qui peut se définir comme la divergence entre la capacité fonctionnelle de l’organe transplanté et les besoins physiologiques du receveur. Le retard de fonction entraîne des difficultés dans la prise en charge des patients au décours de la transplantation en particulier pour le diagnostic de rejet aigu, l’adaptation posologique des médicaments potentiellement néphrotoxiques, un allongement de la durée d’hospitalisation et un surcoût évident.
L’I/R peut favoriser le risque de rejet aigu avec la mise en évidence d’une augmentation de la production de cytokines et d’une hyperexpression des antigènes du CMH (complexe majeur d’histocompatibilité) de classe I et II sur les cellules présentatrices, responsable d’une immunogénicité accrue. Plusieurs études ont confirmé que les patients présentant des reprises différées de fonction immédiatement après la greffe ont un pourcentage élevé de rejets aigus (Nicholson et coll., 1996

; Ojo et coll., 1997

). Ces faits restent d’actualité avec l’emploi des nouveaux traitements immunosuppresseurs (Mikhalski et coll., 2008

). Les lésions précoces peuvent aussi participer au développement des lésions chroniques par le biais de l’immunité innée (Land, 2005a

et b

).
Des études récentes (Land, 2005b

; Boros et Bromberg, 2006

) expérimentales et cliniques suggèrent que des composés mis en jeu dans le processus d’I/R pourraient contribuer au développement des lésions chez le patient transplanté :
• les espèces réactives de l’oxygène (ERO) activent le système inné du donneur et du receveur ;
• certains ligands des Toll-Like Receptors (TLRs) au niveau de l’hôte comme les HSP interagissent avec les cellules dendritiques TLR4 positives et les activent. Les cellules dendritiques induisent la réponse allo-immune adaptative (rejet aigu). Les cellules dendritiques interagissent également avec les cellules vasculaires TLR4 positives et les activent, contribuant ainsi au développement des lésions chroniques ;
• la signalisation liée au TLR4 est impliquée dans les lésions de reperfusion, et semble impliquer le marqueur de différenciation myéloïde 88-indépendant, le domaine Toll du récepteur de l’interleukine-1 induisant l’activation des voies dépendantes de l’interféron γ (IFN-γ) qui semblent associées à la maturation des cellules dendritiques.
Mécanismes physiologiques mis en jeu au cours de la conservation
Depuis plusieurs dizaines d’années, les principes de la conservation ont reposé sur des principes et des bases empiriques (Hicks et coll., 2006

). Les deux points essentiels étaient :
• l’hypothermie autour de 4 °C reposant sur le principe de la diminution du métabolisme de 50 %, en réduisant la température par paliers de 10 °C ;
• la composition d’une solution de conservation devait ressembler au milieu intra-cellulaire avec une composition essentiellement hyperpotassique.
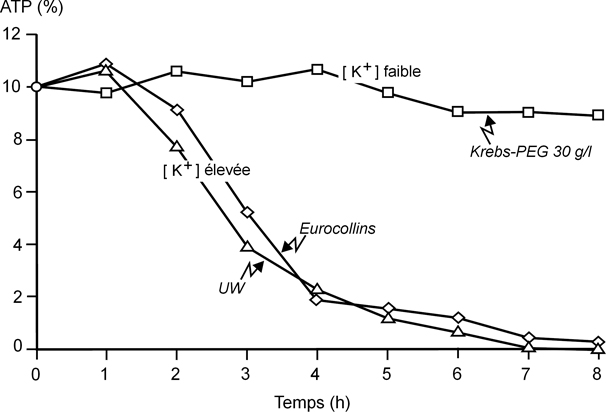
Potassium et ATP
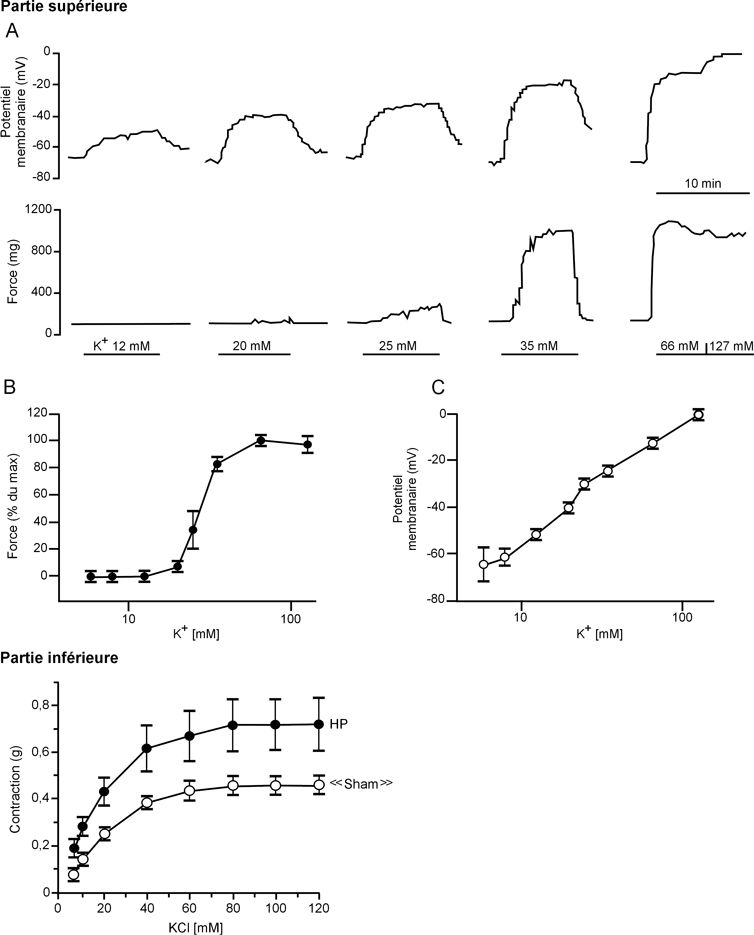
Les solutions de conservation hyperpotassiques présentent des effets indésirables, qui étaient partiellement masqués par les effets bénéfiques des colloïdes et des imperméants ajoutés aux premières solutions cristalloïdes pures. Les concentrations élevées en K
+ sont à l’origine d’une dépolarisation cellulaire, qui induit au niveau du muscle lisse vasculaire une contraction par ouverture des canaux calciques dépendants du voltage (figure 7.3

). La vasoconstriction induite, même si elle est plus faible à 4 °C, augmente les pressions de perfusion pendant le rinçage de l’organe, et diminue le débit de perfusion pendant la reperfusion. Pour combattre cette vasoconstriction, certaines équipes ajoutent des inhibiteurs calciques aux solutions de conservation, alors qu’il suffirait d’utiliser des solutions non-hyperpotassiques. La perte du gradient de concentration potassique de part et d’autre de la membrane cellulaire entraîne une accélération du fonctionnement des pompes ioniques qui accentue la déplétion en composés riches en énergie (ATP et, selon les tissus, phosphocréatine) (figure 7.4

). La dégradation de l’ATP représente la principale source de protons H
+ génératrice d’acidose.
Ces effets du potassium et de la chute de l’ATP ne sont pas sans conséquence sur le lit vasculaire de l’organe conservé et en particulier en cas de conservation prolongée. Dragun et coll. ont rapporté l’effet de la conservation prolongée sur les lésions vasculaires (Dragun et coll., 2001

).
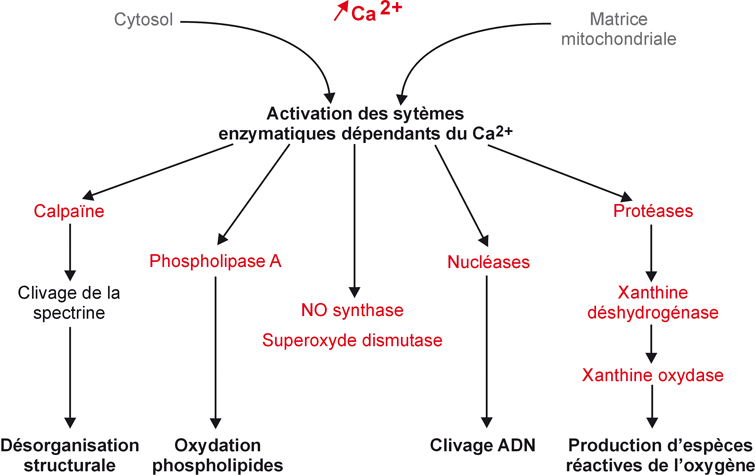
Calcium
Le Ca
2+ joue également un rôle important (et variable suivant l’organe conservé) au cours de l’hypoxie et de l’hypothermie. Ce rôle est lié au fait que le Ca
2+ est régulé de manière extrêmement étroite au niveau du cytosol et dans les différents organites et réservoirs de la cellule. Il joue un rôle majeur dans l’activation de différentes protéases comme la calpaïne, ou celle d’autres composés intervenant dans la formation de xanthine oxydase. La calpaïne intervient dans l’altération du cytosquelette de la cellule (Jassem et coll., 2002

; Rauen et De Groot, 2004

; Salahudeen, 2004

; Jamieson et Friend, 2008

) (figure 7.5

).
Il est clair que l’homéostasie calcique est perturbée lors de la conservation à cause des dysfonctions des différents transporteurs impliqués dans sa régulation (Rauen et de Groot, 2004

). Une augmentation de la concentration du Ca
2+ cytosolique est reconnue comme un médiateur décisif des lésions d’hypoxie dans différents types cellulaires incluant les cellules tubulaires rénales, les hépatocytes et les cardiomyocytes (Blankensteijn et Terpstra, 1991

; Kribben et coll., 1994

; Rosser et Gores, 1995

; Piper et Garcia-Dorado, 1999

; Auger et coll., 2003

; Padanilam, 2003

). L’augmentation du Ca
2+ cytosolique est liée à l’inhibition des transporteurs ATP dépendants et induit l’activation de nombreuses enzymes dépendantes du Ca
2+ qui vont participer à de nombreux mécanismes lésionnels létaux au niveau de la cellule. La surcharge calcique est retrouvée également au niveau de la mitochondrie et entraîne des effets délétères pour l’intégrité et les fonctions de celle-ci.
Imperméants et colloïdes
Au syndrome d’ischémie/reperfusion est associé un œdème cellulaire lié entre autres à l’accumulation des métabolites produits pendant la dégradation de l’ATP et à la production d’ions H+, qui surviennent pendant la conservation hypothermique. L’œdème, intracellulaire et interstitiel, est particulièrement délétère sur la viabilité cellulaire et l’intégrité de la matrice extracellulaire. L’œdème tissulaire entraîne par ailleurs une compression du lit vasculaire et une augmentation de la résistance vasculaire qui diminue le débit de perfusion de l’organe au moment de la reperfusion. Au niveau intracellulaire, il entraîne un gonflement mitochondrial qui s’accompagne d’un dysfonctionnement du métabolisme aérobie, d’une augmentation de la production de radicaux libres oxygénés et de la destruction des membranes cellulaires. La présence dans le milieu extracellulaire de molécules exerçant une pression oncotique permettant d’éviter l’œdème est indispensable. Il est classique de diviser les molécules limitant l’œdème en deux familles : les imperméants et les colloïdes.
Les imperméants sont soit des sucres (raffinose, sucrose, mannitol, glucose) qui limitent par la pression osmotique qu’ils exercent dans le compartiment vasculaire, la formation de l’œdème intracellulaire (leur efficacité étant proportionnelle à l’importance de leur poids moléculaire) ; soit des anions tels que le citrate, le gluconate ou l’acide lactobionique qui présentent également un effet protecteur de membrane. Le glucose pouvant passer la membrane cellulaire n’est pas considéré comme un imperméant efficace (Mühlbacher et coll., 1999

). Les autres saccharides comme le mannitol, le sucrose, ou le raffinose ont été employés dans différentes solutions (Coffey et Andrews, 1983

; Lam et coll., 1989

). Les imperméants qui ne sont pas des sucres comme le gluconate, le citrate ou le lactobionate limitent l’œdème cellulaire par leur effet électrochimique et l’efficacité de ces anions est déterminée par leur charge et leur poids moléculaire.
Les colloïdes tels que l’hydroxy-éthyl amidon (HEA), le polyéthylèneglycol (PEG), l’albumine, le dextran… ne peuvent pas passer la membrane cellulaire et préviennent la constitution d’un œdème interstitiel par la pression oncotique qu’ils exercent au niveau de l’espace intra vasculaire. Leur utilisation semble particulièrement bénéfique pour des temps d’ischémie longs. Le rôle de certains de ces colloïdes comme l’HEA reste discuté (Ploeg et coll., 1992

; van der Plaats et coll., 2004

). Il a été démontré que l’HEA augmentait les amas des globules rouges pouvant perturber le lavage et induire une reperfusion inhomogène (Morariu et coll., 2003

; van der Plaats et coll., 2004

). Ces constatations ont conduit à l’évaluation de nouvelles molécules comme le PEG qui semble prometteur (Ben Abdennebi et coll., 2002

; Faure et coll., 2004a

et b

; Dutheil et coll., 2006

; Fuller et coll., 2006

; Maathuis et coll., 2008

; Hauet et Eugene, 2008

).
Le fait que les solutions de conservation doivent au moins être pourvues d’un imperméant ou d’un colloïde est acquis. Les solutions ne comportant pas de telles associations de molécules comme les solutions Custodiol
® ou Celsior
® démontrent une efficacité limitée pour des temps de conservation prolongée (> 18 h) mais inchangée pour des temps plus courts (Fiser et coll., 2001

; McLaren et Friend, 2003

; Agarwal et coll., 2006

; Maathuis et coll., 2007a

; Opelz et Döhler, 2007

).
La perfusion de l’organe au moment du prélèvement, et donc la qualité du rinçage du lit vasculaire, seront d’autant meilleures que la viscosité de la solution sera basse. Il est donc clair qu’une solution idéale est une solution dont l’index de viscosité n’est pas trop élevé. Cependant, la solution UW qui a une viscosité cinématique d’environ 3,159 cSt (centistoke) donne d’aussi bons résultats que d’autres liquides dont la viscosité est inférieure à 1,2 cSt, ce qui prouve que d’autres facteurs déterminants sont associés. Par ailleurs, il ne faut pas oublier que les solutions à pression oncotique élevée sont généralement plus visqueuses que celles à pression oncotique basse. Il est vraisemblable que la viscosité des solutions (à condition de ne pas être trop élevée) contribue à une meilleure élimination des cellules circulantes par effet d’entraînement dans le lit vasculaire de l’organe perfusé. Toutefois, la viscosité diminuerait le lavage de certains territoires capillaires et augmenterait les pressions de perfusion (Badet et coll., 2006

).
Acidose et ATP
Le rôle de l’acidose et de la déplétion énergétique reste également un point majeur (Southard et Belzer, 1995

; Hicks et coll., 2006

). L’hydrolyse de l’ATP est la principale source de protons et est responsable de l’acidose. La production anaérobie de lactate – qui consomme des protons – permet la réoxydation du NADH en NAD et ainsi le maintien pendant un certain temps de la production d’ATP par la glycolyse anaérobie. Il se développe donc une acidose intracellulaire qui se stabilise autour d’un pH à 6 ± 0,2. Un certain degré d’acidose intracellulaire exerce toutefois des effets bénéfiques pendant la conservation à 4 °C en limitant la surcharge calcique. Les princi-paux tampons fréquemment utilisés sont les tampons bicarbonate, phosphate, histidine, HEPES, tryptophane (Southard et Belzer, 1995

). Le rôle indispensable du tampon est d’amortir les variations de pH du compartiment intra vasculaire, interstitiel et cellulaire. La valeur finale du pH intracellulaire en fin d’ischémie varie relativement peu (0,2 à 0,3 unités pH) en fonction des différents systèmes tampon utilisés (Southard et Belzer, 1995

; Hicks et coll., 2006

).
Composition électrolytique
Enfin, le dernier aspect concerne la composition électrolytique. Il était initialement admis que les solutions de conservation devaient être hyperpotassiques comme le milieu intracellulaire, permettant de limiter l’entrée d’eau et de Na
+ dans la cellule. Cependant, plusieurs constatations remettent en cause ce principe. Tout d’abord, la physiologie de la cellule impose de disposer de part et d’autres de sa membrane d’un milieu intra-cellulaire et extra-cellulaire (riche en Na
+). Le K
+ est un vasoconstricteur puissant et de ce fait a un effet sur le lit vasculaire des organes gênant ainsi le lavage et perturbant la reperfusion aggravant le phénomène de
no-reflow (non-recirculation). La susceptibilité de la cellule endothéliale pendant la conservation et l’I/R est bien établie (Basile, 2007

; Wille et coll., 2008

). La réduction du K
+ dans les solutions de conservation n’a pas démontré d’effet délétère sur les organes (Shiiya et coll., 1993

; Hauet et coll., 2003

). D’autres études ont démontré l’effet bénéfique des solutions à basse concentration de K
+ (mais non strictement normopotassique) comme la solution Celsior
® et Custodiol
® (Sumimoto et coll., 1991

; Urushihara et coll., 1992

; Shiiya et coll., 1993

; Ben Abdennebi et coll., 1998

; de Boer et coll., 1999

; Hauet et coll., 2003

; Pedotti et coll., 2004

; Feng et coll., 2007

).
En conclusion, les éléments importants pour la conservation du greffon peuvent se résumer aux imperméants, aux colloïdes et à une solution tampon adaptée.
Mécanismes cellulaires et moléculairesde l’ischémie/reperfusion
Avec le développement des moyens d’évaluation, de nouveaux éléments pouvant jouer un rôle physiopathologique ont été repérés et étudiés. Dans le contexte de l’I/R, on assiste à une augmentation de la mort cellulaire induite par nécrose ou par apoptose et impliquée dans les différents processus lésionnels (tableau 7.II

). La conjonction de différents facteurs, tels que l’hypoxie, l’hypothermie, le réchauffement et la réoxygénation, peut conduire à la mort cellulaire.
Tableau 7.II Différences entre les lésions induites par apoptose ou nécrose
|
Type de lésions
|
Apoptose
|
Nécrose
|
|
Modifications histologiques
| | |
|
Localisation
|
Éparse
|
Systématisée
|
|
Volume cellulaire
|
Rétracté
|
Gonflé
|
|
Surface cellulaire
|
Étanche
|
Perméable
|
|
Chromatine
|
Condensée
|
En amas
|
|
Mécanisme de réponse
|
Phagocytose
|
Inflammation
|
|
Phénomènes biochimiques
| | |
|
Régulation
|
Complexe
|
–
|
|
Voies enzymatiques
|
Complète (jusqu’à l’effecteur final)
|
Partielle
|
|
Biosynthèse
|
Oui (nécessité d’ATP)
|
Non
|
|
Fragmentation de l’ADN
|
Par étape (organisé et ordonné)
|
Dispersé
|
Rôle de la mitochondrie et des voies de l’apoptose
Le rôle de la mitochondrie apparaît primordial dans le syndrome d’ischémie/reperfusion. Il a été mis en évidence un œdème mitochondrial induit par l’ischémie froide et une activation de la voie apoptotique marquée par une translocation du cytochrome C, ainsi qu’une augmentation du ratio Bax/Bcl-2 avec une activation de la caspase 3 au moment de la reperfusion (Jassem et coll., 2002

; Salahudeen, 2004

; Rauen et De Groot, 2004

; Jassem et Heaton, 2004

). D’autres mécanismes pourraient également être impliqués (Lopez-Neblina et coll., 2005

). La part entre apoptose et nécrose dans le processus de mort cellulaire est étroitement liée au niveau d’ATP résiduel et donc à la durée d’ischémie. Le rein est constitué de divers segments tubulaires qui pourraient mettre en jeu des mécanismes différents de lésions cellulaires (Ma et Devarajan, 2008

).
Il est bien établi que la conservation et l’ischémie chaude entraînent des lésions de nécrose tubulaire au niveau du rein. Cependant, des travaux récents ont mis en évidence le rôle de l’apoptose, en particulier durant la reperfusion (Burns et coll., 1998

; Salahudeen et coll., 2001

). Au cours de l’I/R, plusieurs voies apoptotiques sont impliquées et la mitochondrie occupe une place centrale dans ce processus (Jassem et coll., 2002

; Kim et Lemasters, 2003

; Kim et coll., 2003

; Nieminen, 2003

; Jassem et Heaton, 2004

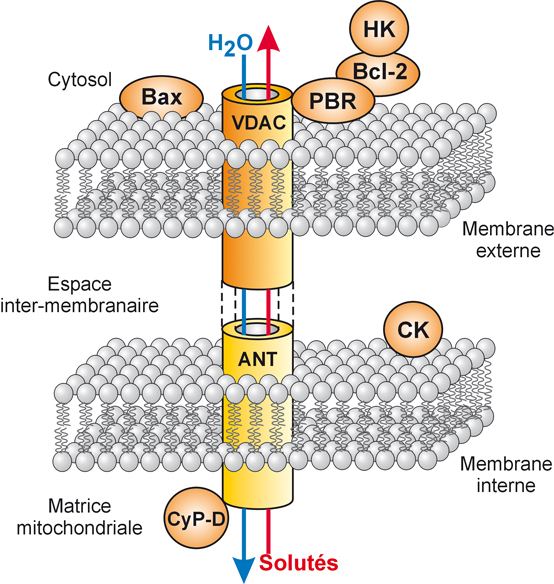
). Un des mécanismes suspectés est fondé sur le pore de transition de perméabilité membranaire (mPTP) de la mitochondrie. Son ouverture est à l’origine de modifications de l’intégrité mitochondriale avec libération de cytochrome C dans le cytoplasme. Le mPTP est une structure particulièrement représentée au niveau des zones de jonction entre la membrane externe et la membrane interne de la mitochondrie (figure 7.6

). Structurellement, le mPTP est cons-titué de l’adénine nucléotide translocase (ANT), de la cyclophiline D (CyP-D) et du
Voltage Dependant Anion Chanel (VDAC). Il faut noter aussi au niveau de ces points de jonction la présence du récepteur périphérique des benzodiazépines (PBR). On retrouve également des protéines de la famille Bcl-2 : Bax, Bcl-Xl et Bcl-2. À l’état normal, le ratio Bcl-2 sur Bax est en faveur de Bcl-2 et donc orienté vers l’état anti-apoptotique. Durant la conservation, ce ratio est inversé en faveur de Bax et donc d’un état pro-apoptotique (Salahudeen et coll., 2003

). Une autre étude a montré que les voies mitochondriales de l’apoptose jouaient un rôle primordial au cours de l’I/R chez les patients greffés avec un rein provenant d’un donneur en mort encéphalique (Castaneda et coll., 2003

). Sous l’effet de différents facteurs liés à la reperfusion (comme la production d’espèces réactives de l’oxygène (ERO) ou le Ca
2+) ou à la conservation du greffon, la mitochondrie va laisser sortir le cytochrome C. L’association du cytochrome C avec d’autres protéines pro-apoptotiques va conduire à la formation d’un complexe (appelé apoptosome) auquel se lient l’ATP et la pro-caspase 9. Ce complexe va permettre le recrutement d’autres caspases (1, 2, 3 et 4) et l’activation de l’effecteur final, la caspase 3.
Une des particularités de ce mPTP est d’être modulé par différents facteurs comme le Ca
2+ et les ERO qui favorisent son ouverture ou la ciclosporine A qui l’empêche (Crompton, 2000

; Feldmann et coll., 2000

). Durant la conservation du greffon rénal, il a été mis en évidence dans les cellules tubulaires rénales humaines des modifications du mPTP ainsi qu’un œdème mitochondrial (Salahudeen et coll., 2003

). Ces effets sont dus à la libération du cytochrome C et aux modifications du ratio de Bax et Bcl-2. La phase finale caractérisée par l’activation de la caspase 3 survient durant le réchauffement.
En ce qui concerne les autres modalités de mise en œuvre de l’apoptose, la voie extrinsèque liée à Fas et à ses ligands, semble être impliquée dans l’infarctus du myocarde chez la souris (Lee et coll., 2003

). Un rôle pour CD95/Fas/Apo 1 et le facteur de nécrose tissulaire TNF-α (
Tumor Necrosis Factor α) a été suggéré dans un modèle de cœur isolé de rat (Jeremias et coll., 2000

). D’autres récepteurs comme les
Tumor necrosis factor-Related Apoptosis-Inducing Ligand receptors 1 and 2 (TRAIL R-1/2, induits par la voie TNF liée à l’apoptose) et le récepteur de Tweak sont autant de récepteurs membranaires impliqués. Ils constituent la voie extrinsèque de l’apoptose (Lopez-Neblina et coll., 2005

). La liaison des ligands à ces récepteurs entraîne leur trimérisation et le recrutement d’une protéine adaptatrice permettant d’enclencher le clivage protéolytique des pro-caspases 8, 10 et 2 qui conduit à l’activation des pro-caspases 3, 6 et 7. Le complexe Fas/Apo-1/CD95 est impliqué à la fois dans l’apoptose et la réaction inflammatoire. Le rôle de cette voie extrinsèque reste à clarifier pour les autres organes que le cœur. Des travaux récents ont démontré le rôle de certaines cellules rénales dans la sécrétion de TNF au cours de la phase très précoce de l’I/R. Ces résultats replacent le rôle de TNF dans le contexte de l’I/R (Dong et coll., 2007

). Il faut souligner que les modèles utilisés sont majoritairement des modèles d’ischémie chaude.
Une augmentation de l’activité de la caspase 3 a été mise en évidence de façon régulière après l’I/R suggérant que la voie Fas ou mitochondriale pourrait initier l’apoptose après l’I/R. D’autres voies induites par le stress comme la voie NF-kB/IKK et la voie p53 ont aussi été identifiées et pourraient jouer un rôle important dans l’I/R (Fortin et coll., 2001

; Tanaka et coll., 2005

).
Importance de la calpaïne, de la calpastatine et des protéines PKC
Le cytosquelette est également impliqué dans le syndrome d’I/R (Mangino et coll., 2008

). L’activation de la calpaïne, une protéase dépendante du Ca
2+, agit sur l’organisation du cytosquelette en dégradant la spectrine et conduit à la perte de la structure de la cellule, de la polarité cellulaire et des contacts avec les autres cellules (Goll et coll., 2003

). Ces résultats, mis en évidence dans les modèles d’ischémie chaude et qui restent à confirmer dans le cas de l’ischémie froide, ont souligné le rôle de la calpastatine, inhibiteur endogène de la calpaïne. La famille des protéines kinase C (PKC) impliquées dans difdférentes fonctions cellulaires, dont la régulation du cycle cellulaire, constitue une autre cible potentielle au cours de la phase de réparation (Padanilam, 2001

). Compte tenu du fait que cette famille de protéines comporte environ une dizaine d’isoenzymes, le rôle des PKC dans l’I/R est parfois contradictoire et de nouvelles études (utilisant des anticorps spécifiques et des molécules pouvant réguler les effets de ces molécules) permettront de clarifier leur contribution.
Rôle de la production des espèces réactives de l’oxygène et du fer
Les ERO sont des médiateurs importants de l’I/R au cours de la reperfusion. Leur rôle au cours de la conservation est moins évident car l’hypothermie semble plutôt limiter le métabolisme de la cellule et ralentir ainsi tout processus de synthèse délétère ou non. Des travaux récents ont permis de mettre en évidence le rôle des ERO durant cette phase (Rauen et coll., 1997

; Rauen et de Groot, 1998

; Salahudeen et coll., 2000

). L’idée d’ajouter des anti-oxydants dans une solution de conservation débute avec Belzer (Southard et Belzer, 1995

). Elle doit maintenant prendre en compte les connaissances récentes sur les mécanismes majoritaires de production de ces ERO pour adapter les options thérapeutiques. Certaines études ont mis en évidence une augmentation de production de l’ARN messager de la manganèse superoxyde dismutase (MnSOD) au cours de la conservation (Salahudeen et coll., 2000

). Cette enzyme a été retrouvée diminuée qualitativement et quantitativement dans d’autres études (Cruthirds et coll., 2003

). Des lésions mitochondriales associées à la conservation ont également été décrites (Kosieradzki et coll., 2003a

; Salahudeen et coll., 2003

). Ces données indiquent que le découplage mitochondrial et la perturbation de la tétraréduction de l’oxygène au cours de l’I/R et de la conservation sont probablement à l’origine de la petite quantité d’ERO produite à cette étape. La production sera ensuite majorée au cours de la reperfusion.
La production d’ERO durant l’I/R peut se faire à plusieurs niveaux :
• l’activation de la xanthine oxydase qui produit des ions superoxyde lors de la reperfusion en métabolisant en acide urique l’adénosine libérée du fait de la dégradation de l’ATP pendant l’ischémie ;
• l’activation de la voie de la cyclo-oxygénase du métabolisme de l’acide arachidonique ;
• l’activation de la chaîne de transport des électrons de la mitochondrie pendant l’ischémie ;
• la libération de NO par les cellules endothéliales ;
• l’activation des polynucléaires neutrophiles pendant la reperfusion. Le fer, ion métal, joue un rôle dans la production des ERO en participant au cycle de Haber Weiss (Koppenol, 2001

).
Au cours de la production d’ERO par la mitochondrie, le superoxyde (
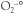
) peut réagir avec le peroxyde d’hydrogène, pour donner le radical hydroxyle hautement réactif, qui peut être à l’origine de l’oxydation des constituants cellulaires. Cette réaction est catalysée par des ions de certains métaux de transition, tels que le fer ou le cuivre. La première étape est la réduction de l’ion ferrique en ion ferreux suivie de la réaction de Fenton et production de OH°. Il a été récemment mis en évidence la libération de fer libre à partir des protéines de stockage durant la conservation (Huang et Salahudeen, 2002

). Ces résultats ont servi de base à l’utilisation de chélateurs du fer comme la déféroxamine dans les solutions de conservation. Cependant, l’utilisation en clinique reste limitée.
Autres facteurs physiopathologiques
On retrouve dans ces nouveaux facteurs, les F2-isoprostanes qui sont issues du métabolisme des prostaglandines. Formées lors de la peroxydation lipidique, elles sont vasoconstrictrices et pourraient jouer un rôle majeur dans la dysfonction du greffon en particulier du greffon rénal (Morrow et coll., 1990

; Takahashi et coll, 1992

; Morrow et coll., 1993

; Salahudeen et coll., 1999

). D’autres acteurs potentiels ont été décrits dans l’I/R, et plus particulièrement dans l’ischémie chaude, comme la stathmine intervenant dans le cycle cellulaire ou l’EphA2 appartenant à la famille des récepteurs à tyrosine kinases ainsi que le ligand Ephrin (Baldwin et coll., 2006

; Jayle et coll., 2007

).
De manière récente, l’enzyme nucléaire poly (ADP-ribose) polymérase (PARP) a été impliquée dans l’I/R normothermique. Son rôle dans la conservation à 4 °C a aussi été mis en évidence avec possiblement un rôle protecteur qui reste à préciser (Mangino et coll., 2004

). D’autres mécanismes font actuellement l’objet d’investigations. L’
Hypoxia Inducible Factor (HIF-1α) en activant la transcription de gènes comme le VEGF (
Vascular Endothelial Growth Factor), l’érythropoïétine (EPO) ou HO-1 constitue un moyen de protection face à l’hypoxie. Le rôle de HIF-1α dans le contexte de l’I/R en transplantation demande à être évalué de manière précise afin de déterminer quel est son rôle protecteur à court terme et son influence sur le développement de lésions chroniques sachant que ce facteur peut moduler la production du
Connective Tissue Growth Factor (CTGF) et du
Plasminogen Activator Inhibitor 1 (PAI-1) (Haase, 2006

; Higgins et coll., 2008

).
L’hypoxie a été impliquée dans la maturation des cellules dendritiques (Rama et coll., 2008

). Pour le rein, les études se sont focalisées sur la sensibilité du tubule proximal au cours de l’I/R. Cependant, la cellule endothéliale reste une des premières cibles compte tenu des mécanismes mis en jeu comme la production de NO, la présence de cellules inflammatoires participant au phénomène de «
no reflow », la production de médiateurs venant du métabolisme des prostaglandines et ayant un effet vasoconstricteur (Cicco et coll., 2005

).
Un dernier aspect à noter est l’influence du sexe sur l’I/R et ses complications. Les hormones sexuelles semblent agir sur les Mitogen Activated Proteins Kinase (MAPK), la synthèse du NO, la Na+/K+ ATPase, l’endothéline, l’adénosine et les canaux potassiques sensibles à l’ATP, les acteurs de l’apoptose. Il s’agit là d’autant de facteurs dont il importe de comprendre les relations et les effets.
Conséquences pour les solutions de conservation
L’ensemble de ces données montre que les solutions de conservation actuellement disponibles sont loin de répondre totalement aux problèmes physiopathologiques liés à la conservation d’organes et à l’ischémie/reperfusion. Cela amène aussi la question des solutions multi-organes. En général, ces solutions sont mises au point pour un organe particulier et leur utilisation est ensuite élargie aux autres organes (Karam et coll., 2005

), ce qui permet de répondre que partiellement aux objectifs spécifiques à chacun d’eux.
Actuellement, de nombreuses solutions sont disponibles. Leur composition est très différente et on distingue trois grandes familles (tableau 7.III

) :
• les solutions à concentration en K supérieure à 30 mM et à concentration en Na inférieure à 100 mM (souvent appelées intracellulaires) ;
• les solutions à concentration en K inférieure à 30 mM et à concentration en Na supérieure à 100 mM (appelées extracellulaires) ;
• les solutions à concentrations en K et à Na inférieures à 30 mM.
Chacun de ces 3 groupes inclut des solutions cristalloïdes pures ou contenant des imperméants et/ou colloïdes. Les solutions les plus utilisées pour le rein sont l’UW et le Custodiol® et de façon plus marginale le Celsior®. Les autres solutions restent marginales dans leur fréquence d’utilisation pour le moment.
Tableau 7.III Différents types de solutions de conservation
| |
Na1
|
K1
|
Imper. Coll.2
|
PEG
|
Cœur
|
Poumon
|
Rein
|
Foie
|
Pancréas
|
|
UW-Belzer-Viaspan
|
28
|
125
|
Oui
| |
x
|
x
|
x
|
x
|
x
|
|
Cardiosol
|
40
|
125
|
Oui
|
Oui
|
x
| | | | |
|
EC (Eurocollins)
|
10
|
113
|
Non
| | |
x
|
x
| | |
|
Unisol UHK-Org Rec Syst
|
62,5
|
70
|
Oui
| | | | | | |
|
IGL 1
|
125
|
30
|
Oui
|
Oui
| | |
o
|
o
| |
|
BMPS Belzer Mach Perf
|
100
|
25
|
Oui
| | | |
x
| | |
|
Lyon Cœur LYPS
|
110
|
20
|
Oui
|
Oui
|
x
| | | | |
|
St Thomas 1-MacCarthy
|
144
|
20
|
Non
| |
x
| | | | |
|
St Thomas 2-Plegisol
|
110
|
16
|
Non
| |
x
| | | | |
|
Celsior
|
100
|
15
|
Oui
| |
x
|
x
|
x
|
x
|
x
|
|
Carolina CRS
|
115
|
6
|
Oui
| | | | |
x
| |
|
LPD Perfadex
|
138
|
6
|
Oui
| | |
x
| | | |
|
SCOT Maco
|
143
|
6
|
Oui
|
Oui
|
o
| |
o
|
o
| |
|
Blood Wallwork
|
105
|
4
|
Oui
| |
x
|
x
| | | |
|
HTK, Custodiol, Bretchneider
|
15
|
18
|
Oui
| |
x
| |
x
|
x
|
x
|
|
Roe
|
28
|
20
|
Non
| |
x
| | | | |
|
Stanford
|
30
|
27
|
Oui
| |
x
| | | | |
1 Concentration en mM ; 2 Imperméants et/ou colloïdes ; X : études publiées ; o : résultats préliminaires publiés
Approches génomiques des mécanismes de l’ischémie/reperfusion
Il existe globalement peu de données sur les approches génomiques des mécanismes de l’ischémie/reperfusion. Il faut noter d’emblée une grande diversité des modèles expérimentaux quant aux espèces utilisées et aux conditions expérimentales. L’étude moléculaire de l’I/R a mis en évidence des gènes impliqués dans certaines voies de signalisation telles que les voies pro- ou anti-apoptotiques, celle de HIF ou de HO-1. D’autres groupes de gènes exprimés au cours de l’I/R ont été identifiés et sont surtout ceux de l’inflammation, des
Heat Shock Proteins, les gènes du cycle cellulaire et ceux gouvernant la prolifération et la différenciation ainsi que ceux régulant les protéines de transport (Hauser et coll., 2004

; Conti et coll., 2007

; Waller et coll., 2007

). D’autres études se sont centrées sur des situations plus particulières comme les donneurs en état de mort encéphalique et les conditions de reprise de fonction (Kaminska et coll., 2007

; Mas et coll., 2008

). Les conditions de prélèvement ont également été évaluées et un profil d’expression différent a été mis en évidence concernant des gènes impliqués dans l’apoptose, l’adhérence cellulaire et les voies de signalisation, la croissance cellulaire et la prolifération, l’immunité et l’inflammation, l’ischémie et la réponse au stress ainsi que la dégradation protéique (Kurian et coll., 2005

). Il apparaît que peu d’éléments sont disponibles sur la période de conservation. Cette phase de ralentissement métabolique n’est pas propice à la synthèse d’ARN messagers. Dans tous les cas, une meilleure connaissance de cette période est un impératif qui devrait permettre de caractériser les cibles thérapeutiques potentielles.
Protection contre les dommages liés à l’ischémie/reperfusion
Les approches thérapeutiques peuvent concerner le donneur où des pistes comme l’utilisation d’agents pharmacologiques, de transfert de gènes ou encore le préconditionnement peuvent être envisagées. L’utilisation d’additifs pharmacologiques a été pratiquée de façon courante. Cependant, il n’y a pas actuellement de traitement ayant permis d’obtenir un effet thérapeutique indiscutable avec ce type d’approche qui reste limité par les problèmes d’ordre éthique et la difficulté de déterminer à quel moment utiliser ces traitements. Des interventions thérapeutiques sont également envisageables à différentes étapes de la transplantation au niveau du greffon ou du receveur afin de réduire les conséquences de l’I/R.
Préconditionnement et postconditionnement
Des études expérimentales, menées sur des modèles
in vivo chez les rongeurs et
in vitro, ont établi le bénéfice du préconditionnement avant transplantation sur l’I/R, qu’il soit pharmacologique ou effectué par cycle de clampage/déclampage (Baldwin et coll., 2006

; Leonard et coll., 2006

; Burne-Taney et coll., 2006

; Gottmann et coll., 2006

; Herrero et coll., 2006

; Nakajima et coll., 2006

). En revanche, le passage à des modèles pré-cliniques chez les grands mammifères reste décevant (Kosieradzki et coll., 2003b

). En clinique, des traitements de suppléance hormonale pour les patients en état de mort encéphalique sont déjà utilisés. D’autres molécules ont été évaluées comme la N-acétyl cystéine. La surexpression de l’HO-1 protège contre l’I/R chez le rat (Blydt-Hansen et coll., 2003

). Cependant, le rôle de l’expression de HO-1 au cours de la transplantation et son impact sur le devenir de la greffe restent à préciser chez l’homme (Geuken et coll., 2005

).
Le préconditionnement par transfert de gènes a également été envisagé et concerne l’interleukine 10, l’interleukine 13 ou 16, l’inhibiteur de TNF, la NO synthase endothéliale, le récepteur de l’interleukine-1, l’HSP 70 et le gène suppresseur de NF-kB (Ke et coll., 2004

; Chien et coll., 2007

; Jamieson et Friend, 2008

). D’autres techniques ont été utilisées comme les oligonucléotides antisens ou encore les
Small Interfering RNA (siRNA), ARN interférents pouvant se lier spécifiquement à une séquence d’ADN et ainsi empêcher l’expression de gènes en clivant leurs ARN messagers (Chen et coll., 2001

; Zheng et coll., 2006

). Ces techniques prometteuses d’un point de vue expérimental méritent une évaluation plus précise pour définir les conditions de leur utilisation et s’assurer de leur innocuité. Le préconditionnement par l’hyperthermie pourrait également améliorer la tolérance à la conservation (Matsumoto et coll., 2001

) et il semble que l’HSP 70 soit impliquée dans ce processus.
De manière plus récente, a été introduite la notion de postconditionnement fondée sur de brèves interruptions de la vascularisation au cours de la reperfusion. Il semble établi que cette voie est intéressante pour le cœur et quelques résultats sont publiés pour le rein (Chen et coll., 2007

).
Additifs aux solutions de conservation
De nombreuses études ont également été menées pour évaluer l’effet de l’ajout de molécules dans les liquides de conservation, mais peu de ces molécules ont été étudiées dans des modèles de transplantation. Cette revue sera limitée à un petit nombre de molécules ayant donné des résultats dans des modèles
in vivo et qui concernent différents organes. Pour une analyse détaillée des différentes molécules, nous invitons le lecteur à se reporter aux revues récentes (Devarajan, 2005

; Boros et Bromberg, 2006

; Jamieson et Friend, 2008

).
L’ajout de facteur de croissance dans les liquides de conservation a montré des effets intéressants en conservation rénale chez le chien (McAnulty et coll., 2002

). Dans le même ordre d’idée, l’érythropoïétine pourrait avoir un rôle précieux aussi bien pour limiter les conséquences de l’I/R que pour favoriser la réparation de l’organe. L’effet du FR167653 a également été démontré dans des modèles de transplantation cardiaque, rénale et hépatique (Yoshinari et coll., 2001

; Koike et coll., 2004

; Doucet et coll., 2008

). Compte tenu des mécanismes en jeu, l’utilisation d’une seule molécule semble aléatoire (Jamieson et Friend, 2008

). Il apparaît donc important de choisir des options thérapeutiques utilisant des composants qui agissent sur des voies diverses ou sur plusieurs molécules d’actions différentes. Le choix de la cible est également majeur, et dans ce sens la mitochondrie peut représenter une cible de premier plan (Morin et coll., 2001

). Les molécules antioxydantes constituent une famille de choix pour améliorer la conservation du greffon, toutefois le choix du type de molécule est important. Les antioxydants stœchiométriques, qui sont efficaces en systèmes fermés, le sont bien moins en milieu vivant où interviennent les enzymes pro-oxydantes (qui produisent des milliers d’ERO à la seconde) et en conséquence les concentrations de ces « piégeurs » doivent être élevées. Ils conviennent bien comme radioprotecteurs, si le processus à l’origine de la formation des dérivés oxygénés est de très courte durée. En revanche, s’il s’agit de neutraliser des radicaux se formant de manière ininterrompue, pendant une certaine durée (activation de macrophages par cytokines, par exemple), il est clair que l’efficacité des antioxydants sera faible. Certaines molécules dérivées des flavonoïdes ont démontré des effets protecteurs lors de la conservation dans des modèles cellulaires (Ahlenstiel et coll., 2003

et 2006

). Leur problème essentiel pour pouvoir être utilisées dans les solutions de conservation est leur insolubilité en milieu aqueux.
De nouvelles molécules, dont la particularité est de pouvoir agir sur des mitochondries perméables et donc déjà altérées, ont montré une efficacité intéressante contre l’I/R (Szetto, 2008

). Ce point est d’importance car nombre de molécules ne peuvent atteindre leur cible dans des situations physiopathologiques diverses. Il semble cependant peu probable de disposer d’un produit unique à moins que celui-ci n’agisse à un stade très précoce ou sur des cibles majeures.
D’autres perspectives sont envisageables pour le rein avec l’utilisation de cellules souches mais cela reste encore du domaine expérimental (Morigi et coll., 2006

; Lucas da Silva et coll., 2007

). En effet, le rôle des cellules souches dans la réparation reste à préciser et pourrait se limiter à un intérêt pour la réparation vasculaire et à un rôle trophique.
Conséquences post-tranplantation du syndrome d’ischémie/reperfusion
L’I/R est actuellement impliquée dans le devenir à long terme des greffons par son lien avec le développement (au niveau qualitatif et quantitatif) des lésions de revascularisation des organes (Basile et coll., 2001

et 2003

). Dans le cas du rein, le concept de masse néphronique est aussi un point à considérer par rapport aux moyens de réparation que peut mettre en œuvre le rein (Cruzado et coll., 2000

). Il semble que le rein, au cours de la réparation, utilise majoritairement des populations de cellules résidentes et non des cellules périphériques (Humphreys et coll., 2008

). Par conséquent, l’équilibre entre les lésions dues au syndrome d’I/R et les processus de restauration/régénération implique de préserver ce potentiel de réparation. Dans la figure 7.7

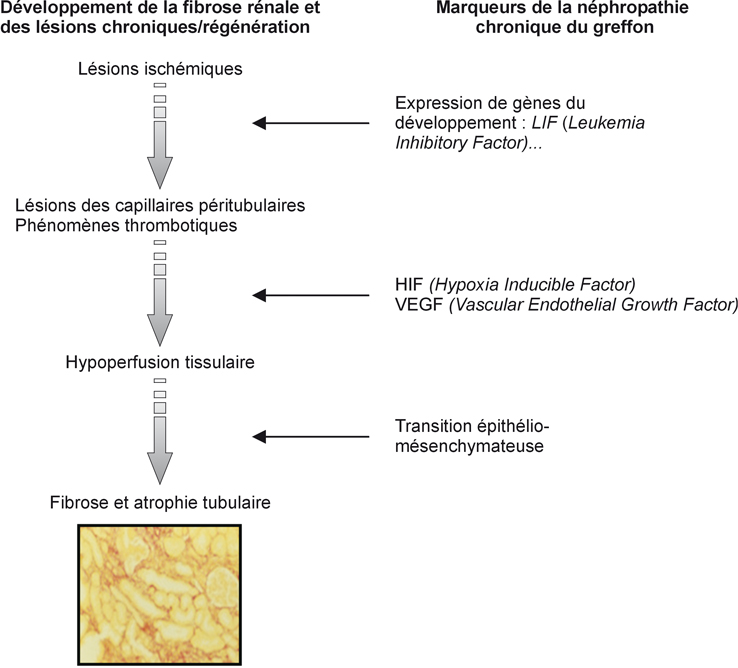
, on retrouve une présentation des liens entre le processus lésionnel de l’I/R et la fibrose et l’atrophie tubulaire, qui sont les conséquences majeures.
La fibrose correspond à une évolution péjorative pour le greffon et constitue donc une cible thérapeutique (Mannon, 2006

).
Donneur à cœur arrêté
Les modifications démographiques des donneurs et l’intérêt d’utiliser des organes provenant de donneurs à cœur arrêté pour élargir le pool des donneurs font envisager l’utilisation de techniques de perfusion, déjà utilisées mais qui semblent avoir un regain d’intérêt dans ce contexte. Parmi les difficultés essentielles rencontrées avec ce type de donneur, la reprise différée de fonction ou la non reprise de fonction reste un problème majeur, laissant la place à d’autres protocoles (Ahmad et coll., 2006

). Comte tenu là aussi d’un certain degré d’empirisme, d’autres techniques émergent comme la perfusion normothermique ou la perfusion oxygénée.
Dans le contexte des donneurs à cœur arrêté, l’ischémie chaude et l’ischémie froide sont associées et concourent au développement des lésions (Brasile et coll., 2001

; Hosgood et coll., 2008

). L’ischémie chaude est responsable de l’activation des cellules endothéliales, de leur œdème et des phénomènes inflammatoires et thrombotiques associés avec les conséquences rhéologiques décrites (augmentation de l’hématocrite dans les microvaisseaux, altérations de la fluidité sanguine, réduction du diamètre des capillaires et phénomène de «
no reflow »).
Perfusion
Un certain nombre de questions restent posées comme la nature de la perfusion en termes de pulsatilité, l’intérêt d’une oxygénation, le type de solution à utiliser ou encore la température de perfusion (Eugene et coll., 1997

; Polyak et coll., 2000

; Kirshbom et coll., 2002

; Fitton et coll., 2005

; Lindell et coll., 2005

; Minor et coll., 2005

; Baicu et coll., 2006

; Bessems et coll., 2006

; Matsuoka et coll., 2006

; Fuller et Lee, 2007

; Maathuis et coll., 2007b

). Il n’en reste pas moins qu’un certain nombre d’avantages est à souligner avec ce type de conservation méritant ainsi une évaluation rationnelle (tableau 7.IV

).
Tableau 7.IV Intérêts des différents types de perfusion
|
Machines à perfuser
Intérêt pour les donneurs marginaux
Possibilité de mise en œuvre de traitement
Possibilité d’évaluer les organes
|
|
Préservation normothermique
Intérêt pour les donneurs marginaux
Environnement « physiologique »
Évaluation
Réparation
|
Évaluation de la viabilité du greffon
L’évaluation de la viabilité du greffon par des biomarqueurs ou des techniques pertinentes et non invasives constitue certainement une voie d’étude prioritaire. Différents moments peuvent être envisagés pour cette évaluation entre la réanimation du donneur, la conservation et la reperfusion (tableau 7.V

, Parikh et coll., 2007

; Coca et coll., 2008

). Disposer de tels marqueurs impose l’évaluation des outils permettant de les mesurer. Parmi ceux-ci, la spectroscopie RMN du proton reste d’actualités (Hauet et coll., 2000

; Serkova et coll., 2005

), en particulier avec les nouvelles techniques de haute résolution (Martinez-Granados et coll., 2006

; Wishart, 2006

). D’autre part, le moment de la perfusion par machine pourrait être mis à profit pour évaluer la viabilité de ces organes (Matsuno et coll., 2006

). D’autres techniques pourraient avoir un intérêt dans ce contexte comme la microdialyse ou la bioimpédence électrique (Jamieson et Friend, 2008

).
Tableau 7.V Marqueurs de viabilité et fonctionnalité des organes en transplantation
|
Différentes étapes où un marqueur a son importance
Donneurs
Conservation
Reperfusion
|
|
Facteurs potentiellement associés aux lésions
Rejet
Nécrose tubulaire
Toxicité ciclosporine
|
|
Marqueurs biochimiques
N-acetyl-beta-D-glucosaminidase (NAG) and B isoenzyme (NAG-B) (urine)
Alanylaminopeptidase (AAP)
Gamma-glutamyltransferase (GGT)
Alpha and π isoenzymes of glutathione S-transferase (alpha-GST, pi-GST)
Retinol Binding Protein (RBP) and beta2-microglobulin (beta2M)
IL-18 (urine)
Neutrophil gelatinase-associated lipocalin
Kidney Injury Molecule 1 (KIM 1) (urine)
|
|
Marqueurs détectés par spectroscopie 1H-NMR et HR mass 1H-NMR
Trimethylamine N oxyde
Allantoine
Lactate
PUFA
|
Phénomènes inflammatoires et relation entre l’I/R et immunité innée
L’I/R est également impliquée dans le lien entre les lésions qu’elle génère et l’immunité innée, via la maturation des cellules dendritiques et la voie des récepteurs Toll-like (Land, 2005a et b).
La relation entre l’inflammation des organes ayant subi une I/R et le développement de phénomènes immunologiques est actuellement l’objet d’un intérêt grandissant (Kieran et Rabb, 2004

; Land, 2005a

et b

). Plusieurs types cellulaires interviennent au cours de l’inflammation et leur rôle est parfois contradictoire. Les macrophages semblent impliqués dans le processus fibrosant (Ko et coll., 2008

) et leur fonction pourrait varier au cours de la reperfusion (Vinuesa et coll., 2008

; Jang et coll., 2008

). Les lymphocytes T pourraient participer à l’amplification de la reconnaissance antigénique ou à l’inverse, pour certains phénotypes avoir un effet protecteur (Ascon et coll., 2006

; Savransky et coll., 2006

; Huang et coll., 2007

). Le rôle des lymphocytes B a été étudié et ces cellules semblent avoir un rôle dans la pathogénie de l’I/R (Burne-Taney et coll., 2003

). Les cellules dendritiques et leur activation
via la production des ERO constituent un lien entre l’I/R et l’immunité innée. Suite à l’engagement des récepteurs
Toll-like (Boros et Bromberg, 2006

; Land, 2005b), ces cellules deviennent actives et matures avec une modification de l’expression de leurs récepteurs de surface conduisant à leur migration vers les organes lymphoïdes secondaires (Boros et Bromberg, 2006

). Les cellules dendritiques deviennent alors capables de stimuler les lymphocytes T naïfs. Il s’ensuit une augmentation de production et d’expression de nombreuses protéines pro-inflammatoires (cytokines et chimiokines et leurs récepteurs) (Furuichi et coll., 2008

).
En conclusion, les différentes régions du rein ont des susceptibilités variables à l’ischémie. La partie externe du cortex est relativement plus tolérante à l’ischémie que la zone externe de la médullaire. Celle-ci est particulièrement exposée à l’ischémie à cause de la dépendance au métabolisme oxydatif de ses cellules et de la faible réserve en oxygène du milieu. Les cellules papillaires sont habituées constitutivement à vivre dans un milieu faiblement oxygéné et peuvent s’adapter à un métabolisme anaérobie. Ces constatations restent valables pour des durées limitées d’ischémie, mais lorsque la durée d’ischémie s’allonge, toutes les régions du rein vont être exposées (Silva, 1990

; Simmons et coll., 2008

).
Malgré une amélioration des performances des solutions de conservation pour limiter les lésions d’I/R, les pourcentages de non-fonction primaire du greffon et de reprise différée de fonction restent non négligeables. Les autres causes de non-fonction primaire du greffon rénal sont représentées par les complications chirurgicales, l’âge du donneur et du receveur (> 60 ans), un appariement HLA médiocre et une durée de prise en charge en dialyse supérieure à 6 ans. À ces causes s’associent la durée de conservation et les lésions d’ischémie chaude et tiède (réchauffement de l’organe lors de la confection des anastomoses). Il existe également des situations favorisant la reprise différée de fonction des greffons comme l’âge du donneur ou la présence de lésions préexistantes, une durée d’ischémie froide prolongée (> 24 h), une ischémie chaude associée prolongée et un accident vasculaire à l’origine de la mort encéphalique.
Ces éléments soulignent le fait que la conservation hypothermique n’est pas totalement adaptée à la conservation des greffons rénaux. L’utilisation de donneurs limites liée à la pénurie d’organes et la perspective d’utiliser les organes des donneurs à cœur arrêté (ayant subi une ischémie chaude) amènent également à s’interroger sur la pertinence des moyens de conservation existants.
L’ischémie/reperfusion est à l’origine de mécanismes complexes ayant pour conséquences des modifications profondes au niveau des tissus exposés. La conservation de l’organe apparaît comme une étape primordiale durant l’I/R, au centre d’un processus plus complexe incluant le donneur et le receveur. Les avancées récentes dans la compréhension de cette pathologie soulignent le rôle prépondérant de la production d’espèces radicalaires et de l’inflammation probablement responsables de l’aggravation mais surtout de la persistance de cette pathologie. Des efforts sont à faire dans la compréhension des mécanismes en cause, imposant l’utilisation d’outils biologiques intégrés et de modèles adaptés. Il apparaît clair que les modèles cellulaires ont leur utilité (Rauen et De Groot, 2008

) mais qu’ils doivent être associés à des modèles in vivo. L’utilisation de nouvelles sources de donneurs conforte ce constat. Il paraît intéressant d’observer et de collecter des informations sur les espèces ayant des comportements d’hibernants ou d’hivernants (Storey, 2004

) pour améliorer la compréhension des mécanismes d’adaptation physiologique au stress engendré par l’ischémie. L’élucidation de ces mécanismes devrait permettre d’améliorer la conservation des organes et limiter les dommages engendrés par l’I/R. L’analyse des mécanismes en cause au cours de l’I/R par une approche intégrée associant des outils de génomique et protéomique devrait permettre d’identifier les cibles essentielles. L’utilisation des machines de perfusion semble être une voie également d’un intérêt majeur avec l’évaluation de la température de perfusion éventuellement avec une oxygénation des milieux. Ce moment de la perfusion est idéal pour l’évaluation des organes d’une part et l’utilisation d’additif(s) pharmacologique(s) d’autre part.
Bibliographie
[1] agarwal a,
murdock p,
fridell ja. Comparison of Histidine-Tryptophan Ketoglutarate solution an University of Wisconsin solution in prolonged cold pres-ervation of kidney allografts.
Transplantation. 2006;
81:480
-482

[2] ahlenstiel t,
burkhardt g,
kohler h,
kuhlmann mk. Bioflavonoids attenuates renal proximal tubular cell injury during cold preservation in Euro-Collins and University of Wisconsin solutions.
Kidney Int. 2003;
63:554
-563

[3] ahlenstiel t,
burkhardt g,
kohler h,
kuhlmann mk. Improved cold preservation of kidney tubular cells by means of adding bioflavonoids to organ preservation solution.
Transplantation. 2006;
81:231
-239

[4] ahmad n,
pratt jr,
potts dj,
lodge jpa. Comparative efficacy of renal preservation solutions to limit functional impairment after warm ischemic injury.
Kidney Int. 2006;
69:884
-893

[5] ascon db,
lopez-briones s,
liu m,
ascou m,
savransky v, et coll.. Phenotypic and functional characterization of kidney-infiltrating lymphocytes in renal ischemia reperfusion injury.
J Immunol. 2006;
177:3380
-3387

[6] auger s,
vallerand d,
haddad ps. Cold preservation-Warm reperfusion perturbs cytosolic calcium ion homeostasis in rat liver sinusoidal endothelail cells.
Liver Transplant. 2003;
9:150
-159

[7] badet l,
eugene m,
hauet t,
barrou b. L’utilisation des liquides de conservation en transplantation rénale.
Prog Urol. 2006;
16:25
-31

[8] baicu sc,
taylor mj,
brockband kgm. The role of preservation solution on acid-base regulation during machine preservation of kidneys.
Clin Transplant. 2006;
20:113
-121

[9] baldwin c,
chen zw,
bedirian a,
yokota n,
nasr sh, et coll.. Upregulation of EphA2 during in vivo and in vitro renal ischemia-reperfusion: role of Src Kinases.
Am J Physiol Renl Physiol. 2006;
291:F960
-F971

[10] basile dp. The endothelial cell in ischemic acute kidney injury: implications for acute and chronic function.
Kidney Int. 2007;
72:151
-156

[11] basile dp,
donohoe dl,
roehte k,
osborn jl. Renal ischemic injury results in permanent damage to peritubular capillaries and influences long-term function.
Am J Physiol Renal Physiol. 2001;
281:F887
-F899

[12] basile dp,
donohoe dl,
roehte k,
mattson dl. Chronic renal hypoxia after acute ischemic injury : effects of L-arginine on hypoxia and secondary damage.
Am J Physiol Renal Physiol. 2003;
284:F338
-F348

[13] bauza g,
lima l,
le moyec l,
gandjbakhch i,
eugène m. 12-hour preservation of rat hearts with « fabrique d’implants et d’instruments » or University of Wisconsin oxygenated microperfused cardioplegic solution.
Transplant Proc. 1996;
28:2899

[14] ben abdennebi h,
steghens jp,
margonari j,
ramella-virieux s,
barbieux a,
boillot o. High-Na
+ low-K
+ UW cold storage solution reduces reperfusion injuries of the rat liver graft.
Transpl Int. 1998;
11:223
-230

[15] ben abdennebi h,
steghens jp,
hadj-aissa a,
barbieux a,
ramella-virieux s, et coll.. A preservation solution with polyethylene glycol and calcium : a possible multiorgan liquid. .
Transplant Int. 2002;
15:348
-354

[16] bessems m,
doorschodt bm,
dinant s,
de graaf w,
van gulik tm. Machine perfusion preservation of the pig liver using a new preservation solution, Polysol.
Transplant Proc. 2006;
38:1238
-1242

[17] blankensteijn jd,
terpstra ot. Liver preservation: the past and the future.
Hepatology. 1991;
13:1235
-1250

[18] blydt-hansen td,
katori m,
lassman c,
ke b,
coito aj, et coll.. Gene transfer-induced local heme oxygenase-1 protects rat kidney transplants from ischemia/reperfusion injury.
J Am Soc Nephrol. 2003;
14:745
-754

[19] boros p,
bromberg js. New cellular and molecular immune pathways in ischemia/reperfusion injury.
Am J Transplant. 2006;
6:652
-658

[20] bos em,
schuurs ta,
kraan m,
ottens pj,
van den eijnden mm, et coll.. Renal expression of heat shock proteins after brain death induction in rats.
Transplant Proc. 2005;
37:359
-360

[21] bos em,
leuvenink hg,
van goor h,
ploeg rj. Kidney grafts from brain dead donors: Inferior quality or opportunity for improvement?.
Kidney Int. 2007;
72:797
-805

[22] brasile l,
stubenitsky bm,
booster mh,
arenada d,
haisch c,
kootstra g. Hypothermia-a limiting factor in using warm ischemically damaged kidneys.
Am J transplant. 2001;
1:316
-320

[23] burne-taney mj,
ascon db,
daniels f,
racusen l,
baldwin w,
rabb h.. B cell deficiency confers protection from renal ischemia reperfusion injury.
J Immunol. 2003;
171:3210
-3215

[24] burne-taney mj,
liu m,
baldwin wm,
racussen l,
rabb h. Decreased capacity of immune cells to cause tissue injury mediates kidney ischemic preconditioning.
J Immunol. 2006;
176:7015
-7020

[25] burns at,
davies dr,
mclaren aj,
cerundolo l,
morris pj,
fuggle sv. Apoptosis in ischemia/reperfusion injury of human renal allografts.
Transplantation. 1998;
66:872
-876

[26] castaneda mp,
swiatecka-urban a,
mitsnefes mm,
feuerstein d,
kaskel fj, et coll.. Activation of mitochondrial apoptosis pathways in human renal allografts after ischemia-reperfusion injury.
Transplantation. 2003;
76:50
-54

[27] chen w,
bennett cf,
condon tp,
stecker k,
tian l, et coll.. Methoxyethyl modification of phosphotorothioate ICAM-1 antisense oligonucleotides improves prevention of ischemia/reperfusion injury.
Transplant Proc. 2001;
33:54

[28] chen h,
xing b,
liu x,
zhan b,
zhou j, et coll.. Ischemic postconditioning inhibits apoptosis after renal ischemia/reperfusion injury in rat.
Transplant Int. 2007;
21:364
-371

[29] chien ct,
shyue sk,
lai mk. Bcl-xL augmentation potentially reduces ischemia/reperfusion induced proximal and distal tubular/apoptosis and autophagy.
Transplantation. 2007;
84:1183
-1190

[30] cicco g,
panzera pc,
catalano g,
memeo v. Microcirculation and reperfusion injury in organ transplantation.
Adv Exp Med Biol. 2005;
566:363
-373

[31] coca sg,
yalavarthy r,
concato j,
parikh cr. Biomarkers for the diagnosis and risk stratification of acute kidney injury: a systematic review.
Kidney Int. 2008;
73:1008
-1016

[32] coffey ak,
andrews pm. Ultrastructure of kidney preservation: varying the amount of an effective osmotic agent in isotonic and hypertonic preservation solu-tions.
Transplantation. 1983;
35:136
-143

[33] connolly c,
cawley t,
mccormick pa,
docherty jr. Portal hypertension increases vasoconstrictor responsiveness of rat aorta.
Clin Sci (Lond). 1999;
96:41
-47

[34] conti a,
scala s,
d’agostina p,
alimenti e,
morelli d, et coll.. Wide gene expression profiling of ischemia-reperfsuion injury in human liver transplantation.
Liver Transpl. 2007;
13:99
-113

[35] crompton m. Bax, Bid and the permeabilization of the mitochondrial outer membrane in apoptosis.
Curr Opin Cell Biol. 2000;
12:414
-419

[36] cruthirds dl,
novak l,
akhi km,
sanders pw,
thompson ja,
macmillan-crow la. Mitochondrial targets of oxidative stress during renal ischemia/reperfusion.
Arch Biochem Biophys. 2003;
412:27
-33

[37] cruzado jm,
torras j,
riera m,
herrero i,
huesco m, et coll.. Influence of nephron mass in development of chronic renal failure after prolonged warm renal ischemia.
Am J Physiol Renal Physiol. 2000;
279:F259
-F269

[38] de boer j,
de meester j,
smits jma, groenewoud af,
bok a, et coll.. Eurotransplant randomized multicenter kidney graft preservation study comparing HTK with UW and Euro-Collins.
Transplant Int. 1999;
12:447
-453

[39] devarajan p. Cellular and molecular derangements in acute tubular necrosis.
Curr Opin Pediatr. 2005;
17:193
-199

[40] dong x,
swaminathan s,
bachman la,
croatt aj,
nath ka,
griffin md. Resient dendritic cells are the predominant TNF-secreting cell in early renal ischemia-reperfusion injury.
Kidney Int. 2007;
71:619
-628

[41] doucet c,
milin s,
favreau f,
desurmont t,
manguy e, et coll.. A p38 mitogen-activated protein kinase inhibitor protects against renal damage in a non-heart beating donor model.
Am J Physiol Renal Physiol. 2008;
295:F179
-F191. Epub 2008 Apr 30

[42] dragun d,
hoff u,
park jk,
qun y,
schneider w, et coll.. Prolonged cold preservation augments vascular injury independent of renal transplantation immunogenicity and function.
Kidney Int. 2001;
60:1173
-1181

[43] dutheil d,
rioja-pastor i,
tallineau c,
goujon jm,
hauet t, et coll.. Protective effect of PEG 35,000 Da on renal cells: paradoxical activation of JNK signaling pathway during cold storage.
Am J Transplant. 2006;
6:1529
-1540

[44] eugene m,
bauza g,
esteves-lima l,
le moyec l,
gandjbakhch i. High-energy phosphate and ventricular function in rat hearts during 12-hour continuous microperfusion at 4°C : effect of oxygenation.
Transplant Proc. 1997;
29:2358
-2359

[45] faure jp,
jayle c,
dutheil d,
eugene m,
zhang k, et coll.. Evidence for protective roles of polyethylene glycol plus high sodium solution and trimetazidine against consequences of renal medulla ischaemia during cold preservation and reperfusion in pig kidney model.
Nephrol Dial Transplant. 2004a;
19:1742
-1751

[46] faure jp,
petit i,
zhang k,
dutheil d,
doucet c, et coll.. Protective roles of polyethylene glycol and trimetazidine against cold ischemia and reperfusion injuries of pig kidney graft.
Am J Transplant. 2004b;
4:495
-504

[47] feldmann g,
haouzi d,
moreau a,
durand-schneider am, et coll.. Opening of the mitochondrial permeability transition pore causes matrix expansion and outer membrane rupture in Fas-mediated hepatic apoptosis in mice.
Hepatology. 2000;
31:674
-683

[48] feng l,
zhao n,
yao x,
sun x,
du l, et coll.. Histidine-tryptophane-ketoglutarate solution vs University of Wisconsin solution for liver transplantation : a systematic review.
Liver Transpl. 2007;
13:25
-36

[49] fiser sm,
kron il,
long sm,
kaza ak,
kern ja,
cassada dc, et coll.. Influences of graft ischemic time on outcomes following lung transplantation.
J Heart Lung Trans-plant. 2001;
20:1291
-1296

[50] fitton tp,
barreiro cj,
bonde pn,
wei c,
cage f, et coll.. Attenuation of DNA damage in canine hearts preserved by continuous hypothermic perfusion.
Ann Thor Surg. 2005;
80:1812
-1820

[51] fortin a,
cregan sp,
maclaurin jg,
kushwaha n,
hickman es, et coll.. APAF1 is a key transcriptional target for p53 in the regulation of neuronal cell death.
J Cell Biol. 2001;
155:207
-216

[52] fuller bj,
lee cy. Hypothermic perfusion preservation: the future of organ preser-vation revisited? Cryobiology.
. 2007;
54:129
-145

[53] fuller bj,
shurey c,
lane n,
petrenko a,
green c. Hypothermic renal preservation with a sucrose/polyethylene glycol solution in a rabbit renal transplant model.
Cry-oLetter. 2006;
27:127
-132

[54] furuichi k,
wada t,
kaneko s,
murphy pm. Roles of chemokines in renal ischemia/reperfusion injury.
Front Biosci. 2008;
13:4021
-4028

[55] geuken e,
buis ci,
katori m,
lassman c,
ke b, et coll.. Expression of heme-oxygenase-1 in human livers before transplantation correlates with graft injury and function after transplantation.
Am J Transplant. 2005;
5:1875
-1885

[56] gokina ni,
bevan ja. Role of intracellular Ca(2+) release in histamine-induced depolarization in rabbit middle cerebral artery.
Am J Physiol Heart Circ Physiol. 2000;
278:H2105
-H2114

[57] goll de,
thompson vf,
li h,
wei w,
cong j. The calpain system.
Physiol Rev. 2003;
83:731
-801

[58] gottmann u,
brinkkoetter pt,
bechtler m,
hoeger s,
karle c, et coll.. Effect of pre-treatment with cathecholamines on cold preservation and ischemia/reperfusion-injury in rat.
Kidney Int. 2006;
70:321
-328

[59] greig pd,
woolf gm,
abecassis m,
forster j,
strasberg sm, et coll.. Prostaglandin E1 for primary nonfunction following liver transplantation.
Transplant Proc. 1989;
21:3360
-3361

[60] haase vh. Hypoxia-inducible factors in the kidney.
Am J Physiol Renal Physiol. 2006;
291:F271
-F281

[61] hauet t,
eugene m. A new approach in organ preservation: potential role of new polymers.
Kidney Int. 2008;
74:998
-1003

[62] hauet t,
gibelin h,
richer jp,
godart c,
eugene m,
carretier m. Influence of retrieval conditions on renal medulla injury: evaluation by proton NMR spectroscopy in an isolated perfused pig kidney model.
J Surg Res. 2000;
93:1
-8

[63] hauet t,
han z,
doucet c,
ramella-virieux s,
hadj aïssa a, et coll.. A modified University of Wisconsin preservation solution with high-NA
+ low-K
+ content reduces reperfusion injury of the pig kidney graft.
Transplantation. 2003;
76:18
-27

[64] hauser p,
schwarz c,
mitterbauer c,
regele hm,
mühlbaher f, et coll.. Genome-wide gene-expression patterns of donor kidney biopsies distinguish primary allograft function.
Lab Invest. 2004;
84:353
-361

[65] herrero f,
morales d,
baamonde c,
salas e,
berrazueta jr,
casanova d. Ischemic perconditioning and kidney transplantation: in vivo nitric oxide monitoring in a rat ischemia-reperfusion experimental model.
Transplant Proc. 2006;
38:2600
-2602

[66] hicks m,
hing a,
gao l,
ryan j,
macdonal ps. Organ preservation.
Methods Mol Biol. 2006;
333:331
-374

[67] higgins df,
kimura k,
iwano m,
haase vh. Hypoxia-inucible factor signaling in the development of tissue fibrosis.
Cell Cyle. 2008;
7:1128
-1132

[68] hosgood sa,
bagul a,
yang b,
nicholson ml. The relative effects of warm and cold ischemic injury in an experimental model of nonheartbeating donor kidneys.
Transplantation. 2008;
85:88
-92

[69] huang h,
salahudeen ak. Cold induces catalytic iron release of cytochrome P450 origin : a critical step in cold storage-induced renal injury.
Am J transplant. 2002;
2:631
-639

[70] huang y,
rabb h,
womer kl. Ischemia-reperfusion and immediate T responses.
Cell Immunol. 2007;
248:4
-11

[71] humphreys bd,
valerius mt,
kobayashi a,
mugford jw,
soeung s, et coll.. Intrinsic epithelial cells repair the kidney after injury.
Cell Stem Cell. 2008;
2:284
-291

[72] jamieson rw,
friend pj. Organ reperfusion and preservation.
Front Biosci. 2008;
13:221
-235

[73] jang hs,
kim j,
park yk,
park km. Infiltrated macrophages contribute to recovery after ischemic injury but not to ischemic preconditioning in kidneys.
Transplantation. 2008;
85:447
-455

[74] jassem w,
heaton nd. . The role of mitochondria in ischemia/reperfusion injury in organ transplantation.
Kidney Int. 2004;
66:514
-517

[75] jassem w,
fuggle sv,
rela m,
koo dd,
heaton nd. The role of mitochondria in ischemia/reperfusion injury.
Transplantation. 2002;
73:493
-499

[76] jayle c,
favreau f,
zhang k,
doucet c,
goujon jm, et coll.. Comparison of pro-tective effects of trimetazidine against experimental warm ischemia of different durations: early and long-term effects in a pig kidney model.
Am J Physiol Renal Physiol. 2007;
292:F1082
-F1093

[77] jeremias i,
kupatt c,
martin-villalba a,
habazettl h,
schenkel j, et coll.. Involvement of CD95/Apo 1/Fas in cell death after myocardial ischemia.
Circulation. 2000;
102:915
-920

[78] kaminska d,
tyran b,
mazanowska o,
rabczynski j,
szyber p, et coll.. Cytokine gene expression in kidney allograft biopsies after donor brain death and ischemia-reperfusion injury in situ reverse-transcription polymerase chain reaction analysis.
Transplantation. 2007;
84:1118
-1124

[79] karam g,
compagnon p,
hourmant m,
despins p,
duveau d, et coll.. A single solution for multiple organ procurement and preservation.
Transplant Int. 2005;
18:657
-663

[80] ke b,
shen xd,
gao f,
bussuttil rw,
kupiec-weglinski jw. Interleukin 13 gene transfer in liver ischemia and reperfusion injury: role of Stat6 and TLR4 pathways in cytoprotection.
Hum Gen Ther. 2004;
15:691
-698

[81] kieran ne,
rabb h. Immune responses in kidney preservation and reperfusion injury.
J Invest Med. 2004;
52:310
-314

[82] kim js,
he l,
lemasters jj. Mitochondrial permeability transition : a common pathway to necrosis and apoptosis.
Biochem Biophys Res Commun. 2003;
304:463
-470

[83] kim js,
he l,
qian t,
lemasters jj. Role of the mitochondrial permeability transition in apoptotic and necrotic death after ischemia/reperfusion injury to hepatocytes.
Curr Mol Med. 2003;
3:527
-535

[84] kirshbom pm,
bridges nd,
myung rj,
gaynor jw,
clark bj,
spray tl. Use of extracorporeal membrane oxygenation in pediatric thoracic organ transplantation.
J Thorac Cardiovasc Surg. 2002;
123:130
-136

[85] ko gj,
boo cs,
cho wy,
kim hk. Macrophages contribute to the development of renal fibrosis following ischaemia/reperfusion induced acute kidney injury.
Nephrol Dial Transplant. 2008;
23:842
-852

[86] koike n,
takeyoshi i,
ohki s,
tokumine m,
matsumoto k,
morishita y. Effects of adding P38 mitogen-activated protein-kinase inhibitor to Celsior solution in canine heart transplantation from non-heart-beating donors.
Transplantation. 2004;
77:286
-292

[87] koppenol wh. The Haber-Weiss cycle–70 years later.
Redox Report. 2001;
6:229
-234

[88] kosieradzki m,
kuczyska j,
piwowarska j,
wegrowicz-rebandel i,
kwiat-kowski a, et coll.. Prognostic significance of free radicals: mediated injury occurring in the kidney donor.
Transplantation. 2003a;
75:1221
-1227

[89] kosieradzki m,
ametani m,
southard jh,
mangino mj. Is ischemic preconditioning of the kidney clinically relevant?.
Surgery. 2003b;
133:81
-90

[90] kribben a,
wieder e,
wetzels j,
yu l,
gengaro pe, et coll.. Evidence for role of cytosolic free calcium in hypoxia-induced proximal tubule injury.
J Clin Invest. 1994;
93:1922
-1929

[91] kurian sm,
flehner sm,
kaouk j,
modlin c,
goldfarb d, et coll.. Laparoscopic donor nephrectomy gene expression profiling reveals upregulation of stress and ischemia associated genes compared to control kidneys.
Transplantation. 2005;
80:1067
-1071

[92] lam ft,
mavor ai,
potts dj,
giles gr. Imporved 72-hour renal preservation with phosphate-buffered sucrose.
Transplantation. 1989;
47:767
-771

[93] land wg. The role of postischemic reperfusion injury and other nonantigen-dependent inflammatory pathways in transplantation.
Transplantation. 2005a;
79:505
-514

[94] land wg. Injury to allografts: innate immunity pathways to acute and chronic rejection.
Saudi J Kidney Dis Transpl. 2005b;
16:520
-539

[95] lee p,
sata m,
lefer dj,
factor sm,
walsh k,
kitsis rn. Fas pathway is a critical mediator of cardiac myocyte death and MI duting ischemia-reperfusion in vivo.
Am J Physiol Heart Circ Physiol. 2003;
284:H456
-H463

[96] leonard mo,
kieran ne,
howell k,
burne mj,
varadarajan r, et coll.. Reoxygenation-specific activation of the antioxidant transcription factor Nrf2 mediates cytoprotective gene expression in ischemia reperfusion injury.
Faseb J. 2006;
20:2624
-2626

[97] lindell sl,
compagnon p,
mangino mj,
southard jh. UW solution for hypo-thermic machine perfusion of warm ischemic kidneys.
Transplantation. 2005;
79:1358
-1361

[98] lopez-neblina f,
toledo ah,
toledo-pereyra lh. Molecular biology of apoptosis in ischemia and reperfusion.
J Invest Sur. 2005;
18:335
-350

[99] lucas da silva lb,
bonini palma pv,
cury pm,
bueno v. Evaluation of stem cell administration in a model of kidney ischemia-reperfusion injury.
Int Immunopharmacol. 2007;
7:1609
-1616

[100] ma q,
devarajan p. Induction of proapoptotic Daxx following ischemic injury.
Kidney Int. 2008;
74:310
-318

[101] maathuis mh,
leuvenink hgd,
ploeg rj. Perspectives in organ preservation.
Transplantation. 2007a;
83:1289
-1298

[102] maathuis mhj,
manekeller s,
van der plaats a,
leuvenink hgdd,
’t hart na, et coll.. Improved kidney graft function after preservation using a novel hypothermic machine perfusion device.
Ann Surg. 2007b;
246:982
-991

[103] maathuis mhj, ottens pj,
van goor h,
zwaagstra jj,
wiersema-buist j, et coll.. Static cold storage of ischemically damaged kidneys. A comparison between IGL-1 and UW solution.
Transplant Int. 2008;
21:473
-482

[104] mangino mj,
ametani m,
szabó c,
southard jh. Poly(ADP-ribose) polymerase and renal hypothermic preservation injury.
Am J Physiol Renal Physiol. 2004;
286:F838
-F847

[105] mangino mj,
tian t,
ametani m,
lindell s,
southard j. Cytoskeletal involvement in hypothermic renal preservation injury.
Transplantation. 2008;
85:427
-436

[106] mannon rb. Therapeutic targets in the treatment of allograft fibrosis.
Am J Transplant. 2006;
6:867
-875

[107] martinez-granados b,
monleón d,
martinez-bisbal mc,
rodrigo jm,
del olmo j, et coll.. Metabolite identification in human liver needle biopsies by high-resolution magic angle spinning 1H NMR spectroscopy.
NMR Biomed. 2006;
19:90
-100

[108] mas vr,
archer kj,
yanek k,
dumur ci,
capparuccini mi, et coll.. Gene expression patterns in deceased donor kidneys developing delayed graft function after kidney transplantation.
Transplantation. 2008;
85:626
-635

[109] matsumoto k,
honda k,
kobayashi n. Protective effect of heat preconditioning of rat liver graft resulting in improved transplant survival.
Transplantation. 2001;
71:862
-868

[110] matsuno n,
konno o,
mejit a,
jyojima y,
akashi i, et coll.. Application of machine perfusion preservation as a viability test for marginal kidney graft.
Transplantation. 2006;
82:1425
-1428

[111] matsuoka l,
shah t,
aswad s,
bunnapradist s,
cho y, et coll.. Pulsatile per-fusion reduces the incidence of delayed graft function in expanded criteria donor kidney transplantation.
Am J Transplant. 2006;
6:1473
-1478

[112] mcanulty jf,
reid tw,
walker kr,
murphy cj. Successful six day kidney preservation using trophic factors supplemented media and simple cold-storage.
Am J Transplant. 2002;
2:712
-718

[113] mclaren a,
friend pj. Trends in preservation.
Transplant Int. 2003;
16:701
-708

[114] mikhalski d,
wissing km,
ghisdal l,
broeders n,
touly m, et coll.. Cold ischemia is a major determinant of acute rejection and renal graft survival in the modern era of immunosuppression.
Transplantation. 2008;
85(7 suppl):S3
-S9

[115] minor t,
sitzia m,
dombrowski f. Kidney transplantation from non-heart-beating donors after oxygenated low-flow machine perfusion preservation with histidine-tryptophan-ketoglutarate solution.
Transplant Int. 2005;
17:707
-712

[116] morariu am,
vd plaats a,
v oeveren w,
’t hart na,
leuvenink hg, et coll.. Hyperaggregating effect of hydroxyethyl starch components and University of Wis-consin solution on human red blood cells: a risk of impaired graft perfusion in organ procurement?.
Transplantation. 2003;
76:37
-43

[117] morigi m,
benigni a,
remuzzi g,
imberti b. The regenerative potential of stem cells in acute renal failure.
Cell Transplant. 2006;
15(suppl 1):S111
-S117

[118] morin d,
hauet t,
spedding m,
tillement j. Mitochondria as target for anti-ischemic drugs.
Adv Drug Deliv Rev. 2001;
49:151
-174

[119] morrow jd,
harris tm,
roberts lj. Non cyclooxygenase oxidative formation of a series of novel prostaglandins: analytical ramifications for measurement of eicosanoids.
Anal Biochem. 1990;
184:1
-10 (erratum in Anal Biochem 186 : 184-185)

[120] morrow jd,
moore kp,
awad ja,
ravenscraft md,
marini g, et coll.. Marked overproduction of non-cyclooxygenase derived prostanoids (F2-isoprostanes) in the hepatorenal syndrome.
J Lipid Mediat. 1993;
6:417
-420

[121] mühlbacher f,
langer f,
mittermayer c. Preservation solutions for transplantation.
Transplant Proc. 1999;
31:2069
-2070

[122] nakajima a,
ueda k,
takaoka m,
kurata h,
takayama j, et coll.. Effets of pre- and post-ischemic treatments with FK409, a nitric oxide donor, on ischemia/reper-fusion-induced renal injury and endothelin-1 production in rats.
Biol Pharm Bull. 2006;
29:577
-579

[123] nicholson ml,
wheatley tj,
horsburgh t,
edwards cm,
veitch ps,
bell pr. The relative influence of delayed graft function and acute rejection on renal transplant survival.
Transpl Int. 1996;
9:415
-419

[124] nieminen al. Apoptosis and necrosis in health and disease: role of mitochondria.
Int Rev Cytol. 2003;
224:29
-55

[125] nijboer wn,
schuurs ta,
van der hoeven ja fekken s,
wiersema-buist j, et coll.. Effect of brain death on gene expression and tissue activation in human donor kidneys.
Transplantation. 2004;
78:978
-986

[126] ojo ao,
wolfe ra,
held pj,
port fk,
schmouder rl. Delayed graft function: risk factors and implications for renal allograft survival.
Transplantation. 1997;
63:968
-974

[127] opelz g,
döhler b. Multicenter analysis of kidney preservation.
Transplantation. 2007;
83:247
-253

[128] organ procurement and transplantation network, scientific registry of transplant recipients, united network for organ sharing . OPTN/SRTR UNOS.
Annual report. 2002;

[129] padanilam bj. Induction and subcellular localization of protein kinase C isozymes following renal ischemia.
Kidney Int. 2001;
59:1789
-1797

[130] padanilam bj. Cell death induced by acute renal injury : a perspective on the con-tributions of apoptosis and necrosis.
Am J Physiol Reanl Physiol. 2003;
284:F608
-F627

[131] parikh cr,
edelstein cl,
devarajan p,
cantley l. Biomarkers of acute kidney injury: early diagnosis, pathogenesis, and recovery.
J Invest Med. 2007;
55:333
-340

[132] pedotti p,
cardillo m,
rigotti p,
gerunda g,
merenda r, et coll.. A comparative prospective study of two available solutions for kidney and liver transplantation.
Transplantation. 2004;
77:1540
-1545

[133] perico n,
cattaneo d,
sayegh mh,
remuzzi g. Delayed graft function in kidney transplantation.
The Lancet. 2004;
364:1814
-1827

[134] piper hm,
garcia-dorado d. Prime causes of rapid cardiomyocytes death during reperfusion.
Ann Thorac Surg. 1999;
68:1913
-1919

[135] ploeg rj,
van bockel jh,
langendijk pt,
groenewegen m,
van der woude fj, et coll.. Effect of preservation solution on results of cadaveric kidney transplantation. The European Multicentre Study Group.
Lancet. 1992;
340:129
-137

[136] ploeg rj,
d’alessandro am,
knechtle sj,
stegall md,
pirsch jd, et coll.. Risk factors for primary dysfunction after liver transplantation-a multivariate analysis.
Transplantation. 1993;
55:807
-813

[137] polyak m,
arrington b,
studenbord w,
boykin j,
brown t, et coll.. The influence of pulsatile preservation on renal transplantation in the 1990s.
Transplantation. 2000;
69:249
-258

[138] pratschke j,
tullius sg,
neuhaus p. Brain death associated ischemia/reperfusion injury.
Ann Transplant. 2004;
9:78
-80

[139] pratschke j,
weiss s,
neuhaus p,
pascher a. Review of nonimmunological causes for deteriorated graft function and graft loss after transplantation.
Transplant Int. 2008;
21:512
-522

[140] rama i,
bruene b,
torras j,
koehl r,
cruzado jm, et coll.. Hypoxia stimulus: an adaptative immune response during dendritic cell maturation.
Kidney Int. 2008;
73:816
-825

[141] rauen u,
de groot h. Cold-induced release of reactive oxygen species as a decisive mediator of hypothermia injury to cultured liver cells.
Free Radic Biol Med. 1998;
24:1316
-1323

[142] rauen u,
de groot h. New insights into the cellular and molecular mechanisms of cold storage.
J Investig Med. 2004;
52:299
-309

[143] rauen u,
de groot h. Inherent toxicity of organ preservation solutions to cul-tured hepatocytes.
Cryobiology. 2008;
56:88
-92

[144] rauen u,
elling b,
gizewski er,
korth hg,
sustmann r,
de groot h. Involvement of reactive oxygen species in the preservation injury to cultured liver endothelial cells.
Free Radic Biol Med. 1997;
22:17
-24

[145] rosser bg,
gores gj. Liver cell necrosis: cellular mechanisms and clinical implica-tions.
Gastroenterology. 1995;
108:252
-275

[146] salahudeen ak. Cold ischemic injury of transplanted kidneys: new insights from experimental studies.
Am J Physiol Renal Physiol. 2004;
287:181
-187

[147] salahudeen ak,
navaz m,
poovala v,
wang c,
kanji v, et coll.. Cold storage induces time-dependent F2-isoprostane formation in renal tubular cells and rat kid-neys.
Kidney Int. 1999;
55:1759
-1762

[148] salahudeen ak,
huang h,
patel p,
jenkins jk. Mechanism and prevention of cold storage-induced human renal tubular cell injury.
Transplantation. 2000;
70:1424
-1431

[149] salahudeen ak,
joshi m,
jenkins ak. Apoptosis versus necrosis during cold stor-age and rewarming of human renal proimal tubular cells.
Transplantation. 2001;
72:798
-804

[150] salahudeen ak,
huang h,
joshi m,
moore na,
jenkins jk. Involvement of the mitochondrial pathway in cold storage and rewarming associated apoptosis of human renal proximal tubular cells.
Am J Transplant. 2003;
3:273
-280

[151] savranski v,
molls rr,
burne-taney m,
chien cc,
racusen l,
rabb h. Role of T-cell receptor in kidney ischemia-reperfusion injury.
Kidney Int. 2006;
69:233
-238

[152] schuurs ta,
gerbens f,
van der hoeven ja,
ottens pj,
kooi ka, et coll.. Distinct transcriptional changes in donor kidneys upon brain death induction in rats: insights in the processes of brain death.
Am J Transplant. 2004;
4:1972
-1981

[153] schwarz c,
oberbauer r. The influence of organ donor factors on early allograft function.
Curr Opin Urol. 2003;
13:99
-104

[154] serkova n,
florian fuller t,
klawitter j,
freise ce,
niemann cu. 1H-NMR-based metabolic signatures of mild and severe ischemia/reperfusion injury in rat kidney transplants.
Kidney Int. 2005;
67:1142
-1151

[155] shaw bw jr,
gordon rd,
iwatsuki s,
starzl te. Retransplantation of the liver.
Semin Liver Dis. 1985;
5:394
-401

[156] sheridan am,
bonventre jv. Cell biology and molecular metabolism of injury in ischemic acute renal failure.
Curr Opin Nephrol Hypertens. 2000;
9:427
-434

[157] shiiya n,
paul m,
benvenuti c,
astier a,
ferrer mj,
loisance d. A lactobionate-based extracellular-type solution for donor heart preservation.
J Heart Lung Trans-plant. 1993;
12:476
-483

[158] silva p. Energy and fuel substrate metabolism in the kidney.
Semin Nephrol. 1990;
10:432
-444

[159] simmons mn,
screiber mj,
gill is. Surgical renal ischemia: a contemporary overview.
J Urol. 2008;
180:19
-30

[160] southard jh,
belzer fo. Organ preservation.
Annu Rev Med. 1995;
46:235
-247

[161] storey kb. Cold ischemic organ preservation : lessons from natural systems.
J Invest Med. 2004;
52:315
-322

[162] sumimoto r,
kamada n,
jamieson nv,
fukuda y,
dohi k. A comparison of a new solution combining histidine and lactobionate with UW solution and eurocollins for rat liver preservation.
Transplantation. 1991;
51:589
-593

[163] szetto hh. Mitochondria-targeted cytoprotective peptides for ischemia-reperfusion injury.
Antioxid Redox Signal. 2008;
10:601
-619

[164] takahashi k,
nammour tm,
fukunaga m,
ebert j,
morrow jd, et coll.. Glomerular actions of a free radical-generated novel prostaglandin, 8-epi-prostaglandin F2 alpha, in the rat.
Evidence for interaction with thromboxane A2 receptors. J Clin Invest. 1992;
90:136
-141

[165] tanaka h,
terada y,
okado t,
inoshita s,
kuwahara m,
sasaki s. Role of the E2F1-p19ARF-p53 pathway in ischemic acute renal failure.
Nephron Physiol. 2005;
101:27
-34

[166] urushihara t,
sumimoto r,
sumimoto k,
jamieson nv,
ito h, et coll.. A comparison of some simplified lactobionate preservation solutions with standard UW solution and Eurocollins solution for pancreas reservation.
Transplantation. 1992;
53:750
-754

[167] vacanti jp,
lillehei cw,
jenkins rl,
donahoe pk,
cosimi ab, et coll.. Liver transplantation in children: the Boston Center experience in the first 30 months.
Transplant Proc. 1987;
19:3261
-3266

[168] van der plaats a,
’t hart na,
morariu am,
verkerke gj,
leuvenink hg, et coll.. Effect of University of Wisconsin organ-preservation solution on haemorheology.
Transpl Int. 2004;
17:227
-233

[169] vinuesa e,
hotter g,
jung m,
herrero-fresneda i,
torras j,
sola a. Macrophage involvement in the kidney repair phase after ischaemia/reperfusion injury.
J Pathol. 2008;
214:104
-113

[170] waller hl,
harper sjf, hosgood sa,
bagul a,
kay md, et coll.. Differential expression of cytoprotective and apoptotic genes in an ischemia-reperfusion isolated organ perfusion model of the transplanted kidney.
Transplant Int. 2007;
20:625
-631

[171] weiss s,
kotsch k,
francuski m,
rutzel-selke a,
mantouvalou l, et coll.. Brain death activates donor organs and is associated with a worse I/R injury after liver transplantation.
Am J Transplant. 2007;
7:1584
-1593

[172] weiss-salz i,
mandel m,
galal n,
nave i,
soner g, et coll.. Factors associated with primary and secondary graft failure following cadaveric kidney transplant.
Clin Transplant. 2004;
18:571
-575

[173] wille t,
de groot h,
rauen u. Improvement of the cold storage of blood vessels with a vascular preservation solution. Study in porcine aortic segments.
J Vasc Surg. 2008;
47:422
-431

[174] wishart ds. Metabolomics in monitoring kidney transplants.
Curr Opin Nephrol Hypertens. 2006;
15:637
-642

[175] yoshinari d,
takeyoshi i,
kobayashi m,
koyama t,
iijima k, et coll.. Effects of a p38 mitogen-activated protein kinase inhibitor as an additive to University of Wis-consin solution on reperfusion injury in liver transplantation.
Transplantation. 2001;
72:22
-27

[176] zheng x,
zhang x,
sun h,
feng b,
li m, et coll.. Protection of renal ischemia injury using combination gene silencing of complement 3 and caspase 3 genes.
Transplantation. 2006;
82:1781
-1786

→ Aller vers SYNTHESE
 et figure 7.1
et figure 7.1 ).
). ; Bos et coll., 2007
; Bos et coll., 2007 ; tableau 7.I
; tableau 7.I ).
). ). Dans le contexte actuel de manque d’organes, les lésions d’I/R sont prépondérantes avec des facteurs favorisants comme l’âge du donneur supérieur à 60 ans, une ischémie froide1
de durée supérieure à 24 h, une ischémie chaude2
associée et prolongée, et la cause de la mort encéphalique (accident vasculaire) (figure 7.2
). Dans le contexte actuel de manque d’organes, les lésions d’I/R sont prépondérantes avec des facteurs favorisants comme l’âge du donneur supérieur à 60 ans, une ischémie froide1
de durée supérieure à 24 h, une ischémie chaude2
associée et prolongée, et la cause de la mort encéphalique (accident vasculaire) (figure 7.2 ). Les lésions préexistantes au niveau des reins chez le donneur sont également à prendre en compte comme les lésions de glomérusclérose avec atrophie tubulaire ou les lésions de fibrose interstitielle et vasculaires (Schwarz et Oberbauer, 2003
). Les lésions préexistantes au niveau des reins chez le donneur sont également à prendre en compte comme les lésions de glomérusclérose avec atrophie tubulaire ou les lésions de fibrose interstitielle et vasculaires (Schwarz et Oberbauer, 2003 ; Opelz et Döhler, 2007
; Opelz et Döhler, 2007 ). Les facteurs impliqués dans la non-fonction primaire3
du greffon semblent liés aux complications chirurgicales, à l’âge du donneur et du receveur supérieur à 60 ans, à un mauvais appariement HLA donneur/receveur et à une durée prolongée sur liste d’attente (Weiss-Salz et coll., 2004
). Les facteurs impliqués dans la non-fonction primaire3
du greffon semblent liés aux complications chirurgicales, à l’âge du donneur et du receveur supérieur à 60 ans, à un mauvais appariement HLA donneur/receveur et à une durée prolongée sur liste d’attente (Weiss-Salz et coll., 2004 ). D’autres facteurs peuvent intervenir parmi lesquels les complications vasculaires (thromboses ou sténoses), les infections, les effets secondaires des agents immunosuppresseurs et la non observance du traitement (Pratschke et coll., 2008
). D’autres facteurs peuvent intervenir parmi lesquels les complications vasculaires (thromboses ou sténoses), les infections, les effets secondaires des agents immunosuppresseurs et la non observance du traitement (Pratschke et coll., 2008 ). À l’ensemble de ces facteurs non immunologiques peuvent se surajouter des facteurs immunologiques qui vont conditionner le devenir du greffon. L’I/R est lui-même un facteur non immunologique influençant de façon précoce le devenir du greffon pour différents organes (Shaw et coll., 1985
). À l’ensemble de ces facteurs non immunologiques peuvent se surajouter des facteurs immunologiques qui vont conditionner le devenir du greffon. L’I/R est lui-même un facteur non immunologique influençant de façon précoce le devenir du greffon pour différents organes (Shaw et coll., 1985 ; Vacanti et coll., 1987
; Vacanti et coll., 1987 ; Greig et coll., 1989
; Greig et coll., 1989 ; Ploeg et coll., 1993
; Ploeg et coll., 1993 ; Sheridan et Bonventre, 2000
; Sheridan et Bonventre, 2000 ; Weiss et coll., 2007
; Weiss et coll., 2007 ).
). ). Il s’ensuit des modifications de la volémie4
, l’installation d’un diabète insipide5
, pouvant s’accompagner d’une hypoperfusion du rein. L’endothélium est activé par un afflux de cellules inflammatoires et une activation de la coagulation qui vont avoir des conséquences sur le devenir de l’organe. Dans ce contexte, des moyens de protection vont se mettre en place et concernent l’hème-oxygénase 1 (HO-1), les Heat Shock Proteins (HSP 70) et la manganèse superoxyde dismutase (MnSOD) (Nijboer et coll., 2004
). Il s’ensuit des modifications de la volémie4
, l’installation d’un diabète insipide5
, pouvant s’accompagner d’une hypoperfusion du rein. L’endothélium est activé par un afflux de cellules inflammatoires et une activation de la coagulation qui vont avoir des conséquences sur le devenir de l’organe. Dans ce contexte, des moyens de protection vont se mettre en place et concernent l’hème-oxygénase 1 (HO-1), les Heat Shock Proteins (HSP 70) et la manganèse superoxyde dismutase (MnSOD) (Nijboer et coll., 2004 ; Schuurs et coll., 2004
; Schuurs et coll., 2004 ; Bos et coll., 2005
; Bos et coll., 2005 ). Dans le cas d’une transplantation à partir de donneur vivant, l’expression de HO-1 peut être le témoin de la mise en place de moyens de protection tandis que dans celui d’un donneur en mort encéphalique, il peut au contraire être le marqueur des lésions (Bos et coll., 2007
). Dans le cas d’une transplantation à partir de donneur vivant, l’expression de HO-1 peut être le témoin de la mise en place de moyens de protection tandis que dans celui d’un donneur en mort encéphalique, il peut au contraire être le marqueur des lésions (Bos et coll., 2007 ).
). ).
). ; Salahudeen, 2004
; Salahudeen, 2004 ; Jamieson et Friend, 2008
; Jamieson et Friend, 2008 ). Les avancées récentes sur les mécanismes physiopathologiques impliqués dans l’I/R ont permis de mettre en évidence les composants importants de ce processus (Salahudeen, 2004
). Les avancées récentes sur les mécanismes physiopathologiques impliqués dans l’I/R ont permis de mettre en évidence les composants importants de ce processus (Salahudeen, 2004 ).
). ; Ojo et coll., 1997
; Ojo et coll., 1997 ). Ces faits restent d’actualité avec l’emploi des nouveaux traitements immunosuppresseurs (Mikhalski et coll., 2008
). Ces faits restent d’actualité avec l’emploi des nouveaux traitements immunosuppresseurs (Mikhalski et coll., 2008 ). Les lésions précoces peuvent aussi participer au développement des lésions chroniques par le biais de l’immunité innée (Land, 2005a
). Les lésions précoces peuvent aussi participer au développement des lésions chroniques par le biais de l’immunité innée (Land, 2005a et b
et b ).
). ; Boros et Bromberg, 2006
; Boros et Bromberg, 2006 ) expérimentales et cliniques suggèrent que des composés mis en jeu dans le processus d’I/R pourraient contribuer au développement des lésions chez le patient transplanté :
) expérimentales et cliniques suggèrent que des composés mis en jeu dans le processus d’I/R pourraient contribuer au développement des lésions chez le patient transplanté : ). Les deux points essentiels étaient :
). Les deux points essentiels étaient : ). La vasoconstriction induite, même si elle est plus faible à 4 °C, augmente les pressions de perfusion pendant le rinçage de l’organe, et diminue le débit de perfusion pendant la reperfusion. Pour combattre cette vasoconstriction, certaines équipes ajoutent des inhibiteurs calciques aux solutions de conservation, alors qu’il suffirait d’utiliser des solutions non-hyperpotassiques. La perte du gradient de concentration potassique de part et d’autre de la membrane cellulaire entraîne une accélération du fonctionnement des pompes ioniques qui accentue la déplétion en composés riches en énergie (ATP et, selon les tissus, phosphocréatine) (figure 7.4
). La vasoconstriction induite, même si elle est plus faible à 4 °C, augmente les pressions de perfusion pendant le rinçage de l’organe, et diminue le débit de perfusion pendant la reperfusion. Pour combattre cette vasoconstriction, certaines équipes ajoutent des inhibiteurs calciques aux solutions de conservation, alors qu’il suffirait d’utiliser des solutions non-hyperpotassiques. La perte du gradient de concentration potassique de part et d’autre de la membrane cellulaire entraîne une accélération du fonctionnement des pompes ioniques qui accentue la déplétion en composés riches en énergie (ATP et, selon les tissus, phosphocréatine) (figure 7.4 ). La dégradation de l’ATP représente la principale source de protons H+ génératrice d’acidose.
). La dégradation de l’ATP représente la principale source de protons H+ génératrice d’acidose. ).
).
 ; Rauen et De Groot, 2004
; Rauen et De Groot, 2004 ; Salahudeen, 2004
; Salahudeen, 2004 ; Jamieson et Friend, 2008
; Jamieson et Friend, 2008 ) (figure 7.5
) (figure 7.5 ).
). ). Une augmentation de la concentration du Ca2+ cytosolique est reconnue comme un médiateur décisif des lésions d’hypoxie dans différents types cellulaires incluant les cellules tubulaires rénales, les hépatocytes et les cardiomyocytes (Blankensteijn et Terpstra, 1991
). Une augmentation de la concentration du Ca2+ cytosolique est reconnue comme un médiateur décisif des lésions d’hypoxie dans différents types cellulaires incluant les cellules tubulaires rénales, les hépatocytes et les cardiomyocytes (Blankensteijn et Terpstra, 1991 ; Kribben et coll., 1994
; Kribben et coll., 1994 ; Rosser et Gores, 1995
; Rosser et Gores, 1995 ; Piper et Garcia-Dorado, 1999
; Piper et Garcia-Dorado, 1999 ; Auger et coll., 2003
; Auger et coll., 2003 ; Padanilam, 2003
; Padanilam, 2003 ). L’augmentation du Ca2+ cytosolique est liée à l’inhibition des transporteurs ATP dépendants et induit l’activation de nombreuses enzymes dépendantes du Ca2+ qui vont participer à de nombreux mécanismes lésionnels létaux au niveau de la cellule. La surcharge calcique est retrouvée également au niveau de la mitochondrie et entraîne des effets délétères pour l’intégrité et les fonctions de celle-ci.
). L’augmentation du Ca2+ cytosolique est liée à l’inhibition des transporteurs ATP dépendants et induit l’activation de nombreuses enzymes dépendantes du Ca2+ qui vont participer à de nombreux mécanismes lésionnels létaux au niveau de la cellule. La surcharge calcique est retrouvée également au niveau de la mitochondrie et entraîne des effets délétères pour l’intégrité et les fonctions de celle-ci.
 ). Les autres saccharides comme le mannitol, le sucrose, ou le raffinose ont été employés dans différentes solutions (Coffey et Andrews, 1983
). Les autres saccharides comme le mannitol, le sucrose, ou le raffinose ont été employés dans différentes solutions (Coffey et Andrews, 1983 ; Lam et coll., 1989
; Lam et coll., 1989 ). Les imperméants qui ne sont pas des sucres comme le gluconate, le citrate ou le lactobionate limitent l’œdème cellulaire par leur effet électrochimique et l’efficacité de ces anions est déterminée par leur charge et leur poids moléculaire.
). Les imperméants qui ne sont pas des sucres comme le gluconate, le citrate ou le lactobionate limitent l’œdème cellulaire par leur effet électrochimique et l’efficacité de ces anions est déterminée par leur charge et leur poids moléculaire. ; van der Plaats et coll., 2004
; van der Plaats et coll., 2004 ). Il a été démontré que l’HEA augmentait les amas des globules rouges pouvant perturber le lavage et induire une reperfusion inhomogène (Morariu et coll., 2003
). Il a été démontré que l’HEA augmentait les amas des globules rouges pouvant perturber le lavage et induire une reperfusion inhomogène (Morariu et coll., 2003 ; van der Plaats et coll., 2004
; van der Plaats et coll., 2004 ). Ces constatations ont conduit à l’évaluation de nouvelles molécules comme le PEG qui semble prometteur (Ben Abdennebi et coll., 2002
). Ces constatations ont conduit à l’évaluation de nouvelles molécules comme le PEG qui semble prometteur (Ben Abdennebi et coll., 2002 ; Faure et coll., 2004a
; Faure et coll., 2004a et b
et b ; Dutheil et coll., 2006
; Dutheil et coll., 2006 ; Fuller et coll., 2006
; Fuller et coll., 2006 ; Maathuis et coll., 2008
; Maathuis et coll., 2008 ; Hauet et Eugene, 2008
; Hauet et Eugene, 2008 ).
). ; McLaren et Friend, 2003
; McLaren et Friend, 2003 ; Agarwal et coll., 2006
; Agarwal et coll., 2006 ; Maathuis et coll., 2007a
; Maathuis et coll., 2007a ; Opelz et Döhler, 2007
; Opelz et Döhler, 2007 ).
). ).
). ; Hicks et coll., 2006
; Hicks et coll., 2006 ). L’hydrolyse de l’ATP est la principale source de protons et est responsable de l’acidose. La production anaérobie de lactate – qui consomme des protons – permet la réoxydation du NADH en NAD et ainsi le maintien pendant un certain temps de la production d’ATP par la glycolyse anaérobie. Il se développe donc une acidose intracellulaire qui se stabilise autour d’un pH à 6 ± 0,2. Un certain degré d’acidose intracellulaire exerce toutefois des effets bénéfiques pendant la conservation à 4 °C en limitant la surcharge calcique. Les princi-paux tampons fréquemment utilisés sont les tampons bicarbonate, phosphate, histidine, HEPES, tryptophane (Southard et Belzer, 1995
). L’hydrolyse de l’ATP est la principale source de protons et est responsable de l’acidose. La production anaérobie de lactate – qui consomme des protons – permet la réoxydation du NADH en NAD et ainsi le maintien pendant un certain temps de la production d’ATP par la glycolyse anaérobie. Il se développe donc une acidose intracellulaire qui se stabilise autour d’un pH à 6 ± 0,2. Un certain degré d’acidose intracellulaire exerce toutefois des effets bénéfiques pendant la conservation à 4 °C en limitant la surcharge calcique. Les princi-paux tampons fréquemment utilisés sont les tampons bicarbonate, phosphate, histidine, HEPES, tryptophane (Southard et Belzer, 1995 ). Le rôle indispensable du tampon est d’amortir les variations de pH du compartiment intra vasculaire, interstitiel et cellulaire. La valeur finale du pH intracellulaire en fin d’ischémie varie relativement peu (0,2 à 0,3 unités pH) en fonction des différents systèmes tampon utilisés (Southard et Belzer, 1995
). Le rôle indispensable du tampon est d’amortir les variations de pH du compartiment intra vasculaire, interstitiel et cellulaire. La valeur finale du pH intracellulaire en fin d’ischémie varie relativement peu (0,2 à 0,3 unités pH) en fonction des différents systèmes tampon utilisés (Southard et Belzer, 1995 ; Hicks et coll., 2006
; Hicks et coll., 2006 ).
). ; Wille et coll., 2008
; Wille et coll., 2008 ). La réduction du K+ dans les solutions de conservation n’a pas démontré d’effet délétère sur les organes (Shiiya et coll., 1993
). La réduction du K+ dans les solutions de conservation n’a pas démontré d’effet délétère sur les organes (Shiiya et coll., 1993 ; Hauet et coll., 2003
; Hauet et coll., 2003 ). D’autres études ont démontré l’effet bénéfique des solutions à basse concentration de K+ (mais non strictement normopotassique) comme la solution Celsior® et Custodiol® (Sumimoto et coll., 1991
). D’autres études ont démontré l’effet bénéfique des solutions à basse concentration de K+ (mais non strictement normopotassique) comme la solution Celsior® et Custodiol® (Sumimoto et coll., 1991 ; Urushihara et coll., 1992
; Urushihara et coll., 1992 ; Shiiya et coll., 1993
; Shiiya et coll., 1993 ; Ben Abdennebi et coll., 1998
; Ben Abdennebi et coll., 1998 ; de Boer et coll., 1999
; de Boer et coll., 1999 ; Hauet et coll., 2003
; Hauet et coll., 2003 ; Pedotti et coll., 2004
; Pedotti et coll., 2004 ; Feng et coll., 2007
; Feng et coll., 2007 ).
). ). La conjonction de différents facteurs, tels que l’hypoxie, l’hypothermie, le réchauffement et la réoxygénation, peut conduire à la mort cellulaire.
). La conjonction de différents facteurs, tels que l’hypoxie, l’hypothermie, le réchauffement et la réoxygénation, peut conduire à la mort cellulaire. ; Salahudeen, 2004
; Salahudeen, 2004 ; Rauen et De Groot, 2004
; Rauen et De Groot, 2004 ; Jassem et Heaton, 2004
; Jassem et Heaton, 2004 ). D’autres mécanismes pourraient également être impliqués (Lopez-Neblina et coll., 2005
). D’autres mécanismes pourraient également être impliqués (Lopez-Neblina et coll., 2005 ). La part entre apoptose et nécrose dans le processus de mort cellulaire est étroitement liée au niveau d’ATP résiduel et donc à la durée d’ischémie. Le rein est constitué de divers segments tubulaires qui pourraient mettre en jeu des mécanismes différents de lésions cellulaires (Ma et Devarajan, 2008
). La part entre apoptose et nécrose dans le processus de mort cellulaire est étroitement liée au niveau d’ATP résiduel et donc à la durée d’ischémie. Le rein est constitué de divers segments tubulaires qui pourraient mettre en jeu des mécanismes différents de lésions cellulaires (Ma et Devarajan, 2008 ).
). ; Salahudeen et coll., 2001
; Salahudeen et coll., 2001 ). Au cours de l’I/R, plusieurs voies apoptotiques sont impliquées et la mitochondrie occupe une place centrale dans ce processus (Jassem et coll., 2002
). Au cours de l’I/R, plusieurs voies apoptotiques sont impliquées et la mitochondrie occupe une place centrale dans ce processus (Jassem et coll., 2002 ; Kim et Lemasters, 2003
; Kim et Lemasters, 2003 ; Kim et coll., 2003
; Kim et coll., 2003 ; Nieminen, 2003
; Nieminen, 2003 ; Jassem et Heaton, 2004
; Jassem et Heaton, 2004 ). Un des mécanismes suspectés est fondé sur le pore de transition de perméabilité membranaire (mPTP) de la mitochondrie. Son ouverture est à l’origine de modifications de l’intégrité mitochondriale avec libération de cytochrome C dans le cytoplasme. Le mPTP est une structure particulièrement représentée au niveau des zones de jonction entre la membrane externe et la membrane interne de la mitochondrie (figure 7.6
). Un des mécanismes suspectés est fondé sur le pore de transition de perméabilité membranaire (mPTP) de la mitochondrie. Son ouverture est à l’origine de modifications de l’intégrité mitochondriale avec libération de cytochrome C dans le cytoplasme. Le mPTP est une structure particulièrement représentée au niveau des zones de jonction entre la membrane externe et la membrane interne de la mitochondrie (figure 7.6 ). Structurellement, le mPTP est cons-titué de l’adénine nucléotide translocase (ANT), de la cyclophiline D (CyP-D) et du Voltage Dependant Anion Chanel (VDAC). Il faut noter aussi au niveau de ces points de jonction la présence du récepteur périphérique des benzodiazépines (PBR). On retrouve également des protéines de la famille Bcl-2 : Bax, Bcl-Xl et Bcl-2. À l’état normal, le ratio Bcl-2 sur Bax est en faveur de Bcl-2 et donc orienté vers l’état anti-apoptotique. Durant la conservation, ce ratio est inversé en faveur de Bax et donc d’un état pro-apoptotique (Salahudeen et coll., 2003
). Structurellement, le mPTP est cons-titué de l’adénine nucléotide translocase (ANT), de la cyclophiline D (CyP-D) et du Voltage Dependant Anion Chanel (VDAC). Il faut noter aussi au niveau de ces points de jonction la présence du récepteur périphérique des benzodiazépines (PBR). On retrouve également des protéines de la famille Bcl-2 : Bax, Bcl-Xl et Bcl-2. À l’état normal, le ratio Bcl-2 sur Bax est en faveur de Bcl-2 et donc orienté vers l’état anti-apoptotique. Durant la conservation, ce ratio est inversé en faveur de Bax et donc d’un état pro-apoptotique (Salahudeen et coll., 2003 ). Une autre étude a montré que les voies mitochondriales de l’apoptose jouaient un rôle primordial au cours de l’I/R chez les patients greffés avec un rein provenant d’un donneur en mort encéphalique (Castaneda et coll., 2003
). Une autre étude a montré que les voies mitochondriales de l’apoptose jouaient un rôle primordial au cours de l’I/R chez les patients greffés avec un rein provenant d’un donneur en mort encéphalique (Castaneda et coll., 2003 ). Sous l’effet de différents facteurs liés à la reperfusion (comme la production d’espèces réactives de l’oxygène (ERO) ou le Ca2+) ou à la conservation du greffon, la mitochondrie va laisser sortir le cytochrome C. L’association du cytochrome C avec d’autres protéines pro-apoptotiques va conduire à la formation d’un complexe (appelé apoptosome) auquel se lient l’ATP et la pro-caspase 9. Ce complexe va permettre le recrutement d’autres caspases (1, 2, 3 et 4) et l’activation de l’effecteur final, la caspase 3.
). Sous l’effet de différents facteurs liés à la reperfusion (comme la production d’espèces réactives de l’oxygène (ERO) ou le Ca2+) ou à la conservation du greffon, la mitochondrie va laisser sortir le cytochrome C. L’association du cytochrome C avec d’autres protéines pro-apoptotiques va conduire à la formation d’un complexe (appelé apoptosome) auquel se lient l’ATP et la pro-caspase 9. Ce complexe va permettre le recrutement d’autres caspases (1, 2, 3 et 4) et l’activation de l’effecteur final, la caspase 3. ; Feldmann et coll., 2000
; Feldmann et coll., 2000 ). Durant la conservation du greffon rénal, il a été mis en évidence dans les cellules tubulaires rénales humaines des modifications du mPTP ainsi qu’un œdème mitochondrial (Salahudeen et coll., 2003
). Durant la conservation du greffon rénal, il a été mis en évidence dans les cellules tubulaires rénales humaines des modifications du mPTP ainsi qu’un œdème mitochondrial (Salahudeen et coll., 2003 ). Ces effets sont dus à la libération du cytochrome C et aux modifications du ratio de Bax et Bcl-2. La phase finale caractérisée par l’activation de la caspase 3 survient durant le réchauffement.
). Ces effets sont dus à la libération du cytochrome C et aux modifications du ratio de Bax et Bcl-2. La phase finale caractérisée par l’activation de la caspase 3 survient durant le réchauffement. ). Un rôle pour CD95/Fas/Apo 1 et le facteur de nécrose tissulaire TNF-α (Tumor Necrosis Factor α) a été suggéré dans un modèle de cœur isolé de rat (Jeremias et coll., 2000
). Un rôle pour CD95/Fas/Apo 1 et le facteur de nécrose tissulaire TNF-α (Tumor Necrosis Factor α) a été suggéré dans un modèle de cœur isolé de rat (Jeremias et coll., 2000 ). D’autres récepteurs comme les Tumor necrosis factor-Related Apoptosis-Inducing Ligand receptors 1 and 2 (TRAIL R-1/2, induits par la voie TNF liée à l’apoptose) et le récepteur de Tweak sont autant de récepteurs membranaires impliqués. Ils constituent la voie extrinsèque de l’apoptose (Lopez-Neblina et coll., 2005
). D’autres récepteurs comme les Tumor necrosis factor-Related Apoptosis-Inducing Ligand receptors 1 and 2 (TRAIL R-1/2, induits par la voie TNF liée à l’apoptose) et le récepteur de Tweak sont autant de récepteurs membranaires impliqués. Ils constituent la voie extrinsèque de l’apoptose (Lopez-Neblina et coll., 2005 ). La liaison des ligands à ces récepteurs entraîne leur trimérisation et le recrutement d’une protéine adaptatrice permettant d’enclencher le clivage protéolytique des pro-caspases 8, 10 et 2 qui conduit à l’activation des pro-caspases 3, 6 et 7. Le complexe Fas/Apo-1/CD95 est impliqué à la fois dans l’apoptose et la réaction inflammatoire. Le rôle de cette voie extrinsèque reste à clarifier pour les autres organes que le cœur. Des travaux récents ont démontré le rôle de certaines cellules rénales dans la sécrétion de TNF au cours de la phase très précoce de l’I/R. Ces résultats replacent le rôle de TNF dans le contexte de l’I/R (Dong et coll., 2007
). La liaison des ligands à ces récepteurs entraîne leur trimérisation et le recrutement d’une protéine adaptatrice permettant d’enclencher le clivage protéolytique des pro-caspases 8, 10 et 2 qui conduit à l’activation des pro-caspases 3, 6 et 7. Le complexe Fas/Apo-1/CD95 est impliqué à la fois dans l’apoptose et la réaction inflammatoire. Le rôle de cette voie extrinsèque reste à clarifier pour les autres organes que le cœur. Des travaux récents ont démontré le rôle de certaines cellules rénales dans la sécrétion de TNF au cours de la phase très précoce de l’I/R. Ces résultats replacent le rôle de TNF dans le contexte de l’I/R (Dong et coll., 2007 ). Il faut souligner que les modèles utilisés sont majoritairement des modèles d’ischémie chaude.
). Il faut souligner que les modèles utilisés sont majoritairement des modèles d’ischémie chaude. ; Tanaka et coll., 2005
; Tanaka et coll., 2005 ).
). ). L’activation de la calpaïne, une protéase dépendante du Ca2+, agit sur l’organisation du cytosquelette en dégradant la spectrine et conduit à la perte de la structure de la cellule, de la polarité cellulaire et des contacts avec les autres cellules (Goll et coll., 2003
). L’activation de la calpaïne, une protéase dépendante du Ca2+, agit sur l’organisation du cytosquelette en dégradant la spectrine et conduit à la perte de la structure de la cellule, de la polarité cellulaire et des contacts avec les autres cellules (Goll et coll., 2003 ). Ces résultats, mis en évidence dans les modèles d’ischémie chaude et qui restent à confirmer dans le cas de l’ischémie froide, ont souligné le rôle de la calpastatine, inhibiteur endogène de la calpaïne. La famille des protéines kinase C (PKC) impliquées dans difdférentes fonctions cellulaires, dont la régulation du cycle cellulaire, constitue une autre cible potentielle au cours de la phase de réparation (Padanilam, 2001
). Ces résultats, mis en évidence dans les modèles d’ischémie chaude et qui restent à confirmer dans le cas de l’ischémie froide, ont souligné le rôle de la calpastatine, inhibiteur endogène de la calpaïne. La famille des protéines kinase C (PKC) impliquées dans difdférentes fonctions cellulaires, dont la régulation du cycle cellulaire, constitue une autre cible potentielle au cours de la phase de réparation (Padanilam, 2001 ). Compte tenu du fait que cette famille de protéines comporte environ une dizaine d’isoenzymes, le rôle des PKC dans l’I/R est parfois contradictoire et de nouvelles études (utilisant des anticorps spécifiques et des molécules pouvant réguler les effets de ces molécules) permettront de clarifier leur contribution.
). Compte tenu du fait que cette famille de protéines comporte environ une dizaine d’isoenzymes, le rôle des PKC dans l’I/R est parfois contradictoire et de nouvelles études (utilisant des anticorps spécifiques et des molécules pouvant réguler les effets de ces molécules) permettront de clarifier leur contribution. ; Rauen et de Groot, 1998
; Rauen et de Groot, 1998 ; Salahudeen et coll., 2000
; Salahudeen et coll., 2000 ). L’idée d’ajouter des anti-oxydants dans une solution de conservation débute avec Belzer (Southard et Belzer, 1995
). L’idée d’ajouter des anti-oxydants dans une solution de conservation débute avec Belzer (Southard et Belzer, 1995 ). Elle doit maintenant prendre en compte les connaissances récentes sur les mécanismes majoritaires de production de ces ERO pour adapter les options thérapeutiques. Certaines études ont mis en évidence une augmentation de production de l’ARN messager de la manganèse superoxyde dismutase (MnSOD) au cours de la conservation (Salahudeen et coll., 2000
). Elle doit maintenant prendre en compte les connaissances récentes sur les mécanismes majoritaires de production de ces ERO pour adapter les options thérapeutiques. Certaines études ont mis en évidence une augmentation de production de l’ARN messager de la manganèse superoxyde dismutase (MnSOD) au cours de la conservation (Salahudeen et coll., 2000 ). Cette enzyme a été retrouvée diminuée qualitativement et quantitativement dans d’autres études (Cruthirds et coll., 2003
). Cette enzyme a été retrouvée diminuée qualitativement et quantitativement dans d’autres études (Cruthirds et coll., 2003 ). Des lésions mitochondriales associées à la conservation ont également été décrites (Kosieradzki et coll., 2003a
). Des lésions mitochondriales associées à la conservation ont également été décrites (Kosieradzki et coll., 2003a ; Salahudeen et coll., 2003
; Salahudeen et coll., 2003 ). Ces données indiquent que le découplage mitochondrial et la perturbation de la tétraréduction de l’oxygène au cours de l’I/R et de la conservation sont probablement à l’origine de la petite quantité d’ERO produite à cette étape. La production sera ensuite majorée au cours de la reperfusion.
). Ces données indiquent que le découplage mitochondrial et la perturbation de la tétraréduction de l’oxygène au cours de l’I/R et de la conservation sont probablement à l’origine de la petite quantité d’ERO produite à cette étape. La production sera ensuite majorée au cours de la reperfusion. ).
). ) peut réagir avec le peroxyde d’hydrogène, pour donner le radical hydroxyle hautement réactif, qui peut être à l’origine de l’oxydation des constituants cellulaires. Cette réaction est catalysée par des ions de certains métaux de transition, tels que le fer ou le cuivre. La première étape est la réduction de l’ion ferrique en ion ferreux suivie de la réaction de Fenton et production de OH°. Il a été récemment mis en évidence la libération de fer libre à partir des protéines de stockage durant la conservation (Huang et Salahudeen, 2002
) peut réagir avec le peroxyde d’hydrogène, pour donner le radical hydroxyle hautement réactif, qui peut être à l’origine de l’oxydation des constituants cellulaires. Cette réaction est catalysée par des ions de certains métaux de transition, tels que le fer ou le cuivre. La première étape est la réduction de l’ion ferrique en ion ferreux suivie de la réaction de Fenton et production de OH°. Il a été récemment mis en évidence la libération de fer libre à partir des protéines de stockage durant la conservation (Huang et Salahudeen, 2002 ). Ces résultats ont servi de base à l’utilisation de chélateurs du fer comme la déféroxamine dans les solutions de conservation. Cependant, l’utilisation en clinique reste limitée.
). Ces résultats ont servi de base à l’utilisation de chélateurs du fer comme la déféroxamine dans les solutions de conservation. Cependant, l’utilisation en clinique reste limitée. ; Takahashi et coll, 1992
; Takahashi et coll, 1992 ; Morrow et coll., 1993
; Morrow et coll., 1993 ; Salahudeen et coll., 1999
; Salahudeen et coll., 1999 ). D’autres acteurs potentiels ont été décrits dans l’I/R, et plus particulièrement dans l’ischémie chaude, comme la stathmine intervenant dans le cycle cellulaire ou l’EphA2 appartenant à la famille des récepteurs à tyrosine kinases ainsi que le ligand Ephrin (Baldwin et coll., 2006
). D’autres acteurs potentiels ont été décrits dans l’I/R, et plus particulièrement dans l’ischémie chaude, comme la stathmine intervenant dans le cycle cellulaire ou l’EphA2 appartenant à la famille des récepteurs à tyrosine kinases ainsi que le ligand Ephrin (Baldwin et coll., 2006 ; Jayle et coll., 2007
; Jayle et coll., 2007 ).
). ). D’autres mécanismes font actuellement l’objet d’investigations. L’Hypoxia Inducible Factor (HIF-1α) en activant la transcription de gènes comme le VEGF (Vascular Endothelial Growth Factor), l’érythropoïétine (EPO) ou HO-1 constitue un moyen de protection face à l’hypoxie. Le rôle de HIF-1α dans le contexte de l’I/R en transplantation demande à être évalué de manière précise afin de déterminer quel est son rôle protecteur à court terme et son influence sur le développement de lésions chroniques sachant que ce facteur peut moduler la production du Connective Tissue Growth Factor (CTGF) et du Plasminogen Activator Inhibitor 1 (PAI-1) (Haase, 2006
). D’autres mécanismes font actuellement l’objet d’investigations. L’Hypoxia Inducible Factor (HIF-1α) en activant la transcription de gènes comme le VEGF (Vascular Endothelial Growth Factor), l’érythropoïétine (EPO) ou HO-1 constitue un moyen de protection face à l’hypoxie. Le rôle de HIF-1α dans le contexte de l’I/R en transplantation demande à être évalué de manière précise afin de déterminer quel est son rôle protecteur à court terme et son influence sur le développement de lésions chroniques sachant que ce facteur peut moduler la production du Connective Tissue Growth Factor (CTGF) et du Plasminogen Activator Inhibitor 1 (PAI-1) (Haase, 2006 ; Higgins et coll., 2008
; Higgins et coll., 2008 ).
). ). Pour le rein, les études se sont focalisées sur la sensibilité du tubule proximal au cours de l’I/R. Cependant, la cellule endothéliale reste une des premières cibles compte tenu des mécanismes mis en jeu comme la production de NO, la présence de cellules inflammatoires participant au phénomène de « no reflow », la production de médiateurs venant du métabolisme des prostaglandines et ayant un effet vasoconstricteur (Cicco et coll., 2005
). Pour le rein, les études se sont focalisées sur la sensibilité du tubule proximal au cours de l’I/R. Cependant, la cellule endothéliale reste une des premières cibles compte tenu des mécanismes mis en jeu comme la production de NO, la présence de cellules inflammatoires participant au phénomène de « no reflow », la production de médiateurs venant du métabolisme des prostaglandines et ayant un effet vasoconstricteur (Cicco et coll., 2005 ).
). ), ce qui permet de répondre que partiellement aux objectifs spécifiques à chacun d’eux.
), ce qui permet de répondre que partiellement aux objectifs spécifiques à chacun d’eux. ) :
) : ; Conti et coll., 2007
; Conti et coll., 2007 ; Waller et coll., 2007
; Waller et coll., 2007 ). D’autres études se sont centrées sur des situations plus particulières comme les donneurs en état de mort encéphalique et les conditions de reprise de fonction (Kaminska et coll., 2007
). D’autres études se sont centrées sur des situations plus particulières comme les donneurs en état de mort encéphalique et les conditions de reprise de fonction (Kaminska et coll., 2007 ; Mas et coll., 2008
; Mas et coll., 2008 ). Les conditions de prélèvement ont également été évaluées et un profil d’expression différent a été mis en évidence concernant des gènes impliqués dans l’apoptose, l’adhérence cellulaire et les voies de signalisation, la croissance cellulaire et la prolifération, l’immunité et l’inflammation, l’ischémie et la réponse au stress ainsi que la dégradation protéique (Kurian et coll., 2005
). Les conditions de prélèvement ont également été évaluées et un profil d’expression différent a été mis en évidence concernant des gènes impliqués dans l’apoptose, l’adhérence cellulaire et les voies de signalisation, la croissance cellulaire et la prolifération, l’immunité et l’inflammation, l’ischémie et la réponse au stress ainsi que la dégradation protéique (Kurian et coll., 2005 ). Il apparaît que peu d’éléments sont disponibles sur la période de conservation. Cette phase de ralentissement métabolique n’est pas propice à la synthèse d’ARN messagers. Dans tous les cas, une meilleure connaissance de cette période est un impératif qui devrait permettre de caractériser les cibles thérapeutiques potentielles.
). Il apparaît que peu d’éléments sont disponibles sur la période de conservation. Cette phase de ralentissement métabolique n’est pas propice à la synthèse d’ARN messagers. Dans tous les cas, une meilleure connaissance de cette période est un impératif qui devrait permettre de caractériser les cibles thérapeutiques potentielles. ; Leonard et coll., 2006
; Leonard et coll., 2006 ; Burne-Taney et coll., 2006
; Burne-Taney et coll., 2006 ; Gottmann et coll., 2006
; Gottmann et coll., 2006 ; Herrero et coll., 2006
; Herrero et coll., 2006 ; Nakajima et coll., 2006
; Nakajima et coll., 2006 ). En revanche, le passage à des modèles pré-cliniques chez les grands mammifères reste décevant (Kosieradzki et coll., 2003b
). En revanche, le passage à des modèles pré-cliniques chez les grands mammifères reste décevant (Kosieradzki et coll., 2003b ). En clinique, des traitements de suppléance hormonale pour les patients en état de mort encéphalique sont déjà utilisés. D’autres molécules ont été évaluées comme la N-acétyl cystéine. La surexpression de l’HO-1 protège contre l’I/R chez le rat (Blydt-Hansen et coll., 2003
). En clinique, des traitements de suppléance hormonale pour les patients en état de mort encéphalique sont déjà utilisés. D’autres molécules ont été évaluées comme la N-acétyl cystéine. La surexpression de l’HO-1 protège contre l’I/R chez le rat (Blydt-Hansen et coll., 2003 ). Cependant, le rôle de l’expression de HO-1 au cours de la transplantation et son impact sur le devenir de la greffe restent à préciser chez l’homme (Geuken et coll., 2005
). Cependant, le rôle de l’expression de HO-1 au cours de la transplantation et son impact sur le devenir de la greffe restent à préciser chez l’homme (Geuken et coll., 2005 ).
). ; Chien et coll., 2007
; Chien et coll., 2007 ; Jamieson et Friend, 2008
; Jamieson et Friend, 2008 ). D’autres techniques ont été utilisées comme les oligonucléotides antisens ou encore les Small Interfering RNA (siRNA), ARN interférents pouvant se lier spécifiquement à une séquence d’ADN et ainsi empêcher l’expression de gènes en clivant leurs ARN messagers (Chen et coll., 2001
). D’autres techniques ont été utilisées comme les oligonucléotides antisens ou encore les Small Interfering RNA (siRNA), ARN interférents pouvant se lier spécifiquement à une séquence d’ADN et ainsi empêcher l’expression de gènes en clivant leurs ARN messagers (Chen et coll., 2001 ; Zheng et coll., 2006
; Zheng et coll., 2006 ). Ces techniques prometteuses d’un point de vue expérimental méritent une évaluation plus précise pour définir les conditions de leur utilisation et s’assurer de leur innocuité. Le préconditionnement par l’hyperthermie pourrait également améliorer la tolérance à la conservation (Matsumoto et coll., 2001
). Ces techniques prometteuses d’un point de vue expérimental méritent une évaluation plus précise pour définir les conditions de leur utilisation et s’assurer de leur innocuité. Le préconditionnement par l’hyperthermie pourrait également améliorer la tolérance à la conservation (Matsumoto et coll., 2001 ) et il semble que l’HSP 70 soit impliquée dans ce processus.
) et il semble que l’HSP 70 soit impliquée dans ce processus. ).
). ; Boros et Bromberg, 2006
; Boros et Bromberg, 2006 ; Jamieson et Friend, 2008
; Jamieson et Friend, 2008 ).
). ). Dans le même ordre d’idée, l’érythropoïétine pourrait avoir un rôle précieux aussi bien pour limiter les conséquences de l’I/R que pour favoriser la réparation de l’organe. L’effet du FR167653 a également été démontré dans des modèles de transplantation cardiaque, rénale et hépatique (Yoshinari et coll., 2001
). Dans le même ordre d’idée, l’érythropoïétine pourrait avoir un rôle précieux aussi bien pour limiter les conséquences de l’I/R que pour favoriser la réparation de l’organe. L’effet du FR167653 a également été démontré dans des modèles de transplantation cardiaque, rénale et hépatique (Yoshinari et coll., 2001 ; Koike et coll., 2004
; Koike et coll., 2004 ; Doucet et coll., 2008
; Doucet et coll., 2008 ). Compte tenu des mécanismes en jeu, l’utilisation d’une seule molécule semble aléatoire (Jamieson et Friend, 2008
). Compte tenu des mécanismes en jeu, l’utilisation d’une seule molécule semble aléatoire (Jamieson et Friend, 2008 ). Il apparaît donc important de choisir des options thérapeutiques utilisant des composants qui agissent sur des voies diverses ou sur plusieurs molécules d’actions différentes. Le choix de la cible est également majeur, et dans ce sens la mitochondrie peut représenter une cible de premier plan (Morin et coll., 2001
). Il apparaît donc important de choisir des options thérapeutiques utilisant des composants qui agissent sur des voies diverses ou sur plusieurs molécules d’actions différentes. Le choix de la cible est également majeur, et dans ce sens la mitochondrie peut représenter une cible de premier plan (Morin et coll., 2001 ). Les molécules antioxydantes constituent une famille de choix pour améliorer la conservation du greffon, toutefois le choix du type de molécule est important. Les antioxydants stœchiométriques, qui sont efficaces en systèmes fermés, le sont bien moins en milieu vivant où interviennent les enzymes pro-oxydantes (qui produisent des milliers d’ERO à la seconde) et en conséquence les concentrations de ces « piégeurs » doivent être élevées. Ils conviennent bien comme radioprotecteurs, si le processus à l’origine de la formation des dérivés oxygénés est de très courte durée. En revanche, s’il s’agit de neutraliser des radicaux se formant de manière ininterrompue, pendant une certaine durée (activation de macrophages par cytokines, par exemple), il est clair que l’efficacité des antioxydants sera faible. Certaines molécules dérivées des flavonoïdes ont démontré des effets protecteurs lors de la conservation dans des modèles cellulaires (Ahlenstiel et coll., 2003
). Les molécules antioxydantes constituent une famille de choix pour améliorer la conservation du greffon, toutefois le choix du type de molécule est important. Les antioxydants stœchiométriques, qui sont efficaces en systèmes fermés, le sont bien moins en milieu vivant où interviennent les enzymes pro-oxydantes (qui produisent des milliers d’ERO à la seconde) et en conséquence les concentrations de ces « piégeurs » doivent être élevées. Ils conviennent bien comme radioprotecteurs, si le processus à l’origine de la formation des dérivés oxygénés est de très courte durée. En revanche, s’il s’agit de neutraliser des radicaux se formant de manière ininterrompue, pendant une certaine durée (activation de macrophages par cytokines, par exemple), il est clair que l’efficacité des antioxydants sera faible. Certaines molécules dérivées des flavonoïdes ont démontré des effets protecteurs lors de la conservation dans des modèles cellulaires (Ahlenstiel et coll., 2003 et 2006
et 2006 ). Leur problème essentiel pour pouvoir être utilisées dans les solutions de conservation est leur insolubilité en milieu aqueux.
). Leur problème essentiel pour pouvoir être utilisées dans les solutions de conservation est leur insolubilité en milieu aqueux. ). Ce point est d’importance car nombre de molécules ne peuvent atteindre leur cible dans des situations physiopathologiques diverses. Il semble cependant peu probable de disposer d’un produit unique à moins que celui-ci n’agisse à un stade très précoce ou sur des cibles majeures.
). Ce point est d’importance car nombre de molécules ne peuvent atteindre leur cible dans des situations physiopathologiques diverses. Il semble cependant peu probable de disposer d’un produit unique à moins que celui-ci n’agisse à un stade très précoce ou sur des cibles majeures. ; Lucas da Silva et coll., 2007
; Lucas da Silva et coll., 2007 ). En effet, le rôle des cellules souches dans la réparation reste à préciser et pourrait se limiter à un intérêt pour la réparation vasculaire et à un rôle trophique.
). En effet, le rôle des cellules souches dans la réparation reste à préciser et pourrait se limiter à un intérêt pour la réparation vasculaire et à un rôle trophique. et 2003
et 2003 ). Dans le cas du rein, le concept de masse néphronique est aussi un point à considérer par rapport aux moyens de réparation que peut mettre en œuvre le rein (Cruzado et coll., 2000
). Dans le cas du rein, le concept de masse néphronique est aussi un point à considérer par rapport aux moyens de réparation que peut mettre en œuvre le rein (Cruzado et coll., 2000 ). Il semble que le rein, au cours de la réparation, utilise majoritairement des populations de cellules résidentes et non des cellules périphériques (Humphreys et coll., 2008
). Il semble que le rein, au cours de la réparation, utilise majoritairement des populations de cellules résidentes et non des cellules périphériques (Humphreys et coll., 2008 ). Par conséquent, l’équilibre entre les lésions dues au syndrome d’I/R et les processus de restauration/régénération implique de préserver ce potentiel de réparation. Dans la figure 7.7
). Par conséquent, l’équilibre entre les lésions dues au syndrome d’I/R et les processus de restauration/régénération implique de préserver ce potentiel de réparation. Dans la figure 7.7 , on retrouve une présentation des liens entre le processus lésionnel de l’I/R et la fibrose et l’atrophie tubulaire, qui sont les conséquences majeures.
, on retrouve une présentation des liens entre le processus lésionnel de l’I/R et la fibrose et l’atrophie tubulaire, qui sont les conséquences majeures. ).
). ). Comte tenu là aussi d’un certain degré d’empirisme, d’autres techniques émergent comme la perfusion normothermique ou la perfusion oxygénée.
). Comte tenu là aussi d’un certain degré d’empirisme, d’autres techniques émergent comme la perfusion normothermique ou la perfusion oxygénée. ; Hosgood et coll., 2008
; Hosgood et coll., 2008 ). L’ischémie chaude est responsable de l’activation des cellules endothéliales, de leur œdème et des phénomènes inflammatoires et thrombotiques associés avec les conséquences rhéologiques décrites (augmentation de l’hématocrite dans les microvaisseaux, altérations de la fluidité sanguine, réduction du diamètre des capillaires et phénomène de « no reflow »).
). L’ischémie chaude est responsable de l’activation des cellules endothéliales, de leur œdème et des phénomènes inflammatoires et thrombotiques associés avec les conséquences rhéologiques décrites (augmentation de l’hématocrite dans les microvaisseaux, altérations de la fluidité sanguine, réduction du diamètre des capillaires et phénomène de « no reflow »). ; Polyak et coll., 2000
; Polyak et coll., 2000 ; Kirshbom et coll., 2002
; Kirshbom et coll., 2002 ; Fitton et coll., 2005
; Fitton et coll., 2005 ; Lindell et coll., 2005
; Lindell et coll., 2005 ; Minor et coll., 2005
; Minor et coll., 2005 ; Baicu et coll., 2006
; Baicu et coll., 2006 ; Bessems et coll., 2006
; Bessems et coll., 2006 ; Matsuoka et coll., 2006
; Matsuoka et coll., 2006 ; Fuller et Lee, 2007
; Fuller et Lee, 2007 ; Maathuis et coll., 2007b
; Maathuis et coll., 2007b ). Il n’en reste pas moins qu’un certain nombre d’avantages est à souligner avec ce type de conservation méritant ainsi une évaluation rationnelle (tableau 7.IV
). Il n’en reste pas moins qu’un certain nombre d’avantages est à souligner avec ce type de conservation méritant ainsi une évaluation rationnelle (tableau 7.IV ).
). , Parikh et coll., 2007
, Parikh et coll., 2007 ; Coca et coll., 2008
; Coca et coll., 2008 ). Disposer de tels marqueurs impose l’évaluation des outils permettant de les mesurer. Parmi ceux-ci, la spectroscopie RMN du proton reste d’actualités (Hauet et coll., 2000
). Disposer de tels marqueurs impose l’évaluation des outils permettant de les mesurer. Parmi ceux-ci, la spectroscopie RMN du proton reste d’actualités (Hauet et coll., 2000 ; Serkova et coll., 2005
; Serkova et coll., 2005 ), en particulier avec les nouvelles techniques de haute résolution (Martinez-Granados et coll., 2006
), en particulier avec les nouvelles techniques de haute résolution (Martinez-Granados et coll., 2006 ; Wishart, 2006
; Wishart, 2006 ). D’autre part, le moment de la perfusion par machine pourrait être mis à profit pour évaluer la viabilité de ces organes (Matsuno et coll., 2006
). D’autre part, le moment de la perfusion par machine pourrait être mis à profit pour évaluer la viabilité de ces organes (Matsuno et coll., 2006 ). D’autres techniques pourraient avoir un intérêt dans ce contexte comme la microdialyse ou la bioimpédence électrique (Jamieson et Friend, 2008
). D’autres techniques pourraient avoir un intérêt dans ce contexte comme la microdialyse ou la bioimpédence électrique (Jamieson et Friend, 2008 ).
). ; Land, 2005a
; Land, 2005a et b
et b ). Plusieurs types cellulaires interviennent au cours de l’inflammation et leur rôle est parfois contradictoire. Les macrophages semblent impliqués dans le processus fibrosant (Ko et coll., 2008
). Plusieurs types cellulaires interviennent au cours de l’inflammation et leur rôle est parfois contradictoire. Les macrophages semblent impliqués dans le processus fibrosant (Ko et coll., 2008 ) et leur fonction pourrait varier au cours de la reperfusion (Vinuesa et coll., 2008
) et leur fonction pourrait varier au cours de la reperfusion (Vinuesa et coll., 2008 ; Jang et coll., 2008
; Jang et coll., 2008 ). Les lymphocytes T pourraient participer à l’amplification de la reconnaissance antigénique ou à l’inverse, pour certains phénotypes avoir un effet protecteur (Ascon et coll., 2006
). Les lymphocytes T pourraient participer à l’amplification de la reconnaissance antigénique ou à l’inverse, pour certains phénotypes avoir un effet protecteur (Ascon et coll., 2006 ; Savransky et coll., 2006
; Savransky et coll., 2006 ; Huang et coll., 2007
; Huang et coll., 2007 ). Le rôle des lymphocytes B a été étudié et ces cellules semblent avoir un rôle dans la pathogénie de l’I/R (Burne-Taney et coll., 2003
). Le rôle des lymphocytes B a été étudié et ces cellules semblent avoir un rôle dans la pathogénie de l’I/R (Burne-Taney et coll., 2003 ). Les cellules dendritiques et leur activation via la production des ERO constituent un lien entre l’I/R et l’immunité innée. Suite à l’engagement des récepteurs Toll-like (Boros et Bromberg, 2006
). Les cellules dendritiques et leur activation via la production des ERO constituent un lien entre l’I/R et l’immunité innée. Suite à l’engagement des récepteurs Toll-like (Boros et Bromberg, 2006 ; Land, 2005b), ces cellules deviennent actives et matures avec une modification de l’expression de leurs récepteurs de surface conduisant à leur migration vers les organes lymphoïdes secondaires (Boros et Bromberg, 2006
; Land, 2005b), ces cellules deviennent actives et matures avec une modification de l’expression de leurs récepteurs de surface conduisant à leur migration vers les organes lymphoïdes secondaires (Boros et Bromberg, 2006 ). Les cellules dendritiques deviennent alors capables de stimuler les lymphocytes T naïfs. Il s’ensuit une augmentation de production et d’expression de nombreuses protéines pro-inflammatoires (cytokines et chimiokines et leurs récepteurs) (Furuichi et coll., 2008
). Les cellules dendritiques deviennent alors capables de stimuler les lymphocytes T naïfs. Il s’ensuit une augmentation de production et d’expression de nombreuses protéines pro-inflammatoires (cytokines et chimiokines et leurs récepteurs) (Furuichi et coll., 2008 ).
). ; Simmons et coll., 2008
; Simmons et coll., 2008 ).
). ) mais qu’ils doivent être associés à des modèles in vivo. L’utilisation de nouvelles sources de donneurs conforte ce constat. Il paraît intéressant d’observer et de collecter des informations sur les espèces ayant des comportements d’hibernants ou d’hivernants (Storey, 2004
) mais qu’ils doivent être associés à des modèles in vivo. L’utilisation de nouvelles sources de donneurs conforte ce constat. Il paraît intéressant d’observer et de collecter des informations sur les espèces ayant des comportements d’hibernants ou d’hivernants (Storey, 2004 ) pour améliorer la compréhension des mécanismes d’adaptation physiologique au stress engendré par l’ischémie. L’élucidation de ces mécanismes devrait permettre d’améliorer la conservation des organes et limiter les dommages engendrés par l’I/R. L’analyse des mécanismes en cause au cours de l’I/R par une approche intégrée associant des outils de génomique et protéomique devrait permettre d’identifier les cibles essentielles. L’utilisation des machines de perfusion semble être une voie également d’un intérêt majeur avec l’évaluation de la température de perfusion éventuellement avec une oxygénation des milieux. Ce moment de la perfusion est idéal pour l’évaluation des organes d’une part et l’utilisation d’additif(s) pharmacologique(s) d’autre part.
) pour améliorer la compréhension des mécanismes d’adaptation physiologique au stress engendré par l’ischémie. L’élucidation de ces mécanismes devrait permettre d’améliorer la conservation des organes et limiter les dommages engendrés par l’I/R. L’analyse des mécanismes en cause au cours de l’I/R par une approche intégrée associant des outils de génomique et protéomique devrait permettre d’identifier les cibles essentielles. L’utilisation des machines de perfusion semble être une voie également d’un intérêt majeur avec l’évaluation de la température de perfusion éventuellement avec une oxygénation des milieux. Ce moment de la perfusion est idéal pour l’évaluation des organes d’une part et l’utilisation d’additif(s) pharmacologique(s) d’autre part.