2009
→ Aller vers ANALYSE→ Aller vers SYNTHESE
Transplantation rénale chez l’enfant
Il est bien admis que la transplantation rénale est le traitement optimal de l’insuffisance rénale chronique de l’enfant. De nombreuses études ont montré que la transplantation améliorait le pronostic, les fonctions cognitives, l’intégration sociale et la qualité de vie.
Indications de la transplantation rénale chez l’enfant
La survie des enfants transplantés rénaux est bien supérieure à celle des enfants traités par dialyse quel que soit l’âge de la transplantation. Les données recueillies aux États-Unis (USRDS, United States Renal Data System) indiquent que l’espérance de vie est supérieure chez les patients transplantés en comparaison aux enfants restant en dialyse avec une amélioration de 30 ans de l’espérance de vie pour les enfants de 0 à 14 ans. Globalement, dans cette tranche d’âge, la transplantation prolonge de 50 ans leur espérance de vie. Pour les enfants âgés de 15 à 19 ans, la différence d’espérance de vie entre les enfants transplantés et ceux restant en dialyse est de 25 ans, avec pour les transplantés une espérance de durée de vie supplémentaire de 40 ans.
L’insuffisance rénale terminale touche plus souvent les garçons que les filles (respectivement 60 % et 40 %). Les uropathies obstructives et les hypoplasies et dysplasies rénales représentent 30 % des causes d’insuffisance rénale terminale. Le syndrome néphrotique idiopathique corticorésistant est la troisième cause par ordre de fréquence représentant 12 % des causes d’insuffisance rénale terminale. Contrairement à ce que l’on observe chez les adultes, la cause précise est identifiée dans plus de 90 % des cas.
En France, le nombre d’enfants de moins de 16 ans qui atteignent le stade d’insuffisance rénale terminale nécessitant le recours à un traitement de suppléance (dialyse ou transplantation rénale) a été de 71 en 2006 et 74 en 2007. Le nombre de patients de moins de 16 ans inscrits sur la liste d’attente en vue d’une transplantation rénale était de 53 au 1er janvier 2006, également 53 au 1er janvier 2007 et 61 au 1er janvier 2008. Le nombre de nouveaux patients inscrits sur la liste d’attente a été de 85 et 88 durant les années 2006 et 2007. Durant les années 2006 et 2007, les nombres d’enfants ayant reçu une transplantation rénale ont été respectivement de 84 et 76. La diminution du nombre de transplantations rénales effectuées en 2007 explique l’augmentation du nombre d’enfants en attente de greffe au 1er janvier 2008. La proportion de transplantations rénales « préemptives », c’est-à-dire avant le stade de la dialyse a été de 10,7 % en 2006 et 11,8 % en 2007.
Caractéristiques des donneurs
En France, la proportion de greffes rénales chez l’enfant à partir de donneur vivant apparenté, le plus souvent un des deux parents a varié au cours des 5 dernières années entre 7 et 19 %, alors qu’en Amérique du Nord, cette proportion est de 52 %. La survie des greffes à partir de donneur vivant est significativement plus élevée que celle des greffes provenant de donneur décédé avec une différence de 10 % 5 ans après la transplantation. La date de la transplantation peut être programmée en dehors de l’urgence en fonction de la disponibilité du donneur et de l’organisation de l’équipe de greffe. La greffe à partir de donneur vivant permet d’éviter la période de dialyse ou d’en limiter la durée. Cela est important chez l’enfant dont la qualité de vie est améliorée par la greffe, la dialyse ayant des effets délétères au niveau des accès vasculaires pour l’hémodialyse ainsi que sur la croissance en taille, la vie familiale et sociale et la fréquentation scolaire. La médiane de la demi-vie d’une greffe de rein chez l’enfant étant d’environ 20 ans, une deuxième transplantation sera nécessaire pour la majorité d’entre eux. Le choix d’une greffe de donneur vivant peut se faire d’emblée ou pour une seconde greffe, sachant que les difficultés d’accès peuvent être plus grandes pour une seconde greffe en fonction d’une éventuelle immunisation et du fait que le receveur a dépassé l’âge de 18 ans (De Meester et coll., 2001

).
Le rapport Nord Américain
1
indique que 25 % des transplantations à partir de donneurs en état de mort cérébrale proviennent de donneurs âgés de moins de 13 ans. Ce même rapport indique que 25 % des transplantations sont effectuées sans passage par le stade de dialyse (transplantation « préemptive »). Ces transplantations préemptives concernent 33 % des greffes de donneurs vivants et 13 % de donneurs décédés.
Traitements immunosuppresseurs
Les traitements immunosuppresseurs prescrits après transplantation rénale pédiatrique ont changé au cours de la dernière décennie.
Les traitements d’induction sont de plus en plus utilisés depuis quelques années et des protocoles sont en cours d’évaluation dans le but en particulier de réduire ou d’éviter l’utilisation de corticoïdes et de réduire les doses d’anticalcineurines qui ont un effet néphrotoxique et qui ont un rôle majeur dans la néphropathie chronique d’allogreffe (Sarwal et coll., 2003

; Delucchi et coll., 2007

; Pedersen et coll., 2007

; Weintraub et coll., 2008

). Parmi les anticorps utilisés, certains sont déplétants, en particulier les globulines de lapin antilymhocytaires (thymoglobulines) (Schwartz et coll., 2007

). L’alemtuzimab est un anticorps monoclonal déplétant dont la cible est la molécule CD52 présente sur les lymphocytes B, les lymphocytes T et les monocytes. L’administration de cet anticorps entraîne une déplétion pro-fonde et prolongée des lymphocytes circulants, des cellules NK et des monocytes. Les anticorps monoclonaux dirigés contre le récepteur de l’interleukine 2 (R-IL2), basiliximab et dacluzimab, sont des anticorps non déplétants. Si la grande majorité des enfants en France reçoit ce type d’anticorps, un tiers des enfants en Amérique du Nord ne reçoit pas de traitement d’induction, 10 % reçoit des globulines de lapin anti-lymphocytaires et 55 % des anticorps monoclonaux anti-R-IL2. L’utilisation de l’anticorps monoclonal OKT3 a totalement disparu en transplantation rénale pédiatrique en raison des effets secondaires et à la suite d’une étude montrant que l’OKT3 ne réduit pas l’incidence du rejet aigu ni des pertes de greffes par rapport au traitement par ciclosporine (Benfield et coll., 2005

).
L’utilisation prolongée de dacluzimab pendant les 6 premiers mois en association au tacrolimus et au mycophénolate dans un protocole sans corticostéroïdes a permis à l’équipe de Sarwal d’obtenir de bons résultats en greffe rénale chez l’enfant avec une incidence de rejets inférieure à 10 % (Sarwal et coll., 2003

). Ce protocole est en cours d’évaluation dans un essai multicentrique du
National Institutes of Health. Une autre étude a montré des résultats comparables avec une induction par deux injections de basiliximab, ce qui laisse penser qu’un blocage prolongé des récepteurs de l’IL-2 n’est pas forcément nécessaire.
L’utilisation d’anticorps déplétants (globulines anti-thymocytes ou alemtuzimab) avec une dose faible de tacrolimus sans autre traitement immunosuppresseur a été évaluée par Ellis et coll. (2007

). L’incidence de rejet est faible (de l’ordre de 10 %) et la croissance des enfants et leur fonction rénale excellentes (Ellis et coll., 2007

).
Les signaux de co-stimulation sont essentiels pour une stimulation efficace des lymphocytes T après la présentation des antigènes par les cellules présentatrices de l’antigène. Certains anticorps sont dirigés contre les molécules de co-stimulation. Le blocage de la voie CD40/CD40L qui avait donné de très bons résultats chez l’animal ne permet pas de prévenir le rejet chez l’homme et s’accompagne en plus de complications thrombo-emboliques. Plus récemment, une version modifiée de CTLA-4Ig, LEA29Y (belatacept), qui permet une dissociation plus lente de ses ligants CD80 et CD86 a un effet immunosuppresseur important. Néanmoins, il n’y a pas eu d’essai d’arrêt des immunosuppresseurs dans les études réalisées jusqu’à présent (Larsen et coll., 2005

; Vincenti et coll., 2005

).
Les changements ont aussi été marqués par l’introduction de nouveaux immunosuppresseurs comme le mycophénolate mofétil et le tacrolimus. Le traitement immunosuppresseur administré à la fin du premier mois comportait une association de ciclosporine, azathioprine et corticoïdes dans un tiers des cas dans les années 1996-1997 alors que cette association n’est plus utilisée actuellement. L’association tacrolimus, mycophénolate mofétil et corticoïdes est actuellement la plus fréquente. Cette association permet de réduire les doses de corticoïdes et dans certaines équipes de proposer des protocoles sans corticoïdes ou avec un arrêt précoce de la corticothérapie. L’utilisation des inhibiteurs de mTOR (mammalian target of rapamycin) a jusqu’à présent été limitée chez l’enfant à des situations particulières comme une néphrotoxicité des anticalcineurines. En effet, les effets secondaires de ces drogues (hypercholestérolémie, pneumonie, anémie, lymphocèle, retard de cicatrisation) en limitent l’utilisation.
Complications
Si l’on constate au fil des années une diminution de l’incidence des crises de rejet et une amélioration de la survie des greffes, nous observons en revanche une incidence grandissante de tumeurs malignes, en particulier les syndromes lymphoprolifératifs (Opelz et Dohler, 2004

; Dharnidharka et Araya, 2007

), probablement à rapporter à l’utilisation de traitements immunosuppresseurs plus puissants. Le registre Nord Américain
2
indique la survenue de tumeurs malignes au cours des trois premières années suivant la transplantation chez 0,96 % des receveurs dans la cohorte d’enfants greffés entre 1987 et 1991, 2 % des enfants greffés entre 1992 et 1995 et 3,6 % des enfants greffés après 1996.
Un autre marqueur d’une forte immunosuppression est l’incidence des complications infectieuses (Dharnidharka et coll., 2004

; Puliyanda et coll., 2007

). Si les traitements prophylactiques efficaces permettent d’éviter les infections à CMV (cytomégalovirus) et le pneumocystis, l’incidence des infections à virus BK a augmenté de façon significative. Smith et coll. dans l’étude Nord Américaine (
North American Pediatric Renal Trials and Collaborative Studies, NAPRTCS) rapportent la survenue d’une néphropathie à virus BK chez 25 (4,6 %) des 542 enfants transplantés et diagnostiquée en moyenne 10 mois après la greffe (Smith et coll., 2007

).
Les effets secondaires des traitements immunosuppresseurs expliquent un problème majeur chez certains transplantés, à savoir la mauvaise observance des traitements. Ceci est particulièrement vrai des adolescents chez lesquels il a été montré que le taux de mauvaise observance pouvait être jusqu’à 4 fois plus élevé que chez les adultes ou les enfants plus jeunes. Ceci explique que la survie des greffes dans cette tranche d’âge soit la moins favorable en comparaison avec les autres tranches d’âge. Ce problème de mauvaise observance du traitement immunosuppresseur est responsable d’au mois un quart des pertes de greffes chez les adolescents (Dobbels et coll., 2005

). L’évaluation de ce problème reste difficile chez un patient donné.
En conclusion, la transplantation rénale est le traitement de choix de l’insuffisance rénale terminale de l’enfant. Les progrès dans la prise en charge des enfants et les nouveaux traitements immunosuppresseurs ont permis d’améliorer la survie des greffes. Les nouvelles voies ont pour but de limiter les effets secondaires de ces traitements en diminuant les corticoïdes et/ou les anticalcineurines. Une bonne adhésion au traitement demeure une préoccupation majeure, en particulier chez les adolescents.
Bibliographie
[1] benfield mr,
tejani a,
harmon we,
mcdonald r,
stablein dm, et coll.. A randomized multicenter trial of OKT3 mAbs induction compared with intravenous cyclosporine in pediatric renal transplantation. Pediatric transplantation.
. 2005;
9:282
-292

[2] de meester j,
smits jm,
offner g,
persijn gg. Renal retransplantation of children: is a policy ’first cadaver donor, then live donor’ an acceptable option?.
Pediatric Transplantation. 2001;
5:179
-186

[3] delucchi a,
valenzuela m,
ferrario m,
lillo am,
guerrero jl, et coll.. Early steroid withdrawal in pediatric renal transplant on newer immunosuppressive drugs.
Pediatric Transplantation. 2007;
11:743
-748

[4] dharnidharka vr,
araya ce. Post-transplant lymphoproliferative disease.
Pediatric Nephrology (Berlin, Germany). 2007 epub;

[5] dharnidharka vr,
stablein dm,
harmon we. Post-transplant infections now exceed acute rejection as cause for hospitalization: a report of the NAPRTCS.
Am J Transplant. 2004;
4:384
-389

[6] dobbels f,
van damme-lombaert r,
vanhaecke j,
de geest s. Growing pains: non-adherence with the immunosuppressive regimen in adolescent transplant recipients.
Pediatric Transplantation. 2005;
9:381
-390

[7] ellis d,
shapiro r,
moritz m,
vats a,
basu a,
tan h, et coll.. Renal transplantation in children managed with lymphocyte depleting agents and low-dose maintenance tacrolimus monotherapy.
Transplantation. 2007;
83:1563
-1570

[8] larsen cp,
pearson tc,
adams ab,
tso p,
shirasugi n, et coll. Rational development of LEA29Y (belatacept), a high-affinity variant of CTLA4-Ig with potent immunosuppressive properties.
Am J Transplant. 2005;
5:443
-453

[9] opelz g,
dohler b. Lymphomas after solid organ transplantation: a collaborative transplant study report.
Am J Transplant. 2004;
4:222
-230

[10] pedersen eb,
el-faramawi m,
foged n,
larsen ke,
jespersen b. Avoiding steroids in pediatric renal transplantation: long-term experience from a single centre.
Pediatric Transplantation. 2007;
11:730
-735

[11] puliyanda dp,
stablein dm,
dharnidharka vr. Younger age and antibody induction increase the risk for infection in pediatric renal transplantation: a NAPRTCS report.
Am J Transplant. 2007;
7:662
-666

[12] sarwal mm,
vidhun jr,
alexander sr,
satterwhite t,
millan m,
salvati-erra o jr. Continued superior outcomes with modification and lengthened follow-up of a steroid-avoidance pilot with extended daclizumab induction in pediatric renal transplantation.
Transplantation. 2003;
76:1331
-1339

[13] schwartz jj,
ishitani mb,
weckwerth j,
morgenstern b,
milliner d,
stegall md. Decreased incidence of acute rejection in adolescent kidney transplant recipients using antithymocyte induction and triple immunosuppression.
Transplantation. 2007;
84:715
-721

[14] smith jm,
dharnidharka vr,
talley l,
martz k,
mcdonald ra. BK virus nephropathy in pediatric renal transplant recipients: an analysis of the North American Pediatric Renal Trials and Collaborative Studies (NAPRTCS) registry.
Clin J Am Soc Nephrol. 2007;
2:1037
-1042

[15] vincenti f,
larsen c,
durrbach a,
wekerle t,
nashan b, et coll.. Costimulation blockade with belatacept in renal transplantation.
The New England Journal of Medicine. 2005;
353:770
-781

[16] weintraub l,
li l,
kambham n,
alexander s,
concepcion w,
miller k, et coll.. Patient selection critical for calcineurin inhibitor withdrawal in pediatric kidney transplantation.
Pediatric Transplantation. 2008;
12:541
-549

Patrick Niaudet et Rémi Salomon
Service de néphrologie pédiatrique,
Hôpital Necker-Enfants Malades, Paris
Transplantation hépatique chez l’enfant
Le nombre de transplantations hépatiques (TH) réalisées chez l’enfant âgé de moins de 16 ans représente environ 6 à 8 % du nombre total de TH réalisées chaque année en France, soit en moyenne 65 greffes par an (nombre relativement constant depuis 10 ans). Les deux tiers de ces greffes sont réalisés dans le groupe de transplantation hépatique pédiatrique à l’Hôpital Bicêtre. Les spécificités de la transplantation hépatique chez l’enfant tiennent essentiellement aux indications, au jeune âge des enfants, aux diverses techniques de prélèvement exposant à un risque accru de complications vasculaires et biliaires, et à la fréquence du syndrome lymphoprolifératif EBV-induit.
Indications de la transplantation hépatique chez l’enfant
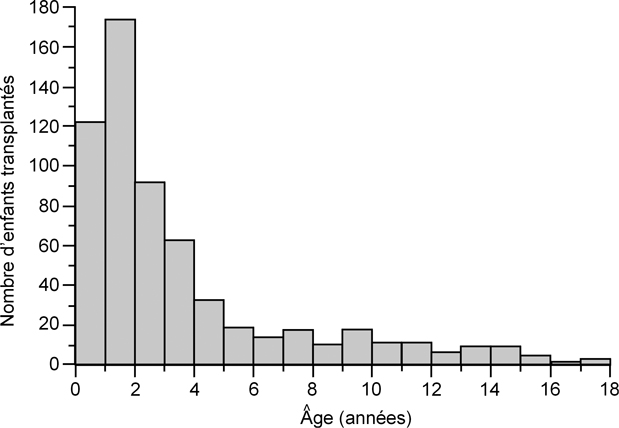
Les indications de TH sont caractérisées par la forte prédominance des maladies cholestatiques chroniques le plus souvent de début néonatal évoluant vers la cirrhose biliaire, par la nécessité d’une TH le plus souvent avant l’âge de 5 ans (médiane 2,5 ans) (figure 1

), et enfin par la très faible proportion de maladies exposant à un risque de récidive sur le greffon.
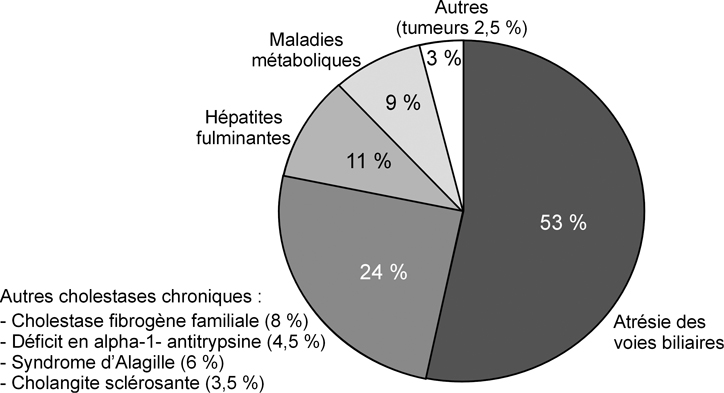
Les indications de transplantation hépatique chez l’enfant peuvent être classées en 3 groupes principaux (figure 2

) : les maladies cholestatiques chroniques (dont l’atrésie des voies biliaires), l’hépatite fulminante et les maladies métaboliques.
Maladies cholestatiques chroniques
La principale indication de TH chez l’enfant est l’atrésie des voies biliaires (AVB) qui représente à elle seule plus de 50 % des indications (Chardot et coll., 1999

). Les cholestases fibrogènes familiales, la cirrhose biliaire secondaire à un déficit en alpha-1-antitrypsine, le syndrome d’Alagille (ou paucité des voies biliaires intrahépatique syndromique) et la cholangite sclérosante constituent également une indication de TH soit en raison de complications liées à la cirrhose biliaire secondaire, soit en raison des conséquences de la cholestase (prurit invalidant, retard de croissance, fractures osseuses) même en l’absence de cirrhose, notamment dans le cas du syndrome d’Alagille (Debray et coll., 1994

; Filipponi et coll., 1994

; Cardona et coll., 1995

; Baussan et coll., 2004

).
Hépatite fulminante
Lorsqu’elle est reconnue, la cause est d’origine virale le plus souvent (virus A essentiellement chez le grand enfant, virus B ou herpès hominis virus-6 chez le nourrisson), auto-immune ou plus rarement toxique (Devictor et coll., 1992

; Debray et coll., 1997

; Durand et coll., 2001

). Cependant, la cause reste fréquemment indéterminée (40 à 75 % des cas selon les études).
Maladies métaboliques
Deux groupes de maladies métaboliques peuvent conduire à poser l’indication d’une TH :
• les maladies responsables d’une atteinte grave du foie (insuffisance hépatique aiguë, cirrhose, cancer du foie) telles que la maladie de Wilson, la tyrosinémie héréditaire, les anomalies de la chaîne respiratoire mitochondriale, les glycogénoses de type I, III ou IV (Dubern et coll., 2001

; Tissières et coll., 2003

; Davis et coll., 2008

; Masurel-Paulet et coll., 2008

) ;
• les maladies dont le déficit enzymatique hépatique expose à des complications extra-hépatiques graves : neurologiques (maladie de Crigler-Najjar, déficit des enzymes du cycle de l’urée), rénales (oxalose de type I), cardiovasculaires (hypercholestérolémie familiale).
Indications diverses
L’indication de TH peut être retenue en cas de tumeur du foie inextirpable chirurgicalement, soit bénigne mais exposant à un risque de dégénérescence secondaire (adénomes), soit maligne strictement limitée au foie (hépatocarcinome lié au virus de l’hépatite B, carcinome fibrolamellaire, hépatoblastome). La cirrhose secondaire à une hépatite chronique C et une hépatite auto-immune, le syndrome de Budd-Chiari, la fibrose hépatique congénitale représentent des indications exceptionnelles chez l’enfant.
Préparation de l’enfant à la transplantation
Les maladies cholestatiques chroniques entraînent rapidement un retard de croissance staturo-pondérale chez l’enfant. La malnutrition est un mauvais élément pronostique pour le succès de la TH, d’où la nécessité de prendre des mesures symptomatiques (suppléments caloriques oraux, nutrition entérale à débit continu, parfois nutrition parentérale) et d’envisager précocement l’indication de TH avant les signes de décompensation d’une cirrhose afin de réaliser la greffe dans les meilleures conditions. À tout moment, une complication grave (hémorragie digestive, aggravation brutale des fonctions hépatiques, sepsis) peut survenir pouvant conduire au décès de l’enfant avant la transplantation ou à la nécessité d’une greffe urgente.
Aspects techniques de la transplantation hépatique spécifiques à l’enfant
Le choix du greffon hépatique dépend essentiellement de l’âge et du poids du receveur et du donneur.
Choix du greffon
Compatibilité ABO
La greffe hépatique est réalisée en compatibilité de groupe sanguin selon les règles de la transfusion sanguine. Néanmoins, les résultats de la greffe hépatique réalisée en situation d’incompatibilité de groupe sanguin donneur-receveur apparaissent satisfaisants lorsque le receveur est âgé de moins de 1 an (Yandza et coll., 1997

; Egawa et coll., 2004

). Cette situation mérite d’être considérée dans les situations de greffe extrêmement urgente chez le nourrisson (hépatite fulminante notamment).
Âge du donneur
Il n’y a pas de limite d’âge du donneur en deçà et au-delà de laquelle la greffe n’est pas réalisable. Cependant, l’utilisation de greffons de donneurs âgés de moins de 1 an (ou de poids < 10 kg) expose à un risque accru de thrombose artérielle et de perte du greffon (Cacciarelli et coll., 1999

). Une diminution de la survie est également rapportée pour les greffons de donneurs âgés de plus de 50 ans (Hoofnagle et coll., 1996

; Busuttil et coll., 2005

). L’âge moyen des donneurs de foie en France est actuellement de 50 ans. Cependant, du fait des règles de répartition des greffons qui offrent en priorité les greffons de donneurs de moins de 30 ans aux receveurs de moins de 18 ans, la majorité des greffes réalisées chez l’enfant le sont avec des greffons de jeunes donneurs.
Volume du greffon
La greffe du foie entier est la technique la plus simple mais nécessite une adéquation de taille entre greffon et receveur et ne représente que 15 à 20 % du nombre total de greffes hépatiques pédiatriques depuis 2000. La relative rareté des prélèvements d’organes chez l’enfant et surtout la pénurie globale de greffons hépatiques ont conduit au développement de techniques chirurgicales particulières pour accroître les possibilités de greffe des enfants mais également des adultes et limiter les décès en liste d’attente. La réduction du foie au foie gauche ou au lobe gauche, après hépatectomie droite ou lobectomie droite, permet d’atteindre des disparités de poids donneur/receveur respectivement de 2 à 4 et de 4 à 10. La technique de bipartition hépatique (« greffon partagé » ou
split) permet de créer 2 greffons à partir d’un foie d’adulte : le foie ou le lobe droit pour un receveur adulte et le foie ou le plus souvent le lobe gauche pour un jeune enfant. Enfin, le prélèvement du lobe gauche du foie peut être réalisé chez l’un des 2 parents. Ce mode de prélèvement à partir d’un donneur vivant permet de programmer l’intervention chez un enfant encore en bonne condition générale avec un greffon de très bonne qualité et une brève ischémie froide mais n’est pas toujours réalisable sur le plan technique (incompatibilité de groupe sanguin, disparité de poids donneur/receveur > 8, particularités anatomiques, facteurs de risque de morbidité post-opératoire chez le donneur…). Le risque de mortalité du donneur est estimé à 0,5 % tout type de prélèvement confondu, mais ce risque apparaît nettement augmenté dans le cas d’un prélèvement de foie droit par rapport à un prélèvement de lobe gauche (Trotter et coll., 2006

). La pénurie de greffons à l’origine d’une augmentation de la mortalité en liste d’attente des plus jeunes enfants, a été la justification principale du recours aux greffons partagés et au développement de la TH à partir d’un donneur vivant parental. Le pourcentage de TH réalisées à Bicêtre à partir d’un greffon partagé et d’un greffon de donneur vivant représente respectivement 50 % et 20 % du nombre total de TH pour la période 2003-2007.
Greffe hépatique
Elle est réalisée habituellement en position orthotopique après ablation du foie malade. La phase d’hépatectomie totale est souvent difficile et hémorragique notamment en cas d’antécédents de chirurgie hépatobiliaire (AVB). L’anastomose artérielle est faite directement sur l’axe artériel du receveur ou sur l’aorte sous-rénale avec un greffon artériel du donneur interposé ; l’anastomose biliaire est dans la majorité des cas réalisée sur une anse jéjunale en Y soit préexistante (antécédent d’hépatoportoentérostomie) soit nouvellement créée.
Complications liées à la transplantation hépatique chez l’enfant
Le jeune âge des receveurs et l’utilisation fréquente de greffons partagés ou de greffons de donneur vivant expliquent la fréquence des complications dans les suites de la greffe hépatique.
Complications « chirurgicales » post-opératoires
Les complications « chirurgicales » post-opératoires sont fréquentes (Fouquet et coll., 2005

). Deux complications sont plus particulièrement à redouter en période post-opératoire immédiate : la dysfonction primaire du greffon et les complications vasculaires. Les complications biliaires, souvent retardées, dominent ensuite.
Dysfonction primaire du greffon
Elle est due à une souffrance ischémique du greffon et impose la re-transplantation en urgence. Sa fréquence est de l’ordre de 3 % après greffe d’un foie de donneur en mort encéphalique. Elle est exceptionnelle lorsque le prélèvement du greffon est réalisé chez l’un des 2 parents en raison notamment de la plus courte durée de l’ischémie froide du greffon.
Complications vasculaires
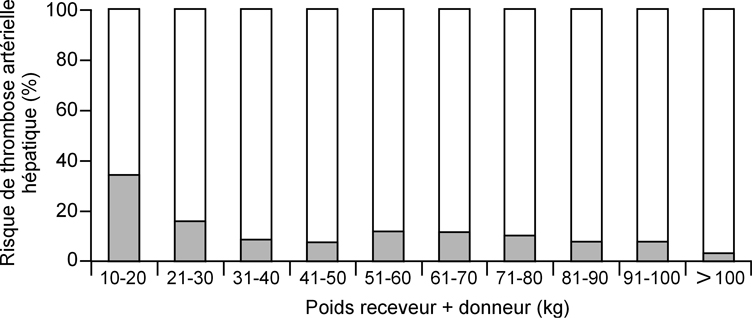
La fréquence de la thrombose de l’artère hépatique après TH chez l’enfant est de 2 % à 20 % selon les publications et de 10 % dans notre expérience personnelle. Elle est plus fréquente lorsque la somme des poids du donneur et du receveur est < 10 kg ou dans le cas de greffe de type « partagé » (figure 3

). Les conséquences sont soit une nécrose massive du foie imposant une re-transplantation hépatique en extrême urgence (30 % des cas pour l’équipe de l’Hôpital Bicêtre), soit une nécrose ischémique des voies biliaires pouvant faire poser l’indication d’une re-transplantation à moyen terme en raison de complications infectieuses (cholangites bactériennes itératives) et du développement d’une cirrhose biliaire.
La thrombose de la veine porte (4 à 8 % selon les séries) s’observe plus particulièrement chez l’enfant greffé pour une AVB qui présente souvent une hypoplasie de la veine porte (Chardot et coll., 1997

; Fouquet et coll., 2005

). En l’absence de thrombose artérielle associée, elle est rarement à l’origine d’une insuffisance hépatique aiguë (< 10 % des cas), mais expose secondairement aux complications de l’hypertension portale.
La sténose de l’anastomose veineuse sus-hépatique est une complication rare (1 à 2 % des cas) qui concerne essentiellement les enfants ayant reçu un lobe gauche avec anastomose directe de l’ostium veineux sus-hépatique du greffon sur la veine cave inférieure du receveur. Cette complication se révèle habituellement par une ascite réfractaire parfois dans des délais de plusieurs années après la greffe (syndrome de Budd-Chiari).
Complications biliaires
Elles sont observées dans 15 à 20 % des cas de TH chez l’enfant, plus particulièrement en cas de greffon de type « partagé » (notamment en cas de donneur parental) et en cas de thrombose de l’artère hépatique. Il s’agit le plus souvent de sténoses des voies biliaires intra-hépatiques ou de l’anastomose biliodigestive, vraisemblablement d’origine post-ischémique associées ou non à une thrombose de l’artère hépatique. Une re-transplantation hépatique peut être indiquée en cas de cholestase sévère, de cholangites bactériennes itératives ou d’évolution vers la cirrhose biliaire.
Complications digestives
Elles sont notées dans moins de 5 % des cas de TH pédiatriques. Elles sont dominées par les perforations digestives qui s’observent plus particulièrement chez les enfants greffés pour une AVB, en raison de l’antécédent de chirurgie hépatobiliaire (Fouquet et coll., 2005

).
Principales complications non chirurgicales
Rejet du greffon
L’immunosuppression primaire classique associe, selon les équipes, la ciclosporine (Néoral
®), les corticoïdes et le mycophénolate mofétil (Cellcept
®) ou le tacrolimus (Prograf
®) et les corticoïdes. La tendance actuelle est à l’arrêt précoce des corticoïdes en post-opératoire (3 mois à 6 mois) voire à leur éviction des schémas d’immunosuppression primaire. Un traitement d’induction par les anticorps monoclonaux anti-récepteur de l’interleukine-2 peut permettre d’éviter la corticothérapie et ainsi éviter ses effets secondaires en termes notamment d’ostéoporose et de retard de croissance (Gras et coll., 2008

). Selon le type d’immunosuppression primaire, l’incidence du rejet aigu au cours des 3 premiers mois post-greffe varie de 50 % sous ciclosporine à 40 % sous tacrolimus (Kelly et coll., 2004

). Le tacrolimus diminue le risque de rejet aigu précoce et surtout prévient plus efficacement que la ciclosporine le risque de rejet aigu cortico-résistant et de rejet chronique (Kelly et coll., 2004

). Le taux global de rejet chronique du greffon conduisant à une re-transplantation hépatique est inférieur à 5 % dans la majorité des séries. En revanche, la réalisation d’une biopsie hépatique systématique à 10 ans de la greffe chez plus de 200 patients a révélé l’existence de signes histologiques compatibles avec un rejet chronique débutant chez 30 % d’entre eux (Fouquet et coll., 2005

; Evans et coll., 2006

). L’inobservance du traitement immunosuppresseur à l’adolescence représente la principale cause (75 % des cas dans notre série) de perte du greffon au-delà de 10 ans post-transplantation.
Complications infectieuses (> 60 % des cas)
Les complications infectieuses surviennent dans plus de 60 % des cas de TH chez l’enfant et représentent la première cause de mortalité de ces enfants. Il s’agit avant tout d’infections bactériennes, d’origine abdominale (favorisées par les complications biliaires, vasculaires et digestives précitées), pulmonaire ou iatrogène (cathéters). Il peut s’agir également d’infections virales. La primo-infection à CMV (cytomégalovirus) est souvent peu symptomatique. La primo-infection à EBV (
Epstein Barr Virus) est très fréquente (> 60 % des cas). Elle apparaît le plus souvent chez l’enfant séronégatif avant la greffe qui reçoit le greffon d’un donneur séropositif, exposant le jeune transplanté à un risque de syndrome lymphoprolifératif (SLP). La fréquence du SLP EBV-induit varie de 4 % à 11 % selon les études (Cacciarelli et coll., 2001

). Le risque de SLP, plus important en cas de primo-infection qu’en cas de réactivation, apparaît plus important sous immunosuppression par le tacrolimus que par la ciclosporine. Le pronostic dépend de la date de survenue du SLP par rapport à la greffe, de la précocité du diagnostic et de la clonalité de la prolifération lymphoïde B. L’arrêt ou la réduction importante de l’immunosuppression permet souvent la régression des SLP précoces au stade d’hyper-plasie lymphoïde polyclonale. Des résultats encourageants dans les formes plus sévères ont été obtenus avec l’emploi d’anticorps monoclonaux anti-CD20 (Nathanson et coll., 2002

; Serinet et coll., 2002

). La chimiothérapie est indiquée dans les cas de lymphomes non-hodgkiniens et lymphome de Burkitt dont la prévalence globale est de 1,5 % dans l’expérience de l’équipe de l’Hôpital Bicêtre.
Allergie alimentaire
La survenue d’une allergie alimentaire après transplantation hépatique se manifestant par un œdème des lèvres ou un œdème de Quincke est une complication sévère pouvant mettre en jeu le pronostic vital (1 décès et 1 enfant conservant des séquelles neurologiques graves dans la série de l’Hôpital Bicêtre). Cette complication est survenue chez environ 15 à 20 % des jeunes enfants (âgés de moins de 6 ans) traités par le tacrolimus
versus 1,5 % chez ceux traités par la ciclosporine (Lykavieris et coll., 2003

). Les mécanismes physiopathologiques de tels événements restent indéterminés.
Insuffisance rénale chronique
Sur une série de 125 patients évalués à 10 ans de la TH, près de 40 % présentent une diminution de la clairance plasmatique à l’EDTA dont la valeur est comprise entre 50 et 80 ml/min/1,73 m
2 et pour 7 % des patients < 50 ml/min/1,73 m
2. Les raisons en sont multiples, mais dominées par les perturbations circulatoires péri-opératoires et le traitement au long cours par les anti-calcineurines (ciclosporine ou tacrolimus). Des kystes rénaux sou-vent multiples et bilatéraux, associés à une diminution de la clairance rénale ont été découverts fortuitement à l’examen tomodensitométrique des reins chez près de 30 % des 108 enfants explorés à 10 ans de la greffe (Franchi-Abella et coll., 2007

).
La prévention de l’insuffisance rénale chronique repose avant tout sur la réduction des doses d’anti-calcineurines sous couvert éventuellement de l’adjonction d’un autre immunosuppresseur non néphrotoxique (mycophénolate mofétil) (Evans et coll., 2005

).
Survie et qualité de vie post-transplantation
Malgré la fréquence des complications, la TH chez l’enfant offre un espoir de survie à long terme et une qualité de vie relativement satisfaisants.
Survie des patients
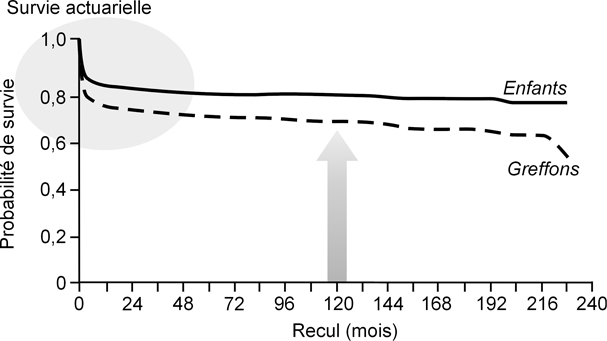
La plupart des équipes rapportent un taux de survie actuarielle de 80 % à 90 % à un an et de 70 à 80 % à 5 et 10 ans. La figure 4

montre la survie actuarielle des 527 enfants transplantés hépatiques et suivis par notre équipe de janvier 1988 à décembre 2007. La majorité des décès est survenue dans les 3 premiers mois après la transplantation. La dysfonction primaire ou secondaire (après thrombose de l’artère hépatique) du greffon et les complications infectieuses représentent les premières causes de décès précoces.
Survie des greffons
Le taux de survie actuarielle des greffons varie de 60 à 75 % à 1 an et de 50 à 70 % à 10 ans selon les séries (figure 4). Les 3 principales circonstances amenant à une re-transplantation sont : la dysfonction secondaire du greffon après thrombose vasculaire (> 40 % des cas), la dysfonction primaire du greffon, les complications biliaires post-ischémiques, et le rejet chronique du greffon (60 % des causes de perte du greffon au-delà de 10 ans post-TH).
Qualité de vie après transplantation hépatique
La qualité de vie est un élément subjectif qu’il est difficile d’apprécier chez l’enfant. On peut néanmoins tenter d’analyser, par différents indicateurs, si l’objectif d’une amélioration de la qualité de vie et si une insertion socioprofessionnelle satisfaisante sont atteints.
Un excellent rattrapage statural est observé durant les 3 premières années suivant la greffe dans la grande majorité des cas. Des grossesses ont été menées à terme, avec naissance d’enfants normaux après TH dans l’enfance.
Le développement intellectuel des enfants transplantés est normal dans la majorité des cas avec un niveau scolaire en rapport avec l’âge ou juste avec un an de retard chez plus de 60 % d’entre eux (Dommergues et coll., 2008

). La qualité de vie après TH chez l’enfant, mesurée par auto-évaluation, a été peu étudiée mais paraît relativement satisfaisante. La plupart des patients vivent, à des degrés variables, des difficultés psycho-sociales en rapport avec la TH (Manificat et coll., 2003

). Sur 116 patients (âge moyen de 21 ans) greffés du foie dans l’enfance à l’Hôpital Bicêtre, 81 % ont répondu être satisfaits ou très satisfaits de leur état de santé actuel, et 75 % de leur qualité de vie. Cependant, un grand nombre (53 %) de sujets ont dit être parfois ou souvent angoissés par leur état de santé. En ce qui concerne l’auto-évaluation de ces jeunes sur leur observance médicamenteuse, 55 % ont déclaré prendre leurs médicaments « très sérieusement », 38 % les prendre « juste sérieusement », 7 % « pas très sérieusement » ou « pas du tout » (Dommergues et coll., 2008

). La fréquence de la mauvaise observance a été bien soulignée dans la littérature et notamment chez l’adolescent (Stuber et coll., 2008

).
En conclusion, l’ensemble de ces résultats indique que la TH est un traitement efficace pour un très grand nombre de maladies létales ou invalidantes du foie de l’enfant donnant un espoir de survie de plus de 70 % à 10 ans. La mise au point de nouveaux protocoles d’immunosuppression devrait permettre de réduire l’incidence du rejet chronique et les effets secondaires à long terme des anticalcineurines, notamment rénaux. Le problème majeur est celui de l’inobservance thérapeutique à l’adolescence responsable de dysfonctions tardives du greffon.
Bibliographie
[1] baussan c,
cresteil d,
gonzales e,
raynaud n,
dumont m, et coll.. Genetic cholestatic liver diseases: the example of progressive familial intrahepatic cholestasis and related disorders.
Acta Gastroenterol Belg. 2004;
67:179
-183

[2] busuttil rw,
farmer dg,
yersiz h,
hiatt jr,
mcdiarmid sv, et coll.. Analysis of long-term outcomes of 3200 liver transplantations over two decades: a single-center experience.
Ann Surg. 2005;
241:905
-916

[3] cacciarelli tv,
dvorchik i,
mazariegos gv,
gerber d,
jain ab, et coll.. An analysis of pretransplantation variables associated with long-term allograft outcome in pediatric liver transplant recipients receiving primary tacrolimus (FK506) therapy.
Transplantation. 1999;
68:650
-655

[4] cacciarelli tv,
reyes j,
jaffe r,
mazariegos gv,
jain a,
fung jj,
green m. Primary tacrolimus (FK506) therapy and the long-term risk of post-transplant lym-phoproliferative disease in pediatric liver transplant recipients.
Pediatr Transplant. 2001;
5:359
-364

[5] cardona j,
houssin d,
gauthier f,
devictor d,
losay j,
hadchouel m,
ber-nard o. Liver transplantation in children with Alagille syndrome--a study of twelve cases.
Transplantation. 1995;
60:339
-342

[6] chardot c,
herrera jm,
debray d,
branchereau s,
de dreuzy o, et coll.. Portal vein complications after liver transplantation for biliary atresia.
Liver Transpl Surg. 1997;
3:351
-358

[7] chardot c,
carton m,
spire-bendelac n,
le pommelet c,
golmard jl,
auvert b. Prognosis of biliary atresia in the era of liver transplantation: French national study from 1986 to 1996.
Hepatology. 1999;
30:606
-611

[8] davis mk,
weinstein da. Liver transplantation in children with glycogen storage disease: controversies and evaluation of the risk/benefit of this procedure.
Pediatr Transplant. 2008;
12:137
-145

[9] debray d,
pariente d,
urvoas e,
hadchouel m,
bernard o. Sclerosing cholangitis in children.
J Pediatr. 1994;
124:49
-56

[10] debray d,
cullufi p,
devictor d,
fabre m,
bernard o. Liver failure in children with hepatitis A.
Hepatology. 1997;
26:1018
-1022

[11] devictor d,
desplanques l,
debray d,
ozier y,
dubousset am, et coll.. Emergency liver transplantation for fulminant liver failure in infants and children.
Hepatology. 1992;
16:1156
-1162

[12] dommergues jp,
letierce a,
descots c,
debray d. Suivi médical, vie quotidienne et vécu de jeunes adultes après transplantation hépatique (TH) dans l’enfance.
Arch Pediatr. 2008;
15:855
-856

[13] dubern b,
broue p,
dubuisson c,
cormier-daire v,
habes d, et coll.. Orthotopic liver transplantation for mitochondrial respiratory chain disorders: a study of 5 children.
Transplantation. 2001;
71:633
-637

[14] durand p,
debray d,
mandel r,
baujard c,
branchereau s, et coll.. Acute liver failure in infancy: a 14-year experience of a pediatric liver transplantation center.
J Pediatr. 2001;
139:871
-876

[15] egawa h,
oike f,
buhler l,
shapiro am,
minamiguchi s, et coll.. Impact of recipient age on outcome of ABO-incompatible living-donor liver transplantation.
Transplantation. 2004;
77:403
-411

[16] evans hm,
mckiernan pj,
kelly da. Mycophenolate mofetil for renal dysfunction after pediatric liver transplantation.
Transplantation. 2005;
79:1575
-1580

[17] evans hm,
kelly da,
mckiernan pj,
hübscher s. Progressive histological damage in liver allografts following pediatric liver transplantation.
Hepatology. 2006;
43:1109
-1117

[18] filipponi f,
soubrane o,
labrousse f,
devictor d,
bernard o, et coll.. Liver transplantation for end-stage liver disease associated with alpha-1-antitrypsin deficiency in children: pretransplant natural history, timing and results of transplantation.
J Hepatol. 1994;
20:72
-78

[19] fouquet v,
alves a,
branchereau s,
grabar s,
debray d, et coll.. .
Long-term outcome of pediatric liver transplantation for biliary atresia: a 10-year follow-up in a single center. Liver Transpl. 2005;
11:152
-160

[20] franchi-abella s,
mourier o,
pariente d,
frank-soltysiak m,
bernard o,
debray d. Acquired renal cystic disease after liver transplantation in children.
Transplant Proc. 2007;
39:2601
-2602

[21] gras jm,
gerkens s,
beguin c,
janssen m,
smets f, et coll.. Steroid-free, tac-rolimus-basiliximab immunosuppression in pediatric liver transplantation: clinical and pharmacoeconomic study in 50 children.
Liver Transpl. 2008;
14:469
-477

[22] hoofnagle jh,
lombardero m,
zetterman rk,
lake j,
porayko m, et coll.. Donor age and outcome of liver transplantation.
Hepatology. 1996;
24:89
-96

[23] kelly d,
jara p,
rodeck b,
lykavieris p,
burdelski m, et coll.. Tacrolimus and steroids versus ciclosporin microemulsion, steroids, and azathioprine in children undergoing liver transplantation: randomised European multicentre trial.
Lancet. 2004;
364:1054
-1061

[24] lykavieris p,
frauger e,
habes d,
bernard o,
debray d. Angioedema in pediatric liver transplant recipients under tacrolimus immunosuppression.
Transplantation. 2003;
75:152
-155

[25] manificat s,
dazord a,
cochat p,
morin d,
plainguet f,
debray d. Quality of life of children and adolescents after kidney or liver transplantation: child, parents and caregiver’s point of view.
Pediatr Transplant. 2003;
7:228
-235

[26] masurel-paulet a,
poggi-bach j,
rolland mo,
bernard o,
guffon n, et coll.. NTBC treatment in tyrosinaemia type I: long-term outcome in French patients.
J Inherit Metab Dis. 2008;
31:81
-87

[27] nathanson s,
debray d,
delarue a,
deschênes g. Long-term survival after post-transplant lymphoproliferative disease in children.
Pediatr Nephrol. 2002;
17:668
-672

[28] serinet mo,
jacquemin e,
habes d,
debray d,
fabre m,
bernard o. Anti-CD20 monoclonal antibody (Rituximab) treatment for Epstein-Barr virus-associated, B-cell lymphoproliferative disease in pediatric liver transplant recipients.
J Pediatr Gastroenterol Nutr. 2002;
34:389
-393

[29] stuber ml,
shemesh e,
seacord d,
washington j 3rd ,
hellemann g,
mcdiar-mid s. Evaluating non-adherence to immunosuppressant medications in pediatric liver transplant recipients.
Pediatr Transplant. 2008;
12:284
-288

[30] tissières p,
chevret l,
debray d,
devictor d. Fulminant Wilson’s disease in children: appraisal of a critical diagnosis.
Pediatr Crit Care Med. 2003;
4:338
-343

[31] trotter jf,
adam r,
lo cm,
kenison j. Documented deaths of hepatic lobe donors for living donor liver transplantation.
Liver Transpl. 2006;
12:1485
-1488

[32] yandza t,
lambert t,
alvarez f,
gauthier f,
jacolot d, et coll.. Outcome of ABO-incompatible liver transplantation in children with no specific alloantibodies at the time of transplantation.
Transplantation. 1994;
58:46
-50

Dominique Debray
Service d’hépatologie pédiatrique, Pôle adolescent-mère-enfant
AP-HP, Hôpital Bicêtre
 ).
). ; Delucchi et coll., 2007
; Delucchi et coll., 2007 ; Pedersen et coll., 2007
; Pedersen et coll., 2007 ; Weintraub et coll., 2008
; Weintraub et coll., 2008 ). Parmi les anticorps utilisés, certains sont déplétants, en particulier les globulines de lapin antilymhocytaires (thymoglobulines) (Schwartz et coll., 2007
). Parmi les anticorps utilisés, certains sont déplétants, en particulier les globulines de lapin antilymhocytaires (thymoglobulines) (Schwartz et coll., 2007 ). L’alemtuzimab est un anticorps monoclonal déplétant dont la cible est la molécule CD52 présente sur les lymphocytes B, les lymphocytes T et les monocytes. L’administration de cet anticorps entraîne une déplétion pro-fonde et prolongée des lymphocytes circulants, des cellules NK et des monocytes. Les anticorps monoclonaux dirigés contre le récepteur de l’interleukine 2 (R-IL2), basiliximab et dacluzimab, sont des anticorps non déplétants. Si la grande majorité des enfants en France reçoit ce type d’anticorps, un tiers des enfants en Amérique du Nord ne reçoit pas de traitement d’induction, 10 % reçoit des globulines de lapin anti-lymphocytaires et 55 % des anticorps monoclonaux anti-R-IL2. L’utilisation de l’anticorps monoclonal OKT3 a totalement disparu en transplantation rénale pédiatrique en raison des effets secondaires et à la suite d’une étude montrant que l’OKT3 ne réduit pas l’incidence du rejet aigu ni des pertes de greffes par rapport au traitement par ciclosporine (Benfield et coll., 2005
). L’alemtuzimab est un anticorps monoclonal déplétant dont la cible est la molécule CD52 présente sur les lymphocytes B, les lymphocytes T et les monocytes. L’administration de cet anticorps entraîne une déplétion pro-fonde et prolongée des lymphocytes circulants, des cellules NK et des monocytes. Les anticorps monoclonaux dirigés contre le récepteur de l’interleukine 2 (R-IL2), basiliximab et dacluzimab, sont des anticorps non déplétants. Si la grande majorité des enfants en France reçoit ce type d’anticorps, un tiers des enfants en Amérique du Nord ne reçoit pas de traitement d’induction, 10 % reçoit des globulines de lapin anti-lymphocytaires et 55 % des anticorps monoclonaux anti-R-IL2. L’utilisation de l’anticorps monoclonal OKT3 a totalement disparu en transplantation rénale pédiatrique en raison des effets secondaires et à la suite d’une étude montrant que l’OKT3 ne réduit pas l’incidence du rejet aigu ni des pertes de greffes par rapport au traitement par ciclosporine (Benfield et coll., 2005 ).
). ). Ce protocole est en cours d’évaluation dans un essai multicentrique du National Institutes of Health. Une autre étude a montré des résultats comparables avec une induction par deux injections de basiliximab, ce qui laisse penser qu’un blocage prolongé des récepteurs de l’IL-2 n’est pas forcément nécessaire.
). Ce protocole est en cours d’évaluation dans un essai multicentrique du National Institutes of Health. Une autre étude a montré des résultats comparables avec une induction par deux injections de basiliximab, ce qui laisse penser qu’un blocage prolongé des récepteurs de l’IL-2 n’est pas forcément nécessaire. ). L’incidence de rejet est faible (de l’ordre de 10 %) et la croissance des enfants et leur fonction rénale excellentes (Ellis et coll., 2007
). L’incidence de rejet est faible (de l’ordre de 10 %) et la croissance des enfants et leur fonction rénale excellentes (Ellis et coll., 2007 ).
). ; Vincenti et coll., 2005
; Vincenti et coll., 2005 ).
). ; Dharnidharka et Araya, 2007
; Dharnidharka et Araya, 2007 ), probablement à rapporter à l’utilisation de traitements immunosuppresseurs plus puissants. Le registre Nord Américain2
indique la survenue de tumeurs malignes au cours des trois premières années suivant la transplantation chez 0,96 % des receveurs dans la cohorte d’enfants greffés entre 1987 et 1991, 2 % des enfants greffés entre 1992 et 1995 et 3,6 % des enfants greffés après 1996.
), probablement à rapporter à l’utilisation de traitements immunosuppresseurs plus puissants. Le registre Nord Américain2
indique la survenue de tumeurs malignes au cours des trois premières années suivant la transplantation chez 0,96 % des receveurs dans la cohorte d’enfants greffés entre 1987 et 1991, 2 % des enfants greffés entre 1992 et 1995 et 3,6 % des enfants greffés après 1996. ; Puliyanda et coll., 2007
; Puliyanda et coll., 2007 ). Si les traitements prophylactiques efficaces permettent d’éviter les infections à CMV (cytomégalovirus) et le pneumocystis, l’incidence des infections à virus BK a augmenté de façon significative. Smith et coll. dans l’étude Nord Américaine (North American Pediatric Renal Trials and Collaborative Studies, NAPRTCS) rapportent la survenue d’une néphropathie à virus BK chez 25 (4,6 %) des 542 enfants transplantés et diagnostiquée en moyenne 10 mois après la greffe (Smith et coll., 2007
). Si les traitements prophylactiques efficaces permettent d’éviter les infections à CMV (cytomégalovirus) et le pneumocystis, l’incidence des infections à virus BK a augmenté de façon significative. Smith et coll. dans l’étude Nord Américaine (North American Pediatric Renal Trials and Collaborative Studies, NAPRTCS) rapportent la survenue d’une néphropathie à virus BK chez 25 (4,6 %) des 542 enfants transplantés et diagnostiquée en moyenne 10 mois après la greffe (Smith et coll., 2007 ).
). ). L’évaluation de ce problème reste difficile chez un patient donné.
). L’évaluation de ce problème reste difficile chez un patient donné.















 ), et enfin par la très faible proportion de maladies exposant à un risque de récidive sur le greffon.
), et enfin par la très faible proportion de maladies exposant à un risque de récidive sur le greffon.
 ) : les maladies cholestatiques chroniques (dont l’atrésie des voies biliaires), l’hépatite fulminante et les maladies métaboliques.
) : les maladies cholestatiques chroniques (dont l’atrésie des voies biliaires), l’hépatite fulminante et les maladies métaboliques. ). Les cholestases fibrogènes familiales, la cirrhose biliaire secondaire à un déficit en alpha-1-antitrypsine, le syndrome d’Alagille (ou paucité des voies biliaires intrahépatique syndromique) et la cholangite sclérosante constituent également une indication de TH soit en raison de complications liées à la cirrhose biliaire secondaire, soit en raison des conséquences de la cholestase (prurit invalidant, retard de croissance, fractures osseuses) même en l’absence de cirrhose, notamment dans le cas du syndrome d’Alagille (Debray et coll., 1994
). Les cholestases fibrogènes familiales, la cirrhose biliaire secondaire à un déficit en alpha-1-antitrypsine, le syndrome d’Alagille (ou paucité des voies biliaires intrahépatique syndromique) et la cholangite sclérosante constituent également une indication de TH soit en raison de complications liées à la cirrhose biliaire secondaire, soit en raison des conséquences de la cholestase (prurit invalidant, retard de croissance, fractures osseuses) même en l’absence de cirrhose, notamment dans le cas du syndrome d’Alagille (Debray et coll., 1994 ; Filipponi et coll., 1994
; Filipponi et coll., 1994 ; Cardona et coll., 1995
; Cardona et coll., 1995 ; Baussan et coll., 2004
; Baussan et coll., 2004 ).
). ; Debray et coll., 1997
; Debray et coll., 1997 ; Durand et coll., 2001
; Durand et coll., 2001 ). Cependant, la cause reste fréquemment indéterminée (40 à 75 % des cas selon les études).
). Cependant, la cause reste fréquemment indéterminée (40 à 75 % des cas selon les études). ; Tissières et coll., 2003
; Tissières et coll., 2003 ; Davis et coll., 2008
; Davis et coll., 2008 ; Masurel-Paulet et coll., 2008
; Masurel-Paulet et coll., 2008 ) ;
) ; ; Egawa et coll., 2004
; Egawa et coll., 2004 ). Cette situation mérite d’être considérée dans les situations de greffe extrêmement urgente chez le nourrisson (hépatite fulminante notamment).
). Cette situation mérite d’être considérée dans les situations de greffe extrêmement urgente chez le nourrisson (hépatite fulminante notamment). ). Une diminution de la survie est également rapportée pour les greffons de donneurs âgés de plus de 50 ans (Hoofnagle et coll., 1996
). Une diminution de la survie est également rapportée pour les greffons de donneurs âgés de plus de 50 ans (Hoofnagle et coll., 1996 ; Busuttil et coll., 2005
; Busuttil et coll., 2005 ). L’âge moyen des donneurs de foie en France est actuellement de 50 ans. Cependant, du fait des règles de répartition des greffons qui offrent en priorité les greffons de donneurs de moins de 30 ans aux receveurs de moins de 18 ans, la majorité des greffes réalisées chez l’enfant le sont avec des greffons de jeunes donneurs.
). L’âge moyen des donneurs de foie en France est actuellement de 50 ans. Cependant, du fait des règles de répartition des greffons qui offrent en priorité les greffons de donneurs de moins de 30 ans aux receveurs de moins de 18 ans, la majorité des greffes réalisées chez l’enfant le sont avec des greffons de jeunes donneurs. ). La pénurie de greffons à l’origine d’une augmentation de la mortalité en liste d’attente des plus jeunes enfants, a été la justification principale du recours aux greffons partagés et au développement de la TH à partir d’un donneur vivant parental. Le pourcentage de TH réalisées à Bicêtre à partir d’un greffon partagé et d’un greffon de donneur vivant représente respectivement 50 % et 20 % du nombre total de TH pour la période 2003-2007.
). La pénurie de greffons à l’origine d’une augmentation de la mortalité en liste d’attente des plus jeunes enfants, a été la justification principale du recours aux greffons partagés et au développement de la TH à partir d’un donneur vivant parental. Le pourcentage de TH réalisées à Bicêtre à partir d’un greffon partagé et d’un greffon de donneur vivant représente respectivement 50 % et 20 % du nombre total de TH pour la période 2003-2007. ). Deux complications sont plus particulièrement à redouter en période post-opératoire immédiate : la dysfonction primaire du greffon et les complications vasculaires. Les complications biliaires, souvent retardées, dominent ensuite.
). Deux complications sont plus particulièrement à redouter en période post-opératoire immédiate : la dysfonction primaire du greffon et les complications vasculaires. Les complications biliaires, souvent retardées, dominent ensuite. ). Les conséquences sont soit une nécrose massive du foie imposant une re-transplantation hépatique en extrême urgence (30 % des cas pour l’équipe de l’Hôpital Bicêtre), soit une nécrose ischémique des voies biliaires pouvant faire poser l’indication d’une re-transplantation à moyen terme en raison de complications infectieuses (cholangites bactériennes itératives) et du développement d’une cirrhose biliaire.
). Les conséquences sont soit une nécrose massive du foie imposant une re-transplantation hépatique en extrême urgence (30 % des cas pour l’équipe de l’Hôpital Bicêtre), soit une nécrose ischémique des voies biliaires pouvant faire poser l’indication d’une re-transplantation à moyen terme en raison de complications infectieuses (cholangites bactériennes itératives) et du développement d’une cirrhose biliaire.
 ; Fouquet et coll., 2005
; Fouquet et coll., 2005 ). En l’absence de thrombose artérielle associée, elle est rarement à l’origine d’une insuffisance hépatique aiguë (< 10 % des cas), mais expose secondairement aux complications de l’hypertension portale.
). En l’absence de thrombose artérielle associée, elle est rarement à l’origine d’une insuffisance hépatique aiguë (< 10 % des cas), mais expose secondairement aux complications de l’hypertension portale. ).
). ). Selon le type d’immunosuppression primaire, l’incidence du rejet aigu au cours des 3 premiers mois post-greffe varie de 50 % sous ciclosporine à 40 % sous tacrolimus (Kelly et coll., 2004
). Selon le type d’immunosuppression primaire, l’incidence du rejet aigu au cours des 3 premiers mois post-greffe varie de 50 % sous ciclosporine à 40 % sous tacrolimus (Kelly et coll., 2004 ). Le tacrolimus diminue le risque de rejet aigu précoce et surtout prévient plus efficacement que la ciclosporine le risque de rejet aigu cortico-résistant et de rejet chronique (Kelly et coll., 2004
). Le tacrolimus diminue le risque de rejet aigu précoce et surtout prévient plus efficacement que la ciclosporine le risque de rejet aigu cortico-résistant et de rejet chronique (Kelly et coll., 2004 ). Le taux global de rejet chronique du greffon conduisant à une re-transplantation hépatique est inférieur à 5 % dans la majorité des séries. En revanche, la réalisation d’une biopsie hépatique systématique à 10 ans de la greffe chez plus de 200 patients a révélé l’existence de signes histologiques compatibles avec un rejet chronique débutant chez 30 % d’entre eux (Fouquet et coll., 2005
). Le taux global de rejet chronique du greffon conduisant à une re-transplantation hépatique est inférieur à 5 % dans la majorité des séries. En revanche, la réalisation d’une biopsie hépatique systématique à 10 ans de la greffe chez plus de 200 patients a révélé l’existence de signes histologiques compatibles avec un rejet chronique débutant chez 30 % d’entre eux (Fouquet et coll., 2005 ; Evans et coll., 2006
; Evans et coll., 2006 ). L’inobservance du traitement immunosuppresseur à l’adolescence représente la principale cause (75 % des cas dans notre série) de perte du greffon au-delà de 10 ans post-transplantation.
). L’inobservance du traitement immunosuppresseur à l’adolescence représente la principale cause (75 % des cas dans notre série) de perte du greffon au-delà de 10 ans post-transplantation. ). Le risque de SLP, plus important en cas de primo-infection qu’en cas de réactivation, apparaît plus important sous immunosuppression par le tacrolimus que par la ciclosporine. Le pronostic dépend de la date de survenue du SLP par rapport à la greffe, de la précocité du diagnostic et de la clonalité de la prolifération lymphoïde B. L’arrêt ou la réduction importante de l’immunosuppression permet souvent la régression des SLP précoces au stade d’hyper-plasie lymphoïde polyclonale. Des résultats encourageants dans les formes plus sévères ont été obtenus avec l’emploi d’anticorps monoclonaux anti-CD20 (Nathanson et coll., 2002
). Le risque de SLP, plus important en cas de primo-infection qu’en cas de réactivation, apparaît plus important sous immunosuppression par le tacrolimus que par la ciclosporine. Le pronostic dépend de la date de survenue du SLP par rapport à la greffe, de la précocité du diagnostic et de la clonalité de la prolifération lymphoïde B. L’arrêt ou la réduction importante de l’immunosuppression permet souvent la régression des SLP précoces au stade d’hyper-plasie lymphoïde polyclonale. Des résultats encourageants dans les formes plus sévères ont été obtenus avec l’emploi d’anticorps monoclonaux anti-CD20 (Nathanson et coll., 2002 ; Serinet et coll., 2002
; Serinet et coll., 2002 ). La chimiothérapie est indiquée dans les cas de lymphomes non-hodgkiniens et lymphome de Burkitt dont la prévalence globale est de 1,5 % dans l’expérience de l’équipe de l’Hôpital Bicêtre.
). La chimiothérapie est indiquée dans les cas de lymphomes non-hodgkiniens et lymphome de Burkitt dont la prévalence globale est de 1,5 % dans l’expérience de l’équipe de l’Hôpital Bicêtre. ). Les mécanismes physiopathologiques de tels événements restent indéterminés.
). Les mécanismes physiopathologiques de tels événements restent indéterminés. ).
). ).
). montre la survie actuarielle des 527 enfants transplantés hépatiques et suivis par notre équipe de janvier 1988 à décembre 2007. La majorité des décès est survenue dans les 3 premiers mois après la transplantation. La dysfonction primaire ou secondaire (après thrombose de l’artère hépatique) du greffon et les complications infectieuses représentent les premières causes de décès précoces.
montre la survie actuarielle des 527 enfants transplantés hépatiques et suivis par notre équipe de janvier 1988 à décembre 2007. La majorité des décès est survenue dans les 3 premiers mois après la transplantation. La dysfonction primaire ou secondaire (après thrombose de l’artère hépatique) du greffon et les complications infectieuses représentent les premières causes de décès précoces. ). La qualité de vie après TH chez l’enfant, mesurée par auto-évaluation, a été peu étudiée mais paraît relativement satisfaisante. La plupart des patients vivent, à des degrés variables, des difficultés psycho-sociales en rapport avec la TH (Manificat et coll., 2003
). La qualité de vie après TH chez l’enfant, mesurée par auto-évaluation, a été peu étudiée mais paraît relativement satisfaisante. La plupart des patients vivent, à des degrés variables, des difficultés psycho-sociales en rapport avec la TH (Manificat et coll., 2003 ). Sur 116 patients (âge moyen de 21 ans) greffés du foie dans l’enfance à l’Hôpital Bicêtre, 81 % ont répondu être satisfaits ou très satisfaits de leur état de santé actuel, et 75 % de leur qualité de vie. Cependant, un grand nombre (53 %) de sujets ont dit être parfois ou souvent angoissés par leur état de santé. En ce qui concerne l’auto-évaluation de ces jeunes sur leur observance médicamenteuse, 55 % ont déclaré prendre leurs médicaments « très sérieusement », 38 % les prendre « juste sérieusement », 7 % « pas très sérieusement » ou « pas du tout » (Dommergues et coll., 2008
). Sur 116 patients (âge moyen de 21 ans) greffés du foie dans l’enfance à l’Hôpital Bicêtre, 81 % ont répondu être satisfaits ou très satisfaits de leur état de santé actuel, et 75 % de leur qualité de vie. Cependant, un grand nombre (53 %) de sujets ont dit être parfois ou souvent angoissés par leur état de santé. En ce qui concerne l’auto-évaluation de ces jeunes sur leur observance médicamenteuse, 55 % ont déclaré prendre leurs médicaments « très sérieusement », 38 % les prendre « juste sérieusement », 7 % « pas très sérieusement » ou « pas du tout » (Dommergues et coll., 2008 ). La fréquence de la mauvaise observance a été bien soulignée dans la littérature et notamment chez l’adolescent (Stuber et coll., 2008
). La fréquence de la mauvaise observance a été bien soulignée dans la littérature et notamment chez l’adolescent (Stuber et coll., 2008 ).
).