L’organisation fonctionnelle du génome repose sur la chromatine, dont l’unité structurale, le nucléosome, est quasi universelle chez les eucaryotes. On trouve comme toujours en biologie des exceptions remarquables, telles que les dinoflagellés, organismes planctoniques unicellulaires, dont les chromosomes, chez certains groupes, sont organisés en cristaux liquides et sont largement dépourvus d’histones. Chez les métazoaires, c’est le gamète mâle mature qui fait figure d’exception. Au cours du long processus de différenciation des spermatides haploïdes en spermatozoïdes, la grande majorité des histones (voire la quasi-totalité chez certaines espèces) est en effet remplacée par de petites protéines chromosomiques très basiques (nommées SNBP, pour sperm nuclear basic proteins). Les SNBP forment un groupe très hétérogène de protéines dont les mieux caractérisées sont les protamines. Ces protéines, très enrichies en résidus chargés positivement (arginine et/ou lysine selon les espèces), neutralisent les charges négatives de l’ADN et permettent son organisation sous une forme extrêmement compacte, qui diffère radicalement de l’organisation en nucléosomes [1].
Si la compaction du noyau spermatique par les protamines contribue certainement aux performances hydrodynamiques du gamète et joue vraisemblablement un rôle protecteur pour son ADN, cette organisation chromatinienne unique n’est pas compatible en l’état avec l’intégration du génome paternel dans le zygote lors de la fécondation. La formation d’un pro-noyau mâle, capable notamment de répliquer son ADN, implique en effet le remplacement des protéines SNBP par des histones fournies par le cytoplasme de l’œuf. Notre équipe a d’ailleurs montré, en 2005, que cette étape d’assemblage de novo de la chromatine paternelle mobilise spécifiquement le chaperon d’histones HIRA (histone cell cycle regulator) [2] (→). Dans des œufs de drosophile dépourvus de chaperon HIRA, les protéines SNBP sont éliminées du noyau fécondant mais la chromatine n’est pas réassemblée, ce qui empêche la formation du pro-noyau mâle [3]. On sait maintenant que le rôle critique du chaperon HIRA dans l’assemblage de la chromatine paternelle à la fécondation est conservé chez les mammifères ainsi que chez d’autres vertébrés. En revanche, le mécanisme qui permet l’élimination des protéines SNBP est beaucoup moins bien compris.
(→) Voir la Nouvelle de B. Loppin et P. Couble, m/s n° 6–7, juin-juillet 2006, page 565
Chez certains groupes d’animaux, comme par exemple les mammifères placentaires, l’existence d’un réseau tridimensionnel de ponts disulfures reliant les protamines associées à l’ADN spermatique ajoute une dimension supplémentaire au problème de leur élimination à la fécondation [1]. Les ponts disulfures (-S-S-) sont des liaisons covalentes formées par l’oxydation de deux groupements thiols (-SH) provenant de deux résidus cystéines proches. La présence de ces ponts disulfures contribue efficacement au maintien de la chromatine spermatique dans sa configuration ultracompacte. Il est d’ailleurs bien connu que la décondensation in vitro de ces noyaux nécessite la présence d’un agent réducteur, comme le dithiothréitol (DTT).
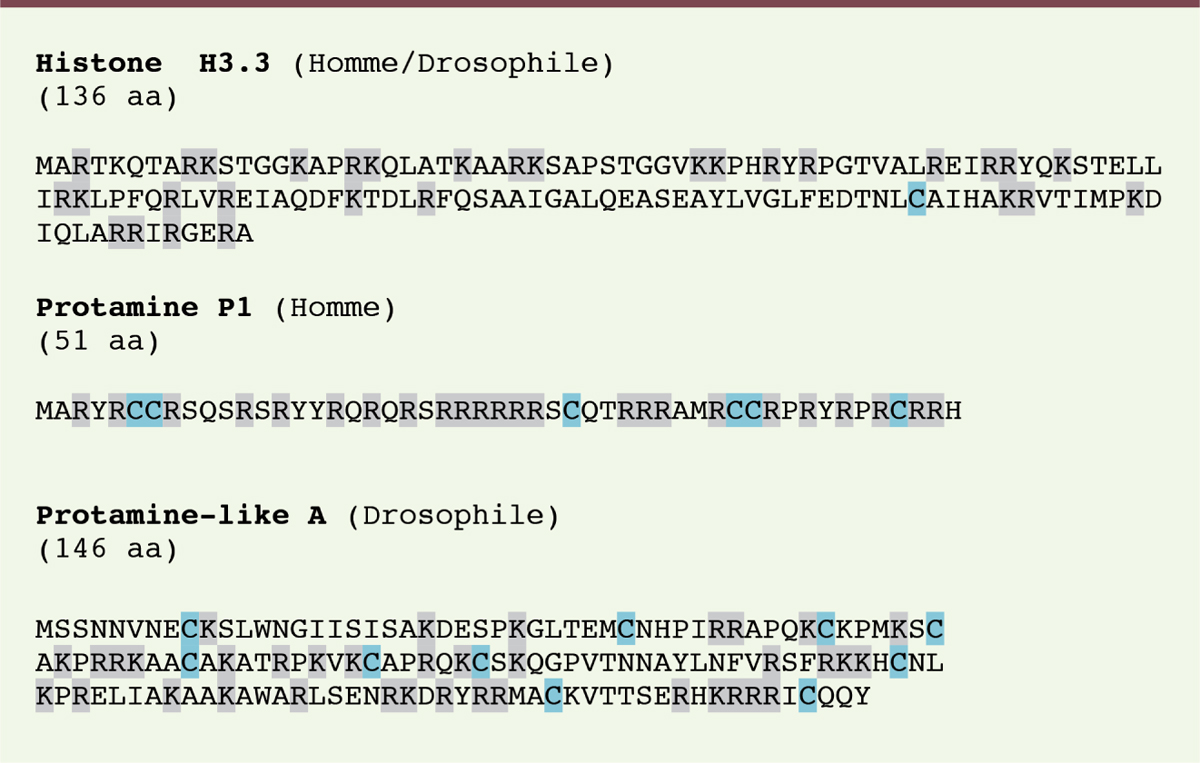
Les résidus cystéines sont généralement très rares dans les protéines de la chromatine comme les histones. L’acquisition au cours de l’évolution de ces résidus cystéines dans la séquence protéique des protamines signe la présence de ponts disulfures dans le noyau spermatique [4]. Il est intéressant de souligner que les protéines SNBP protamine-like de drosophile, bien que non apparentées aux protamines de mammifères, sont également enrichies en cystéines (Figure 1). Un simple test de décondensation in vitro en présence de DTT nous a permis de confirmer que la chromatine spermatique de drosophile était effectivement « verrouillée » par des ponts disulfures, suggérant que ce processus est beaucoup plus répandu qu’initialement supposé [5].
| Figure 1.
Distribution des résidus cystéines dans la séquence de trois protéines de la chromatine. L’histone H3.3 est l’une des rares histones à posséder au moins un résidu cystéine (surligné en bleu). Les petites protéines chromosomiques très basiques (SNBP) de mammifères euthériens (protamine P1) et de drosophile (protamin-like A) sont enrichies en cystéines. Les résidus basiques (R, K) sont indiqués en gris. |
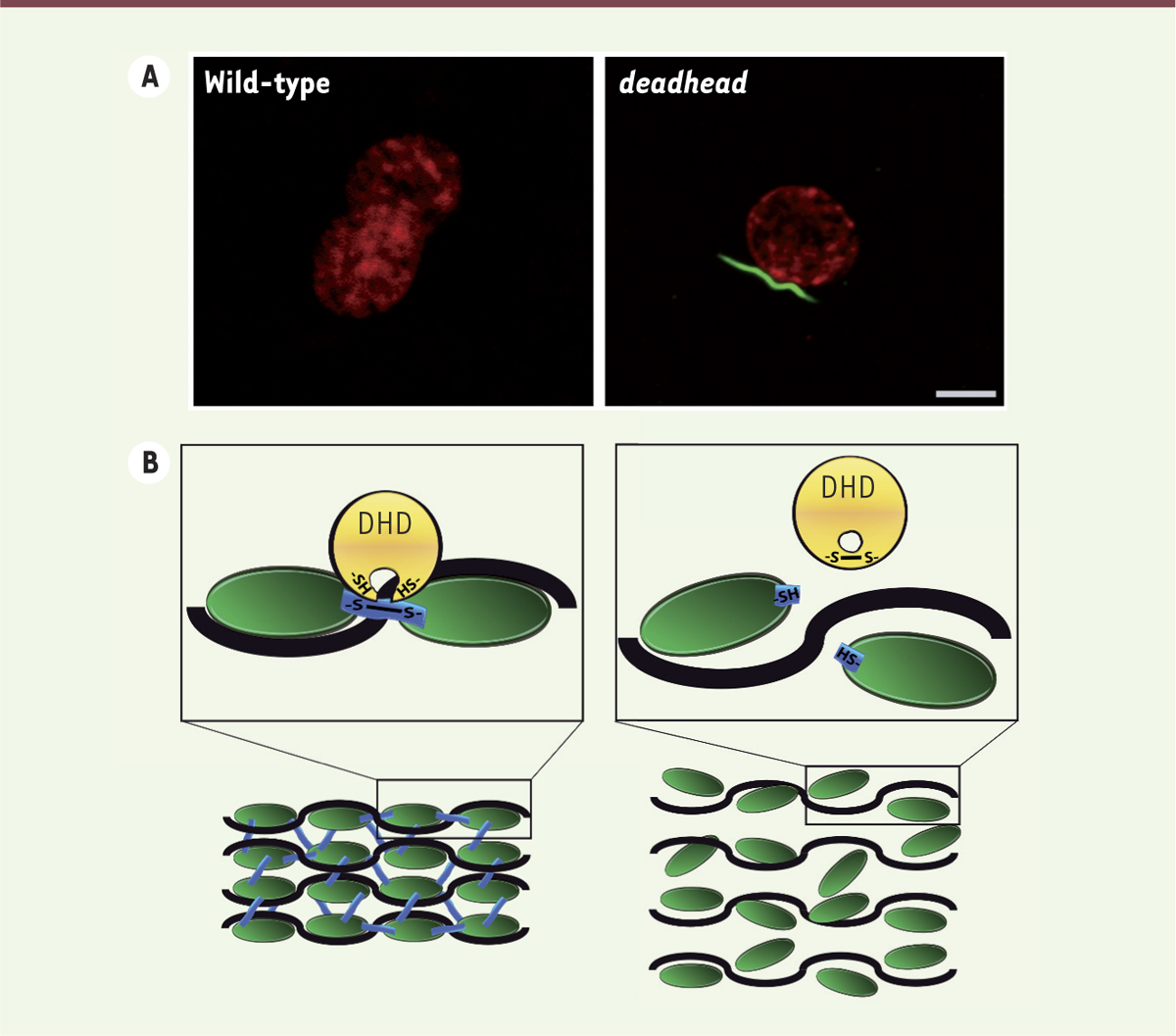
En 1994, une équipe américaine publie la caractérisation phénotypique d’un mutant de drosophile appelé deadhead (dhd). dhd est un mutant à effet maternel : les femelles dhd pondent des œufs dont la plupart ne se développent pas [6]. L’article mentionne néanmoins la présence de rares embryons qui se développent, mais qui meurent en fin d’embryogenèse avec des défauts au niveau de leur tête. Ce que ces chercheurs ignorent alors, c’est que ce phénotype bimodal associé à des défauts d’involution de la tête est caractéristique des mutants à développement embryonnaire haploïde [7]. Notre propre caractérisation de ce mutant, une vingtaine d’années plus tard, confirme en effet que les embryons issus de mères dhd sont haploïdes et sont, plus précisément, dépourvus de chromosomes d’origine paternelle. Notre analyse cytologique a également révélé que le noyau du spermatozoïde dans les œufs dhd ne montre aucun signe de décondensation (Figure 2A). Sa morphologie caractéristique en aiguille est intacte et, surtout, les protéines SNBP sont toujours présentes [5]. Il est important de préciser que l’élimination des SNBP est un processus très fugace chez la drosophile, à tel point qu’il est presque impossible à observer dans des œufs sauvages.
| Figure 2.
La thiorédoxine « deadhead » permet la décondensation du noyau spermatique. A. Images de microscopie confocale montrant des œufs de drosophile au stade pro-noyaux apposés. À gauche, un œuf sauvage (wild-type) avec les deux pro-noyaux mâle et femelle décondensés. À droite, un œuf pondu par une femelle deadhead (dhd). Le noyau du spermatozoïde ne s’est pas décondensé et ses petites protéines chromosomiques très basiques SNBP (en vert) n’ont pas été enlevées. L’ADN est en rouge. Barre d’échelle : 5 µm. B. Représentation schématique du mode d’action de la thiorédoxine Deadhead (DHD) à la fécondation. À gauche, la thiorédoxine DHD (en jaune) réduit les ponts disulfures (-S-S-, en bleu) reliant les protéines SNBP (en vert) de la chromatine spermatique compacte, conduisant à la libération des résidus -SH. À droite, cette réduction des ponts disulfures permet l’éviction des protéines SNBP et la décompaction de l’ADN (trait noir). La réaction d’oxydoréduction entraîne la formation d’un pont disulfure entre les deux résidus cystéines du site catalytique de la thiorédoxine DHD. SNBP : sperm nuclear basic proteins. |
Le gène deadhead (dhd) code une thiorédoxine spécifiquement exprimée dans la lignée germinale femelle. Les thiorédoxines sont de petites protéines d’une centaine d’acides aminés présentes chez tous les êtres vivants. Elles sont généralement connues pour leur rôle dans la régulation de l’équilibre redox (oxydo-réduction) de la cellule et ont justement pour fonction moléculaire de réduire les ponts disulfures [8]. Si l’hypothèse d’une implication directe de la thiorédoxine DHD dans la réduction des ponts disulfures spermatiques semblait s’imposer, encore fallait-il le démontrer. Nous avons tout d’abord pu établir que la protéine DHD s’accumule spécifiquement dans le cytoplasme des œufs avant d’être rapidement dégradée après la fécondation. Nous avons également montré que la thiorédoxine DHD (mais pas la thiorédoxine-2 généraliste Trx-2) s’avère tout aussi capable, in vitro, de décondenser les noyaux spermatiques qu’un traitement au DTT. Enfin, grâce à l’expression d’un mutant catalytique de DHD capable de rester lié de façon covalente à ses cibles, nous avons pu démontrer que cette thiorédoxine était active sur le noyau spermatique in vivo. Une étude complémentaire récente montre que la thiorédoxine DHD est capable de réduire in vitro les ponts disulfures intermoléculaires présents entre les monomères de protamines [9].
Ces travaux élucident donc le mécanisme moléculaire par lequel le noyau spermatique est déverrouillé à la fécondation chez la drosophile (Figure 2B). Cette étape, absolument cruciale pour la formation du zygote diploïde, fait donc appel à une activité oxydoréductase spécialisée. Les observations faites en étudiant la drosophile contrastent singulièrement avec celles faites chez la souris, où plusieurs travaux suggèrent que la réduction des ponts disulfures spermatiques s’opère passivement, par le niveau réducteur intrinsèque de l’ovocyte [10]. Ainsi, c’est le glutathion ovocytaire (un tripeptide réducteur) qui serait impliqué dans ce processus chez les mammifères euthériens, même si une étude récente suggère que la question n’est pas encore tranchée [11].
La transformation nucléaire complexe que subit le gamète mâle à la fécondation est au cœur des techniques d’assistance à la reproduction humaine comme l’injection intracytoplasmique de spermatozoïdes (ICSI, pour intra-cytoplasmic sperm injection). Cette technique, en particulier, a révolutionné la médecine de la reproduction en quelques décennies, sans que ne progressent très significativement les connaissances fondamentales dans ce domaine. Beaucoup reste à découvrir sur ces mécanismes dont le bon déroulement est si précieux pour l’intégrité génétique et épigénétique du zygote et du futur embryon.