| |
| Med Sci (Paris). 33(6–7): 596–599. doi: 10.1051/medsci/20173306013.Navβ4 : un-suppresseur de métastases et un nouveau biomarqueur des cancers agressifs Emeline Bon,1 Lucie Brisson,1 Stéphan Chevalier,1 Pierre Besson,1 and Sébastien Roger1,2* 1Inserm UMR1069, nutrition, croissance et cancer, université François-Rabelais de Tours, faculté de médecine de Tours, 10, boulevard Tonnellé, 37032Tours, France 2Institut universitaire de France, 1, rue Descartes, 75231Paris Cedex 05, France |
La mortalité associée aux cancers d’origine épithéliale (carcinomes) dépend essentiellement du développement des métastases, pour lesquelles il n’existe, à ce jour, aucun marqueur ni traitement spécifique. Les mécanismes conduisant à la formation des métastases incluent l’acquisition de propriétés de migration et d’invasion, permettant l’échappement de cellules cancéreuses de la tumeur primaire et la colonisation d’autres tissus. De récentes études indiquent que les canaux sodiques dépendants du voltage membranaire (Nav), initialement connus pour leur rôle dans la génération et la propagation des potentiels d’action dans les cellules excitables, telles que les cellules musculaires, cardiaques ou nerveuses, pourraient avoir un rôle déterminant dans ces mécanismes cancéreux. |
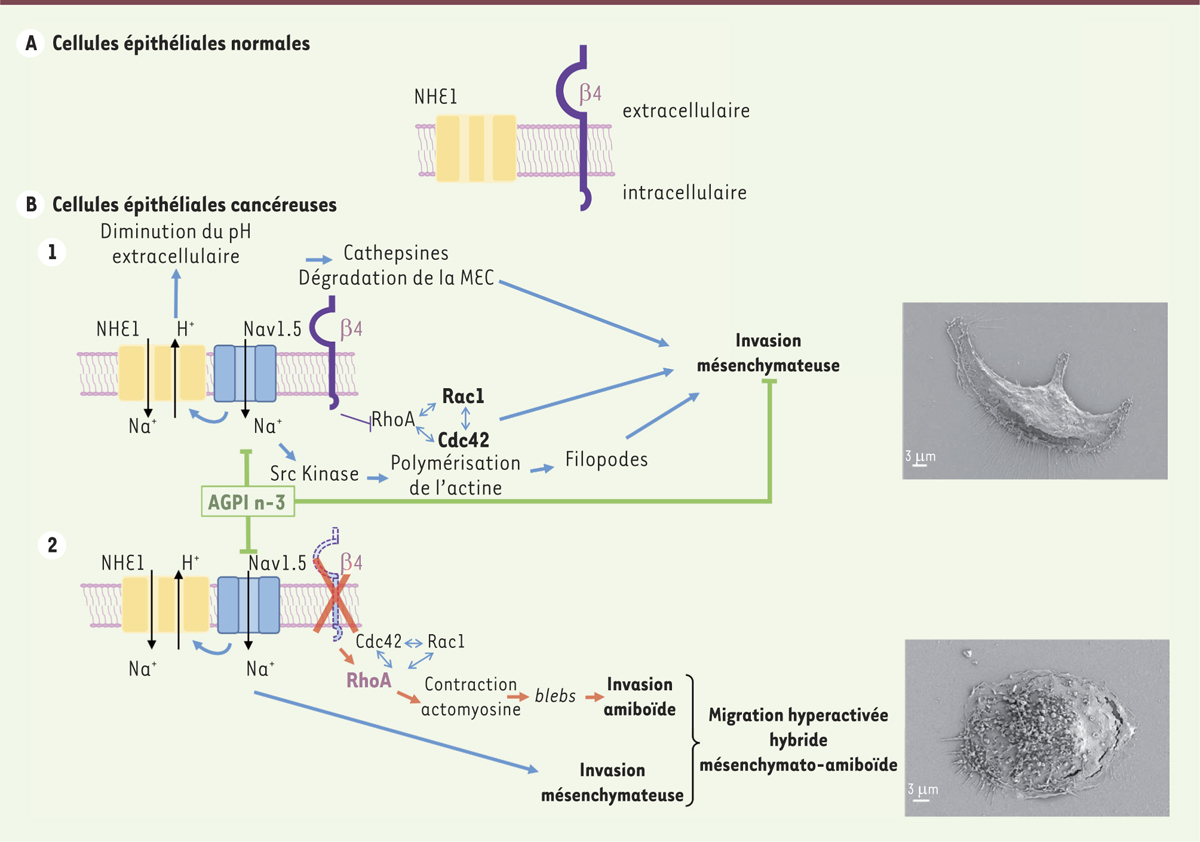
Canaux sodiques dépendants du voltage membranaire (Nav) et invasivité cancéreuse Les canaux sodiques Nav sont des complexes protéiques membranaires constitués d’une sous-unité principale alpha (Navα) formant le domaine pore du canal. Navα permet le passage sélectif des ions Na+ dans le sens du gradient électrochimique au travers de la membrane plasmique, par un courant rapide et transitoire. À cette sous-unité principale, sont généralement associées des sous-unités Navβ, dites auxiliaires ou régulatrices. Neuf isoformes de Navα ont été décrites à ce jour : notées Nav1.1 à Nav1.9, codées par 9 gènes (SCN[sodium voltage-gated channel alpha subunit]1A à SCN5A et SCN8A à SCN11A). Étonnamment, un courant sodique impliqué dans la régulation du potentiel invasif de cellules cancéreuses mammaires (non-excitables) humaines avait déjà été identifié. Ce courant a par la suite été attribué à l’activité de l’isoforme Nav1.5 présente à la membrane plasmique des cellules cancéreuses mammaires humaines [1]. Ce canal n’est pas exprimé dans les cellules épithéliales normales (Figure 1a). Dans les cellules cancéreuses, Nav1.5 a une activité basale (par le biais d’un courant persistant) qui stimule l’activité d’efflux de protons H+ de l’échangeur sodium-proton NHE1 (Na+-H+ exchanger, isoform 1). La sous-unité Nav1.5 et l’échangeur NHE1 sont co-exprimés dans les invadopodes, des structures protrusives des cellules cancéreuses hautement agressives [2] qui permettent la dégradation des matrices extracellulaires (MEC) et l’échappement cellulaire (Figure 1B, 1). En effet, l’efflux d’ions H+ généré par ce complexe Nav1.5-NHE1 stimule la dégradation de la MEC du fait de l’augmentation de l’activité de protéases spécifiques, les cathepsines B et S, favorisée par l’acidification du milieu [3, 4]. Toutes ces activités sont diminuées, soit par des inhibiteurs des canaux sodiques Nav déjà utilisés en clinique pour le traitement d’autres pathologies comme la ranolazine pour le traitement de l’angine de poitrine [5], soit par la supplémentation en acides gras polyinsaturés. Les acides gras polyinsaturés à longue chaîne de la série n-3 (nommés AGPI n-3) induisent des effets anticancéreux en réduisant la transcription dépendante du récepteur nucléaire PPAR (peroxisome proliferator-activated receptor)β [6].
 | Figure 1.
Dérégulation de l’expression des sous-unités Nav1.5 et Navβ4 dans les cellules cancéreuses mammaires et ses conséquences sur l’invasivité cellulaire. A. L’échangeur NHE1 (sodium/hydrogen exchanger 1) est exprimé au pôle basolatéral des cellules épithéliales polarisées. Il est quiescent et n’est activé que lors d’une diminution du pH intracellulaire. Les cellules épithéliales normales expriment fortement la sous-unité Navβ4, mais pas la sous-unité principale Navα du canal sodique. B. 1. NHE1 est exprimé au front de migration et dans les invadopodes des cellules cancéreuses. Les cellules cancéreuses expriment de façon aberrante la sous-unité principale Nav1.5 qui active NHE1 par modulation allostérique. NHE1 présente alors une activité constitutive générant un efflux de protons vers le milieu extracellulaire. La diminution du pH extracellulaire favorise l’activité des cathepsines à cystéine responsables de la dégradation de la MEC (matrice extracellulaire). Les acides gras polyinsaturés à longue chaîne de la série n-3 (nommés AGPI) diminuent l’activité du complexe [Nav1.5-NHE1], la dégradation de la MEC ainsi que l’invasion mésenchymateuse. L’entrée de sodium provoquée par l’activité du canal Nav1.5 active les kinases Src qui régulent la polymérisation de l’actine. Le canal Nav1.5 favorise l’invasion mésenchymateuse, au cours de laquelle les cellules présentent une morphologie allongée, possèdent des filopodes et dégradent la MEC. 2. La perte de l’expression de la sous-unité Navβ4 entraîne une sur-activation de la GTPase RhoA et une contraction du complexe acto-myosine, se traduisant par la présence de « blebs » (protrusions membranaires sphériques dénuées d’organites et d’actine corticale) qui sont caractéristiques de l’invasion amiboïde. L’absence de la sous-unité Navβ4 ne supprime pas l’activité mésenchymateuse de Nav1.5, ce qui se traduit par un phénotype mixte (hybride) mésenchymato-amiboïde et une migration accrue. En B. 1 et 2 sont inclues des micrographies représentatives des deux types cellulaires, obtenues par microscopie électronique à balayage. Les barres d’échelle représentent 3 µm. |
L’activité du complexe Nav1.5-NHE1 active la kinase Src1,. La phosphorylation de son substrat, la cortactine (sur la tyrosine Tyr421), induit des modifications du cytosquelette d’actine F et l’adoption par les cellules cancéreuses mammaires d’un phénotype de type mésenchymateux [3]. Ainsi, l’expression et l’activité des canaux sodiques Nav dans les cellules cancéreuses semblent promouvoir l’invasion dite « mésenchymateuse » qui fait intervenir la dégradation protéolytique des constituants de la MEC. La sous-unité principale Navα, sous-unité suffisante pour générer un courant sodique par elle-même, est physiologiquement associée à une ou plusieurs sous-unités Navβ (Navβ1 à Navβ4, codées par 4 gènes : SCN1B à SCN4B). Les sous-unités Navβ peuvent être co-immunoprécipitées avec Navα, dont elles modulent l’adressage membranaire, les cinétiques d’activation et d’inactivation, et la pharmacologie. De plus, après des clivages protéolytiques, les sous-unités Navβ peuvent moduler la transcription d’isoformes de Navα [7]. Enfin, de nombreuses mutations des Navβ sont à l’origine de pathologies des tissus excitables par gain ou perte de fonction des Navα. En conséquence, les Navβ ont été qualifiées de sous-unités auxiliaires des Navα. Pourtant, elles semblent posséder, indépendamment de la sous-unité principale Navα, des fonctions de protéines d’adhérence cellulaire [7]. Dans les cellules cancéreuses, l’expression et le(s) rôle(s) des sous-unités β sont encore moins connus que dans les cellules excitables. Les sous-unités Navβ1 et Navβ2 sont exprimées dans des cellules cancéreuses mammaires, du col de l’utérus, du poumon non à petites cellules, et de la prostate. La sous-unité Navβ3 n’est pas exprimée dans les cellules cancéreuses mammaires hautement invasives, mais elle est présente dans les cellules de cancers du poumon non à petites cellules, de la prostate et du col de l’utérus [8]. L’expression de Navβ1 est associée à une augmentation de la capacité migratoire et de l’invasivité des cellules cancéreuses mammaires et favorise la croissance tumorale, ainsi que le développement des métastases pulmonaires et hépatiques [9]. |
La sous-unité auxiliaire des canaux sodiquesNavβ4, un suppresseur de métastases Nous avons mis en évidence par immunohistochimie l’expression de la sous-unité Navβ4 dans les tissus sains, indépendamment de l’expression d’une sous-unité Navα (Figure 1a) [10]. Dans les tissus cancéreux, et plus particulièrement dans des tumeurs mammaires, l’expression de Navβ4 est plus faible dans celles de grades les plus élevés, voire absente des métastases ganglionnaires. De plus, une faible expression du gène SCN4B correspondant est associée au développement métastatique et à une diminution de la survie des patientes atteintes de cancer du sein. Dans une lignée de cellules cancéreuses mammaires, l’altération expérimentale de l’expression de Navβ4 augmente de 2,5 fois l’invasivité des cellules au travers d’une matrice extracellulaire par rapport aux cellules témoins. À l’inverse, la surexpression de la sous-unité Navβ4 diminue de 2 fois les capacités invasives de ces cellules. Dans un premier temps, l’utilisation de la technique électrophysiologique de patch-clamp
2, sur cellule entière a montré que la perte d’expression de Navβ4 ne modifie pas le courant sodique persistant auquel sont attribuées l’invasion mésenchymateuse et la dégradation de la matrice extracellulaire. Cet effet de l’expression de la sous-unité Navβ4 sur l’invasivité cellulaire n’est donc pas dû à sa fonction de sous-unité régulatrice du canal sodique. Dans un second temps, nous avons étudié le phénotype des cellules cancéreuses mammaires en fonction de l’expression de la sous-unité Navβ4. Plusieurs phénotypes invasifs ont été décrits, caractérisés par des paramètres morphologiques, migratoires ou relevant de l’activation de GTPases3 de la famille des Rho-GTPases [11] (→). L’altération expérimentale de l’expression de la sous-unité Navβ4 permet d’orienter les cellules vers un phénotype hybride « mésenchymato-amiboïde ». En effet, la perte d’expression de Navβ4 entraîne une migration cellulaire accélérée de type amiboïde, caractérisée par la présence de protrusions membranaires sphériques dénuées d’organites et d’actine corticale, appelées « blebs » à la surface membranaire. Ces protrusions sont associées à une augmentation de la forme active (liée au GTP) de la Rho-GTPAse RhoA, tout en conservant intactes les propriétés de dégradation de la MEC (Figure 1B, 2). À l’inverse, la surexpression de la sous-unité Navβ4 dans ces mêmes cellules permet de diminuer leurs capacités invasives, la vitesse de migration, la quantité de RhoA active et le nombre de protrusions.
(→) Voir la Nouvelle de G. Galdéa, m/s n° 4, avril 2009, page 343
Les rôles des sous-unités Navβ en tant que protéines d’adhérence cellulaire ont été attribués à leur domaine extracellulaire N-terminal semblable à celui des immunoglobulines. Dans notre étude, nous avons tenté d’identifier le fragment de la protéine Navβ4 impliqué dans la régulation du potentiel invasif des cellules cancéreuses mammaires. Nous avons donc cloné plusieurs séquences nucléotidiques permettant d’exprimer, dans les cellules dépourvues de la protéine Navβ4 (ces cellules exprimant de façon stable un ARN interférant ciblant l’expression du gène SCN4B, cellules dites « shβ4 »), un fragment N-terminal (ΔCter) ou C-terminal (ΔNter), ou la protéine entière β4 (β4 full-length ou β4fl). In vitro, l’expression de la protéine complète β4fl réduit l’invasivité des cellules shβ4. L’expression du fragment ΔNter a un effet identique. En revanche, l’expression du fragment ΔCter ne réduit pas l’invasivité des cellules n’exprimant pas la protéine Navβ4 (shβ4). De manière similaire, la vitesse de migration des cellules invalidées shβ4 isolées est diminuée par l’expression du fragment ΔNter ou de β4fl, alors que celle du fragment ΔCter ne la réduit pas. Ainsi, le rôle anti-invasif de la sous-unité Navβ4 est dû à son domaine C-terminal intracellulaire et non au domaine extracellulaire. L’implication de la sous-unité Navβ4 du canal sodique dans la régulation de l’invasivité des cellules cancéreuses mammaires a été confirmée in vivo. La surexpression de la sous-unité Navβ4 limite la croissance tumorale mammaire et inhibe le développement des métastases chez la souris [10]. En conclusion, notre étude montre que la perte d’expression de la sous-unité Navβ4 du canal sodique favorise l’acquisition d’un phénotype hybride « mésenchymato-amiboïde » par les cellules cancéreuses, tandis que sa surexpression réduit l’invasion et le développement des métastases. L’expression de la sous-unité Navβ4 du canal sodique pourrait ainsi constituer un marqueur pronostique dans les cancers épithéliaux. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Gillet L, Roger S, Besson P, et al. Voltage-gated sodium channel activity promotes cysteine cathepsin-dependent invasiveness and colony growth of human cancer cells . J Biol Chem. 2009; ; 284 : :8680.–8691. 2.
Brisson L, Reshkin SJ, Gore J, Roger S. pH regulators in invadosomal functioning: proton delivery for matrix tasting . Eur J Cell Biol. 2012; ; 91 : :847.–860. 3.
Brisson L, Driffort V, Benoist L, et al. NaV1.5 Na+ channels allosterically regulate the NHE-1 exchanger and promote the activity of breast cancer cell invadopodia . J Cell Sci. 2013; ; 126 : :4835.–4842. 4.
Brisson L, Gillet L, Calaghan S, et al. Na(V)1.5 enhances breast cancer cell invasiveness by increasing NHE1-dependent H(+) efflux in caveolae . Oncogene. 2011; ; 30 : :2070.–2076. 5.
Driffort V, Gillet L, Bon E, et al. Ranolazine inhibits NaV1.5-mediated breast cancer cell invasiveness and lung colonization . Mol Cancer. 2014; ; 13 : :264.. 6.
Wannous R, Bon E, Gillet L, et al. Suppression of PPARbeta, and DHA treatment, inhibit NaV1.5 and NHE-1 pro-invasive activities . Pflugers Arch. 2015; ; 467 : :1249.–1259. 7.
O’Malley HA, Isom LL. Sodium channel beta subunits: emerging targets in channelopathies . Annu Rev Physiol. 2015; ; 77 : :481.–504. 8.
Besson P, Driffort V, Bon E, et al. How do voltage-gated sodium channels enhance migration and invasiveness in cancer cells? . Biochim Biophys Acta. 2015; ; 1848 : :2493.–2501. 9.
Nelson M, Millican-Slater R, Forrest LC, Brackenbury WJ. The sodium channel beta1 subunit mediates outgrowth of neurite-like processes on breast cancer cells and promotes tumour growth and metastasis . Int J Cancer. 2014; ; 135 : :2338.–2351. 10.
Bon E, Driffort V, Gradek F, et al. SCN4B acts as a metastasis-suppressor gene preventing hyperactivation of cell migration in breast cancer . Nat Commun. 2016; ; 7 : :13648.. 11.
Gadéa G. Migration des cellules tumorales : GEF et GAP montrent le chemin . Med Sci (Paris). 2009; ; 25 : :343.–345. |