| |
| Med Sci (Paris). 33(6–7): 599–602. doi: 10.1051/medsci/20173306014.Prédire la réponse placebo grâce à l’imagerie par résonance magnétique fonctionnelle Pascal Tétreault1* and A. Vania Apkarian1,2,3 1Department of physiology, Northwestern University, Feinberg school of medicine, Chicago, Illinois, États-Unis 2Department of physical medicine and rehabilitation, Northwestern University, Feinberg school of medicine, Chicago, Illinois, États-Unis 3Department of anesthesia, Northwestern University, Feinberg school of medicine, Chicago, Illinois, États-Unis |
De l’effet à la réponse placebo Bien que sa description remonte à la Grèce antique, l’effet placebo a longtemps été considéré comme un phénomène mystérieux et non scientifiquement prouvé. Son effet bénéfique a pu être observé de nombreuses fois, mais la médecine moderne a toujours eu une relation amour/haine avec ce phénomène et elle peine à l’appliquer efficacement. Depuis de nombreuses années, des chercheurs tentent de mieux comprendre l’« effet placebo ». Un des enjeux majeurs pour la compréhension de cet effet est de faire progresser sa connaissance, fondée sur l’observation de l’ensemble d’un groupe de patients ou de volontaires sains, vers une connaissance de la « réponse placebo » individuelle. Si quantifiable et directement liée au patient, la « réponse placebo » pourrait en effet s’utiliser dans un contexte clinique. De nombreuses études tentent notamment d’élucider les mécanismes de la réponse placebo dans le contexte du soulagement de la douleur afin de promouvoir une application clinique. |
La réponse placebo face à la douleur aiguë Dans un contexte de douleur aiguë, il est maintenant reconnu que les voies opioïdergiques (sensibles aux opioïdes1) descendantes sont fortement activées lorsqu’une réponse placebo est déclenchée chez une personne. En effet, l’activation de cette réponse, notamment à la suite d’une manipulation des attentes envers un traitement analgésique [1], stimule la production d’opioïdes endogènes et diminue la douleur ressentie face à un stimulus douloureux. Le fonctionnement des mécanismes aigus, observé dans un environnement expérimental, est de mieux en mieux compris, mais la transposition de ces connaissances en clinique semble faire face à des défis considérables. |
La réponse placebo face à la douleur chronique Certains de ces défis viennent du fait que la douleur chronique et la douleur aiguë sont en réalité deux entités bien différentes faisant appel à des mécanismes indépendants d’intégration de la douleur [2]. La recherche de biomarqueurs cérébraux permettant d’étayer la réponse placebo a été réalisée principalement chez des sujets sains, dans un contexte de douleur aiguë. C’est pourquoi même si la réponse placebo est, à ce jour, contrôlable en milieu expérimental, l’application de ses mécanismes pour le traitement de la douleur chronique n’a pas connu le succès escompté. En recherche clinique, la réponse placebo n’est que constatée. Son interprétation est souvent remise en question en raison de lacunes expérimentales [3]. Cependant, un nombre croissant d’études a montré que la neuroimagerie permettait de prédire des phénomènes complexes comme la perception douloureuse [4], le développement de la douleur chronique lombaire [5, 6], les capacités d’apprentissage [7], l’intelligence [8] et la réponse à certains traitements [9]. Le système nerveux central est considéré comme le promoteur de la réponse placebo, il est donc envisageable que certaines mesures cérébrales spécifiques puissent identifier, parmi les individus souffrant de douleurs chroniques, ceux prédisposés à une réponse positive à un traitement placebo. C’est cette hypothèse qui a guidé le projet de recherche que nous relatons, développé par l’équipe du Pr Apkarian, à l’université Northwestern de Chicago [10]. |
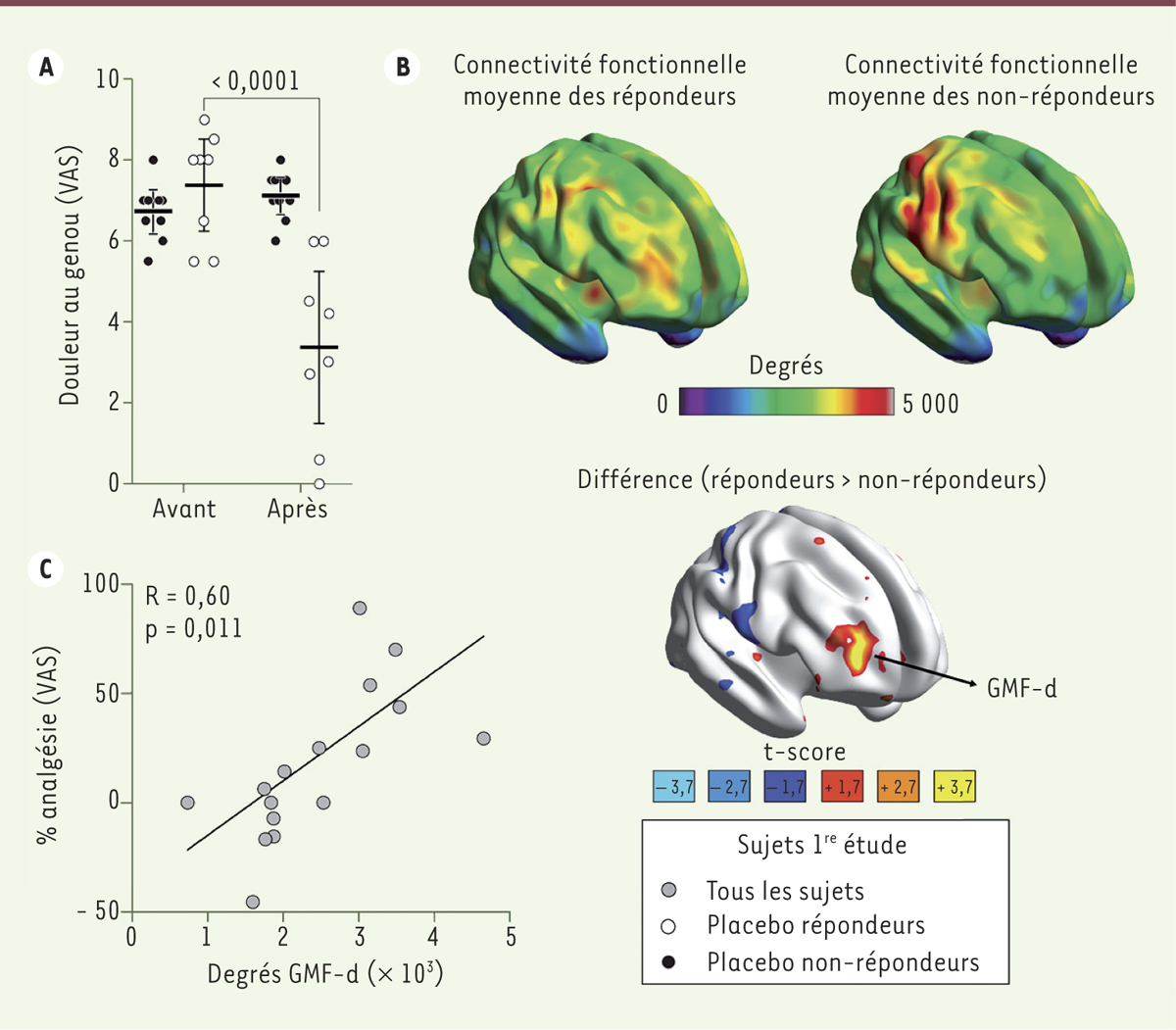
Découverte d’un biomarqueur de la réponse placebo Notre étude a porté sur des patients atteints de douleurs ostéoarthritiques du genou. Chaque patient, après avoir été informé qu’il pouvait recevoir, soit un composé analgésique, soit un placebo, a reçu un traitement placebo constitué d’une pilule de lactose, à raison d’une fois par jour pendant deux semaines. Avant le début du traitement, chaque patient a bénéficié d’une imagerie par résonnance magnétique fonctionnelle (IRMf) afin d’enregistrer l’activité cérébrale au repos [11] (→). À la fin de la période de traitement, les patients dont les douleurs ont diminué d’au moins 20 % ont été qualifiés de répondeurs au placebo ; les autres de non-répondeurs (Figure 1A). Pour chaque patient, nous avons créé une carte cérébrale qui représente le nombre de connexions fonctionnelles que fait chaque région du cerveau avec les autres régions. Pour cela, le cerveau est segmenté numériquement en sous-parties mesurant 4 mm3, ce qui représente, à cette résolution, un total de 29 015 régions appelées « voxel2, ». L’activité de chaque voxel est ensuite corrélée avec celle de chacun des autres voxels du cerveau pendant la totalité de la durée de l’enregistrement. Si une corrélation positive significative est observée, on considère que les deux régions en cause établissent une connexion fonctionnelle (appelé degré) l’une avec l’autre. Après avoir ainsi généré la carte des connexions fonctionnelles pour chaque patient, nous avons comparé les cartes de tous les répondeurs à celles des non-répondeurs (Figure 1B). Cette approche a permis d’identifier, avant le début du traitement, les régions du cerveau qui génèrent un ensemble de connexions uniques chez les patients qui ont, par la suite, répondu positivement. Nous avons ainsi observé qu’une région du gyrus médian frontal droit3 (
Figure 1B
, GMF-d) engendre un nombre plus élevé de connexions chez les patients qui répondent de façon significative au traitement placebo. Le nombre de connexions est également corrélé avec la réponse analgésique du patient (Figure 1C). Ce paramètre cérébral – le nombre de connexions engendrées par le gyrus médian frontal droit – semble donc être un candidat prometteur comme biomarqueur prédictif de la réponse à un traitement placebo.
(→) Voir la Synthèse de R. Peyron et I. Faillenot, m/s n° 1, janvier 2011, page 82
 | Figure 1.
Découverte d’un biomarqueur associé à la réponse placebo. A. Après deux semaines de traitement, il est possible d’observer, comme attendu, une diminution significative de la douleur au genou (VAS, pour visual analogue score) seulement chez les répondeurs (ronds blancs) en comparaison avec les non-répondeurs (ronds noirs) qui restent au même niveau qu’avant le traitement. B. Représentation graphique des cartes de connectivités fonctionnelles moyennes initiales (c’est-à-dire avant traitement) des répondeurs (à gauche) et non-répondeurs (à droite) montrant le nombre de connexions (degrés) générées par chaque région du cerveau. Le cerveau du bas illustre les régions cérébrales des répondeurs qui créent plus (ton de rouge jaune) et moins (ton de bleu) de connexions en comparaison des non-répondeurs. C. Lorsque corrélé avec l’analgésie obtenue après le traitement, le nombre de degrés issu du gyrus médian frontal droit (GMF-d) indique une corrélation positive significative (adaptée de [ 10]). |
|
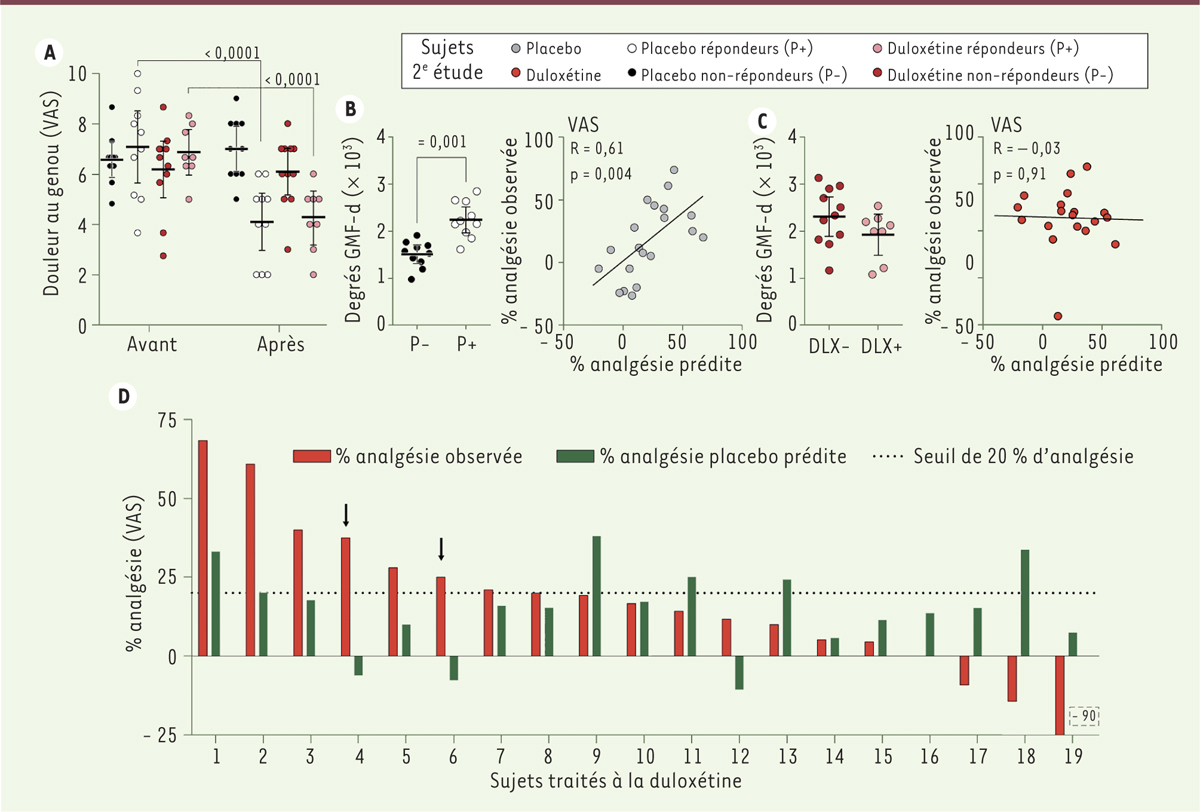
Validation d’un biomarqueur de réponse placebo Nous avons réalisé une seconde étude afin de tester la validité de ce biomarqueur. L’effet placebo est un problème majeur dans les études randomisées contrôlées en double aveugle qui tentent d’établir l’efficacité d’une approche thérapeutique. Nous nous sommes donc fondés sur ce type d’études pour valider le biomarqueur. Quarante patients souffrant de douleurs ostéoarthritiques du genou ont été recrutés et ont reçu pendant trois mois, soit un traitement placebo, soit de la duloxétine4. Conformément à l’étude précédente, chaque patient a subi un examen en IRMf à l’état de repos avant le début du traitement afin de créer leur carte individuelle de connectivité fonctionnelle. Nous avons extrait l’information provenant de la région préalablement identifiée, le GMF-d, et avons montré que les répondeurs au traitement placebo (Figure 2A) avaient, comme dans la première étude, une plus grande connectivité au niveau du GMF-d (Figure 2B gauche). Comme précédemment, l’intensité de connectivité était également associée à la réponse analgésique observée (Figure 2B droite). Ce résultat suggère donc fortement que la connectivité fonctionnelle générée par le gyrus médian frontal droit est en mesure de prédire la réponse à un traitement placebo.
 | Figure 2.
Validation du biomarqueur de prédiction de la réponse placebo dans une étude randomisée contrôlée en double aveugle. A. Après trois mois de traitement, les répondeurs au placebo (ronds blancs) et à la duloxétine (ronds roses) sont, par définition, les seuls à avoir montré une diminution significative des douleurs au genou telles que mesurées par le VAS ( visual analogue score). B. Le nombre de degrés générés par le gyrus médian frontal droit (GMF-d) est encore une fois plus élevé pour les répondeurs au placebo et la réponse analgésique observée est corrélée avec la réponse prédite grâce à la régression linéaire calculée avec la corrélation initiale (voir Figure 1C). C. À l’inverse, le nombre de degrés générés par le GMF-d est identique chez les répondeurs et non-répondeurs à la duloxétine ; l’analgésie observée n’est pas corrélée avec l’analgésie prédite. D. Schématisation de l’analgésie observée (en rouge) et de l’analgésie placebo prédite grâce au niveau de connectivité du GMF-d (en vert) chez les patients traités à la duloxétine. Il est possible d’observer que pour deux sujets (4 et 6), la contribution de la réponse placebo apparaît négligeable dans l’analgésie observée. Chez d’autres patients, la duloxétine semble bonifier la réponse placebo prédite (sujets 1, 2 et 3), tandis que pour les sujets 9, 11, 13 et 18, la duloxétine semble interférer négativement avec la réponse placebo. Il est également possible d’observer que l’effet de la duloxétine peut être principalement de type placebo (sujets 7 et 8) (adapté de [ 10]). |
|
Modéliser la réponse placebo dans un traitement actif Notre deuxième étude confirme donc la validité du biomarqueur pour prédire une réponse placebo. Elle a également permis d’évaluer son application dans le contexte d’un traitement pharmacologique actif puisqu’un groupe de patients a été traité par la duloxétine. Dans ce groupe, l’ampleur de la réponse analgésique était comparable à celle obtenue avec le traitement placebo (Figure 2A), suggérant que l’effet du traitement n’est pas supérieur à celui dû au placebo. Toutefois, l’analyse de la connectivité du GMF-d n’a pu prédire les répondeurs à la duloxétine (Figure 2C). Cette observation nous a incité à comparer la réponse placebo normalement prédite par la connectivité du GMF-d, avec l’effet analgésique observé chez ces patients (Figure 2D). Nous avons notamment identifié deux patients pour lesquels la réponse analgésique observée semblait être le moins influencée par une réponse placebo (Figure 2D, sujets 4 et 6). Nous avons donc examiné les particularités des cartes cérébrales de connexions fonctionnelles de ces deux patients (que l’on peut qualifier de répondeurs directs à la duloxétine), après soustraction de la réponse placebo prédite. Nous avons ainsi identifié que le nombre de connexions fonctionnelles générées par une région du gyrus parahippocampique droit était associé à cette réponse directe au traitement. Cette région possède donc un fort potentiel prédictif de la réponse à ce traitement pharmacologique actif. Cette analyse a également permis d’observer d’autres phénomènes particuliers ; par exemple, un effet secondaire inédit de la duloxétine : le traitement semble en effet interférer négativement avec la réponse placebo prédite pour certains sujets (voir les sujets 9, 11, 13 et 18). |
Notre étude est l’une des premières à montrer non seulement que la réponse placebo est prévisible et imbriquée dans les fonctions cérébrales, mais que certains patients pourraient être prédisposés à répondre efficacement à un traitement pharmacologique précis. Elle s’inscrit dans les études actuelles visant à utiliser la neuroimagerie afin de prévoir l’état de santé futur d’un individu et prendre les décisions qui sont nécessaires pour améliorer ses conditions de vie. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Wager TD, Rilling JK, Smith EE, et al. Placebo-induced changes in FMRI in the anticipation and experience of pain . Science. 2004; ; 303 : :1162.–1167. 2.
Hashmi JA, Baliki MN, Huang L, et al. Shape shifting pain: chronification of back pain shifts brain representation from nociceptive to emotional circuits . Brain. 2013; ; 136 : :2751.–2768. 3.
Finniss DG, Kaptchuk TJ, Miller F, et al. Biological, clinical, and ethical advances of placebo effects . Lancet. 2010; ; 375 : :686.–695. 4.
Wager TD, Atlas LY, Lindquist MA, et al. An fMRI-based neurologic signature of physical pain . N Engl J Med. 2013; ; 368 : :1388.–1397. 5.
Baliki MN, Petre B, Torbey S, et al. Corticostriatal functional connectivity predicts transition to chronic back pain . Nat Neurosci. 2012; ; 15 : :1117.–1119. 6.
Vachon-Presseau E, Tetreault P, Petre B, et al. Corticolimbic anatomical characteristics predetermine risk for chronic pain . Brain. 2016; ; 139 : :1958.–1970. 7.
Bassett DS, Wymbs NF, Porter MA, et al. Dynamic reconfiguration of human brain networks during learning . Proc Natl Acad Sci U S A. 2011; ; 108 : :7641.–7646. 8.
Langer N, Pedroni A, Gianotti LR, et al. Functional brain network efficiency predicts intelligence . Hum Brain Mapp. 2012; ; 33 : :1393.–1406. 9.
Gabrieli JD, Ghosh SS, Whitfield-Gabrieli S. Prediction as a humanitarian and pragmatic contribution from human cognitive neuroscience . Neuron. 2015; ; 85 : :11.–26. 10.
Tetreault P, Mansour A, Vachon-Presseau E, et al. Brain connectivity predicts placebo response across chronic pain clinical trials . PLoS Biol. 2016; ; 14 : :e1002570.. 11.
Peyron R, Faillenot I. Imagerie fonctionnelle cérébrale appliquée à l’analyse des phénomènes douloureux . Med Sci (Paris). 2011; ; 27 : :82.–87. |