| |
| Med Sci (Paris). 33(6–7): 606–609. doi: 10.1051/medsci/20173306016.Les lésions hépatiques induites par la cholestase : le rôle de S1PR2 Louise Dissous,1a Elizabeth Cesard,1b Arnaud Dance,1c and Thierry Tordjmann2d 1M1 Biologie Santé, Université Paris-Saclay91405Orsay, France 2Équipe interactions cellulaires et physiopathologie hépatique (ICPH), Inserm UMR S1174, Université Paris-Saclay, bâtiments440-443, rue des Adèles, 91400Orsay, France |
Les acides biliaires et leurs récepteurs Les maladies cholestatiques sont des pathologies associées à une diminution, ou un arrêt, de l’écoulement de la bile vers le duodénum ; il en résulte une augmentation des concentrations hépatique et systémique en acides biliaires. Les cholestases peuvent schématiquement résulter d’un défaut de sécrétion biliaire par les hépatocytes, ou d’une obstruction des voies biliaires par une lithiase, une tumeur, ou dans le cadre de maladies chroniques (cholangite biliaire primitive ou cholangite sclérosante primitive). Les acides biliaires ayant des effets cytotoxiques directs et indirects, leur accumulation dans le foie induit des lésions hépatiques (nécrose et inflammation) qui contribuent au développement d’une fibrose, puis d’une cirrhose. Dans des conditions cholestastiques, on observe une prolifération excessive des cellules épithéliales des canaux biliaires (cholangiocytes), constituant la « réaction ductulaire » dont la contribution aux processus de réparation et de fibrose est connue [1]. Les acides biliaires sont produits à partir du cholestérol et sont sécrétés dans la bile par les hépatocytes. Historiquement connus pour être indispensables à la digestion des lipides, ils sont aujourd’hui également considérés comme des molécules de signalisation paracrine et endocrine [2]. Plusieurs récepteurs des acides biliaires ont en effet été identifiés, dont les plus étudiés sont le récepteur nucléaire FXR (farnesoid X receptor), TGR5 (Takeda G-protein-coupled receptor 5) [11] (→) et S1PR2 (sphingosine-1-phosphate receptor 2, un récepteur membranaire couplé aux protéines G). L’activation de FXR en cas de surcharge en acides biliaires conduit à une réponse adaptative protégeant l’hépatocyte de la toxicité des acides biliaires [3, 4]. L’activation de TGR5 par les acides biliaires secondaires stimule la prolifération et inhibe l’apoptose des cholangiocytes [5]. Au niveau des macrophages, TGR5 limite la production de cytokines pro-inflammatoires [6]. Ainsi, les récepteurs FXR et TGR5 sont aujourd’hui associés à la régénération et la protection hépatiques en cas de surcharge en acides biliaires [3, 4, 6], et pourraient représenter des cibles thérapeutiques intéressantes lors de certaines pathologies biliaires. Le récepteur S1PR2, fortement exprimé dans le foie, est l’un des cinq récepteurs membranaires de la S1P (sphingosine-1-phosphate). Cette famille de récepteurs est connue pour réguler la prolifération, la migration et la survie de différents types cellulaires [2, 12] (→). Plus récemment, il a été montré que S1PR2 pouvait être activé par les acides biliaires conjugués tels que l’acide taurocholique (TCA) qui, via ce récepteur, réguleraient certaines voies de signalisation dans les hépatocytes murins [2] et favoriseraient la prolifération et la surexpression de facteurs pro-inflammatoires dans les lignées cellulaires de cholangiocarcinome [7, 8]. Dernièrement, une étude réalisée in vitro et in vivo suggère un impact supplémentaire de S1PR2 dans la prolifération des cholangiocytes non tumoraux et le développement des lésions hépatiques induites par la cholestase chez la souris [9].
(→) Voir la Nouvelle de C. Barichon et al., m/s n° 6–7, juin-juillet 2016, page 585
(→) Voir la Synthèse de O. Cuvillier, m/s n° 11, novembre 2011, page 951
|
S1PR2 et prolifération cholangiocytaire induite par les acides biliaires Dans cette étude, Wang et al. [9] ont tout d’abord montré que S1PR2 était le récepteur prédominant de la S1P des cholangiocytes murins normaux, et qu’il y était surexprimé dans un modèle de cholestase obstructive obtenu après ligature de la voie biliaire principale (bile duct-ligation, BDL). De plus, l’acide taurocholique induisait une prolifération cellulaire importante des cholangiocytes en culture primaire. Cette prolifération était relayée par S1PR2 - ce dont attestait sa disparition lorsque l’expression du gène codant S1PR2 était inhibée par une technique d’ARN interférence -, et faisait intervenir la phosphorylation des protéines ERK1/2 et AKT - ce que démontrait l’utilisation d’inhibiteurs pharmacologiques spécifiques. |
Rôle de S1PR2 dans les lésions et la fibrose hépatiques Dans le modèle d’obstruction de la voie biliaire chez la souris, on observe une forte augmentation de la concentration en acides biliaires dans le foie et le sérum, d’autant plus importante que la pathologie hépatique est avancée. Or, ce n’est pas le cas chez les souris génétiquement invalidées pour le S1PR2 (knock-out, S1PR2-KO). Par ailleurs, la cholestase induit des lésions hépatiques associées à une cytolyse hépatocytaire (que mesurent l’élévation des concentrations sériques en alanine aminotransférase et l’analyse histologique), et le développement de ces lésions hépatiques était significativement moindre chez les souris S1PR2-KO que chez les souris sauvages. Il en était de même pour la prolifération cholangiocytaire associée à la ligature de la voie biliaire, évaluée par l’expression du marqueur cholangiocytaire cytokératine-19. Il semble donc que, en présence d’une cholestase, l’activation du récepteur S1PR2 favorise le développement des lésions hépatocytaires et la prolifération cholangiocytaire. La lyse hépatocytaire chronique peut évoluer vers la fibrose, qui correspond au remplacement des zones tissulaires lésées par du tissu conjonctif fibreux, majoritairement constitué de collagène. Celle-ci se mesure par le contenu en collagène et l’expression de certains gènes marqueurs des tissus conjonctifs (collagen 1, alpha-smooth muscle actin) dans le foie des souris. Les auteurs ont également étudié le rôle potentiel de S1PR2 sur le développement de la fibrose hépatique, et montré que les souris n’exprimant pas S1PR2 (KO) étaient significativement protégées de la fibrose induite par la cholestase. Ces souris sont aussi protégées des processus inflammatoires impliqués dans le développement de la fibrose hépatique. Parmi les enzymes surexprimées dans ces conditions inflammatoires, la cyclo-oxygénase-2 (COX-2) catalyse la production de prostaglandine-H2, médiateur lipidique de l’inflammation. Dans des cellules de cholangiocarcinome humain, les auteurs avaient déjà montré que l’activation de S1PR2 par le TCA conduisait à une augmentation de l’expression du gène codant COX-2 via une voie de transduction dépendante de ERK1/2-NK-kB (Figure 1) [7]. De même, une surexpression significative de COX-2 a été observée dans le foie et les cholangiocytes des souris sauvages soumises à des conditions cholestatiques, mais pas dans ceux des souris S1PR2-KO. Ces données indiquent que l’activation de S1PR2 par les acides biliaires pourrait favoriser l’inflammation et la fibrose hépatiques en condition de cholestase. Cependant, il faut souligner que cette étude a été réalisée chez des souris dont l’invalidation de S1PR2 est constitutive (dans la totalité de l’organisme), ou par une approche pharmacologique systémique (antagoniste spécifique de S1PR2). On ne peut donc pas exclure l’impact de l’absence du récepteur dans les cellules autres que des cholangiocytes sur le phénotype observé. Ce pourrait être le cas des macrophages S1PR2-KO ; leur diminution, par défaut de recrutement hépatique par les acides biliaires, pourrait participer à la réduction de l’inflammation, des lésions et de la prolifération cholangiocytaire observée après ligature de la voie biliaire.
 | Figure 1.
Le rôle du récepteur S1PR2 dans l’inflammation et la fibrose induites par la cholestase. Lors de l’obstruction du canal biliaire, on observe une augmentation de la concentration en acides biliaires tels que l’acide taurocholique (TCA) dans le foie et une augmentation de l’expression du récepteur S1PR2 dans les cholangiocytes. Lorsque S1PR2 est activé par le TCA, il entraîne la phosphorylation de ERK1/2 et AKT, relayant plusieurs effets tels que la transcription des gènes clés de la prolifération cellulaire, l’activation du facteur de transcription NF-kB et la transcription du gène codant la cyclo-oxygénase 2 (COX-2). Ainsi, l’inflammation augmente et favorise le développement de la fibrose chez un patient atteint de cholestase hépatique. L’inhibition de S1PR2 par un antagoniste tel que JTE-013 permet de bloquer ces voies de signalisation, diminuer l’inflammation, réduire les risques de fibrose et, par conséquent, semble être un moyen possible de traiter les cholestases hépatiques. |
|
La signalisation induite par les acides biliaires : une arme à double tranchant La confrontation de ces résultats aux données de la littérature révèle donc un paradoxe apparent. En effet, dans des conditions cholestatiques, l’activation de S1PR2 par les acides biliaires conjugués dans différents types cellulaires semble promouvoir la destruction hépatocytaire et l’avancée de la maladie vers la fibrose. À l’inverse, l’activation du récepteur TGR5 par les acides biliaires secondaires est connue pour ses propriétés protectrices et favorisant la régénération en condition de surcharge en acides biliaires. Elle pourrait ainsi s’opposer à l’évolution vers la fibrose [4, 6] (Figure 2). Selon le récepteur engagé par les différents acides biliaires, les effets de la signalisation peuvent donc apparaître comme opposés. La composition du pool des différents types d’acides biliaires, ainsi que les niveaux d’expression et d’activité de TGR5 et S1PR2, apparaissent donc comme des éléments déterminants dans le contrôle de l’homéostasie biliaire et la survenue de lésions du foie en condition cholestatique.
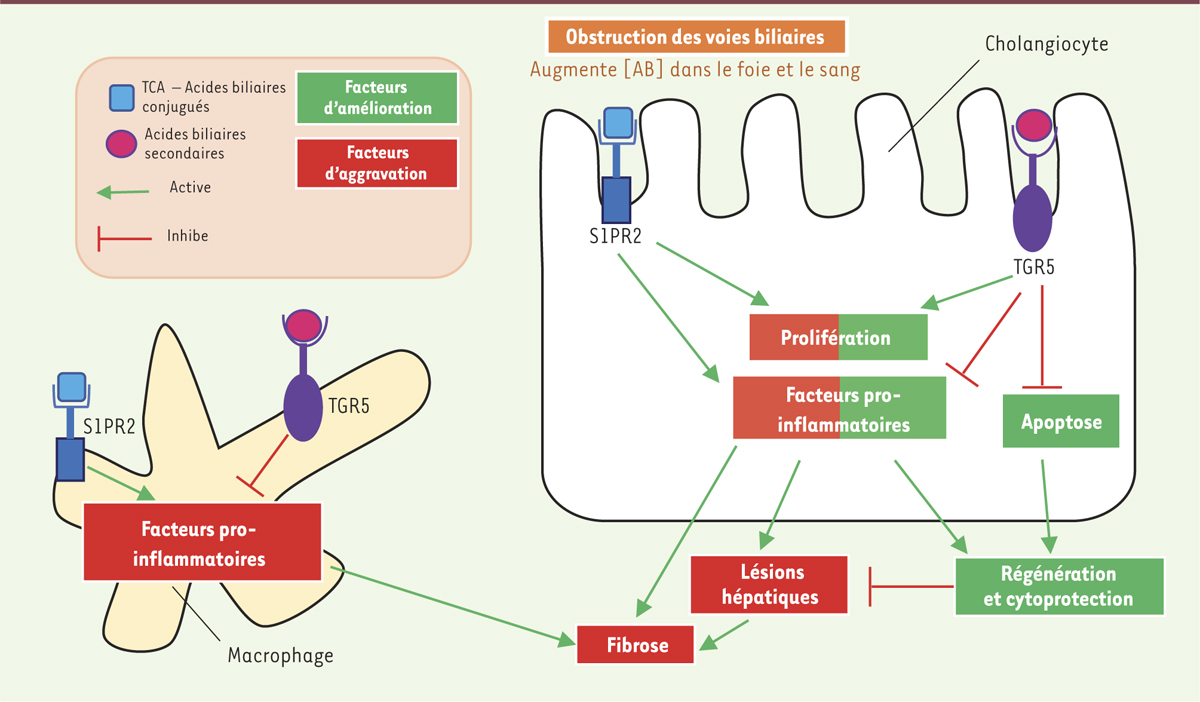
 | Figure 2.
Effets opposés des récepteurs des acides biliaires (AB) en conditions cholestatiques : entre régénération et fibrose hépatiques. S1PR2 et TGR5 ont des effets antagonistes au sein des mêmes cellules (cholangiocytes et macrophages). Bien qu’ils activent tous les deux la prolifération cholangiocytaire, dans les cholangiocytes, S1PR2 active des facteurs pro-inflammatoires tandis que TGR5 inhibe l’inflammation et l’apoptose. De plus, dans les macrophages, l’activation de S1PR2 a des effets pro-inflammatoires, tandis que celle de TGR5 limite l’inflammation. En cas de concentration élevée en acides biliaires, TGR5 a donc un rôle anti-inflammatoire et contribue à la régénération et à la cytoprotection, alors que S1PR2 a un rôle pro-inflammatoire et favorise les lésions hépatiques et la fibrose. |
Ces récepteurs pourraient par conséquent constituer des cibles pharmacologiques intéressantes, bien que complexes, dans le traitement des cholestases. Cette étude suggère notamment que des antagonistes de S1PR2 ou des agonistes de TGR5 pourraient avoir des effets protecteurs vis-à-vis des lésions cholestastiques. Toutefois, des questions restent en suspens. Par quelle voie de signalisation S1PR2 induit-il ses effets pro-inflammatoires dans les cholangiocytes ? Quelle est l’importance relative de la signalisation de S1PR2 et de TGR5 en condition de cholestase ? Existe-il un équilibre ou des interactions entre ces deux signalisations aux effets opposés dans certains types cellulaires ? Une étude récente suggère que l’activation de TGR5 limiterait l’inflammation et la fibrose rénales en condition de néphropathie diabétique, via l’inhibition de l’expression de S1PR2 [10]. L’existence potentielle d’un tel mécanisme régulateur dans le foie lors d’une cholestase reste à élucider. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Lee YA, Wallace MC, Friedman SL. Pathobiology of liver fibrosis: a translational success story . Gut. 2015; ; 64 : :830.–841. 2.
Nagahashi M, Yuza K, Hirose Y, et al. The roles of bile acids and sphingosine-1-phosphate signaling in the hepatobiliary diseases . J Lipid Res. 2016; ; 57 : :1636.–1643. 3.
Jung D, York JP, Wang L, et al. FXR-induced secretion of FGF15/19 inhibits CYP27 expression in cholangiocytes through p38 kinase pathway . Plugers Arch. 2014; ; 466 : :1011.–1019. 4.
Jourdainne V, Péan N, Doignon I, et al. The bile acid receptor TGR5 and liver regeneration . Digestive Diseases. 2015; ; 33 : :319.–326. 5.
Reich M, Deutschmann K, Sommerfeld A, et al. TGR5 is essential for bile acid-dependent cholangiocyte proliferation in vivo and in vitro . Gut. 2016; ; 65 : :487.–501. 6.
Péan N, Doignon I, Garcin I, et al. The receptor TGR5 protects the liver from bile acid overload during liver regeneration in mice . Hepatology. 2013; ; 58 : :1451.–1460. 7.
Liu R, Li X, Qiang X, et al. Taurocholate induces cyclooxygenase-2 expression via the sphingosine 1-phosphate receptor 2 in a human cholangiocarcinoma cell line . J Biol Chem. 2015; ; 290 : :30988.–31002. 8.
Liu R, Zhao R, Zhou X, et al. Conjugated bile acids promote cholangiocarcinoma cell invasive growth through activation of sphingosine 1- phosphate receptor 2 . Hepatology. 2014; ; 60 : :908.–918. 9.
Wang Y, Aoki H, Yang J, et al. The role of S1PR2 in bile acid-induced cholangiocyte proliferation and cholestasis-induced liver injury in mice . Hepatology. 2017 ; doi : doi: 10.1002/hep.29076. 10.
Yang Z, Xiong F, Wang Y, et al. TGR5 activation suppressed S1P/S1P2 signaling and resisted high glucose-induced fibrosis in glomerular mesangial cells . Pharmacol Res. 2016; ; 111 : :226.–236. 11.
Barichon C, Correia C, Tordjmann T. La prolifération des cholangiocytes induite par les acides biliaires : place du récepteur TGR5 . Med Sci (Paris). 2016; ; 32 : :585.–587. 12.
Cuvillier O. Les récepteurs de la sphingosine 1-phosphate -De la biologie à la physiopathologie . Med Sci (Paris). 2012; ; 28 : :951.–957. |