| |
| Med Sci (Paris). 33(6–7): 609–612. doi: 10.1051/medsci/20173306017.La guerre des clones : une compétition cellulaire antitumorale féroce Céline De Flori,1a Augustin Walter,1b Abd el moumen Kassoussi,1c and Bernard Mignotte2d 1M1 Biologie Santé, Université Paris-Saclay, 91405Orsay, France 2laboratoire de génétique et biologie cellulaire, EA 4589, UVSQ/Université Paris-Saclay, EPHE/ PSL Research University, 78180Montigny-le-Bretonneux, France |
Chez l’homme, 80 % des cancers proviennent de la transformation de cellules épithéliales aboutissant à des carcinomes. C’est pourquoi de nombreuses études portent sur les mécanismes de transformation et d’élimination des cellules épithéliales tumorales. Des phénomènes de compétition cellulaire (un processus d’élimination de cellules qui intervient au sein d’une population cellulaire hétérogène) conduisant à l’élimination de cellules transformées par l’oncogène ras (Rat Sarcoma) ou src ont déjà été observés, respectivement au sein d’une monocouche de cellules épithéliales de reins de chien et dans des épithéliums d’embryons de zebrafish (poisson zèbre). La compétition cellulaire est donc un processus qui permet à certaines cellules - les « winners » (gagnantes) - en contact avec d’autres cellules « losers » (perdantes) d’induire leur élimination selon différents mécanismes moléculaires. Ce phénomène de compétition est conservé des insectes aux mammifères. Chez la drosophile, une perte de fonction des gènes scribble (scrib) ou discs large – impliqués dans la polarité apico-basale des cellules – conduit dans les disques imaginaux de l’œil (structures larvaires à l’origine de l’œil adulte) à une élimination de ces clones devenus oncogéniques par les cellules normales voisines, via un mécanisme de compétition cellulaire. La voie de transduction du signal impliquant la JNK (c-Jun N-terminal kinase), activée par Eiger, l’homologue du TNFα (tumor necrosis factor α) chez la drosophile, joue un rôle essentiel dans cette élimination [1] en induisant l’apoptose des cellules oncogéniques. Les travaux publiés en début d’année par l’équipe de T. Igaki ont permis d’identifier les mécanismes moléculaires mis en œuvre pour éliminer les cellules dans le cadre d’une compétition chez la drosophile [2]. |
À la recherche de mutants déficients pour la compétition cellulaire Afin d’identifier les événements qui interviennent à l’interface entre les cellules normales et les cellules oncogéniques, des mutants affectant le processus de compétition cellulaire ont été recherchés. Des drosophiles mâles sauvages ont été nourries avec un milieu contenant un mutagène (EMS1, : éthyl methane sulfonate) afin d’identifier les gènes requis dans l’élimination des clones de cellules affectées dans leur polarité apico-basale par les clones sauvages. Les auteurs ont utilisé le système FLP/FRT2 qui permet d’induire la recombinaison mitotique de façon à produire une cellule homozygote mutante (-/-) et une cellule homozygote sauvage pour cette mutation (+/+) au sein d’individus hétérozygotes (+/-) [11] (→). Ce système permet notamment de générer in vivo des clones cellulaires homozygotes qui peuvent être identifiés par l’expression de marqueurs comme la GFP (green fluorescent protein) [3] (→). Les mâles portant une mutation hétérozygote ont donc été croisés avec des femelles vierges issues d’une lignée de mutants hétérozygotes pour une perte de fonction du gène scrib. La descendance porte donc l’allèle muté scrib-
maternel et l’allèle scrib+
sauvage paternel ainsi que la mutation aléatoire paternelle induite par l’EMS. Grâce à la technique de recombinaison mitotique, certaines mitoses vont donc aboutir à la formation de deux cellules filles différentes, la première étant homozygote pour la mutation scrib-/-
tandis que la seconde sera homozygote pour l’allèle sauvage.
(→) Voir la Synthèse de M. Jagut et J.R. Huynh, m/s n° 6–7, juin-juillet 2007, page 611
(→) Voir la Nouvelle de S. Pantalacci et al., m/s n° 2, février 2003, page 149
Lors du crible génétique, les auteurs ont recherché les mutants présentant un défaut de compétition cellulaire et donc présentant une importante survie des clones scrib-/-
dans le disque imaginal des larves. Quatre mutants appartenant au même groupe de complémentation ont été isolés. Ces mutants présentent également – au stade adulte – des tissus surnuméraires. Des expériences de génétique classique ont permis de localiser la mutation d’intérêt sur le chromosome 3R. Le séquençage de la région chromosomique concernée a permis de déterminer qu’il s’agissait d’une mutation ponctuelle non-sens introduisant un codon stop prématuré dans le gène codant la protéine transmembranaire Sas (stranded at second protein). Les auteurs ont finalement confirmé l’implication de Sas dans l’élimination des clones oncogéniques, à l’aide d’ARN interférents dirigés contre Sas dans les clones scrib-/-
qui miment l’effet du mutant. |
Quel est le partenaire de Sas ? Par ailleurs, la protéine PTP10D (protein tyrosine phosphatase 10D) était connue dans la littérature pour être un récepteur transmembranaire de Sas notamment impliqué dans le guidage axonal lors de l’embryogenèse [4], ce qui a conduit les auteurs à étudier le rôle potentiel de PTP10D dans la compétition cellulaire relayée par Sas. Ainsi, l’absence de compétition cellulaire suite à la perte de fonction de PTP10D dans les clones scrib-/-
leur a permis de révéler son implication dans ce processus d’élimination. Enfin, des expériences d’immunohistochimie ont révélé que, lors de la compétition, Sas et PTP10D - initialement présents à la membrane apicale (Figure 1A), respectivement dans les clones sauvages et scrib-/-, - sont relocalisés ensemble latéralement à l’interface entre les cellules sauvages et les cellules à polarité déficiente (scrib-/-
) (Figure 1B). L’ensemble de ces résultats suggèrent que l’interaction entre Sas et PTP10D est impliquée dans l’élimination des clones scrib-/-
par les clones sauvages.
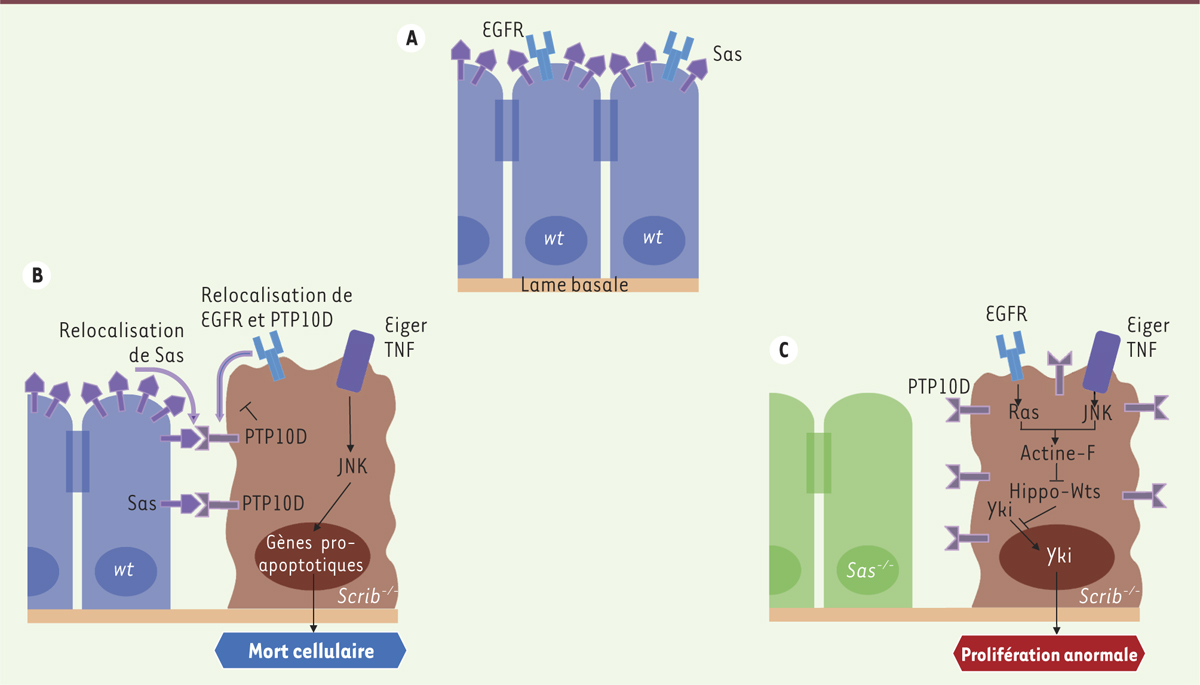
 | Figure 1.
Mécanisme d’élimination par compétition cellulaire de cellules oncogéniques par les cellules sauvages voisines. A. Au sein d’un épithélium sauvage, les protéines Sas et EGFR ont une localisation apicale. B..Quand les cellules voisines de la cellule scrib-/-
expriment le gène sas, la protéine Sas est relocalisée en position latérale, se lie au récepteur PTP10D de la cellule scrib-/-
et active PTP10D. Il en résulte une inhibition de la voie EGF (epithelial growth factor) et une activation de la voie JNK, ce qui induit l’expression de gènes pro-apoptotiques. C. Quand les cellules voisines scrib-/-
n’expriment pas le gène sas, la coactivation des voies de signalisation EGF-Ras (EGF-RAt Sarcoma) et Eiger-JNK (c-Jun N-terminal kinase) - au sein des cellules scrib-/- - induit une accumulation d’actine-F qui inhibe la kinase Wts (Warts), permettant ainsi la translocation dans le noyau du facteur de transcription Yki (Yorkie) et l’induction de la transcription de gènes favorisant la prolifération cellulaire. |
|
Quelles voies sont mises en jeu ? Sachant que l’absence de PTP10D dans les clones scrib-/-
induit une prolifération cellulaire accrue, et que, par ailleurs, PTP10D et son orthologue mammalien PTPRJ régulent négativement la voie EGF en déphosphorylant le domaine tyrosine kinase de EGFR, les auteurs ont ensuite étudié l’implication de la voie de signalisation EGF (epithelial growth factor). Ils ont constaté qu’en absence de PTP10D, l’expression du facteur de transcription Capicua diminue, ce qui reflète l’activation de la voie EGF [5]. De plus, l’utilisation de deux ARNi différents ciblant, d’une part, PTP10D et, d’autre part, le récepteur à l’EGF (EGFR) rétablit la compétition cellulaire. L’ensemble de ces résultats indiquent que l’interaction Sas-PTP10D lors de la compétition aboutit à l’inhibition de la voie EGF, ce qui empêche la prolifération cellulaire des clones scrib-/- (Figure 1C). Enfin, la coactivation dans les clones scrib-/-
des voies EGF et JNK augmente fortement l’accumulation intracellulaire de l’actine-F, ce qui inactive la voie Hippo [6]. Cette voie est impliquée dans la suppression de tumeurs via l’inhibition de la translocation nucléaire de l’oncogène Yki (Yorkie) [6, 7]. La surexpression de Wts (Warts), la kinase inhibitrice de Yki, dans les clones scrib-/- PTP10D-ARNi rétablit leur élimination par compétition cellulaire, ce qui montre que Wts est nécessaire à l’élimination cellulaire (Figure 1B). Cette étude met en évidence l’implication de Sas et PTP10D et de leur interaction dans le mécanisme de suppression tumorale impliquant la compétition cellulaire au sein de l’épithélium imaginal de drosophile. La relocalisation latérale de Sas et PTP10D (Figure 1A–C) est activée spécifiquement lors de l’émergence de cellules affectées dans la polarité apico-basale dans l’épithélium imaginal. Cependant, le mécanisme sous-jacent à cette relocalisation latérale n’est pas encore connu et les auteurs ont observé des relocalisations d’autres protéines membranaires qui pourraient faire l’objet de recherches futures. Ce système impliquant Sas et PTP10D n’est cependant pas généralisable. En effet, il n’est pas requis dans d’autres types de compétition cellulaire comme la compétition en faveur des cellules exprimant des niveaux élevés de myc [8–10]. |
Ces résultats sont-ils transposables à l’Homme ? Des études précédentes avaient montré que PTPRJ, l’homologue mammalien de PTP10D, agissait comme suppresseur de tumeur lors de compétitions cellulaires et régulait négativement la signalisation de l’EGFR. Cependant, à ce jour, aucun homologue de Sas n’a été découvert chez les mammifères. L’étude des ligands de PTPRJ constitue donc une piste prometteuse qui pourrait permettre de déterminer si ce potentiel mécanisme d’élimination tumoral par compétition cellulaire mis en évidence chez la drosophile est conservé chez les mammifères et en particulier chez l’homme. La connaissance de ces ligands permettrait d’identifier de nouvelles cibles thérapeutiques potentielles qui pourraient présenter un intérêt majeur pour manipuler la croissance tumorale. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Oshawa S, Sugimura K, Takino K, et al. Elimination of oncogenic neighbors by JNK-mediated engulfment in Drosophila . Dev Cell. 2011; ; 20 : :315.–328. 2.
Yamamoto M, Ohsawa S, Kunimasa K, et al. The ligand Sas and its receptor PTP10D drive tumour-suppressive cell competition . Nature. 2017; ; 542 : :246.–250. 3.
Pantalacci S, Léopold P, Tapon N. Drosophile et cancer : la preuve par sav . Med Sci. 2003; ; 19 : :149.–151. 4.
Lee H, Cording K, Vielmetter A, et al. Interactions between a receptor tyrosine phosphatase and a cell surface ligand regulate axon guidance and glial-neuronal communication . Neuron. 2013; ; 78 : :813.–826. 5.
Tseng AS, Tapon N, Kanda H, et al. Capicua regulates cell proliferation downstream of the receptor tyrosine kinase/Ras signaling pathway . Curr Biol. 2007; ; 17 : :728.–733. 6.
Enomoto M, Kizawa D, Ohsawa S, et al. JNK signaling is converted from anti- to pro-tumor pathway by Ras-mediated switch of Warts activity . Dev Biol. 2015; ; 403 : :162.–171. 7.
Morata G, Ripoll P. Minutes: mutants of Drosophila autonomously affecting cell division rate . Dev Biol. 1975; ; 42 : :211.–221. 8.
Bardet PL. La voie Hippo contrôle la croissance des organes au cours du développement . Med Sci. 2009; ; 25 : :253.–257. 9.
Moreno E, Basler K. dMyc transforms cells into super-competitors . Cell. 2004; ; 117 : :117.–129. 10.
Albagli O, Pelczar H. Myc et compétition intercellulaire chez la drosophile . Med Sci. 2006; ; 22 : :621.–625. 11.
Jagut M, Huynh JR. Régulation des cellules souches de la lignée germinale . Med Sci (Paris). 2007; ; 23 : :611.–618. |