| |
| Med Sci (Paris). 33: 7–10. doi: 10.1051/medsci/201733s102.Sur la technique des biopsies musculaires (IV) L’avènement de l’histochimie et de la cytoenzymologie dans l’analyse des biopsies musculaires. Un bref et personnel survol historique Michel Fardeau1* 1Professeur honoraire au CNAM, Fondateur de la Société Française de Myologie, Paris, France |
Ranvier est considéré comme le premier observateur à avoir mis en évidence des différences fonctionnelles entre muscles « rouges » et « blancs » chez le lapin. La référence à son traité [1] figure en tête de tous les travaux qui ont exploré à sa suite les différences physiologiques ou biochimiques entre les muscles squelettiques. Les travaux sur les différents substrats et activités enzymatiques, en particulier oxydatives et ATPasiques, qui s’en sont suivis, sont aujourd’hui bien classiques. Pour un survol très rapide, le lecteur peut en référer à un ouvrage du même auteur que cet article [2]. Cependant, la transposition de ces données biochimiques sur des coupes à congélation, pour tenter d’en définir la localisation intra-cellulaire précise, ne sera vraiment lancée qu’en 1951, après la publication dans « Science » du travail de A. Seligman et A. Rutenberg [3] proposant l’utilisation des sels de tétrazolium et leur réduction en un substrat coloré, bleuâtre, et insoluble, de diformazan pour localiser une activité oxydative en l’occurrence la succino-dehydrogenase. Ce travail fut poursuivi aux États-Unis par H. Padykula [4], puis au Japon sur toute une série de muscles de vertébrés par T. Ogata [5], ce qui lui permit de visualiser non pas seulement deux types de fibres musculaires, mais trois, avec l’identification d’un type « intermédiaire » entre les fibres « rouges » et « blanches ». S. Takeuchi devait réussir de son côté à visualiser l’activité phosphorylasique des fibres musculaires [6], travail poursuivi dans le laboratoire de A.G.E Pearse, à Londres, dans lequel un jeune pathologiste, V. Dubowitz, établit une relation réciproque, dans les fibres musculaires squelettiques, entre activités oxydatives et phosphorylasiques [7]. Aux États-Unis, H. Padykula et A. Herman étendaient ces travaux à la mise en évidence de l’activité ATPasique des fibres musculaires de mammifères [8]. L’importance et la nouveauté des résultats obtenus devaient bientôt conduire à l’application de ces techniques au muscle humain normal et pathologique. |
L’application au muscle humain normal et pathologique Elle sera entreprise essentiellement dans le laboratoire de M. Shy au 9e étage du « Building 10 » du NIH à Bethesda, et sera en particulier l’œuvre d’un jeune clinicien pathologiste, W.K. Engel. Etendant la technique de mise en évidence de la SDH à toute une série d’autres activités oxydatives (β-hydroxybutyrate déhydrogénase, NADH-tétrazolium-réductase, cytochrome oxydase), adoptant la technique de mise en évidence de la phosphorylase, il leur adjoignait la mise en évidence de l’activité ATPasique myofibrillaire qui, à pH 9,4 permettait de distinguer 2 types de fibres, les fibres II étant plus foncées que les fibres I [9]. Cette division fondée sur l’activité ATPasique de la myosine devait donner lieu à une à une controverse aiguë avec une autre équipe du NIH, localisée, elle, au « Building 9 », autour de L. Guth et F. Samaha, qui proposait également une autre nosographie (α, β, αβ [10]). G. Drews et W.K. Engel montrèrent qu’il était possible d’inverser cette coloration grâce à une pré-incubation avec un chélateur calcique, l’EDTA [11] mais cette dernière réaction fut rendue beaucoup plus simple et plus efficace lorsque M.H. Brooke, dans le laboratoire de W.K. Engel (
Figure 1
), montra que le même résultat pouvait être obtenu par une simple pré-incubation en milieu acide à pH 4,30. Une modulation précise du pH de ce milieu de pré incubation, devait permettre à M.H. Brooke de réussir à mettre en évidence trois types de fibres musculaires, les fibres II étant divisées en IIA, blanches après une pré-incubation à pH 4,63, et fibres IIB, de teinte brune intermédiaire entre les fibres IIA et les fibres I, ces dernières étant noires après visualisation de leur activité ATPasique [12]. On retrouvait ainsi une division ternaire des fibres musculaires squelettiques, déjà mise en évidence avec les techniques oxydatives. W.K. Engel réussissait à imposer cette classification (I, IIA, IIB) indépendante des propriétés physiologiques supposées des fibres musculaires (lentes, rapides, etc.), propriétés « qui ne se voient pas sur les coupes », comme le rappelait chaque fois W.K. Engel.
 | Figure 1.
Pionniers de la mise en évidence des activités ATPasiques dans le muscle.
|
À cette série de réactions histoenzymologiques, W.K. Engel adjoignait naturellement les réactions histologiques classiques, hématéine-éosine, PAS, Soudans pour la mise en évidence du glycogène et des lipides intracellulaires. Avec l’aide de son technicien G. Cunningham, il simplifiait et standardisait la coloration trichromique introduite par Gomori [13], technique qui devait rapidement prendre la première place dans ce qui devait constituer, dans ce laboratoire du NIH, une « batterie » de techniques d’analyse d’une biopsie musculaire. La qualité des résultats morphologiques, et bientôt la mise en évidence de toute une série de nouvelles altérations pathologiques dans les fibres musculaires devait imposer la diffusion de cette « batterie ». Des pathologistes du monde entier venaient se former dans ce laboratoire du NIH. Pendant des années, la publication de W.K. Engel dans Neurology viendra en tête de toutes les demandes de tirés à part dans le domaine neurologique. |
La visualisation du territoire des unités motrices À l’état normal, chez l’adulte, dans les muscles habituellement biopsiés, les différents types de fibres musculaires se disposent de façon aléatoire (
Figure 2
). Expérimentalement chez le rat, G. Karpati et W.K. Engel avaient déjà démontré qu’après dénervation (par section du nerf moteur) et réinnervation (après repousse des neurites moteurs), cette topographie aléatoire était remaniée, les fibres de même type ayant tendance à se grouper (« type grouping »). Ceci suggérait déjà que le « type » de fibres musculaires était dépendant de leur innervation par les branches collatérales des neurites ayant repoussé [14].
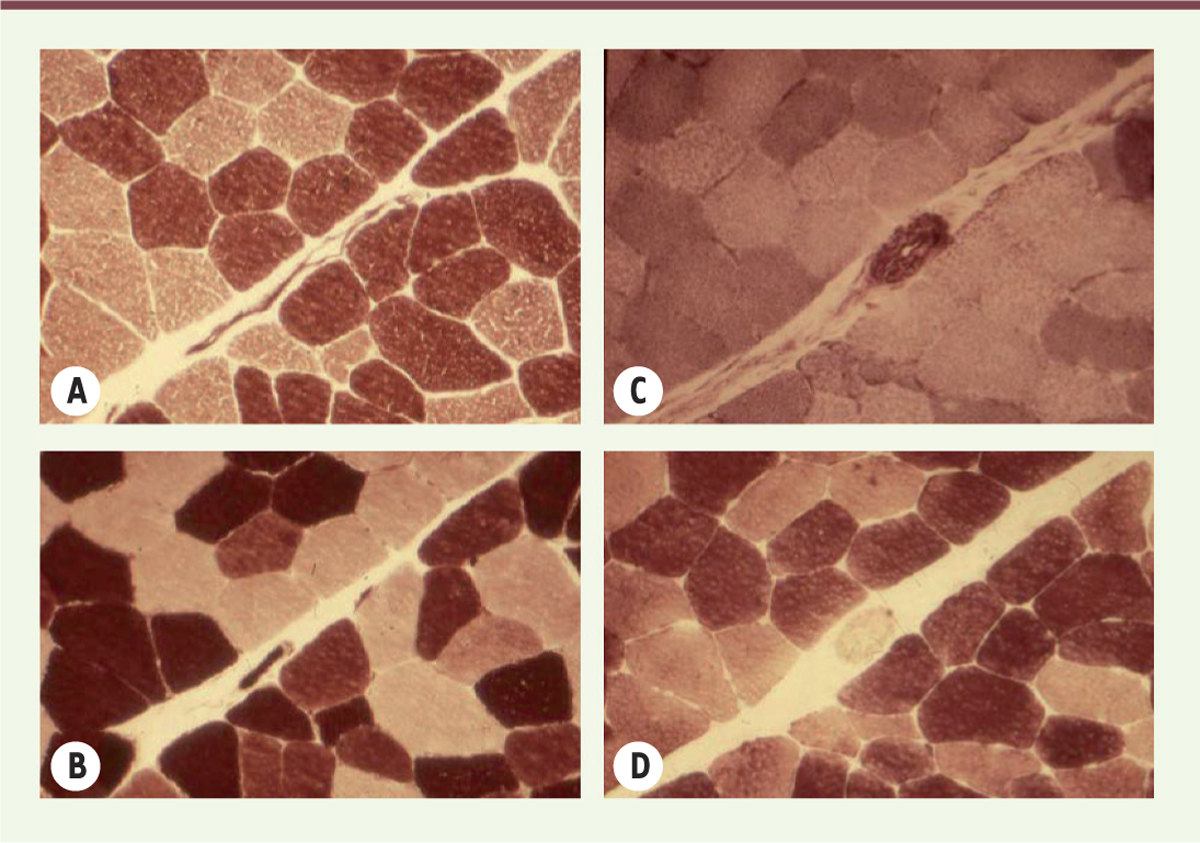
 | Figure 2.
Muscle humain adulte normal. Coupes sériées. ATPase myofibrillaire à pH 9,4 (A) et après pré-incubation à pH 4,63 (B), NADH-TR (C) et phosphorylase (D). |
Une preuve directe de cette dépendance devait être ensuite apportée par une étude coopérative, toujours au NIH, entre le laboratoire de physiologie dirigé par E. Burke, et le laboratoire de W.K. Engel. L’équipe de Burke avait mis au point une technique de déplétion glycogénique pour identifier les fibres musculaires innervées par une fibre nerveuse motrice isolée et stimulée jusqu’à épuisement de la réponse motrice. En combinant cette technique avec la mise en évidence, dans le secteur stimulé, de l’activité myofibrillaire ATPasique, il fut aussitôt démontré que les fibres musculaires appartenant à une même unité motrice étaient du même type cytoenzymologique [15]. Cette découverte majeure impliquait que pour la première fois, on puisse « lire », sur une coupe de tissu musculaire, le territoire innervé par des unités motrices de même type. La modification de la disposition aléatoire des différents types de fibres (« type grouping ») impliquait donc un processus de réinnervation collatérale, et donc une origine neuropathique au processus musculaire pathologique. |
Premières « nouveautés » pathologiques L’application régulière des « batteries » de techniques histologiques et cytoenzymologiques aux biopsies musculaires devait mettre en évidence des altérations jusqu’ici insoupçonnées ou difficilement appréciables après fixation formolée et inclusion en paraffine. Il en a été ainsi pour les « cores », zones arrondies, à limites souvent nettes, centrales ou excentrées, visibles dans les fibres musculaires en sections transversales ; en coupes longitudinales, ces zones anormales s’étendent sur tout ou partie de la longueur de la fibre musculaire. Ces « cores » avaient été décrits par M. Shy et al. [16] dans une observation familiale restée classique, et les lésions avaient donné naissance à la dénomination d’une nouvelle entité au sein des myopathies congénitales « non progressives », la « Central Core Disease ». La mise en œuvre des techniques oxydatives dans une seconde observation étudiée par W.K. Engel, devait révéler ces « cores » de façon spectaculaire, et en permettre l’analyse ultrastructurale par H. Huxley [17]. Des observations similaires, grâce à ces techniques, se multiplièrent rapidement. Tout aussi aisée fut, sur les coupes à congélation, la mise en évidence par le trichrome « Engel-Gomori » des amas de bâtonnets fuchsinophiles, (rouges sur le fond vert de la fibre musculaire), caractéristique d’une autre famille de myopathies congénitales, les « Nemaline Myopathies » [18]. On remarquera en passant le goût de l’équipe de M. Shy pour des dénominations imagées et de préférence non traductibles. L’association de « rods » et de « cores » sera décrite beaucoup plus tard, dessinant une nouvelle formule particulière de myopathie congénitale. La disposition centrale, en longue chaîne, des noyaux musculaires accompagnée d’une disposition radiaire des travées sarcoplasmiques en section transversale, très aisée à apprécier sur des coupes à congélation colorées selon les techniques oxydatives ou phosphorylasiques, devait permettre l’individualisation d’une autre famille de myopathies congénitales, les myopathies centro-nucléaires [19]. Cependant, l’innovation la plus marquante, initialement, de ces techniques fut la mise en évidence par W.K. Engel, des « ragged-red fibers » (
Figure 3
) qui deviendront vite le marqueur privilégié des myopathies « avec anomalies mitochondriales majeures » ; on remarquera à nouveau le goût de W.K. Engel pour une dénomination nosographique imagée et non traductible. La confirmation cytochimique par les réactions oxydatives et ultrastructurales de l’origine mitochondriale de ces amas rougeâtres, occupant la périphérie « déchiquetés » des fibres musculaires fut très rapidement apportée, et contribuera à la découverte de nombreuses entités dans ce nouveau champ pathologique lié à des anomalies mitochondriales.
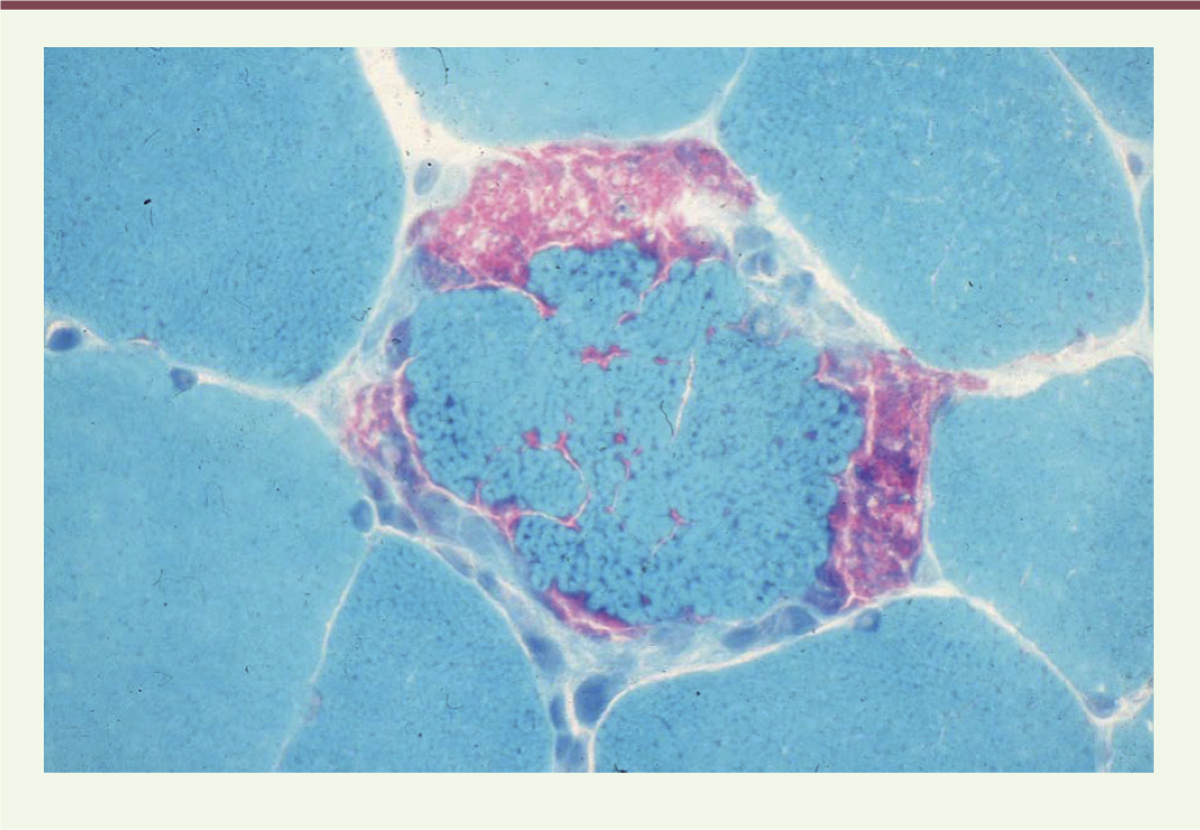
 | Figure 3.
Une ragged-red fiber.
|
Des inclusions rougeâtres, fuchsinophiles, souvent multiples dans une même fibre et intensément colorées par le NADH-TR, ou directement par le « nitro blue » de tétrazolium, mais non par les SDH ou les COX, caractériseront l’existence d’agrégats tubulaires développés aux dépens du réticulum sarcoplasmique, dont la définition ultrastructurale fut apportée secondairement [20]. Ces nouvelles anomalies pathologiques, la lisibilité accrue des altérations intracellulaires, et l’absence d’artéfacts liés à la fixation formolée et au mode d’inclusion ont fortement contribué à l’effacement progressif des modalités classiques d’examen du tissu musculaire au profit des coupes à congélation sériées. On a reproché initialement, à ces réactions cytoenzymologiques, et en particulier aux ATPases myofibrillaires, leur relative difficulté technique. M. Brooke avait coutume de répondre à ces objections avec son humour très britannique « vous pratiquez ces techniques pendant dix ans, et ensuite tout sera simple et parfait » |
L’auteur déclare n’avoir aucun lien d’intérêt concernant les don- nées publiées dans cet article.
|
1.
Ranvier L. Leçons d’anatomie générale sur le système musculaire . Paris: : Progrès Médical; , 1880. 2.
Fardeau M. L’Homme de chair . Paris: : Odile Jacob; , 2005. 3.
Seligman AM, Rutenberg AM. The histochemical demonstration of succino-dehydrogenase . Science. 1951; ; 113 : :317.. 4.
Padykula H. The localization of succinic dehydrogenase in tissue sections of the Rat . Am J Anat. 1952; ; 91 : :107.. 5.
Ogata T. A histochmical study of the red and white muscle fibers. Part I. Activity of the succinoxydase system in muscle fibers . Acta Med Okayama. 1958; ; 12 : :216.. 6.
Takeuchi T. Histochemical demonstration of phosphorylase . J Histochem Cytochem. 1956; ; 4 : :84.. 7.
Dubowitz V, Pearse AGE. Reciprocal relatronship of phosphorylase and oxidative enzymes in skeletal muscle . Nature. 1960; ; 185 : :701.. 8.
Padykula H, Herman A. The specificity of the histochemical method for adenosine-triphosphate . J Histochem Cytochem. 1955; ; 3 : :170.. 9.
Engel WK. The essentiality of histo and cytochemical studies of skeletal muscle in the investigation of neuromuscular disease . Neurology. 1962; ; 12 : :778.. 10.
Guth L, Samaha FJ. Qualitative differences between actomyosin: ATPase of slow and fast mammalian muscle . Exp Neurol. 1969; ; 25 : :138.. 11.
Drews GA, Engel WK. Reversal of the ATPase reaction in muscle fiber by EDTA . Nature. 1966; ; 212 : :1551.. 12.
Brooke MH, Kaiser KK. Muscle fiber types: how many and what kind . Arch Neurol. 1970; ; 23 : :369.. 13.
Engel WK, Cunningham GC. Rapid examination of muscle tissue: an improved trichrome method for fresh frozen biopsy sections . Neurology. 1963; ; 13 : :919.. 14.
Karpati G, Engel WK. Type grouping in skeletal muscles after experimental reinnervation . Neurology. 1968; ; 18 : :447.. 15.
Burke RE, Levine DN, Tsairis P, Zajac FE. Physiological types and histochemical profiles in motor units of the cat gastrocnemius . J Physiol. 1973; ; 234 : :723.. 16.
Shy GM, Magee KR. A new congenital non progressive myopathy . Brain. 1956; ; 79 : :610.. 17.
Engel WK, Foster JB, Hughes BP, et al. Central core disease an investigation of a rare muscle cell abnormality . Brain. 1961; ; 84 : :167.. 18.
Shy GM, Engel WK, Somers JE, Wanko T. Nemaline myopathy: a new congenital myopathy . Brain. 1963; ; 79 : :793.. 19.
Goulon M, Fardeau M, Got C, et al. Myopathie centronucléaire d’expression clinique tardive . Rev Neurol. 1976; ; 132 : :275.. 20.
Engel WK, Bishop DW, Cunningham G. Tubular aggregates in type II muscle fibers: ultrastructural and histochemical observations . J Ultrastr Res. 1970; ; 31 : :507.. |