« Clysterium donare, Postea seignare, Ensuita purgare »1. La dernière recommandation de cette méthode thérapeutique du XVIIe siècle, recommandée par le Docteur Purgon à son patient Argan, dans le Malade imaginaire de Molière, s’avère être mise en œuvre naturellement par les cellules de l’épithélium intestinal exposées à une catégorie de toxines bactériennes.
Les pathogènes menacent en permanence l’intégrité et la survie de l’organisme. Les défenses de l’hôte sont alors mises en œuvre et comprennent deux volets complémentaires et essentiels : la résistance et la résilience [1]. La notion de résistance recouvre essentiellement la réponse immunitaire par laquelle l’organisme cible les pathogènes à l’aide d’effecteurs moléculaires et cellulaires. Cependant, les tissus de l’organisme peuvent être endommagés au cours de l’infection, soit par des facteurs de virulence du pathogène, soit par la propre réponse immunitaire de l’hôte. Divers mécanismes interviennent par la suite pour limiter les dégâts et réparer les cellules ou tissus lésés : c’est la résilience. On peut donc définir la résilience comme étant l’intersection entre la pathogénèse microbienne et l’homéostasie de l’organisme. Ce deuxième aspect a été beaucoup moins étudié que la réponse immunitaire. Néanmoins, lorsque l’un des deux volets de la défense de l’hôte est défaillant, les chances de survie de l’organisme sont réduites de manière conséquente. Dans cette nouvelle, nous décrivons l’existence d’un nouveau mécanisme qui permet à l’épithélium intestinal de se protéger rapidement contre les effets nocifs d’une intoxication microbienne [2].
L’intestin représente une importante surface d’échange avec le milieu extérieur, surface qui permet d’assimiler les nutriments présents dans la nourriture. Cet organe doit également nous protéger contre les bactéries pathogènes qui peuvent contaminer les aliments2, tout en préservant le microbiote. L’intestin et les cellules principales de son épithélium simple, appelées entérocytes, possèdent un système de défense diversifié comprenant notamment la production de peptides antimicrobiens et d’espèces réactives de l’oxygène. À cette réponse immunitaire innée, s’ajoute la réponse immunitaire adaptative avec, notamment, la sécrétion d’immunoglobulines A (IgA). Jusqu’à présent, deux mécanismes de résilience permettant de maintenir l’intégrité de l’épithélium ont été décrits dans un organisme modèle, la drosophile. Les entérocytes tués par l’infection sont remplacés par de nouveaux entérocytes produits par une division accrue des cellules souches intestinales. Les effets toxiques des espèces réactives de l’oxygène sont, quant à eux, limités par l’expression par ces cellules d’une enzyme détoxifiante, la catalase [1, 3].
La drosophile (Drosophila melanogaster), aussi appelée mouche du vinaigre, est un excellent modèle d’étude pour les infections intestinales. Cet insecte, utilisé dans la recherche depuis le début du XXe siècle, est un modèle d’étude performant grâce à la disponibilité d’outils génétiques sophistiqués, modèle qui a notamment permis d’ouvrir la voie à la découverte des récepteurs de l’immunité innée, les PRR (pattern recognition receptors) [4, 5] (→).
(→) Voir la Nouvelle de D. Ferrandon et al., m/s n° 8-9, août-septembre 2007, page 29, et la Synthèse de J.L. Imler et D. Ferrandon, m/s n° 11, novembre 2011, page 1019
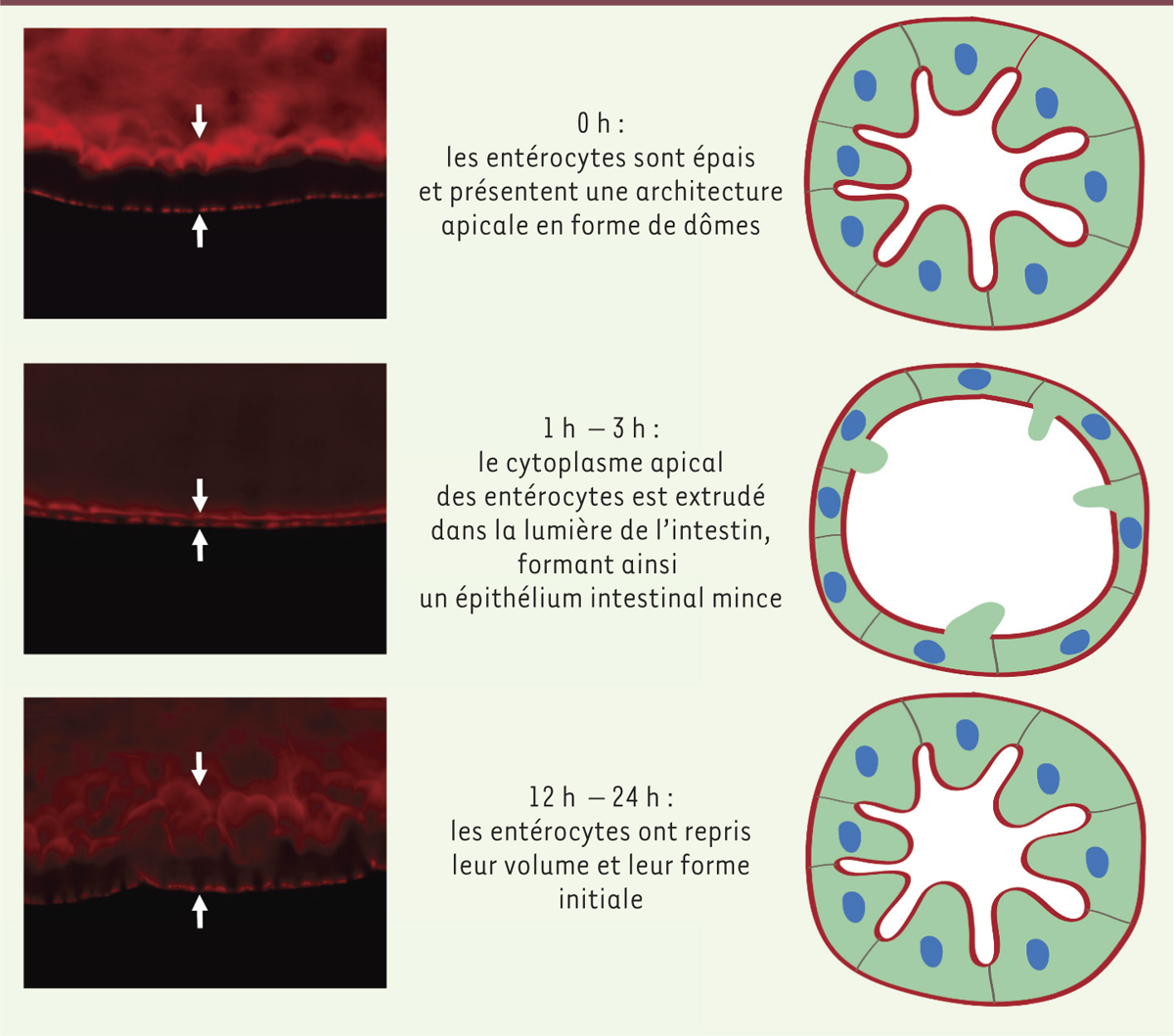
Comme notre tube digestif, l’épithélium de la drosophile est simple et constitué de seulement quatre types cellulaires majeurs, les entérocytes, les entéroblastes, les cellules entéro-endocrines et les cellules souches. Au sein de notre laboratoire, nous avons mis en place un protocole d’infection intestinale des drosophiles avec Serratia marcescens. Cette bactérie entomopathogène3 à Gram négatif est présente de manière ubiquitaire dans l’environnement et résiste à de nombreux antibiotiques. Serratia est fréquemment impliquée dans des cas d’infection nosocomiale, notamment dans les unités de néo-natalité ou de soins intensifs. Au laboratoire, l’infection des mouches est réalisée en les nourrissant avec une solution sucrée contenant les bactéries. Les drosophiles succombent en une dizaine de jours lorsqu’elles se nourrissent constamment de ce milieu. Après ingestion de la solution microbienne, leur intestin est disséqué puis analysé par microscopie afin de constater les éventuels dégâts provoqués par la bactérie. L’observation de l’intestin, 24 heures ou plusieurs jours après l’infection, ne révèle aucune modification morphologique majeure. En revanche, l’intestin de la drosophile subit des changements drastiques entre une et trois heures après l’ingestion du pathogène : durant cette phase précoce, les entérocytes s’aplatissent, sans toutefois augmenter leur surface, jusqu’à produire un amincissement spectaculaire de l’épithélium intestinal. La récupération subséquente de l’épaisseur et de l’architecture de l’épithélium intestinal est alors remarquable par sa rapidité. Grâce à différentes techniques de microscopie, nous avons mis en évidence un processus tout à fait surprenant. L’amincissement observé dans l’intestin repose sur une extrusion du cytoplasme apical des entérocytes de l’épithélium vers la lumière intestinale, sans que, toutefois, cela induise leur mort. Le cytoplasme est éjecté par de larges embrasures formées dans la membrane des cellules. Un amincissement semblable de l’épithélium intestinal est observé, in vivo, chez des souris infectées en injectant directement une solution bactérienne dans le duodénum. Cet amincissement, ainsi que l’extrusion cytoplasmique, se produisent également in vitro, dans des cultures de cellules intestinales humaines formant un épithélium, lorsqu’elles sont exposées à la bactérie Serratia marcescens.
| Figure 1.
Purge des entérocytes exposés à une toxine formant des pores et récupération rapide subséquente de l’épithélium intestinal. Les cellules de l’épithélium intestinal de drosophiles ayant ingéré la bactérie Serratia marcescens se purgent de leur cytoplasme apical à la suite de la détection de l’activité de l’hémolysine, une toxine bactérienne formant des pores nanométriques. Il s’ensuit une phase de récupération rapide. La coloration rouge permet de détecter les filaments d’actine présents dans les cellules musculaires circulaires qui enserrent le tube digestif au niveau basal, tandis que les microvillosités riches en actine sont apparentes au niveau apical des entérocytes. Les flèches délimitent l’épaisseur de l’épithélium intestinal. Le processus est schématisé sur la partie droite. |
Le facteur responsable de la formation des embrasures et de l’extrusion cytoplasmique subséquente est une toxine bactérienne formant des pores nanométriques, l’hémolysine. En effet, une souche mutante de S. marcescens qui ne sécrète plus d’hémolysine est incapable d’induire cet amincissement ou cette extrusion du cytoplasme, et est plus virulente pour les drosophiles que la bactérie non-mutante. Ces données suggèrent fortement que la réponse observée dans l’intestin représente une purge, qui permet d’éliminer non seulement les quelques bactéries ayant pu pénétrer dans les entérocytes et les toxines bactériennes sécrétées, mais aussi tous les composants cellulaires qui ont pu être endommagés par l’infection, tels que les organites et les membranes. C’est donc un mécanisme protecteur qui constitue une nouvelle forme de résilience, efficace lors d’expositions occasionnelles à des pathogènes ayant recours à ce type de toxines (près de 30 % des toxines bactériennes forment des pores). L’hémolysine représente dans cette réponse le signal permettant de déclencher l’amincissement de l’épithélium intestinal, mais aussi d’engendrer sa régénération. Cette étape de récupération rapide est importante. Lorsque celle-ci est bloquée, l’épithélium demeure fin et les mouches succombent plus rapidement à l’infection. C’est le cas des drosophiles mutantes pour le gène codant la cycline J, une protéine conservée au cours de l’évolution et dont la fonction dans les cellules somatiques était jusqu’alors inconnue. Une étude transcriptomique a permis d’identifier plusieurs peptides dont la synthèse dépend de cette cycline et qui sont sécrétés dans la lumière de l’intestin. La surexpression de l’un d’entre eux est suffisante pour assurer la récupération de l’épithélium intestinal de mouches mutantes pour le gène qui code la cycline J. Ces peptides orchestrent donc un programme qui permet aux entérocytes de récupérer rapidement leurs formes et fonctions originelles.
Ce nouveau phénomène d’homéostasie des entérocytes soulève de nouvelles questions de biologie cellulaire. Premièrement, le mécanisme par lequel sont formées les embrasures nécessitera d’être appréhendé. Deuxièmement, il faudra comprendre comment une telle ouverture dans les entérocytes n’entraîne pas leur mort. Il est vraisemblable que des phénomènes de réparation des membranes interviennent. Cette stratégie inédite permet peut-être de réduire les coûts énergétiques de la réponse à l’infection et de réparer les dommages qu’elle induit plus rapidement que le remplacement d’entérocytes subissant la mort cellulaire et la prolifération compensatoire des cellules souches intestinales qui s’ensuit. Il sera également nécessaire de comprendre le processus de détection de l’action de la toxine par la cellule et d’activation d’une voie de signalisation intracellulaire impliquant la cycline J, aboutissant à la sécrétion des peptides signaux orchestrant la phase de récupération. Il importe de souligner l’aspect métabolique de la récupération de l’épaisseur de l’épithélium intestinal, laquelle prend seulement quelques heures. Nos données suggèrent que les réserves métaboliques de la mouche participent également au processus de régénération de l’intestin après l’infection, ce qui pose le problème de la coordination de cette réponse au niveau de l’ensemble de l’organisme.
La conservation évolutive de la purge cytoplasmique des entérocytes ouvre un nouveau domaine d’étude. Ce mécanisme de résilience surprenant et très rapide aurait pu ne pas être détecté pendant encore plusieurs années sans l’apport d’études fondamentales réalisées sur l’organisme modèle qu’est la drosophile. Il est vraisemblable que l’élucidation des questions soulevées sera facilitée chez celle-ci. En ce qui concerne plus directement l’impact de ces processus sur notre santé, il devient pertinent de se demander si des altérations de ces mécanismes de résilience ne contribuent pas à l’étiologie des maladies inflammatoires de l’intestin, comme par exemple la maladie de Crohn. Dans les pays sous-développés, les enfants sont souvent exposés à des pathogènes intestinaux. Il est possible que des expositions répétées entraînant des cycles de purge des entérocytes participent, sur le long terme, en raison de leurs coûts métaboliques, à des retards de croissance de ces enfants, lesquels ont des conséquences importantes sur leur devenir [6].