L’interféron gamma (IFN-γ) est une cytokine essentielle de l’immunité innée et adaptative pour lutter contre les infections virales, parasitaires ou même bactériennes et est impliqué dans les processus d’immuno-surveillance et d’échappement des tumeurs. Il est, entre autres, produit par les cellules natural killer (NK), les lymphocytes T CD4+ auxiliaires de type 1 (TH1 ) et CD8+ au cours des différentes phases de la réponse immunitaire. L’IFN-γ est sécrété, de manière autocrine mais également paracrine, sous forme d’un dimère non covalent liant son récepteur exprimé à la surface des cellules dendritiques et d’autres cellules phagocytaires (macrophages, neutrophiles, etc.). Le récepteur de l’IFN-γ est un tétramère préassemblé comportant deux chaînes IFN-γR1 auxquelles se fixe le dimère d’IFN-γ et deux chaînes IFN-γR2. Les Janus kinases JAK1 et JAK2 sont associées aux domaines cytoplasmiques, respectivement aux chaînes IFN-γR1 et R2, même à l’état inactif. En réponse à la fixation de l’IFN-γ, JAK1 et JAK2 s’activent mutuellement, phosphorylent le domaine intracytoplasmique des chaînes IFN-γR1 et permettent l’ancrage, la phosphorylation, puis la dimérisation du facteur de transcription STAT1. Le dimère phospho-STAT1 migre alors vers le noyau et promeut la transcription de gènes pro-inflammatoires [1].
Cette voie canonique ne s’active pas au cours de l’infection des patients atteints de prédisposition mendélienne aux infections mycobactériennes (MSMD). Cette maladie rare se caractérise par une prédisposition génétique à des symptômes cliniques causés par des mycobactéries faiblement virulentes ou par le vaccin du BCG (vaccin bilié de Calmette et Guérin). Depuis 1996, neuf gènes ont été associés à la survenue de la MSMD. Tous ces gènes ont en commun de coder des protéines impliquées directement ou indirectement dans la réponse immunitaire dépendante de l’IFN-γ. La majeure partie des mutations identifiées consiste en un décalage du cadre de lecture, aboutissant à une protéine tronquée, et donc à une perte de fonction [2,3] (→) conduisant à la MSMD. Il existe par ailleurs une mutation ponctuelle dans la chaine IFN-γR2 qui entraîne également une perte de fonction [3]. En effet, la mutation de la thréonine 168 en asparagine (T168N) induit la présence anormale d’une chaîne N-glycosylée venant s’additionner aux six autres chaînes de carbohydrates déjà présentes sur la protéine sauvage. Cette mutation dite « gain de glycosylation », bien que très rare chez les patients atteints de MSMD (retrouvée chez quatre enfants issus de trois fratries différentes), appartient à une famille plus large de mutations similaires retrouvées sur 77 gènes différents [4]. Le récepteur portant la chaîne mutée IFN-γR2 (T168N) n’est alors plus capable d’induire la signalisation JAK/STAT, bien que son adressage à la membrane plasmique, son recyclage membranaire, sa capacité à lier l’IFN-γ et son association avec les JAK ne présentent aucun défaut mesurable [5].
(→) Voir la Nouvelle de G. Vogt et al., m/s n° 5, mai 2006, page 480
En fait, le mécanisme moléculaire de l’initiation de la signalisation par l’IFN-γ est encore assez méconnu. Le traitement préalable de fibroblastes immortalisés de patients par l’enzyme peptide-N-glycosidase F entraîne la digestion des carbohydrates des glycoprotéines extracellulaires et a permis de rétablir partiellement la signalisation JAK/STAT. Ceci confirme que le défaut occasionné par cette mutation est effectivement lié à la présence de récepteurs membranaires ayant cette glycosylation surnuméraire. Peu d’études se sont intéressées en fait par le passé à l’organisation membranaire du récepteur IFN-γR et à la façon dont la bicouche protéo-lipidique de la membrane plasmique influait sur son activation. Ces études sont difficiles à mener car, même si le récepteur a été retrouvé dans les fractions insolubles aux détergents non ioniques (DRM pour detergent resistant membranes) [6], ces détergents dénaturent la physiologie des cellules, ce qui complexifie fortement les études fonctionnelles et les conclusions que l’on peut en tirer [7].
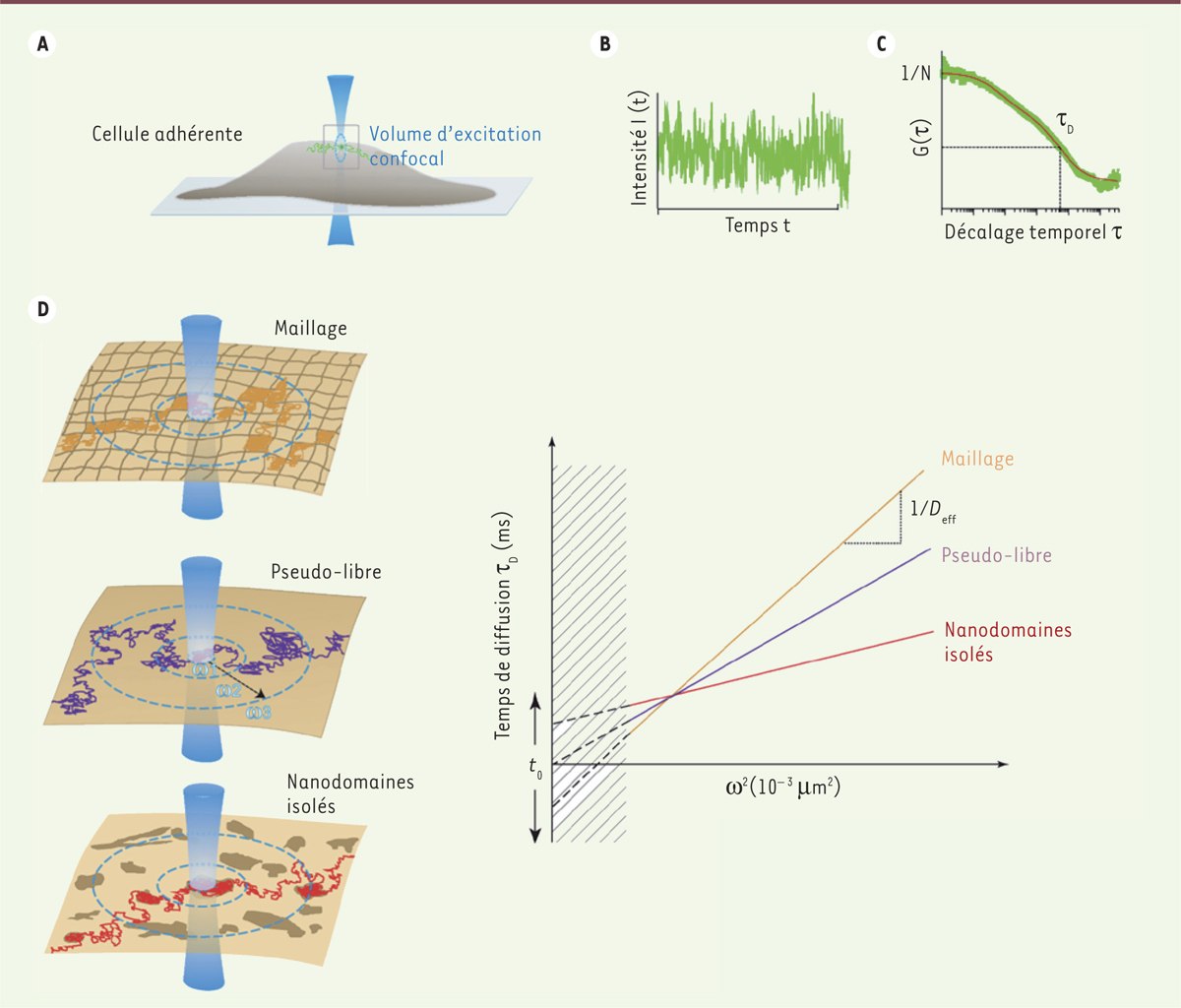
Cependant, depuis une dizaine d’années, le concept de nano-organisation latérale de la membrane plasmique des cellules a émergé grâce à l’utilisation de techniques biophotoniques avancées comme la spectroscopie de corrélation de fluorescence à rayon variable (svFCS pour spot variation fluorescence correlation spectroscopy) (Figure 1) [8–10]. Cette technique permet de déterminer le mode de diffusion des protéines ou des lipides avec une précision spatiale et temporelle exceptionnelle sur des cellules vivantes, en conditions physiologiques. Elle repose sur l’analyse des fluctuations de fluorescence générée par une illumination confocale1 dont le rayon varie, à l’échelle de la dizaine de nanosecondes. La technique svFCS permet d’apporter de nouvelles preuves non seulement de l’existence de nano-organisations dans la membrane plasmique (comme le concept de radeau lipidique « ou lipid raft ») mais également de leur importance fonctionnelle, en particulier dans la voie de signalisation PI3K (phosphoinositide 3-kinase)/AKT(ou PKB, protéine kinase B) [11]. Ces mesures de diffusion en conditions physiologiques suggèrent que les nanodomaines lipidiques seraient des structures nanométriques dynamiques dépendantes des sphingolipides et du cholestérol, dans lesquelles s’assembleraient lipides et protéines pendant des laps de temps de quelques dizaines de millisecondes.
| Figure 1.
Principe de la spectroscopie de corrélation de fluorescence à rayon variable. La spectroscopie FCS (fluorescent correlation spectroscopy) nécessite un montage optique permettant (A) de positionner précisément une source d’illumination confocale (« spot d’illumination »), (B) d’enregistrer les fluctuations de fluorescence produites par la diffusion de molécules fluorescentes à travers ce spot immobile et (C) d’analyser ces fluctuations par une fonction d’autocorrélation G(τ). Cette analyse permet de déterminer le temps moyen de résidence dans le spot d’illumination (ou temps de diffusion τd), ainsi que le nombre moyen de particules diffusantes (N). D. En faisant varier expérimentalement la surface d’excitation (de rayon ω1, ω2, ω3, etc.), on peut définir une relation linéaire entre les temps de diffusion mesurés et le carré des rayons du spot d’illumination (ω²) pour des valeurs au-dessus de la limite de diffraction (zone hachurée). La droite coupe l’axe à l’origine (t
0=0) dans le cas de mouvements browniens (diffusion libre ou pseudo-libre). Une déviation de cette relation est mesurée si la diffusion est restreinte par un maillage (t
0 <0) ou si les molécules sont transitoirement partitionnées dans des nanodomaines isolés (t
0 >0). |
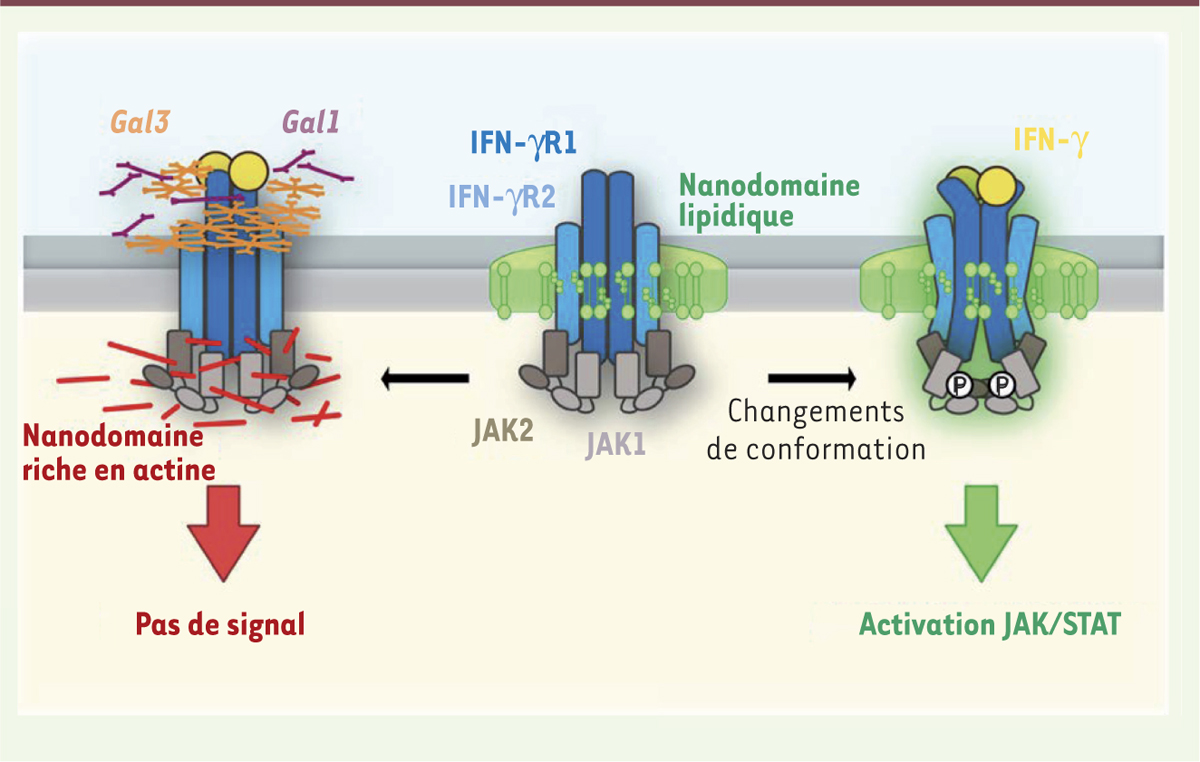
| Figure 2.
Mécanisme moléculaire de l’activation du récepteur membranaire de l’IFN-γ. À l’état basal, l’IFN-γR est associé de façon dynamique à des nanodomaines lipidiques riches en cholestérol et en sphingolipides qui sont nécessaires aux changements de conformation induits par la liaison de l’IFN-γ des sous-unités du récepteur et des kinases qui leur sont associées. Ces réarrangements moléculaires conduisent à la transduction du signal. À l’inverse, la liaison en excès de galectines (Gal1 et Gal3) à la sous-unité IFN-γR2 due à la mutation « gain de glycosylation » (T168N) ou à l’augmentation de leur concentration extracellulaire, ségrège le complexe IFN-γR dans des nanodomaines riches en actine, empêchant l’activation de la voie de signalisation JAK/STAT. |
Nous avons utilisé cette approche de svFCS pour analyser le mécanisme moléculaire d’activation du récepteur IFN-γR et pour comprendre comment la mutation T168N le rend défectueux [5]. L’analyse de la diffusion de la chaîne IFN-γR2 couplée à la protéine naturellement verte (GFP, green fluorescent protein) indique que ce récepteur est confiné majoritairement dans des nanodomaines lipidiques, dépendants de l’organisation des sphingolipides et du cholestérol. En réponse à l’IFN-γ, la diffusion du récepteur IFN-γR change progressivement au cours du temps, basculant in fine vers une diffusion de type maillage (mesh-work en anglais). Ce terme désigne une diffusion non brownienne à l’intérieur d’un réseau semi-perméable de clôtures et de piquets (fence and pickets), qui correspondent le plus généralement aux filaments constituant le cytosquelette d’actine cortical et aux molécules auxquelles ils sont ancrés. Les surfaces délimitées sont estimées (en moyenne) à des formes géométriques de 100 à 200 nm de côté, distantes de 5 à 10 nm de la membrane plasmique. De plus, nous avons montré qu’il était nécessaire que le récepteur IFN-γR soit au préalable confiné dans ces nanodomaines lipidiques pour que puisse avoir lieu ce basculement de mode de diffusion. Nous avons soupçonné que la cause de ce basculement pouvait être liée à un changement de conformation du domaine intra-cytoplasmique du récepteur IFN-γR et utilisé alors une approche de transfert d’énergie par résonance fondé sur la bioluminescence (BRET pour bioluminescence resonance energy transfer), approche qui permet de suivre des modifications de conformation des protéines dans les cellules vivantes en conditions physiologiques. Cette technique consiste en la mesure du transfert d’énergie lumineuse émise par une protéine bioluminescente, renilla luciferase, fusionnée à une protéine A, vers une molécule fluorescente acceptrice (YFP, yellow fluorescent protein) fusionnée à une protéine B, dont on veut étudier l’interaction avec la protéine A. De fait, l’utilisation de cette technique a permis de montrer que les valeurs maximales de transfert d’énergie varient au cours de l’activation entre les deux chaînes du récepteur, ou encore entre la chaîne IFN-γR2 et la kinase JAK1. En revanche, la désorganisation préalable des nanodomaines lipidiques ou l’inhibition de l’activité catalytique des kinases JAK annulent les variations de bioluminescence « BRET » dépendantes de l’IFN-γ.
Ainsi, grâce à l’utilisation de deux approches indépendantes de biophotonique, nous avons montré que la transduction du signal induite par la fixation de l’IFN-γ à son récepteur IFN-γR s’accompagne de changements de mode de diffusion de ce dernier, causées par des modifications de la conformation des domaines cytoplasmiques de ses chaînes. Ces changements sont initialement indépendants de l’activité des kinases JAK, puis le deviennent. Nous avons établi que, si le récepteur IFN-γR ne reste pas confiné dans des nanodomaines lipidiques, il ne peut alors assurer la transmission du signal normalement induite par l’IFN-γ.
Suivant la même stratégie, nous avons étudié si la mutation (T168N) induisait un défaut remarquable en spectroscopie svFCS et en bioluminescence BRET. Le récepteur portant la chaîne mutée n’est pas confiné dans des nanodomaines lipidiques, mais sa mobilité est restreinte par des nanodomaines dépendants de l’actine. La diffusion du récepteur muté est, de plus, insensible à la présence d’IFN-γ, comme le confirment les mesures de BRET. En effet, si les valeurs de BRET mesurées à l’état basal entre la chaîne IFN-γR2 mutée et IFN-γR1 ou JAK1 sont similaires aux valeurs obtenues avec la chaine IFN-γR2 sauvage, aucune variation de ces valeurs n’est observée en réponse à IFN-γ. Ceci montre que le récepteur n’opère plus les changements diffusifs et/donc conformationnels requis pour transmettre le signal.
L’interactome2 de la chaîne IFN-γR2 montre une augmentation des galectines (Gal-1 et Gal-3) liées à cette chaîne mutante en comparaison de la chaîne sauvage. Les galectines sont des lectines extracellulaires se liant aux chaînes glycosylées et sont des intermédiaires jouant un rôle important dans les réponses immune et inflammatoire. Gal-3 et, dans une moindre mesure, Gal-1 ont la propriété de se multimériser et de provoquer l’apparition de treillis membranaires (lattices) de récepteurs [12, 13] (→).
(→) Voir la Synthèse de T. Advediddian et al., m/s n° 5, mai 2015, page 499
Dans le cas du récepteur IFN-γR2 sauvage, il existe une association constitutive de ce récepteur aux galectines, association finement régulée que l’on peut perturber par l’ajout exogène de galectines recombinantes. La mutation T168N trouvée sur la chaîne IFN-γR2 induit une association excessive à ces galectines, que l’on peut inhiber soit par des ARN interférentiels soit par un inhibiteur compétitif. Le récepteur est alors à nouveau confiné dans des nanodomaines lipidiques et récupère sa fonction activatrice.
Cette étude apporte l’une des premières preuves expérimentales que la biophotonique avancée permet de comprendre des défauts génétiques, en apparence plus « anodins » qu’une délétion génique. Elle souligne le rôle fondamental de la nano-organisation des récepteurs de la membrane plasmique dans les phénomènes de signalisation/transduction du signal, grâce à des arguments génétiques totalement nouveaux. De nouvelles perspectives thérapeutiques s’ouvrent désormais pour cibler le rôle des galectines dans les maladies génétiques liées aux mutations « gain de glycosylation », et au-delà dans des pathologies comme le cancer ou liées à divers dysfonctionnements métaboliques ou immunitaires.