| |
| Med Sci (Paris). 33(8-9): 720–723. doi: 10.1051/medsci/20173308011.Hépatite C : le serial killer photographié plus de 25 ans après sa mise en examen Eric Piver,1,3 Anne Bull,1 Philippe Roingeard,1,2 and Jean-Christophe Meunier1* 1Inserm U966, Faculté de médecine, université François Rabelais et CHRU de Tours, 10, boulevard Tonnellé, 37032Tours, France 2Plate-forme infrastructures en biologie santé et agronomie (IBiSA) des microscopies, PPF (programme pluri-formation) ASB (analyse des systèmes biologiques), université François Rabelais et CHRU de Tours, 37000Tours, France 3Biochimie et biologie moléculaire, hôpital Trousseau, CHRU de Tours, 37000Tours, France |
Développée dans les années 1950, la microscopie électronique en transmission (MET) a contribué à l’identification d’un grand nombre de virus [1]. Ces agents infectieux sont en effet, pour la plupart, trop petits pour être observables en microscopie en lumière visible. Ainsi, la majorité des virus responsables des hépatites ont été découverts à l’aide de la MET : le virus de l’hépatite B (VHB), par Dane et al., en 1970 [2], le virus de l’hépatite A (VHA), par Steve Feinstone et al., en 1973 [3] et le virus de l’hépatite E (VHE), par Mikhail Balayan et al., en 1983 [4]. Le virus de l’hépatite C constitue une exception notable à cette stratégie d’identification. Bien que son existence ait été suspectée depuis le début des années 1980, il n’a été isolé qu’en 1989, par l’équipe de Michael Houghton [5], se fondant exclusivement sur des techniques de biologie moléculaire. La visualisation de ce virus en microscopie électronique a, par la suite, constitué un objectif logique pour les laboratoires de recherche. Mais ces travaux se sont heurtés à une caractéristique unique du virus de l’hépatite C : sa capacité à interagir avec les composants du métabolisme des lipides. |
Un cycle de vie sous dépendance Il est aujourd’hui clairement établi que le virus de l’hépatite C (VHC) présent chez les patients a la particularité de s’associer à certains composants du métabolisme du cholestérol, lors de sa morphogenèse. Ces particules hybrides appelées « lipo-viro particules » (LVP) associent des composants d’origine virale (les protéines d’enveloppe, la nucléocapside, les ARN) à des constituants cellulaires [6]. Ces derniers sont les composants des lipoprotéines de très faible densité (VLDL, very low density lipoprotein) comme le triacylglycérol, le cholestérol, les apolipoprotéines E, B et C1. La maturation et le relargage des lipo-viro particules hors des cellules productrices sont étroitement associés à la voie de synthèse des VLDL [6]. Cependant, le mécanisme d’initiation de l’interaction entre ces composants d’origines différentes est longtemps resté mal connu. Une des étapes initiales de la morphogenèse virale consiste en un regroupement de protéines virales et cellulaires, sur la face luminale ou cytosolique du réticulum endoplasmique (RE) et à proximité du complexe de réplication. Ce recrutement permettrait d’établir un microenvironnement favorable à l’assemblage de particules virales [6]. À la suite d’un événement déclencheur inconnu, la nucléocapside est alors transférée dans le RE où elle va interagir avec la voie de morphogenèse des VLDL selon un mécanisme qui a été décrit récemment. Ainsi, deux études publiées en 2014 par notre groupe [7] puis par celui du Pr Bartenschlager, à Heidelberg, ont démontré que les glycoprotéines d’enveloppe du VHC, E1 et E2, et l’apolipoprotéine E (ApoE) s’associaient précocement dans le RE et que ce complexe était retrouvé à la surface des particules infectieuses. L’interaction de ces protéines va entraîner l’association de deux structures naissantes : la pré-VLDL (portant ApoE) et la particule virale initiale (portant les glycoprotéines E1 et E2). La « lipo-viro particule » ainsi formée s’associera ensuite à des quantités variables de triacylglycérol/cholesterylester, le long de la voie de maturation des VLDL, dans le RE, pour produire des particules virales de faible densité, mais fortement infectieuses. Cette caractéristique du virus de l’hépatite C va donc fortement influencer sa morphologie et donc son apparence lorsqu’il circule chez les patients. |
Le tueur aime les faux-semblants Le virus de l’hépatite C ressemble donc fortement à une VLDL. Ceci représente un obstacle à son identification et à sa visualisation en MET. Il faut noter que l’exploitation de l’ensemble des informations obtenues par des techniques de biologie moléculaire a néanmoins permis de proposer une organisation ultrastructurale possible pour cette particule, proposition qui s’avèrera par la suite très proche de la réalité. L’une des solutions explorée pour isoler le virus de façon spécifique a été d’exploiter la présence à sa surface des glycoprotéines d’enveloppe E1 et E2. Malheureusement, il s’est avéré que cette stratégie était délicate à manier puisqu’en 2008, l’équipe du Pr Patrice André montrait que, dans les hépatocytes infectés, les protéines d’enveloppe du virus se retrouvaient associées aux lipoprotéines riches en triglycérides produites dans le milieu extracellulaire [8]. Il s’agissait donc, pour les chercheurs, de visualiser un virus ayant l’apparence d’une lipoprotéine, au sein des lipoprotéines portant les protéines d’enveloppe du virus de l’hépatite C ! De nombreux travaux, destinés à caractériser l’ultrastructure de la particule du virus de l’hépatite C, ont ainsi été publiés depuis sa première caractérisation en 1989, sans que les auteurs parviennent à proposer des images montrant une organisation interne caractéristique. Ces études reposaient pour la plupart sur des techniques de préparation d’échantillons faisant intervenir un gradient de flottaison, puis un gradient de vitesse de sédimentation. Les deux ultra-centrifugations successives nécessaires à l’obtention de ces gradients sont en fait susceptibles d’altérer la structure de la particule ; ces techniques imposent aussi de sélectionner, dans le gradient, la population à étudier. Il est possible que ce double biais soit à l’origine de l’échec à produire des images convaincantes du virus. |
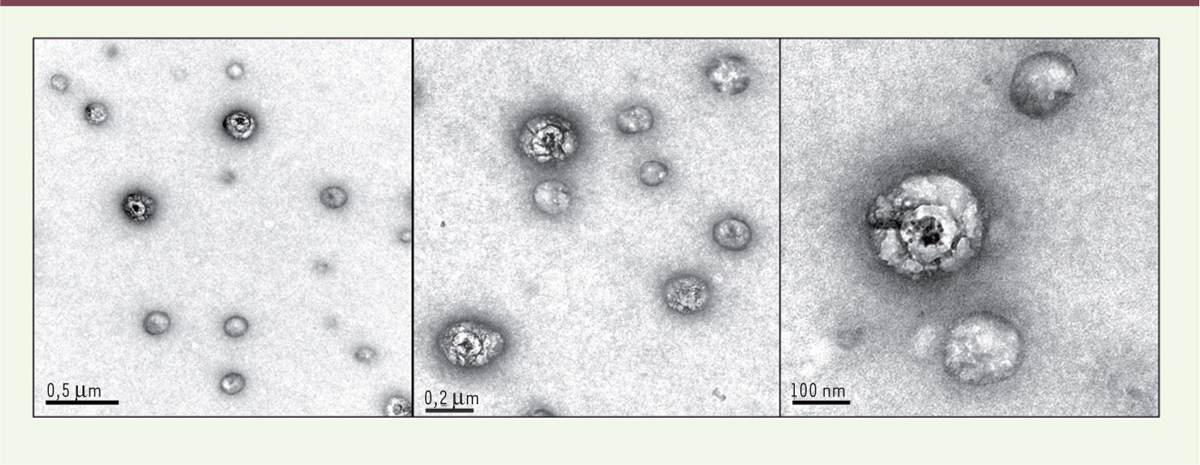
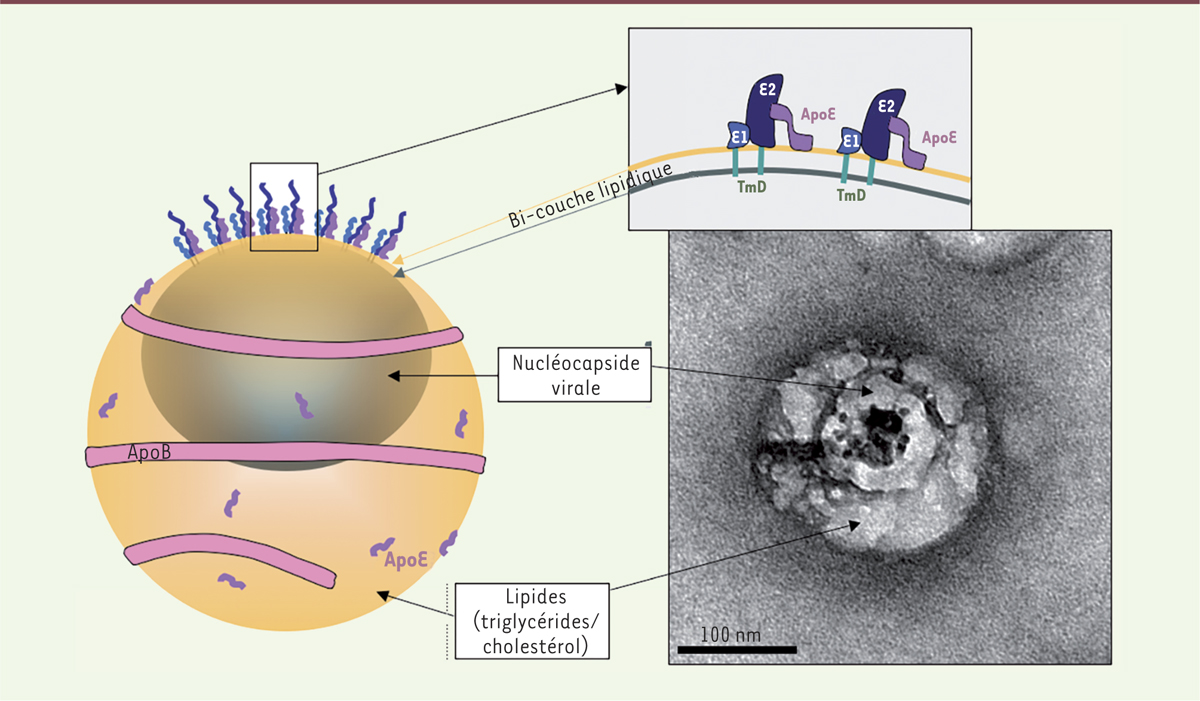
Une solution simple pour un problème complexe Lorsque nous avons initié ce projet au laboratoire, nous souhaitions définir un protocole de préparation des échantillons viraux pour l’observation en MET qui soit rapide, permette de respecter au mieux la structure native du virus, et s’affranchisse de toute sélection arbitraire de la population de particules étudiée. Nous avons, pour cela, utilisé des grilles (supports d’échantillons) de microscopie électronique sur lesquelles nous avons directement fixé des anticorps dirigés contre les protéines d’enveloppes virales (E1, E2) ou les apolipoprotéines E et B. Ces grilles ont été mises en contact avec les échantillons à étudier (des sérums de patients contaminés par le virus de l’hépatite C, par exemple), lavées, fixées par le paraformaldéhyde, contrastées à l’acétate d’uranyle, puis observées immédiatement sous MET. Cette stratégie de visualisation de particules virales en microscopie électronique en transmission après immuno-capture spécifique s’est avérée rapidement efficace [9]. Nous avons ainsi observé, après capture à l’aide d’anticorps dirigés contre la glycoprotéine E2, l’ApoE ou l’ApoB, dans du sérum de patients infectés, une population mixte, composée d’une part de particules sphériques sans structure complexe et ressemblant à des lipoprotéines et, d’autre part, de particules asymétriques présentant clairement une organisation ultra-structurale commune (Figure 1). L’organisation de ces particules asymétriques ressemblait, de façon frappante, au modèle imaginé à partir de données de biologie moléculaire. Nous avons ensuite caractérisé finement les populations identifiées en microscopie électronique. La « lipo-viro particule » du VHC est constituée d’une nucléocapside qui contient l’ARN viral, sans géométrie clairement définie, elle-même entourée d’une couche de lipides (triglycerides/cholestérol) de taille variable (Figure 2). Cette capside apparaît systématiquement décentrée : la monocouche lipidique qui l’entoure se situe à proximité immédiate de la couche lipidique externe du virus. Il se forme donc au niveau de cette zone de contact une double membrane (Figure 2). Ce phénomène pourrait s’expliquer par la nécessaire présence d’une bicouche lipidique, pour une insertion correcte des domaines trans-membranaires des protéines d’enveloppe virales.
 | Figure 1.
Les particules immuno-capturées chez les patients constituent une population mixte. Ces images de microscopie électronique sont représentatives de la population immuno-capturée dans un sérum de patient positif pour le virus de l’hépatite C, à l’aide d’un anticorps anti-glycoprotéine E2. Les grilles de microscopie électronique sont préparées avec un anticorps anti-E2, mises en contact avec le sérum contenant le virus de l’hépatite C, lavées, fixées, puis contrastées à l’acétate d’uranyle. L’observation est effectuée sous microscopie électronique en transmission (Jeol 1230). Les structures sphériques grises sans organisation interne sont les lipoprotéines ; les particules virales sont ici de plus grande taille et présentent une ultrastructure nettement définie. |
 | Figure 2.
Une organisation ultrastructurale commune est observée pour les particules virales. Le modèle d’organisation de la particule virale établi d’après les résultats de biologie moléculaire (à gauche) est comparé à l’image d’une particule virale isolée d’un patient (à droite). TmD : domaine transmembranaire. |
|
Nous savons enfin à quoi ressemble le tueur ! … à rien ! Ce virus semble donc organisé de façon complètement asymétrique, avec seulement une fraction de la surface de l’enveloppe virale présentant des glycoprotéines d’enveloppe (Figure 2) : une organisation de cette nature constitue une exception dans le monde des virus. La taille de la couche de lipides étant variable, le diamètre des particules virales est extrêmement hétérogène chez un même patient. Lorsque nous avons déterminé la répartition des particules par taille, chez plusieurs patients, nous avons constaté que celle-ci pouvait varier grandement d’un patient à l’autre. Il semble que chaque patient possède une population virale qui lui est propre. Une étude réalisée par l’équipe du Pr Margaret Bassendine, à l’université de Newcastle pourrait expliquer ce phénomène [10]. Les particules virales, présentes chez un patient donné, présentaient en effet une augmentation de taille moyenne après que celui-ci ait ingéré un repas riche en lipides… un milk-shake, en l’occurrence. Il est donc probable que, chez un même patient, la taille moyenne des particules virales puisse varier significativement au cours de la journée. Ainsi, 27 années après sa découverte, il apparaît que le virus de l’hépatite C ne possède ni forme, ni taille bien définies. Seule l’organisation ultra-structurale semble commune à toutes les particules virales. Nos travaux ont permis de révéler des caractéristiques ultrastructurales, uniques à ce jour, d’un virus qui s’est redoutablement bien adapté à son hôte principal, l’être humain. Il existe aujourd’hui des traitements efficaces (anti-protéases, anti-polymérases) qui permettent d’éradiquer le virus. Ces traitements sont cependant extrêmement onéreux et ne concernent qu’une minorité de porteurs chroniques du virus de l’hépatite C. Ainsi, un article récent [11] publié dans Science indique que, sur les 185 millions de porteurs du virus de l’hépatite C dans le monde, seul 5 % (soit environ 10 millions) sont conscients de leur infection. Et sur ces dix millions de personnes, seuls 5 % ont bénéficié des traitements disponibles. À l’échelle planétaire, ce virus est donc loin d’être éradiqué. La mise au point d’un vaccin reste donc une priorité [12] (→).
(→) Voir la Nouvelle de E. Beaumont et P. Roingeard, m/s n° 1, janvier 2014, page 33
Nos résultats, démontrant une organisation ultrastructurale spécifique du virus, pourront certainement contribuer à mieux définir les épitopes qui devront être ciblés par ce vaccin potentiel. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Les auteurs remercient la Région Centre et l’ANRS pour avoir accordé les financements de recherche indispensables à la finalisation de cette étude. Les auteurs remercient également le Dr Y. Bacq et le Dr L. d’Alteroche du service d’hépato-gastroentérologie du CHRU de Tours pour l’obtention des sérums des patients.
|
1.
Roingeard P. Viral detection by electron microscopy: past, present and future . Biol Cell. 2008; ; 100 : :491.–501. 2.
Dane DS, Cameron CH, Briggs M. Virus-like particles in serum of patients with Australia-antigen-associated hepatitis . Lancet. 1970; ; 1 : :695.–698. 3.
Feinstone SM, Kapikian AZ, Purceli RH. Hepatitis A: detection by immune electron microscopy of a viruslike antigen associated with acute illness . Science. 1973; ; 182 : :1026.–1028. 4.
Balayan MS, Andjaparidze AG, Savinskaya SS, et al. Evidence for a virus in non-A, non-B hepatitis transmitted via the fecal-oral route . Intervirology. 1983; ; 20 : :23.–31. 5.
Choo QL, Kuo G, Weiner AJ, et al. Isolation of a cDNA clone derived from a blood-borne non-A, non-B viral hepatitis genome . Science. 1989; ; 244 : :359.–362. 6.
Bartenschlager R, Penin F, Lohmann V, Andre P. Assembly of infectious hepatitis C virus particles . Trends Microbiol. 2010; ; 19 : :95.–103. 7.
Boyer A, Dumans A, Beaumont E, et al. The association of hepatitis C virus glycoproteins with apolipoproteins E and B early in assembly is conserved in lipoviral particles . J Biol Chem. 2014; ; 289 : :18904.–18913. 8.
Scholtes C, Ramiere C, Rainteau D, et al. High plasma level of nucleocapsid-free envelope glycoprotein-positive lipoproteins in hepatitis C patients . Hepatology. 2012; ; 56 : :39.–48. 9.
Piver E, Boyer A, Gaillard J, et al. Ultrastructural organization of hepatitis C virus from the bloodstream of infected patients revealed by electron microscopy after specific Immunocapture . Gut. 2017; pii: gutjnl-2016-311726.. doi: 10.1136/gutjnl-2016-311726. 10.
Felmlee DJ, Sheridan DA, Bridge SH, et al. Intravascular transfer contributes to postprandial increase in numbers of very-low-density hepatitis C virus particles . Gastroenterology. 2010;; 139 : :1774.–1783, 83 e1–6.. 11.
Cox AL. MEDICINE. Global control of hepatitis C virus . Science. 2015; ; 349 : :790.–791. 12.
Beaumont E, Roingeard P. Vers un vaccin prophylactique bivalent contre les virus des hépatites B et C ? . Med Sci (Paris). 2014; ; 30 : :33.–35. |