| |
| Med Sci (Paris). 33(8-9): 741–743. doi: 10.1051/medsci/20173308018.La myéloperoxydase : un fin stratège face à l’infection par un pathogène Manon Poret,1a Thanh Tran,1b Marie Villotte,1c and Oliver Nüsse2d 1M1 Biologie Santé, Université Paris-Saclay, 91405Orsay, France 2Laboratoire de chimie physique, UMR8000, Université Paris-Sud, CNRS, Université Paris-Saclay, 91405Orsay, France |
Polynucléaires neutrophiles et immunité innée. Lors d’une infection par un agent pathogène tel que l’entérobactérie Salmonella, une réponse immunitaire innée se met en place ; elle fait intervenir les cellules capables de phagocytose telles que les neutrophiles. Les polynucléaires neutrophiles internalisent les microorganismes dans le phagosome, qui fusionne avec les granules lysosomiaux pour former le phagolysosome à l’intérieur duquel les particules infectieuses seront digérées. Plusieurs enzymes interviennent dans la destruction du pathogène. À la membrane phagosomale, les neutrophiles activent leur NADPH oxydase pour réduire le dioxygène (O2) en ion superoxyde (O2
. -) qui sera converti en peroxyde d’hydrogène (H2O2). Une autre enzyme, la myéloperoxydase (MPO), convertit l’H2O2 en HOCl. L’O2
. -, l’H2O2 et HOCl constituent les espèces réactives de l’oxygène (ROS). Celles-ci sont responsables du stress oxydant et permettent la destruction du pathogène. Mais ce stress oxydant peut également conduire à une situation pathologique si le système de détoxification de l’hôte est saturé, car ces ROS peuvent causer des dommages collatéraux dans les tissus environnants et provoquer une inflammation. La production contrôlée des ROS apparaît aussi comme un mécanisme essentiel de la signalisation cellulaire qui participe au maintien de l’homéostasie de la cellule. |
L’action de la MPO est controversée Paradoxalement, alors que l’HOCl est un puissant agent antimicrobien, un déficit partiel en l’enzyme MPO passe souvent inaperçu chez les personnes qui en sont atteintes [1]. Pourquoi les neutrophiles expriment-ils la MPO en grande quantité si la réduction de son activité n’a que peu d’effet ? De plus, la MPO semble avoir des effets délétères dans certaines maladies cardiovasculaires comme l’athérosclérose [2], et des inhibiteurs de l’enzyme sont développés dans un but thérapeutique. Dans un article paru dans Nature Microbiology [3], l’équipe de Dirk Bumannen, se fondant sur les travaux de Winterbourn et al. [4], a développé un modèle mathématique de la production et de la fuite des ROS dans un neutrophile stimulé par Salmonella afin de mieux comprendre l’action de la MPO. La modélisation révèle qu’en absence de MPO, la conversion en HOCl n’étant plus possible, le ROS majoritaire au sein du phagosome n’est autre que l’H2O2. Ce dernier va, dans un premier temps, éliminer le pathogène, puis il s’accumule dans le phagosome. Du fait de sa stabilité relative, H2O2 diffuse hors du phagosome. Lorsque la MPO est présente en concentration normale, la conversion de H2O2 en HOCl est efficace et peu d’H2O2 fuit hors du phagosome. L’HOCl a une distance de diffusion d’environ 30 nm, son action est donc confinée à l’intérieur du phagosome. Grâce à ces deux paramètres, conversion efficace de H2O2 en HOCl et action locale de HOCl, Salmonella est éliminée par HOCl et non pas par H2O2. En transformant un agent microbicide (H2O2) en un autre plus efficace et de localisation restreinte (HOCl), le rôle de la MPO consisterait ainsi à confiner l’action des ROS dans le phagosome. |
La MPO contrôle la production de H2O2 dans les infections à SalmonellaAfin de tester la pertinence physiologique de son modèle informatique, l’équipe de Dirk Bumann [3] stimule des neutrophiles humains par Salmonella et analyse la production des ROS. Dans les neutrophiles d’individus déficients en myéloperoxydase, la diminution de l’activité de la MPO est corrélée de façon inverse à l’augmentation de la fuite de H2O2, ce qui confirme la modélisation informatique. Des résultats similaires sont obtenus si on utilise des bactéries tuées avant d’être mises au contact des neutrophiles, ou un pathogène fongique, Candida albicans, capable de détoxifier les ROS. La fuite d’H2O2 est donc indépendante des capacités antioxydantes du pathogène. Par la suite, les auteurs ont utilisé un modèle murin de fièvre typhoïde car cette maladie infectieuse - très répandue dans les pays en voie de développement - est directement déclenchée par le pathogène Salmonella. Afin d’analyser s’il existe un lien entre l’infection par Salmonella et la présence d’H2O2, l’équipe a utilisé un biosenseur de H2O2 spécifique de Salmonella [5]. Il s’agit d’une souche de Salmonella qui exprime la green fluorescent protein (GFP) sous contrôle du promoteur de la catalase katGp de Salmonella. L’activité de ce promoteur est contrôlée par le facteur de transcription OxyR qui est activé par l’H2O2 [5]. La souche exprime également de façon constitutive la protéine fluorescente m-Cherry. Ainsi, en présence de salmonelles vivantes, il y aura émission de fluorescence rouge et, si Salmonella se trouve en présence de H2O2, émission de fluorescence rouge et de fluorescence verte. Lorsque cette souche Salmonella biosenseur est injectée à des souris déficientes en MPO et à des souris sauvages, la fluorescence verte est plus importante dans la rate des premières que des secondes, indiquant une plus forte concentration de H2O2. Il a été montré également que la majorité des salmonelles vertes ne se trouvaient pas dans les neutrophiles mais dans les macrophages, ce qui est surprenant car, contrairement aux neutrophiles, les macrophages n’expriment pas la MPO [6]. Cette observation suggère que le H2O2, fuyant les neutrophiles déficients en MPO, diffuse dans le tissu environnant pour atteindre les macrophages et y activer le biosenseur de Salmonella. De plus, chez les souris déficientes en MPO, les auteurs décrivent un taux plus élevé de lipides peroxydés et de lésions de l’ADN, témoignant d’un stress oxydant plus important. Les ROS peuvent donc provoquer des dommages collatéraux à moins que la MPO ne les confine dans le phagosome.
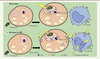 | Figure 1.
Production et diffusion des ROS en présence (A) ou absence (B) de MPO. Lorsqu'un individu est infecté par la bactérie Salmonella, les polynucléaires ingèrent le pathogène. La fusion avec les granules lysosomiaux présents dans la cellule et contenant la MPO et la NADPH oxydase va conduire à la formation du phagolysosome. La NADPH oxydase ancrée à la membrane de ce dernier permet la transformation de l'oxygène en ion superoxyde (O2.-); qui sera converti en peroxyde d'hydrogène (H2O2). A. Chez les individus avec un taux de MPO normal, le H2O2 est converti en HOCl et l'attaque oxydative par ce ROS reste localisée. B. Chez les individus dépourvus ou possèdant peu de MPO, le H2O2 n'est pas converti en HOCl et diffuse en dehors des neutrophiles pour atteindre les macrophages résidents, provoquant un stress oxydatif aux sites d'infection.
|
|
Le bon et le mauvais côté de la MPO En conclusion, la MPO joue un rôle majeur dans l’atténuation des lésions tissulaires collatérales lors d’attaques antimicrobiennes oxydantes, en convertissant H2O2 en HOCl hautement réactif, microbicide et localement confiné au phagosome. L’augmentation des dommages oxydatifs pendant les infections chez les patients déficients en MPO pourrait avoir des conséquences néfastes cumulatives au cours de la vie d’un individu. Si ces dommages se répètent, ils pourraient contribuer à l’émergence de différentes maladies, comme les maladies neurodégénératives et le cancer dans le cas d’une carence totale en MPO [7]. Toutefois, ces effets néfastes ne sont apparents que chez des patients dont la déficience en cette enzyme est sévère ou totale, une occurrence beaucoup plus rare que celle des patients ayant une déficience en MPO légère. Cependant, les études sur la déficience en MPO ont été menées dans des pays industrialisés où le taux d’infection est faible, et la situation pourrait être différente dans des pays où les infections sont plus fréquentes. Par ailleurs, certains types d’infection provoquent la mort des neutrophiles [8], conduisant au relargage de la MPO dans l’espace extracellulaire. L’augmentation des concentrations de MPO extracellulaire serait à l’origine de la peroxydation des lipides [9] et d’autres dommages collatéraux, faisant le lit des pathologies auto-immunes avec production d’anticorps anti-MPO. Il reste donc des points à éclaircir quant au rôle de la MPO : cette enzyme semble être un mécanisme de contrôle des dommages collatéraux des ROS mis en place par l’immunité innée. En se fixant à la surface des pathogènes et en catalysant la formation de HOCl par l’H2O2, elle permet de cibler de façon précise l’attaque oxydative des ROS contre le pathogène. Mais la balance bénéfice-risque reste très sensible et l’utilisation d’inhibiteurs de la MPO - comme ceux qui sont préconisés pour prévenir l’athérosclérose - pourrait avoir des effets secondaires en cas d’infections répétées par des pathogènes. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Klebanoff SJ, Kettle AJ, Rosen H, et al. Myeloperoxidase: a front-line defender against phagocytosed microorganisms . J Leukoc Biol. 2013; ; 93 : :185.–198. 2.
Ruggeri RB, Buckbinder L, Bagley SW, et al. Discovery of 2-(6-(5-chloro-2-methoxyphenyl)-4-oxo-2- thioxo-3,4-dihydropyrimidin-1(2H)-yl) acet amide (PF-06282999): a highly selective mechanism-based myeloperoxidase inhibitor for the treatment of cardiovascular diseases . J Med Chem. 2015; ; 58 : :8513.–8528. 3.
Schürmann N, Forrer P, Casse O, et al. Myeloperoxydase targets oxidative host attacks to Salmonella and prevents collateral tissue damage . Nat Microbiol. 2017; ; 2 : :16268.. 4.
Winterbourn CC, Hampton MB, Livesey JH, et al. Modeling the reactions of superoxide and myeloperoxidase in the neutrophil phagosome: implications for microbial killing . J Biol Chem. 2006; ; 281 : :39860.–39869. 5.
Lee C, Lee SM, Mukhopadhyay P, et al. Redox regulation of OxyR requires specific disulfide bond formation involving a rapid kinetic reaction path . Nat Struct Mol Biol. 2004; ; 11 : :1179.–1185. 6.
Swirski FK, Wildgruber M, Ueno T, et al. Myeloperoxidase-rich Ly-6C+ myeloid cells infiltrate allografts and contribute to an imaging signature of organ rejection in mice . J Clin Invest. 2010; ; 120 : :2627.–2634. 7.
Lanza F. Clinical manifestation of myeloperoxidase deficiency . J Mol Med (Berl). 1998; ; 76 : :676.–681. 8.
Kolaczkowska E, Koziol A, Plytycz B, et al. Inflammatory macrophages, and not only neutrophils, die by apoptosis during acute peritonitis . Immunobiology. 2010; ; 215 : :492.–504. 9.
Zhang R, Brennan ML, Shen Z, et al. Myeloperoxidase functions as a major enzymatic catalyst for initiation of lipid peroxidation at sites of inflammation . J Biol Chem. 2002; ; 277 : :46116.–46122. |