| |
| Med Sci (Paris). 33(8-9): 744–747. doi: 10.1051/medsci/20173308019.Le neutrophile : un agent infiltré aux nouvelles compétences antitumorales Julie Mazet1* and Marie-Cécile Michallet2** 1Master cancer, ISPB (institut des sciences pharmaceutiques et biologiques) - Université Claude Bernard Lyon 1 2Université Lyon, Université Claude Bernard Lyon 1, Inserm 1052, CNRS 5286, centre Léon Bérard, centre de recherche en cancérologie de Lyon, Lyon, 69008, France |

Master cancer, ISPB Lyon
Responsable du module
Julien Marie (julien.marie@inserm.fr)
Département immunologie, virologie et inflammation, centre de recherche en cancérologie de Lyon, bâtiment Cheney A, 5e étage, 69373 Lyon Cedex 08, France. Le système immunitaire nous protège efficacement contre les pathogènes lors d’infections. Mais qu’en est-il lorsque la menace provient de l’intérieur, du soi devenu néfaste : lors de cancers ? Certaines réponses immunitaires comme l’inflammation ont été décrites comme favorisant la progression tumorale [1], alors que d’autres sont plutôt antitumorales, en particulier l’immunosurveillance [2]. Associées à ces réponses, certaines populations immunitaires peuvent présenter une dualité fonctionnelle comme par exemple les polynucléaires neutrophiles. Les neutrophiles font partie des acteurs de l’immunité innée et constituent notre première ligne de défense. Dans des modèles murins de cancers, les neutrophiles ont été décrits comme infiltrant les tumeurs - d’où le nom de TAN (tumor-associated neutrophils) - avec une polarisation de type N1 (antitumorale) ou N2 (protumorale) [3], parallèle évident avec les macrophages M1/M2 [4]. Dans le premier cas (type N1), les neutrophiles sont capables d’induire la lyse directe des cellules tumorales ainsi que le recrutement de cellules immunitaires via la sécrétion de différents facteurs tels que les CC-chimiokines, l’IL-8 (interleukine-8) ou l’IFN-γ (interféron-gamma) [5]. À l’inverse (type N2), ils peuvent dégrader la matrice extracellulaire, favoriser les métastases, stimuler la croissance cellulaire tumorale ou encore induire l’angiogenèse [6]. Cependant, à ce jour, il n’y a que peu d’arguments en faveur d’un rôle antitumoral des TAN chez l’homme. C’est l’objet de l’étude publiée par l’équipe de E.B. Eruslanov dans Cancer Cell en 2016 [7], qui démontre un rôle antitumoral des TAN, lié à l’acquisition d’une nouvelle propriété fonctionnelle. |
Les neutrophiles : agents rapides et efficaces Les neutrophiles sont des phagocytes professionnels très rapidement recrutés sur le site inflammatoire, indispensables aux phases précoces de la réponse immunitaire. Une fois dans les tissus, leur durée de vie est limitée à quelques jours ; cette courte existence est due à leur fonction de clairance des pathogènes trop gourmande en énergie, conduisant à leur sacrifice. Ils sont produits dans la moelle osseuse à raison de 1012 par jour en cas d’infection, ce qui fait d’eux la population leucocytaire majoritaire (50-70 %) chez l’homme. La capacité cytotoxique des neutrophiles dépend de trois mécanismes principaux : la phagocytose, facilitée via leurs récepteurs d’opsonisation1 (FcγR [récepteur de la fraction Fc des immunoglobulines] ou récepteurs lectine C), la production de ROS (reactive oxygen species) et la fusion de granules contenant des peptides antimicrobiens au phagosome [8]. Les neutrophiles ont leur propre forme de mort cellulaire, la NETose, libérant localement des structures particulières (NET : neutrophil extracellular traps) formées de chromatine et de protéines antimicrobiennes, ce qui permet de contenir localement le pathogène lors d’une infection [9]. |
Des neutrophiles infiltrés tumoraux aux caractéristiques hybrides Dans l’article qu’elle a publié [7], l’équipe de E.B. Eruslanov a mis en évidence la présence de neutrophiles infiltrés dans des tumeurs pulmonaires à des stades précoces chez l’homme. Ces TAN présentent des caractéristiques phénotypiques inédites de cellules présentatrices d’antigènes (CPA), leur conférant un potentiel antitumoral [7]. Grâce à la disponibilité d’échantillons de tumeurs pulmonaires précoces, des prélèvements de moelle osseuse et de sang frais de patients, les auteurs ont pu caractériser cette sous-population de TAN sur un plan phénotypique et fonctionnel, et définir leur origine. À l’aide de la cytométrie en flux2,, les auteurs ont montré que ces TAN expriment des marqueurs spécifiques de CPA tels que la molécule HLA-DR. Ces molécules sont indispensables à la présentation antigénique et à l’activation de la réponse immunitaire adaptative dépendante des lymphocytes. Ceux-ci deviennent alors capables de reconnaître et d’éliminer spécifiquement les cellules tumorales par des mécanismes cytotoxiques. L’analyse plus exhaustive de cette nouvelle sous-population de TAN révèle un phénotype dit « hybride » que caractérisent des marqueurs et des fonctions partagés par les neutrophiles et les CPA [7]. |
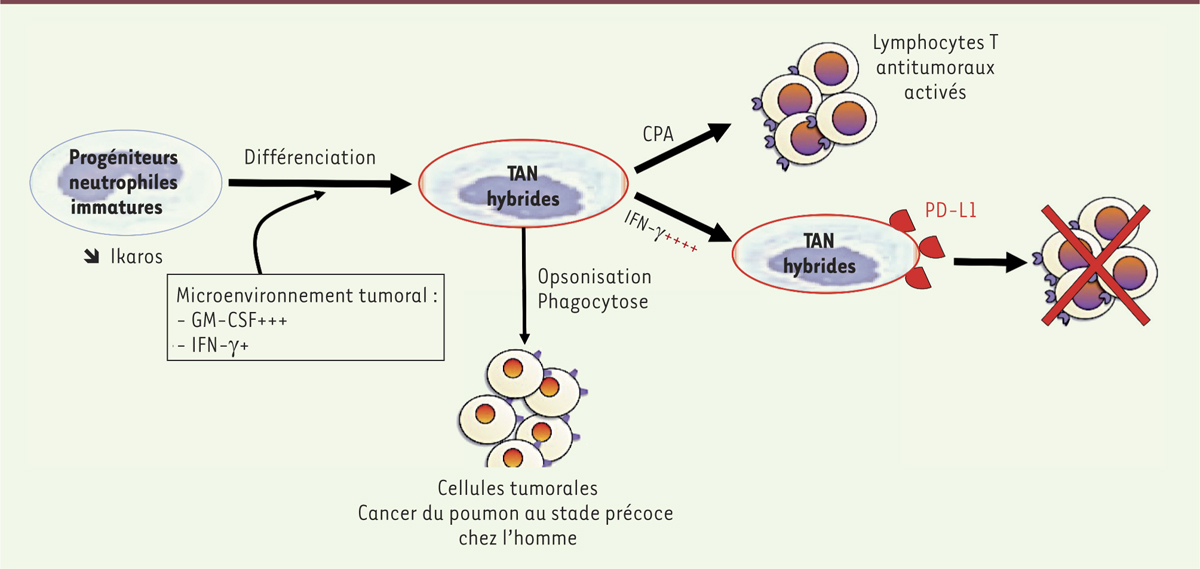
Origine de ces neutrophiles infiltrés : recrutement ou différenciation locale ? Différentes expériences ont été menées afin d’identifier l’origine de ces TAN hybrides [7]. Sont-ils recrutés au sein de la tumeur ou se différencient-ils sur place à partir d’une population progénitrice ? Le système immunitaire est une entité dynamique, composée de différents organes lymphoïdes primaires, secondaires et tertiaires. Les cellules immunitaires sont générées à partir de cellules souches hématopoïétiques dans la moelle osseuse. Une fois matures, elles cheminent entre les circulations sanguine et lymphatique afin de surveiller l’organisme entier, en attendant leur activation suivie de leur différenciation terminale. La dimension spatio-temporelle est essentielle dans la mise en place de la réponse immunitaire. L’analyse de surnageants tumoraux a permis de mettre en évidence deux cytokines agissant de manière synergique sur le développement des TAN hybrides : l’IFN-γ et le GM-CSF (granulocyte macrophage colony-stimulating factor). Cependant, il est à noter que la concentration d’IFN-γ est déterminante pour la fonction antitumorale des TAN hybrides, elle doit être faible. Cette cytokine inflammatoire est connue pour être sécrétée pendant la réponse immunitaire, notamment lors d’infections virales, afin d’agir comme agent cytotoxique sur les cellules infectées. Dans notre modèle, une forte concentration d’IFN-γ induit l’expression de PD-L1 (programmed death-ligand 1) à la surface des TAN de phénotype hybride, leur conférant une activité suppressive des lymphocytes T et donc un rôle protumoral. Différentes expériences in vitro ont montré que les TAN de phénotype hybride pouvaient se différencier à partir de toutes les sous-populations progénitrices immatures de neutrophiles présentes dans la moelle osseuse [7]. En effet, la différenciation des TAN hybrides semble impossible à partir de neutrophiles matures, ce qui corrobore l’hypothèse d’une différenciation de progéniteurs in situ dans le microenvironnement tumoral. Enfin, les résultats montrent que le facteur de transcription Ikaros – qui est indispensable à la différenciation lymphoïde et impliqué dans l’inhibition du lignage monocyte/macrophage chez la souris – est un régulateur négatif de la différenciation des TAN hybrides [10]. Nous comprenons donc que la différenciation de ces agents infiltrés semble se faire sur place, après que les précurseurs immatures aient été recrutés dans la tumeur à partir de la moelle osseuse. Elle se fait via des voies intracellulaires répondant à des stimulus externes conditionnés par la tumeur. |
Des cellules infiltrées au phénotype hybrique et aux capacités antitumorales Afin d’évaluer la capacité des TAN hybrides à activer des lymphocytes T antitumoraux, les auteurs ont utilisé une lignée cellulaire d’adénocarcinome pulmonaire génétiquement modifiée pour exprimer un antigène de cancer testiculaire humain. Ces cellules ont été cocultivées en présence de lymphocytes T exprimant le récepteur spécifique de cet antigène tumoral. Lorsque ces deux populations cellulaires sont mises en présence de TAN hybrides, une augmentation de production d’IFN-γ et de granzyme B est observée, témoin de l’activation des lymphocytes T CD8 effecteurs cytotoxiques antitumoraux. Les auteurs ont ensuite démontré que les TAN de phénotype hybride pouvaient effectuer une présentation croisée des antigènes tumoraux (cross-presentation) en réponse à la phagocytose facilitée par la capture des cellules tumorales opsonisées par des molécules du complément ou par des IgG (qui représentent alors des complexes immuns3,). La présentation croisée est une fonction indispensable à la mise en place d’une réponse T cytotoxique antitumorale [7]. |
Dans cet article, les auteurs mettent en évidence une nouvelle sous-population de neutrophiles antitumoraux présents aux stades précoces de cancer du poumon non à petites cellules chez l’homme. Ces TAN hybrides semblent être différenciés à partir de précurseurs recrutés dans la tumeur en présence d’un microenvironnement particulier. Ainsi, la présence de GM-CSF et d’une faible concentration d’IFN-γ permet la différenciation des TAN hybrides, régulée par la diminution du facteur de transcription Ikaros (Figure 1). Ces nouveaux « acteurs infiltrés » dans ce type de tumeurs ont un rôle antitumoral et pourraient être des indicateurs de bon pronostic, ou pourraient être bénéfiques pour le patient, par leur capacité de présentation croisée d’antigènes tumoraux, déclenchant ainsi une réponse immunitaire adaptative spécifique via l’activation de lymphocytes T CD8 cytotoxiques. Cependant, il est à noter que l’effet dose-dépendant de l’IFN-γ peut inverser la balance, puisqu’à concentration élevée, l’IFN-γ induit l’expression de PD-L1 à la surface des TAN hybrides, inhibant la réponse lymphocytaire T antitumorale (Figure 1). Néanmoins, l’identification de cette sous-population de neutrophiles antitumoraux ouvre de nouvelles perspectives thérapeutiques. La caractérisation du microenvironnement tumoral reste également un défi majeur dans la régulation des fonctions anti- ou protumorales des cellules immunitaires présentes dans la tumeur telles que les TAN4. Enfin, la dynamique des cellules immunitaires ainsi que leurs interactions dans le microenvironnement tumoral demeurent un large champ d’investigation dans la lutte contre le cancer.
 | Figure 1.
Identification et caractérisation de TAN (tumor-asssociated neutrophil) ayant un phénotype hybride dans des tumeurs pulmonaires à des stades précoces. La présence d’IFN-γ et de GM-CSF dans le microenvironnement tumoral engendre la différenciation de progéniteurs immatures en neutrophiles infiltrés de phénotype hybride (TAN de phénotype hybride). La diminution d’expression du facteur de transcription Ikaros est également impliquée dans ce processus de différenciation. Une fois différenciés, les TAN de phénotype hybride seraient capables de phagocyter des cellules tumorales et de présenter des antigènes tumoraux par un mécanisme de présentation croisée (CPA : cellule présentatrice d’antigène). Ainsi, les lymphocytes T CD4 et T CD8 spécifiques de la tumeur peuvent être activés et induire une réponse immunitaire adaptative antitumorale efficace. Cependant, si des concentrations élevées d’IFN-γ sont présentes dans le microenvironnement tumoral, l’induction de l’expression de PD-L1 à la surface des TAN hybrides inhibe leur fonction antitumorale. |
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Coussens LM, Werb Z. Inflammation and cancer . Nature. 2002; ; 420 : :860.–867. 2.
Iannello A, Thompson TW, Ardolino M, et al. Immunosurveillance and immunotherapy of tumors by innate immune cells . Curr Op Immunol. 2016; ; 38 : :52.–58. 3.
Powell DR, Huttenlocher A. Neutrophils in the tumor microenvironment . Trends Immunol. 2016; ; 72 : :41.–52. 4.
Sica A, Erreni M, Allavena P, et al. Macrophage polarization in pathology . Cell Mol Life Sci. 2015; ; 72 : :4111.–4126. 5.
Selders GS, Fetz AE, Radic MZ, et al. An overview of the role of neutrophils in innate immunity, inflammation and host-biomaterial integration . Regen Biomater. 2017; ; 4 : :55.–68. 6.
Murdoch C, Muthana M, Coffelt SB, et al. The role of myeloid cells in the promotion of tumour angiogenesis . Nat Rev Cancer. 2008; ; 8 : :618.–631. 7.
Singhal S, Bhojnagarwala PS, O’Brien S, et al. Origin and role of a subset of tumor-associated neutrophils with antigen-presenting cell features in early-stage human lung cancer . Cancer Cell. 2016; ; 30 : :120.–135. 8.
Mayadas TN, Cullere X, Lowell CA. The multifaceted functions of neutrophils . Annu Rev Pathol. 2014; ; 9 : :181.–218. 9.
Yipp BG, Kubes P. NETosis: how vital is it? . Blood. 2013; ; 122 : :2784.–2794. 10.
Dumortier A, Kirstetter P, Kastner P, et al. Ikaros regulates neutrophil differentiation . Blood. 2003; ; 101 : :2219.–2226. |