| |
| Med Sci (Paris). 33(10): 856–859. doi: 10.1051/medsci/20173310014.Fibromoduline, stress oxydant, et régulation de la fibrose hépatique Adelin Rouchon1* and Eve-Isabelle Pécheur2** 1Master de cancérologie, module d’immunologie - virologie, université de Lyon, université Claude Bernard Lyon 1, Lyon, France 2Université de Lyon, Université Claude Bernard Lyon 1, CNRS 5286, Inserm U 1052, centre de recherche en cancérologie de Lyon, 151, cours Albert Thomas, 69003Lyon, France MeSH keywords: Animaux, Modèles animaux de maladie humaine, Fibromoduline, Foie, Cirrhose du foie, Souris, Stress oxydatif, métabolisme, anatomopathologie, physiologie |
La fibrose du foie est souvent observée chez les patients infectés par le virus de l’hépatite C1 ou ayant une consommation excessive d’alcool. Le processus de fibrose est une réaction physiologique engagée pour réparer une « blessure » hépatique. Mal régulé, il devient pathologique. Phénotypiquement, la fibrose correspond à une augmentation de la rigidité de la matrice extracellulaire (MEC) due à un dépôt en quantité excessive de collagène de type I qui forme des fibrilles. Cette cicatrisation incontrôlée empêche le foie de remplir ses fonctions physiologiques. Une fibrose hépatique chronique peut aboutir à une cirrhose et, à long terme, faciliter le développement d’un cancer. Les cancers du foie sont les seconds cancers les plus meurtriers : leur incidence mondiale était de 782 000 en 2012, et le taux de survie à 5 ans est de 19 %. La compréhension des événements moléculaires liés au développement de la fibrose hépatique est donc un prérequis pour envisager une prévention de ce cancer. La fibromoduline, un protéoglycane sécrété et produit majoritairement par les cellules stellaires hépatiques, intervient dans l’organisation de la MEC en favorisant l’association des filaments de collagène de type I [1, 2]. Son implication dans la fibrose n’est pas encore parfaitement comprise, mais sa fonction en fait une cible thérapeutique. |
Surexpression de la fibromoduline dans des modèles murins de fibrose hépatique Afin de déterminer le lien entre expression de la fibromoduline et développement d’une fibrose, trois modèles ont été utilisés chez la souris : la ligature du canal biliaire, l’injection répétée à long terme de tétrachlorure de carbone (CCl4) et l’administration per os de thioacétamide [3, 4]. Quel que soit le modèle, la fibromoduline est significativement plus abondante chez les souris fibrotiques que chez les souris saines [5]. Dans le foie, les cellules stellaires hépatiques, les hépatocytes et les cellules endothéliales sinusoïdales expriment et sécrètent la fibromoduline, et ce de manière plus importante dans le modèle de fibrose induite par le CCl4 [5]. Ceci souligne l’influence du stress hépatique, correspondant ici à une perte d’homéostasie liée aux blessures occasionnées par le CCl4, sur la synthèse et la sécrétion de fibromoduline par ces types cellulaires. Dans les trois modèles, les cellules stellaires hépatiques sont les principales productrices et sécrétrices de fibromoduline, tandis que la contribution des cellules endothéliales sinusoïdales est minoritaire [5]. |
Le stress oxydant : un régulateur de la fibromoduline Les lésions cellulaires, comme celles qu’engendre une fibrose hépatique, s’accompagnent d’une production d’espèces réactives de l’oxygène (ROS). Ces radicaux libres sont toxiques pour les cellules dont ils provoquent la mort à fortes concentrations [6]. À faibles concentrations, ils agissent comme signaux d’échange et de communication [7]. L’addition in vitro à des cellules stellaires hépatiques d’une faible dose d’H2O2, un type de ROS, induit l’expression et la sécrétion de fibromoduline [5]. Au contraire, la co-injection à des souris de CCl4 et de S-adénosylméthionine, un antioxydant dégradant les ROS via le glutathion, diminue de moitié la quantité de fibromoduline sécrétée et l’étendue de la fibrose observées chez les souris traitées par CCl4 seul [7]. L’expression de fibromoduline est donc sensible à un stress oxydant. |
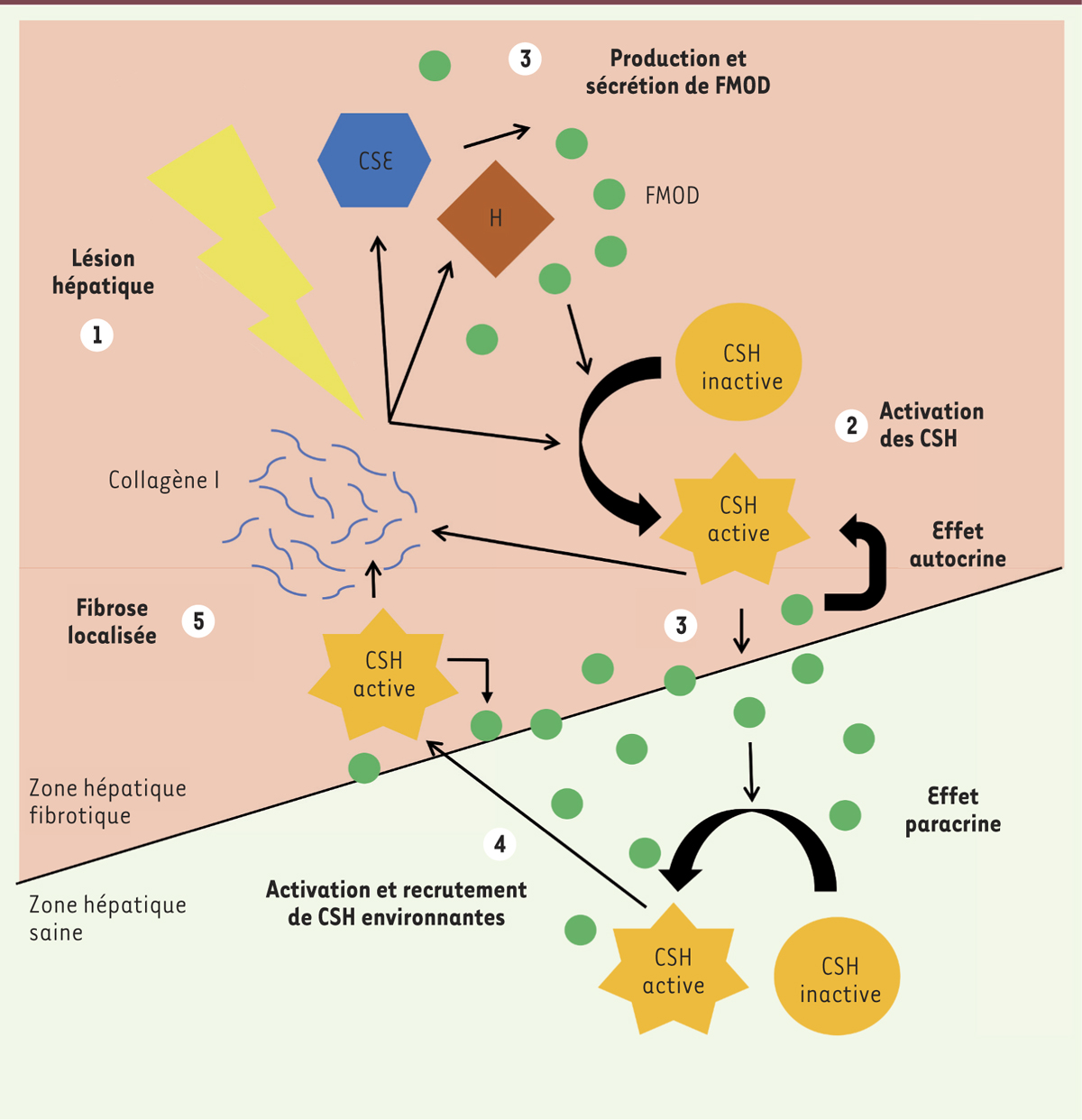
La fibromoduline active les cellules stellaires hépatiques et agit comme une molécule chimioattractante 2
La fibromoduline extracellulaire favorise la fibrose en permettant l’assemblage des fibrilles de collagène I dans la MEC [1, 2]. Une fois activées, les cellules stellaires expriment l’α-smooth muscle actin (α-SMA)3 [9] et surexpriment le collagène de type I et la fibromoduline. Celle-ci agit ensuite via une signalisation autocrine et paracrine, et entretient la surexpression de collagène I et la stimulation des cellules stellaires [5], dont l’activation prolongée augmente la prolifération. Une boucle d’activation s’installe (
Figure 1
). Hépatocytes et cellules endothéliales sinusoïdales, sources de fibromoduline, favorisent aussi l’activation des cellules stellaires et amplifient le processus de fibrose. La fibromoduline sécrétée agit également comme un chimioattractant et guide la relocalisation des cellules stellaires au niveau de la blessure [5]. Bien que les cascades de signalisation induites par ce protéoglycane restent inconnues, il est capable d’induire une réponse fibrotique pleinement active et localisée aux zones lésées. De plus, ces fonctions sont conservées dans d’autres pathologies comme les gliomes4, où la fibromoduline est nécessaire à la migration des cellules de la tumeur primaire [10]. Cibler la fibromoduline pourrait donc s’avérer être une approche thérapeutique intéressante dans un large spectre de pathologies.
 | Figure 1.
Le processus de fibrose hépatique est régulé par la fibromoduline. Les différents acteurs cellulaires et moléculaires ainsi que les étapes chronologiques menant à une fibrose hépatique localisée sont représentés. CSH : cellule stellaire hépatique ; H : hépatocyte ; FMOD : fibromoduline ; CES : cellules endothéliales sinusoïdales. |
|
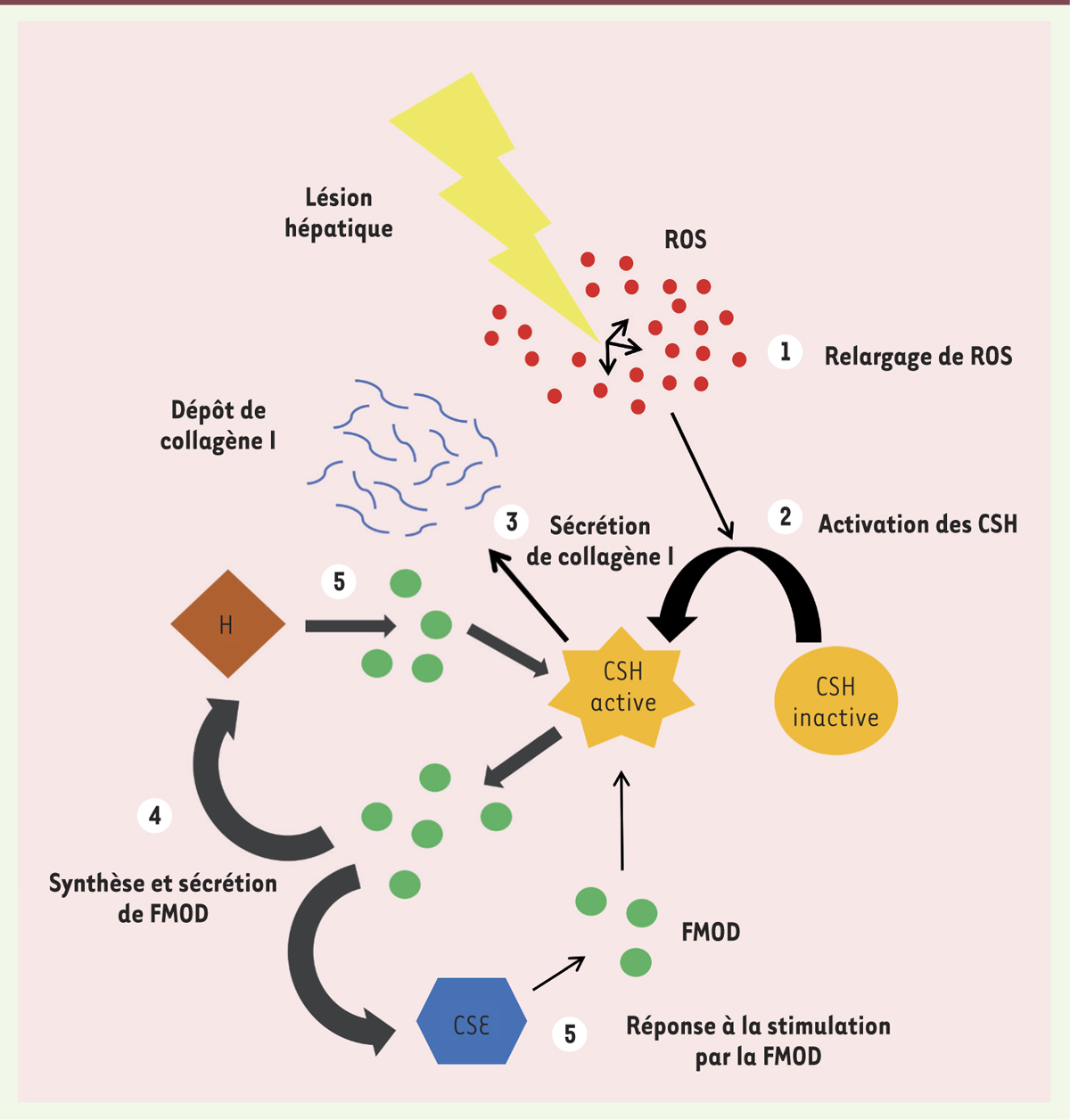
La coopération entre hépatocytes, cellules stellaires du foie et cellules endothéliales sinusoïdales contribue au phénotype profibrogénique Au sein d’un organe, les échanges entre différents types cellulaires sont essentiels à l’homéostasie. Ainsi, lorsque des cellules stellaires sont cocultivées avec soit des hépatocytes, soit des cellules endothéliales sinusoïdales primaires isolés d’animaux normaux, leur production de fibromoduline et de collagène de type I est plus élevée que dans les monocultures. Dans ces deux types de cocultures, l’expression d’α-SMA augmente dans les cellules stellaires, signant leur activation. Toutefois, la sécrétion de fibromoduline et de collagène I n’est augmentée que dans les cocultures de cellules stellaires et d’hépatocytes [5]. Ainsi, le dialogue qui se met en place entre cellules stellaires et hépatocytes, ainsi qu’entre cellules stellaires et cellules endothéliales sinusoïdales, active les premières, y induit un profil pro-fibrogénique, et stimule la production de fibromoduline et de collagène I intra- et extra-cellulaire (
Figure 2
).
 | Figure 2.
Le dialogue entre cellules du foie, orchestré par les ROS, amplifie les effets profibrogéniques de la fibromoduline. CSH : cellule stellaire hépatique ; H : hépatocyte ; CES : cellule endothéliale sinusoïdale ; FMOD : fibromoduline ; ROS : espèces réactives de l’oxygène. |
Les ROS pouvant agir comme des molécules de signalisation, leur implication dans ce dialogue cellulaire a été suspectée. De fait, la concentration extracellulaire de ROS dans les cocultures est supérieure à celle des monocultures. De plus, un traitement à la catalase - une enzyme dégradant les ROS - entraîne une quasi extinction de l’expression et de la sécrétion de fibromoduline et de collagène I par les cellules stellaires et les hépatocytes, indiquant que c’est via les ROS que s’instaure le dialogue entre ces types cellulaires [5]. Par ce rôle de médiateur, les ROS interviendraient lors de la phase initiale d’établissement de la fibrose (
Figure 2
). |
La fibromoduline est une cible thérapeutique avérée chez la souris Pour déterminer si la fibromoduline est une cible thérapeutique dans les pathologies fibrosantes, des souris sauvages ou des souris dont le gène Fmod a été préalablement inactivé (souris transgéniques Fmod
-/-) ont été traitées, soit par injection de CCl4, soit par ligature du canal biliaire. En l’absence de fibromoduline (souris Fmod
-/-), il n’y a ni dépôt de collagène, ni activation des cellules stellaires, ni inflammation [5] ; les souris sont protégées de la fibrose, confirmant le rôle central de ce protéoglycane dans ce type de pathologies. Inhiber la fibromoduline, par une stratégie de type immunothérapie, pourrait s’avérer efficace pour résorber la fibrose ou protéger le foie. Cependant, de plus amples recherches seront encore nécessaires avant d’envisager le développement de telles stratégies thérapeutiques. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Rydell-Törmänen K, Andréasson K, Hesselstrand R, et al. Absence of fibromodulin affects matrix composition, collagen deposition and cell turnover in healthy and fibrotic lung parenchyma . Sci Rep. 2014; ; 4 : :6383.. 2.
Kalamajski S, Bihan D, Bonna A, et al. Fibromodulin interacts with collagen cross-linking sites and activates lysyl oxidase . J Biol Chem. 2016; ; 291 : :7951.–7960. 3.
Delire B, Stärkel P, Leclercq I. Animal models for fibrotic liver diseases: what we have, what we need, and what is under development . J Clin Transl Hepatol. 2015; ; 3 : :53.–66. 4.
Crespo Yanguas S, Cogliati B, Willebrords J, et al. Experimental models of liver fibrosis . Arch Toxicol. 2016;; 90 : :1025.–1048. 5.
Mormone E, Lu Y, Ge X, et al. Fibromodulin, an oxidative stress-sensitive proteoglycan, regulates the fibrogenic response to liver injury in mice . Gastroenterology. 2012; ; 142 : :612.–621. 6.
Orrenius S, Gogvadze V, Zhivotovsky B. Mitochondrial oxidative stress: implications for cell death . Annu Rev Pharmacol Toxicol. 2007; ; 47 : :143.–183. 7.
Noctor G, Foyer C. Intracellular redox compartmentation and ROS-related communication in regulation and signaling . Plant Physiol. 2016; ; 171 : :1581.–1592. 8.
Urtasun R, Lopategi A, George J, et al. Osteopontin, an oxidant stress-sensitive cytokine, up- regulates collagen-1 via integrin alpha(V) beta(3) engagement and PI3K-pAkt-NFkappaB signaling . Hepatology. 2012; ; 55 : :594.–608. 9.
DeLeve L, Wang X, Guo Y. Sinusoidal endothelial cells prevent rat stellate cell activation and promote reversion to quiescence . Hepatology. 2008; ; 48 : :920.–930. 10.
Mondal B, Patil V, Shwetha SD, et al. Integrative functional genomic analysis identifies epigenetically regulated fibromodulin as an essential gene for glioma cell migration . Oncogene. 2017; ; 36 : :71.–83. |