| |
| Med Sci (Paris). 33(10): 859–862. doi: 10.1051/medsci/20173310015.Rôle protumoral des lymphocytes B dans le cancer du pancréas Vers de nouvelles pistes thérapeutiques ? Carolane Seiller1* and Bertrand Dubois2** 1Master de cancérologie, module d’immunologie-virologie, université de Lyon, université Claude Bernard Lyon 1, Lyon, France 2Université de Lyon, Université Claude Bernard Lyon 1, Inserm U1052, CNRS 5286, centre Léon Bérard, centre de recherche en cancérologie de Lyon, 69008Lyon, France MeSH keywords: Animaux, Lymphocytes B, Carcinome du canal pancréatique, Cytokines, Évolution de la maladie, Humains, Tumeurs du pancréas, métabolisme, anatomopathologie, immunologie |
À l’origine de 8,2 millions de décès chaque année dans le monde, le cancer est un enjeu majeur de santé publique. Pour y répondre, il est essentiel de comprendre les mécanismes qui régissent son émergence et sa progression afin d’identifier de nouvelles cibles thérapeutiques. Le système immunitaire est reconnu comme un acteur majeur, capable d’exercer un rôle soit antitumoral, soit protumoral, en fonction de l’identité des populations de cellules immunitaires infiltrant la tumeur ainsi que des stades de la maladie. Les cellules NK (natural killer) et les LT (lymphocyte T) CD8+ cytotoxiques jouent ainsi un rôle antitumoral dans plusieurs cancers [1]. À l’inverse, les Treg (lymphocytes T régulateurs), les cellules myéloïdes suppressives et les TAM (tumor associated macrophages) favorisent la progression tumorale, en particulier par leur production d’IL-10 (interleukine 10)1. Longtemps négligé, le rôle des LB (lymphocytes B) reste débattu. Si leur présence dans le microenvironnement tumoral est associée à un meilleur pronostic dans de nombreux cancers, elle peut aussi favoriser la progression tumorale [2, 3]. Trois articles publiés en 2016 dans la revue Cancer Discovery décrivent le rôle protumoral des LB dans le cancer du pancréas le plus répandu, l’adénocarcinome canalaire pancréatique ou PDAC (pancreatic ductal adenocarcinoma), qui touche les cellules épithéliales des canaux pancréatiques (
Figure 1
). C’est l’un des cancers au pronostic le plus défavorable – le taux de survie à cinq ans des patients est inférieur à 6 % - en raison du diagnostic souvent tardif et du peu d’options thérapeutiques. Dans la majorité des cas, l’événement initial inducteur est une mutation dans le gène KRAS (Kirsten rat sarcoma viral oncogene homolog), qui conduit à la substitution dans la séquence primaire d’une glycine par un acide aspartique en position 12 (KRASG12D). Des lésions précancéreuses appelées PanIN (pancreatic intraepithelial neoplasia) précèdent le développement de l’adénocarcinome canalaire. La chirurgie étant souvent impossible, le traitement de référence est la chimiothérapie à base de gemcitabine, un agent endommageant l’ADN. Les patients en bon état général peuvent recevoir un autre protocole de chimiothérapie plus efficace combinant quatre molécules, le folfirinox2. Une radiothérapie peut aussi être associée à la chimiothérapie. Néanmoins, compte tenu des effets secondaires très invalidants de ces traitements et d’un taux de survie qui reste très faible, la recherche de nouvelles thérapies est un enjeu majeur. L’immunothérapie est un bon candidat, mais aucune approche de ce type n’est encore disponible pour traiter les cancers du pancréas, ce qui incite à mieux comprendre le rôle du système immunitaire dans ces tumeurs.
 | Figure 1.
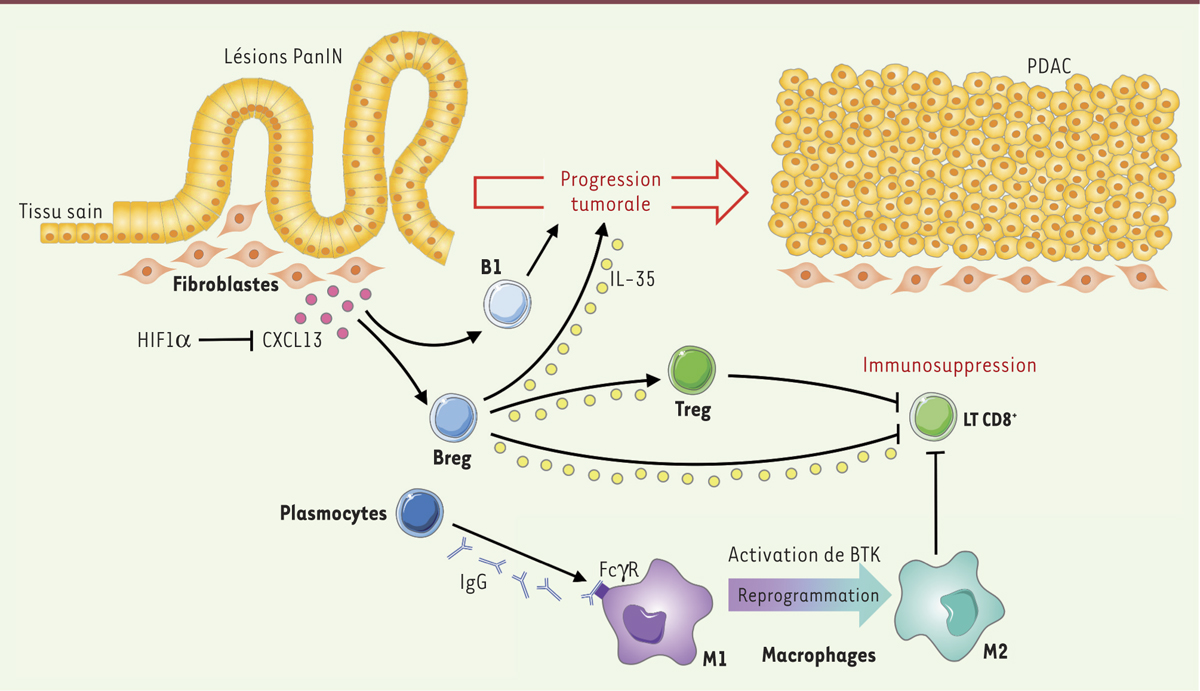
Mécanismes d’action protumorale des lymphocytes B dans l’adénocarcinome canalaire pancréatique. Dès le stade prétumoral (PanIN) et sous le contrôle de l’hypoxie et de HIF1α, les fibroblastes du stroma sécrètent la chimiokine CXCL13 qui recrute des Breg (CD1dhiCD5+) et des lymphocytes B1, qui favorisent tous deux la progression tumorale. Les Breg produisent de l’IL-35, qui stimule la prolifération des cellules tumorales et pourrait également inhiber la réponse immunitaire antitumorale. Les PDAC sont aussi infiltrés par des plasmocytes qui produisent des anticorps de type IgG capables d’induire une reprogrammation des macrophages M1 en M2 protumoraux via l’activation de la kinase BTK. |
Or, récemment, trois études ont mis en évidence des infiltrats de lymphocytes B dans l’adénocarcinome canalaire pancréatique par marquage immunohistologique de tumeurs et analyse de banques de données de transcriptome de tumeurs [4–6]. Dans chacune de ces études, les chercheurs identifient un mécanisme par lequel ces lymphocytes B pourraient exercer une action facilitant le développement tumoral. |
Un rôle protumoral des lymphocytes B révélé par la délétion de HIF1α Lee et ses collaborateurs [4] ont étudié le rôle des LB dans le PDAC en identifiant un mécanisme dépendant de HIF1α (hypoxia-inducible factor 1 alpha). Ce facteur de transcription est activé en réponse à l’hypoxie ; or, un déficit en oxygène est l’un des éléments clés du microenvironnement qui peut influencer le développement tumoral [7]. Ainsi, dans l’adénocarcinome canalaire, HIF1α est surexprimé par les cellules épithéliales pancréatiques des lésions précancéreuses PanIN, ce qui traduit une situation d’hypoxie. Or, si l’on invalide HIF1α spécifiquement dans ces cellules dans un modèle murin de tumeur pancréatique spontanée, la sécrétion de la chimiokine CXCL13 (C-X-C motif chemokine ligand 13) - qui est le principal chimioattractant des LB - est induite, ainsi que celle d’autres chimioattractants des LB, favorisant ainsi le recrutement de ces cellules dans l’environnement tumoral. La conséquence de cette infiltration est une accélération de la tumorigenèse. Celle-ci est ralentie si les LB sont éliminés par un anticorps anti-CD20, confirmant le rôle protumoral des LB dans le PDAC en l’absence de HIF1α. Dans cette situation, le nombre de lymphocytes B1 (CD43+IgMhi) augmente au détriment des lymphocytes B conventionnels ou B2 (CD43-CD5-). Ces lymphocytes B1 produisent des anticorps naturels de type IgM (immunoglobuline M) et interviennent notamment dans la régulation du système immunitaire ; ils pourraient donc avoir un rôle protumoral dans le PDAC et très probablement dans d’autres cancers. |
Les lymphocytes B régulateurs contribuent à la progression tumorale via la production d’IL-35 Dans une seconde étude réalisée dans un modèle murin de greffe de cellules tumorales pancréatiques, l’équipe de Pylayeva-Gupta [5] montre que, chez les souris dépourvues de LB3, la croissance tumorale est moindre que chez les souris immunocompétentes. Pour comprendre le mécanisme de l’action protumorale de ces LB, les auteurs démontrent d’abord que la cytokine CXCL13, sécrétée par les fibroblastes du stroma tumoral, permet, comme dans l’étude précédente, le recrutement des LB. Des expériences de transfert de lymphocytes chez les souris totalement déficientes en LB identifient la sous-population CD1dhiCD5+ comme majoritairement responsable de la prolifération des cellules tumorales. Cette population rare de cellules B est connue pour son rôle immunosuppresseur via la production d’IL-10 et d’IL-35, d’où sa dénomination de B régulateurs. De manière surprenante, les auteurs montrent que ce n’est pas la production d’IL-10 qui accélère la progression du PDAC, mais celle d’IL-35. Cette cytokine est connue pour participer à la suppression des réponses immunitaires et son absence, comme celle des Breg CD1dhiCD5+, conduit au développement de maladies auto-immunes chez la souris [8, 9]. Dans le cas du PDAC, les auteurs privilégient l’idée selon laquelle l’IL-35 induit la prolifération directe des cellules tumorales sans toutefois le démontrer formellement. Elle pourrait également contribuer au rôle protumoral des LB en inhibant la prolifération et les fonctions des LT CD8+, acteurs clés de l’immunité antitumorale, et en favorisant la différenciation des LT CD4+ en Treg. |
Reprogrammation des macrophages par les lymphocytes B intratumoraux Dans la troisième étude, Gunderson et ses collaborateurs [6] mettent en évidence un rôle essentiel des cellules myéloïdes dans l’effet protumoral des LB. Les plasmocytes intratumoraux produisent des anticorps de type IgG qui peuvent se fixer sur les macrophages via le récepteur pour la partie Fc (fragment cristallisable) des IgG, FcγR. L’engagement du FcγR active la kinase BTK (Bruton’s tyrosine kinase) par un mécanisme dépendant de la PI3Kγ (phosphoinositide 3-kinase gamma). BTK est une kinase clé des LB et des macrophages, et elle est fortement activée dans le stroma tumoral des adénocarcinomes canalaires pancréatiques murin et humain. Dans le modèle murin, l’activation de BTK dans les macrophages associés aux tumeurs induit leur reprogrammation, du phénotype M1 vers un phénotype M2. Les macrophages M1 sont considérés comme antitumoraux et produisent notamment du TNFα (tumor necrosis factor alpha). À l’inverse, les macrophages M2 produisent de l’IL-10, ce qui leur confère une activité immunosuppressive. De manière intéressante, l’inhibition de BTK restaure le phénotype M1 et conduit à un ralentissement de la croissance tumorale. |
Conclusions et perspectives Ces trois études, réalisées dans des modèles murins, révèlent donc un rôle essentiel, protumoral, des lymphocytes B dans le PDAC. Deux sous-populations favorisent la croissance tumorale pancréatique par des mécanismes différents : les Breg, via la production d’IL-35, et les plasmocytes producteurs d’IgG via une reprogrammation des macrophages. Les lymphocytes B1 pourraient également favoriser le développement du PDAC. L’importance relative de ces différents mécanismes devra être définie dans des études supplémentaires. Quoi qu’il en soit, ces découvertes pourraient déboucher sur de futures applications thérapeutiques car les caractéristiques des trois mécanismes décrits : surexpression de HIF1α (a priori protectrice car freinant le recrutement des B), présence de LB producteurs d’IL-35 et de la chimiokine CXCL13 (action protumorale), sont retrouvés dans les lésions PanIN humaines, et peuvent être associés in vivo. De plus, des taux sériques élevés d’IL-35 sont associés à la présence de métastases chez les patients atteints de PDAC [10], et BTK est fortement activée dans les LB et les macrophages de leurs tumeurs. Il serait donc intéressant de combiner les thérapies classiques ciblant les cellules tumorales avec des stratégies visant à limiter le rôle protumoral des LB infiltrant les PDAC. Pour cela, l’inhibition de la BTK avec l’ibrutinib, un inhibiteur déjà utilisé en clinique et ralentissant la croissance tumorale dans les modèles murins, la neutralisation des chimioattractants des lymphocytes B tels que CXCL13, ou la déplétion des populations B avec le rituximab, un anticorps anti-CD20, pourraient constituer des pistes à explorer. Néanmoins, il est important de noter que certaines populations de LB peuvent exercer un rôle antitumoral et qu’éliminer intégralement le compartiment B n’est pas nécessairement souhaitable. La neutralisation de l’IL-35 pourrait donc s’avérer préférable. Outre ces stratégies thérapeutiques possibles, la présence de certaines sous-populations B, l’activation de la BTK ou encore les taux d’IL-35 et de CXCL13 pourraient être utilisés comme biomarqueurs précoces du développement d’un adénocarcinome canalaire, ce qui pourrait permettre de diagnostiquer plus tôt les patients et donc d’améliorer leur pronostic. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Medler TR, Cotechini T, Coussens LM. Immune response to cancer therapy : mounting an effective antitumor response and mechanisms of resistance . Trends Cancer. 2015; ; 1 : :66.–75. 2.
Silina K, Rulle U, Kalnina Z. Line A. Manipulation of tumour-infiltrating B cells and tertiary lymphoid structures : a novel anti-cancer treatment avenue? . Cancer Immunol Immunother. 2014; ; 63 : :643.–662. 3.
Zhang Y, Gallastequi N, Rosenblatt JD. Regulatory B cells in anti-tumor immunity . Int Immunol. 2015; ; 27 : :521.–530. 4.
Lee KE, Spata M, Bayne LJ, et al. Hif1a deletion reveals pro-neoplastic function of B cells in pancreatic neoplasia . Cancer Discov. 2016; ; 6 : :256.–269. 5.
Pylayeva-Gupta Y, Das S, Handler JS, et al. IL35-producing B cells promote the development of pancreatic neoplasia . Cancer Discov. 2016; ; 6 : :247.–255. 6.
Gunderson AJ, Kaneda MM, Tsujikawa T, et al. Bruton tyrosine kinase-dependent immune cell cross-talk drives pancreas cancer . Cancer Discov. 2016; ; 6 : :270.–285. 7.
Wilson WR, Hay MP. Targeting hypoxia in cancer therapy . Nat Rev Cancer. 2011; ; 11 : :393.–410. 8.
Watanabe R, Ishiura N, Nakashima H, et al. Regulatory B cells (B10 cells) have a suppressive role in murine lupus : CD19 and B10 cell deficiency exacerbates systemic autoimmunity . J Immunol. 2010; ; 184 : :4801.–4809. 9.
Shen P, Roch T, Lampropoulou V, et al. IL-35-producing B cells are critical regulators of immunity during autoimmune and infectious diseases . Nature. 2014; ; 507 : :366.–370. 10.
Jin P, Ren H, Sun W, et al. Circulating IL-35 in pancreatic ductal adenocarcinoma patients . Hum Immunol. 2014; ; 75 : :29.–33. |