| |
| Med Sci (Paris). 33(10): 862–864. doi: 10.1051/medsci/20173310016.Le butyrate, un médiateur métabolique bactérien salutaire pour la réaction du greffon contre l’hôte Joseph Bisaccia1* and Saidi Soudja2 1Master de cancérologie, module d’immunologie - virologie, université de Lyon, université Claude Bernard Lyon 1, Lyon, France 2Centre de recherches en cancérologie, UMR Inserm 1052, CNRS 5286, Centre Léon Bérard, Lyon, France MeSH keywords: Animaux, Butyrates, Microbiome gastro-intestinal, Maladie du greffon contre l'hôte, Humains, Intestins, métabolisme, pharmacologie, immunologie, traitement médicamenteux, microbiologie |
Le microbiote est un ensemble de microorganismes vivant dans un site corporel défini chez un hôte1. Cette flore microbienne vit en symbiose avec l’hôte et tapisse différentes parties du corps comme la peau, le vagin et l’intestin. Le tractus gastro-intestinal est l’organe du corps qui accueille le plus de microorganismes. Ainsi, 1014 bactéries - dont plus de 500 espèces - colonisent notre intestin et y cohabitent. La composition du microbiote varie fortement chez un individu selon le site corporel, mais aussi entre individus. Ainsi, une étude de l’université d’Harvard a montré qu’il est possible d’identifier une personne grâce à son microbiote intestinal avec une probabilité de plus de 80 % [1] ; le microbiote constitue donc une empreinte microbienne au même titre qu’une empreinte digitale. Une symbiose s’établit entre la flore microbienne et l’hôte qui repose sur une coopération mutuelle entre les deux protagonistes. L’hôte fournit aux microorganismes un abri, des niches favorables à leur croissance et leur maintien. L’absorption par l’hôte d’aliments riches en nutriments fournit de l’énergie à ceux qui tapissent l’intestin. Par ailleurs, la flore microbienne constitue une première barrière de protection pour l’individu. En effet, elle permet d’éviter l’implantation de microorganismes pathogènes. De nombreuses études soulignent le rôle central du microbiote dans l’éducation et la maturation du système immunitaire. Sa présence fournit un signal tonique permettant de garder notre système de défense immunitaire toujours en alerte [2]. Outre cet aspect protecteur, le microbiote est la source de pléthore de molécules essentielles telles que certaines vitamines (K, B12) dites essentielles du fait de l’incapacité de l’homme à les synthétiser. De plus, le microbiote facilite la digestion du bol alimentaire en dégradant des composés non dégradables par l’homme tels que les polysaccharides. La fermentation par les bactéries de ces polysaccharides alimentaires génère des acides gras à chaînes courtes comme l’acétate, le propionate et le butyrate, qui seront une source d’énergie indispensable à l’hôte. Depuis plusieurs années, de nombreuses publications scientifiques rapportent l’importance du microbiote chez l’homme. En effet, sa dérégulation serait la cause de nombreuses maladies, soulignant la liaison intime entre l’hôte et la flore commensale. Si l’un des deux est altéré, l’autre peut l’être aussi. L’enjeu crucial aujourd’hui est d’essayer de comprendre les mécanismes de ce dialogue entre l’hôte et son microbiote afin d’intervenir efficacement lorsqu’il est altéré. L’étude de Mathewson et al. [3] en offre un exemple : cette équipe a identifié le rôle protecteur d’un des dérivés métaboliques issus de la fermentation bactérienne, le butyrate. L’étude montre que le butyrate agit comme un médiateur métabolique salutaire diminuant les pathologies intestinales associées à la réaction du greffon contre l’hôte (GvH). |
Le butyrate prévient les manifestations intestinales de la GvH Lors d’une hémopathie maligne, ou d’un traitement par chimiothérapie, la moelle osseuse peut être affectée, justifiant parfois une greffe de cellules souches hématopoïétiques allogéniques (issues de la moelle osseuse ou du sang périphérique d’un donneur compatible). Malheureusement, celle-ci n’est pas sans conséquences. En effet, 50 % des patients développent une réaction immunitaire dite du greffon contre l’hôte, ou graft versus host (GvH). Celle-ci affecte différents organes de l’hôte et en particulier l’intestin. Les lymphocytes du donneur vont reconnaître les cellules de l’hôte comme non-soi, et engendrer une réaction immunitaire dirigée contre celles-ci. Paradoxalement, dans le contexte d’une hémopathie, les lymphocytes agissent aussi contre les cellules leucémiques restantes de l’hôte : cet effet bénéfique constitue la réaction du greffon contre la leucémie, ou graft versus leukemia (GvL). Différentes études ont montré une altération du microbiote lors de la GvH [4, 5]. En analysant de façon extensive la concentration de ces différents métabolites dans un modèle murin de GvH, les auteurs ont pu montrer une diminution spécifique du butyrate au niveau du tissu intestinal. Le butyrate est un acide gras à chaînes courtes qui dérive de la fermentation des fibres alimentaires. La supplémentation de l’alimentation des souris avec du butyrate et le transfert d’une combinaison de bactéries de la famille des Clostridium capables de produire du butyrate diminuent les effets pathologiques de la GvH au niveau de l’intestin. Sans le démontrer formellement, les auteurs suggèrent que l’inflammation déclenchée par la GvH est à l’origine de la baisse d’expression par les cellules épithéliales de l’intestin de récepteurs clés dans l’incorporation du butyrate, tels que les récepteurs SLC5a8 et GPR43, conduisant à la diminution du butyrate dans le tissu intestinal. |
Action directe du butyrate sur la physiologie de la cellule épithéliale Le butyrate est la principale source d’énergie dans les cellules épithéliales. Il y est soumis à une succession de réactions biochimiques aboutissant à la production de deux molécules d’acétyl-CoA qui entrent dans le cycle de Krebs, fournissant alors de l’énergie. D’autre part, le butyrate se fixe sur des histones déacétylases (HDAC), entraînant leur inhibition [6] (Figure 1). Les HDAC sont des enzymes qui participent au contrôle épigénétique de la cellule. Elles enlèvent les groupements acétyles sur les résidus lysine des histones, qui avaient préalablement été ajoutés par des histones acétylases (HAT). L’inhibition des HDAC conduit à un enrichissement des histones en résidus lysine acétylés, ce qui favorise l’activité transcriptionnelle de la cellule.
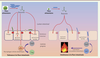 | Figure 1.
Impact du butyrate sur l’épithélium intestinal et le système immunitaire. Le butyrate agit en tant qu’inhibiteur des histones déacétylases (HDAC), ce qui permet l’expression de gènes impliqués dans la survie cellulaire et la cohésion intercellulaire. Le butyrate permet également la génération et le maintien de lymphocytes T régulateurs (Treg) au niveau de l’intestin. Les Treg vont secréter des cytokines suppressives garantes du maintien de la tolérance vis-à-vis de la flore intestinale. Si l’apport de butyrate décroît, l’intégrité de l’épithélium est affectée, du fait de l’augmentation de la mort cellulaire, de la perte des jonctions serrées et de celle des lymphocytes Treg. Ainsi, la diminution du butyrate augmentera la perméabilité intestinale et favorisera donc la translocation des bactéries dans la lamina propria. Les lymphocytes pourront alors s’activer et se différencier en cellules effectrices pathogéniques (Teff), conduisant à l’établissement d’une inflammation qui peut mener à la rupture de la tolérance vis-à-vis du microbiote et à une inflammation chronique. |
Résistance des cellules épithéliales à l’apoptose Lors de la GvH, beaucoup de cellules de l’hôte meurent en raison de l’apoptose induite par les cellules immunitaires du greffon. Dans cette étude, les auteurs montrent que le traitement des cellules épithéliales avec du butyrate diminue ce processus apoptotique. De manière intéressante le butyrate, en inhibant les HDAC, induit l’expression de gènes codant des protéines telle que BCL-B, qui a un effet anti-apoptotique, et freine l’expression de molécules pro-apoptotiques telles que BAK1 et BAX. Ainsi, l’intestin sera moins affecté par les attaques cytotoxiques des cellules immunitaires du donneur contre l’hôte, préservant son intégrité. Cohésion des cellules épithéliales Les cellules épithéliales et la couche de mucus constituent des barrières physiques contre l’intrusion des microorganismes. L’hyperacétylation provoquée par le butyrate permet la synthèse de protéines des jonctions serrées des cellules épithéliales telles que JAM ( junctional adhesion molecule), claudines et occludine [ 7]. La cohésion intercellulaire est augmentée, limitant la translocation bactérienne dans la lamina propria et ainsi l’activation du système immunitaire (Figure 1). Action indirecte du butyrate sur la physiologie de la cellule épithéliale D’autres études ont montré que le butyrate peut agir sur les cellules immunitaires, en particulier sur les lymphocytes T régulateurs exprimant le facteur de transcription clé FOXP3. En effet, une combinaison de bactéries du type Clostridium permet l’induction de lymphocytes T régulateurs par la production du butyrate [ 8, 9]. Cependant, l’étude de Matheweson et al montre que, chez la souris, les cellules T régulatrices ne semblent pas jouer un rôle primordial dans la protection conférée par le butyrate dans la GvH. Néanmoins, l’action directe du butyrate sur les cellules épithéliales est un paramètre de la protection. |
Vers une solution thérapeutique Une alimentation riche en fibres et/ou une complémentation en butyrate permettent d’éviter de nombreux désagréments intestinaux en agissant sur plusieurs paramètres physiologiques de l’hôte. Nul ne doute du rôle primordial des fibres alimentaires dans le bon transit intestinal. Cependant, outre cette fonction mécanique, ces fibres alimentaires, après leur fermentation bactérienne, permettent la génération de composés métaboliques essentiels pour la physiologie de l’épithélium. Ainsi, le butyrate, un de ces composés issus de la fermentation bactérienne, joue un rôle clé dans le maintien de l’intégrité de la barrière intestinale en agissant directement sur l’activité transcriptionnelle de la cellule épithéliale. De nos jours, la part des fibres dans notre alimentation diminue, l’apport de butyrate s’en trouve amoindri. Il serait intéressant d’approfondir l’exploration du rôle de l’évolution de notre comportement alimentaire, de plus en plus remis en question, sur l’émergence et la ténacité de certaines maladies. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Franzosa EA, Huang K, Meadow JF, et al. Identifying personal microbiomes using metagenomic codes . Proc Natl Acad Sci USA. 2015; ; 112 : :2930.–2938. 2.
Gaboriau-Routhiau Cerf-Bensussan N. Microbiote intestinal et développement du système immunitaire . Med Sci (Paris). 2016; ; 32 : :961.–967. 3.
Mathewson ND, Jenq R, Mathew AV, et al. Gut microbiome-derived metabolites modulate intestinal epithelial cell damage and mitigate graft-versus-host disease . Nat Immunol. 2016; ; 17 : :505.–513. 4.
Jenq RR, Ubeda C, Taur Y, et al. Regulation of intestinal inflammation by microbiota following allogeneic bone marrow transplantation . J Exp Med. 2012; ; 209 : :903.–911. 5.
Taur Y, Jenq RR, Perales MA, et al. The effects of intestinal tract bacterial diversity on mortality following allogeneic hematopoietic stem cell transplantation . Blood. 2014; ; 124 : :1174.–1182. 6.
Davie JR. Inhibition of histone deacetylase activity by butyrate . J Nutr. 2003; ; 133 : :2485S.–2493S. 7.
Peng L, Li ZR, Green RS, Holzman IR, Lin J. Butyrate enhances the intestinal barrier by facilitating tight junction assembly via activation of AMP-activated protein kinase in Caco-2 cell monolayers . J Nutr. 2009; ; 139 : :1619.–1625. 8.
Furusawa Y, Obata Y, Fukuda S, et al. Commensal microbe-derived butyrate induces the differentiation of colonic regulatory T cells . Nature. 2013; ; 504 : :446.–450. 9.
Arpaia N, Campbell C, Fan X, et al. Metabolites produced by commensal bacteria promote peripheral regulatory T cell generation . Nature. 2013; ; 504 : :451.–455. |