| |
| Med Sci (Paris). 33(10): 871–877. doi: 10.1051/medsci/20173310019.Le système du complément Une épée à double tranchant dans la progression tumorale Marie Daugan,1,2,3* Remi Noe,1,2,3,4* Wolf Herman Fridman,2,3,5 Catherine Sautes-Fridman,2,3,5 and Lubka T. Roumenina1,2,3 1Inserm UMRS 1138, Centre de recherche des Cordeliers, équipe complément et maladies, 15, rue de l’École de Médecine, 75006Paris, France 2Sorbonne Paris Cité, Université Paris Descartes, Paris, France 3Sorbonne Universités, UPMC Université Paris 06, Paris, France 4École pratique des hautes études (EPHE), Paris, France 5Inserm UMRS 1138, Centre de recherche des Cordeliers, équipe cancer et immunité anti-tumorale, Paris, France |
Vignette (Photo © Alain Puisieux). Le système du complément (SC) a été découvert à la fin des années 1890. Il est alors décrit comme un composant thermolabile du sérum, qui possède des propriétés antimicrobiennes, capable de complémenter l’action des anticorps. Depuis, les connaissances ont évolué et il est désormais établi que ce système fait partie intégrante du système immunitaire inné. Le SC fait référence à un ensemble de protéines sériques qui jouent un rôle primordial dans l’immunité innée : elles permettent à l’hôte de se défendre contre les pathogènes ; elles participent à l’élimination de ses propres cellules en condition d’apoptose [1]. À la surface des cellules apoptotiques ou du pathogène, le système du complément peut être activé en cascade selon trois voies : la voie classique, la voie des lectines ou la voie alterne (Figure 1). Ces trois voies convergent pour aboutir à l’activation de la protéine C3 (C pour complément) avec pour résultat la formation du complexe d’attaque membranaire (CAM). Le CAM est à l’origine de la lyse des pathogènes ou de l’activation de certaines cellules de l’hôte. En dehors de leur action directe, chacune de ces voies peut induire des réponses inflammatoires et moduler les réponses immunitaires innée et adaptative conduisant ainsi à l’élimination des pathogènes, des complexes immuns et des cellules apoptotiques [2].
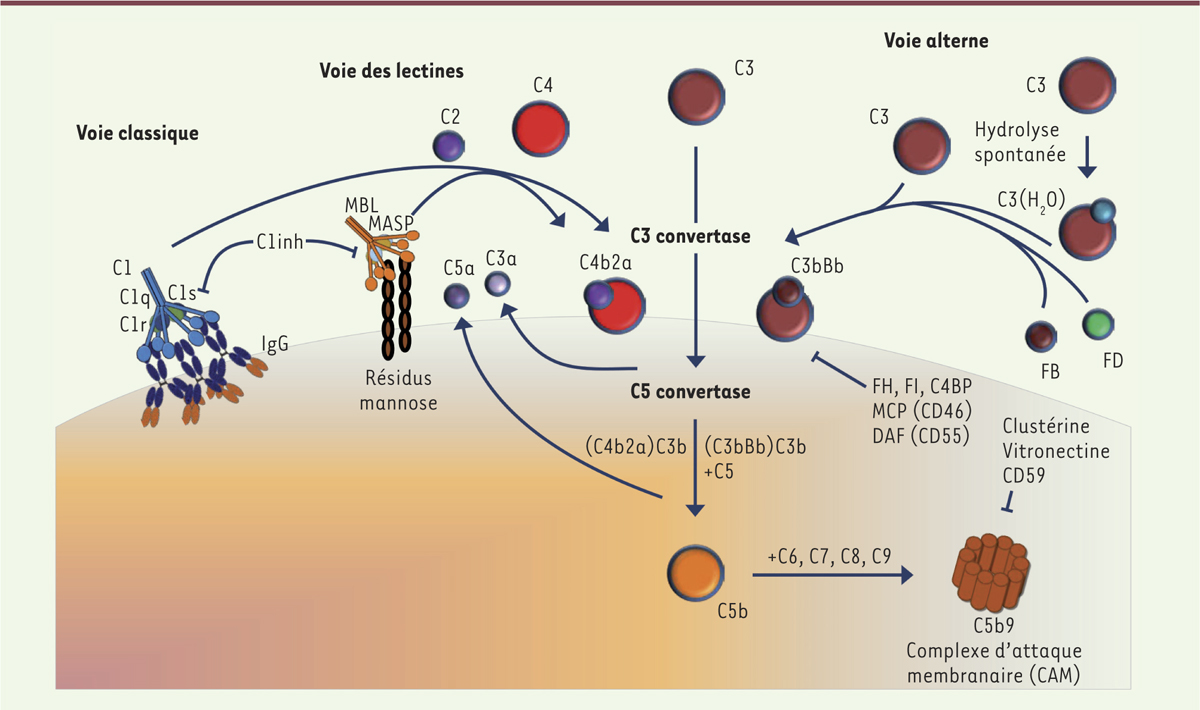
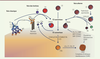 | Figure 1.
Le système du complément. La voie classique est initiée par la fixation du complexe C1 à des immunoglobulines ou à des ligands endogènes. Ce complexe va pouvoir cliver le C4 et le C2 pour former la C3 convertase classique (C4b2a). La voie des lectines (analogue à la voie classique) est activée par la fixation d’un complexe MBL-MASP à la surface des pathogènes. Ce complexe, lié au pathogène, permet de cliver le C4 et le C2 de façon identique à ce qu’il advient lors de l’activation par la voie classique. Ces clivages forment ainsi une C3 convertase (C4b2a) identique à celle formée dans la voie classique. La voie alterne agit comme un système de surveillance en maintenant un faible niveau d’activation du système par un processus connu sous le nom de « tick-over ». Le tick-over est l’hydrolyse spontanée du C3 en C3(H2O), forme bio-active du C3, dans la phase fluide. Le C3(H2O) peut se fixer au facteur B, qui est ensuite clivé par le facteur D pour former la C3 convertase alterne en phase fluide : C3(H2O)Bb. À la surface des pathogènes, le facteur B, fixé au C3b, pourra ensuite être clivé par le facteur D pour former la C3 convertase alterne (C3bBb). Ces trois voies conduisent à la formation d’une C3 convertase permettant de cliver le C3 en C3a, une anaphylatoxine, et en C3b à l’origine de la formation de la C5 convertase (C4b2a3b ou C3bBb3b). Le C5 est ensuite clivé en C5a, une anaphylatoxine, et en C5b qui va initier l’assemblage de la voie terminale du complément. Cette voie terminale conduit à la formation du complexe d’attaque membranaire (CAM, C5b-9) et permet de lyser les pathogènes. Le système du complément est hautement régulé par des protéines sériques (C1inh, FI, C4BP, FH, clusterine, vitronectine) et membranaires (CR1, MCP, DAF, CD59). MBL-MASP : mannan binding protein- mannan-binding lectin serine protease ; C1inh : C1 inhibiteur ; C4BP : C4 binding protein ; MCP : membrane cofactor protein ; DAF : decay accelerating factor. |
|
Les voies d’activation du complément La voie classique L’activation de la voie classique est initiée à la suite de la fixation à une cible du complexe C1 constitué d’une molécule de reconnaissance, le C1q, et deux sérine protéases, C1r et C1s 1 [ 3]. Le C1q peut se lier à une grande variété de cibles, dont les complexes immuns, par les régions constantes des immunoglobulines de classe M ou G, mais également des ligands endogènes comme les pentraxines [ 4] et d’autres molécules qui sont exposées à la surface des cellules apoptotiques [ 5]. La voie des lectines La voie des lectines est initiée à la suite de la reconnaissance de résidus glycaniques par le complexe constitué de l’association de lectines, comme la MBL ( mannan-binding lectin) ou les ficolines, avec des sérine estérases, les MASP ( MBL-associated serine proteases) [ 6]. La voie alterne La voie alterne agit comme un système de surveillance. Elle maintient un faible niveau d’activation des cellules par le système du complément. Elle peut subir une boucle d’auto-amplification dans un contexte infectieux [ 1]. |
Les voies effectrices du complément Les trois voies d’activation du complément aboutissent à la formation d’une C3 convertase (classique ou alterne) qui est responsable du clivage du C3 en deux fragments, le C3a et le C3b [7], puis d’une C5 convertase qui clive la protéine C5 en deux fragments, le C5a et le C5b. Ces deux convertases (C3 et C5 convertases) sont des composants essentiels pour la lutte contre les pathogènes. En générant le C3b, elles permettent en effet l’opsonisation de la cible (le C3b la recouvrant, il favorise sa reconnaissance par le système immunitaire inné). Elles sont également à l’origine d’une réponse inflammatoire induite par les anaphylatoxines C3a et C5a. Elles initient enfin l’assemblage du CAM : le C5b qu’elles génèrent se lie aux protéines C6, C7, C8 et à plusieurs molécules de C9 qui s’ancrent à la membrane de la cellule permettant de former un pore lytique [8]. |
Les régulateurs du complément Afin de limiter les dommages potentiels qu’il peut induire sur les tissus sains, le système du complément est finement régulé. Cette régulation s’effectue à trois niveaux : (1) l’inhibition de l’activité des protéases qui sont impliquées dans la cascade d’activation du complément ; (2) la facilitation de la dégradation de ces protéases ; et (3) le contrôle de la formation du complexe d’attaque membranaire. Les régulateurs intervenant sur le système du complément peuvent être solubles, comme le C1 inhibiteur, le facteur I et le facteur H, ou membranaires, comme le CD35 (ou complement receptor 1, CR1), le CD46 (ou membrane cofactor protein, MCP), le CD55 (decay-accelerating factor, DAF) et le CD59 [1]. |
Implication du système du complément en physiopathologie La régulation du système du complément est essentielle afin d’assurer l’homéostasie de l’hôte. Une déficience de certains de ses composants peut en effet être à l’origine d’une susceptibilité accrue aux infections, notamment aux méningocoques, et aux maladies auto-immunes comme le lupus [2]. À l’inverse, la suractivation du système du complément peut avoir des conséquences délétères et être responsable de dommages tissulaires. C’est notamment le cas dans les C3 glomérulopathies [9], le syndrome urémique hémolytique atypique, ou dans la dégénérescence maculaire liée à l’âge [2, 10]. Récemment, des études ont suggéré un rôle du système du complément dans le cancer. La question de son intérêt comme biomarqueur, ou cible thérapeutique, dans un contexte tumoral a ainsi été évoquée. |
Protéines du complément et contexte tumoral Le rôle anti-tumoral du complément semblait acquis depuis plusieurs années en raison de son activité lytique, de ses propriétés de chimiotactisme et d’opsonisation des cellules stressées. Cependant, de récentes études semblent contredire ce paradigme en montrant que le système du complément peut être relié à des effets pro-tumoraux. L’expression anormale de protéines du complément a été révélée dans de nombreux types de tumeurs, notamment dans des tumeurs du poumon [11], du sein [12], du pancréas [13], du rein [14] et urothéliales (vessie et haut appareil urinaire) [15]. Parmi ces protéines, le C1q, le C1s, le C3, le C4, les anaphylatoxines C3a et C5a, et leurs récepteurs, ainsi que les protéines régulatrices comme le facteur B, facteur H, facteur I, CD46, CD55 et CD59, sont le plus souvent surexprimées. La possibilité d’une activation locale du complément au sein de ces tumeurs a été suggérée, ce qui soulève la question de son rôle possible dans la progression tumorale. Les cellules tumorales sont capables de s’adapter à leur environnement. Elles peuvent profiter des effets pro-inflammatoires induits par le complément, tout en s’affranchissant de ses activités cytotoxiques qui reposent sur le CAM. Cette adaptation implique la surexpression des protéines régulatrices du système comme le facteur H, le facteur I, le CD46, le CD55 et le CD59 [16, 17]. Une certaine contradiction sur le rôle du complément dans le cancer subsiste donc selon les données de la littérature. En fonction du type de cancer considéré, l’impact du système du complément peut en effet varier en ce qui concerne les protéines impliquées, mais également en termes de valeur pronostique. Dans la majorité des cancers, comme le cancer du rein [14], du sein [12], du poumon [11], de l’ovaire [18] et urothéliales [15], les protéines du complément favorisent la croissance tumorale. Dans d’autres, comme le cancer de la prostate [19], ces protéines n’ont aucune influence sur la croissance tumorale, elles peuvent même la ralentir. |
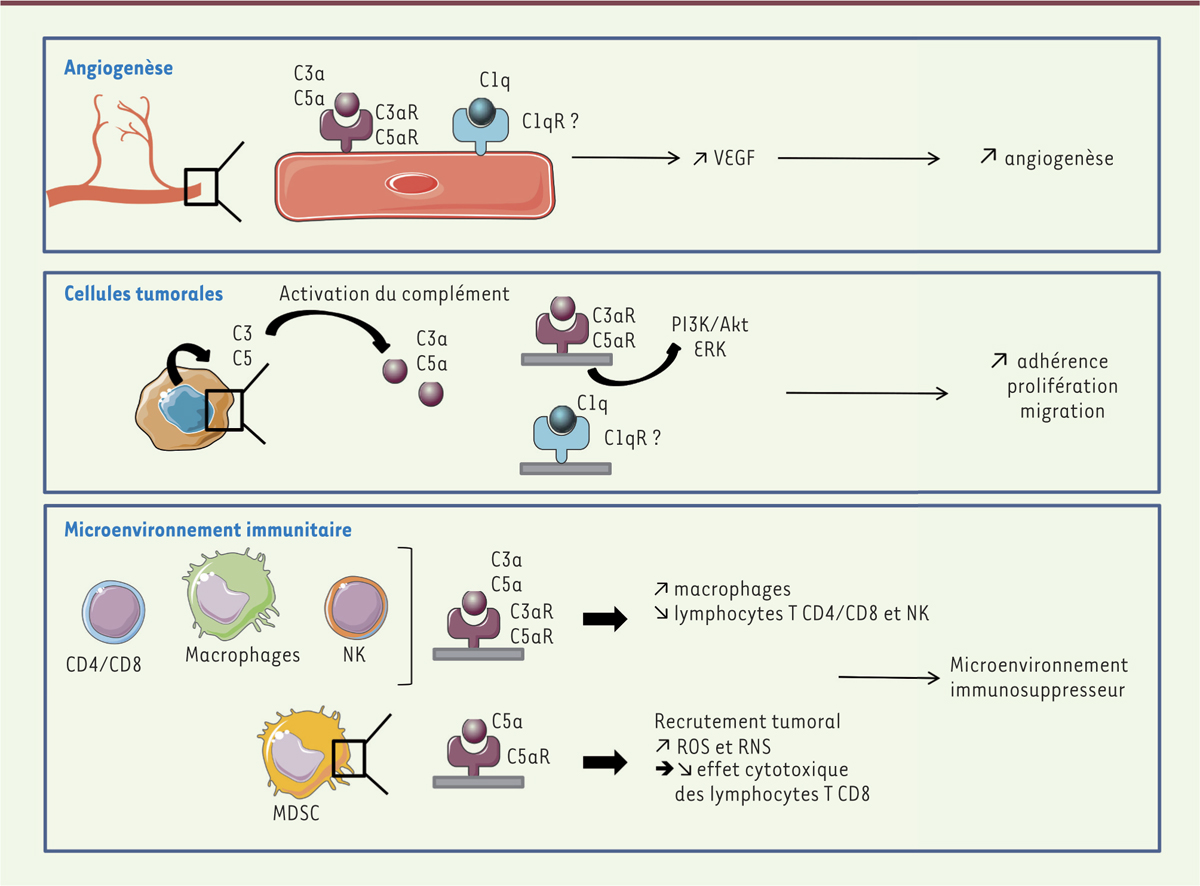
Mécanismes impliqués dans les effets du complément sur la progression tumorale Effets du complément sur les cellules tumorales Dans différents types de tumeurs comme le cancer de l’ovaire, du poumon, du rein, du sein et du foie, l’activation du complément par la génération des anaphylatoxines C3a et C5a, est associée à un mauvais pronostic. En effet, le C3a et le C5a, connus pour être de puissants médiateurs de l’inflammation, induisent la croissance tumorale en activant des voies de signalisation pro-tumorales (Figure 2). Cet effet repose sur l’interaction des anaphylatoxines avec leurs récepteurs respectifs, le C3aR et le C5aR, deux récepteurs couplés aux protéines G qui peuvent être exprimés à la membrane des cellules tumorales. Parmi les voies de signalisation activées par la stimulation du C3aR ou du C5aR, les voies ERK ( extracellular signal-regulated kinases) et PI3K (p hosphoinositide 3-kinase)/Akt (protéine kinase B) [ 20, 21] favorisent la prolifération, la survie et l’invasion des cellules tumorales. Cette activation pourrait résulter, en partie, d’une action autocrine des anaphylatoxines sur leurs récepteurs. En effet, il a été montré, dans des modèles cellulaires de cancers de l’ovaire et du poumon, que C3 et C5 sont sécrétés par les cellules tumorales [ 22] puis clivés respectivement par les convertases C3 et C5, ce qui permet la production des anaphylatoxines C3a et C5a. Elles exercent ainsi une action autocrine via leurs récepteurs qui sont exprimés par les cellules tumorales, activant des voies de signalisation comme la voie PI3K/Akt.
 | Figure 2.
Effets pro-tumoraux du complément. Le système du complément est responsable d’effets pro-tumoraux dans de nombreux cancers en agissant au niveau de différentes étapes clés de la progression tumorale. Au niveau de l’angiogenèse, le C1q et les anaphylatoxines C3a et C5a, stimulent l’adhérence, la prolifération et la migration des cellules endothéliales, notamment, via l’induction de la production de VEGF (vascular endothelial growth factor). Au niveau des cellules tumorales, le C1q et les anaphylatoxines induisent l’activation de voies de signalisation impliquées dans la survie et la prolifération des cellules comme PI3K (phosphatidylinositol-3-kinase)/Akt ou ERK (extracellular-signal-regulated kinase). Enfin, les anaphylatoxines possèdent des propriétés inflammatoires qui permettent le remodelage des populations immunitaires présentes, ainsi que leur fonctionnalité. Parmi, ces populations, les macrophages, les cellules natural killer (NK), les MDSC (myeloid-derived suppressor cells) et lymphocytes T CD4 et CD8 semblent être les plus impliquées dans l’axe C5a/C5aR. ROS : reactive oxygen species ; RNS : reactive nitrogen species. |
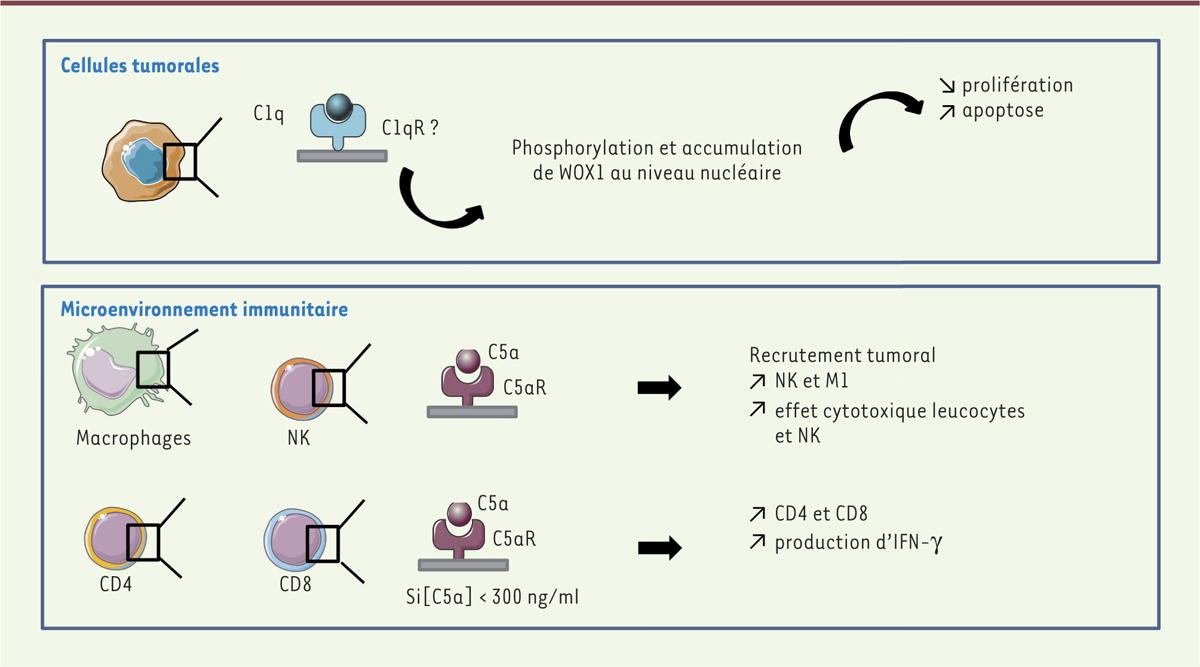
Le C5a est également associé à la formation de métastases. Dans un modèle murin de cancer colorectal, une diminution du nombre de métastases hépatiques est observée chez des souris déficientes pour le gène codant le récepteur C5aR, par rapport aux souris sauvages [23]. Ce potentiel métastatique aurait pour origine une modulation par le C5a de la capacité invasive des cellules. De même, dans un modèle in vitro de cancer gastrique, la stimulation du récepteur du C5a favorise la motilité cellulaire, via une activation de RhoA (ras homolog gene family, member A), et donc, la capacité invasive des cellules tumorales [24]. Dans des cellules de différentes lignées tumorales du côlon et des voies biliaires, qui expriment le C5aR, le C5a peut induire un réarrangement du cytosquelette des cellules, modifier leur motilité, et induire la sécrétion de métalloprotéinases (MMP) qui favorisent l’invasion par ces cellules [25]. Bien que les principaux effets du complément sur la croissance tumorale reposent sur l’activité du C3a et du C5a, un rôle pour les autres protéines du complément ne peut être écarté. De récentes études ont en effet montré que le C1q et le CAM possédaient également des propriétés pro-mitogéniques et pro-métastatiques. Ainsi, dans le modèle murin syngénique de mélanome B16/F102, la croissance tumorale observée chez des souris déficientes pour le gène codant C1q est ralentie et la survie des animaux est prolongée [26]. Le C1q agit directement sur les cellules tumorales dont il augmente l’adhérence, la migration et la prolifération. Il interagit également avec certaines MMP, dont MT1-MMP (membrane-type matrix metalloproteinase 1 ou matrix metalloproteinase-14), des protéines impliquées dans la dégradation de la matrice extracellulaire et l’acquisition par les cellules, d’un phénotype invasif [27]. Malgré ces propriétés cytotoxiques anti-tumorales, le CAM peut également favoriser la croissance tumorale en stimulant des voies de signalisation pro-tumorales comme ERK1/2, PI3K/Akt, et p70 S6 kinase. Il inhibe également l’apoptose des cellules en bloquant FLIP (FLICE-inhibitory protein) et la caspase-8 [28]. D’un point de vue thérapeutique, cette dualité des effets du CAM sur la progression tumorale nécessite une meilleure compréhension afin d’optimiser l’utilisation des anticorps monoclonaux activant le complément. Les effets pro-tumoraux du complément peuvent s’observer dans la majorité des cancers. Cependant, dans certains cas, il peut présenter des effets anti-tumoraux (Figure 3). Le C1q est exprimé au niveau de la prostate. Son expression protéique est significativement diminuée en cas d’hyperplasie bénigne ou de cancer de la prostate [19]. Indépendamment de son rôle dans l’activation de la voie classique du complément, le C1q peut induire une apoptose des cellules tumorales de prostate en activant le gène suppresseur de tumeur WWOX/WOX1 (WW domain-containing oxidoreductase) et en déstabilisant l’adhérence cellulaire. In vitro, le C1q conduit à l’accumulation rapide dans le noyau de WOX1 sous sa forme phosphorylée, qui est responsable de signaux antiprolifératifs et proapoptotiques. À noter que cette association entre C1q et WOX1 a également été observée dans d’autres types de cancers comme le cancer du sein ou le neuroblastome [19]. L’effet du C1q sur l’apoptose des cellules tumorales a aussi été observé sur une lignée de cancer de l’ovaire. Il repose dans ce cas sur un mécanisme impliquant le TNF-α (tumor necrosis factor-α) [29].
 | Figure 3.
Effets anti-tumoraux du complément. Dans certains types tumoraux tels que le cancer de la prostate ou du sein, le système du complément peut exercer des effets pro-tumoraux. D’une part, le C1q peut induire la voie de signalisation WWOX/WOX1 limitant ainsi la prolifération et favorisant l’apoptose des cellules tumorales. D’autre part, les anaphylatoxines peuvent selon le type tumoral et la concentration locale, favoriser le recrutement et l’action de cellules cytotoxiques et notamment les lymphocytes T, NK (natural killer) et les macrophages de type 1 (M1). WWOX/WOX1 : WW domain-containing oxidoreductase ; IFN-γ : interféron gamma. |
Effets du complément sur le microenvironnement immunitaire Dans un contexte d’inflammation chronique comme celui produit par la transformation cellulaire, les anaphylatoxines, C3a et C5a, participent à l’instauration d’une tolérance qui favorise une croissance plus rapide de la tumeur. Dans le modèle murin de mélanome, la délétion du gène codant le récepteur du C3a, le C3aR [30], ou une déficience en C3 [31], sont à l’origine d’une croissance tumorale ralentie qui est associée à un remodelage du microenvironnement immunitaire. Cela se traduit par une augmentation du nombre de neutrophiles et de lymphocytes T CD4, associé à une diminution du nombre de macrophages intra-tumoraux et une amélioration de la réponse T cytotoxique. L’anaphylatoxine C5a exerce également des effets immunomodulateurs. En effet, dans un modèle de cancer cervical, la génération de C5a dans le microenvironnement tumoral induit un chimiotactisme touchant les cellules myéloïdes suppressives (myeloid-derived suppressor cell, MDSC) qui, activées, sécrètent des espèces réactives de l’oxygène (reactive oxygen species, ROS) et de l’azote (reactive nitrogen species, RNS) à l’origine d’une immunosuppression des lymphocytes T CD8 [32]. Cet effet sur le recrutement des MDSC par chimiotactisme a également été observé dans un modèle de cancer pulmonaire dans lequel l’ajout d’un antagoniste du C5aR conduit à une diminution de l’infiltrat de MDSC et une réduction de l’expression des protéines immunomodulatrices ARG1 (arginase 1), CTLA-4 (cytotoxic T-lymphocyte antigen 4), IL(interleukine)-6, IL-10, LAG3 (lymphocyte-activation gene 3) et PD-L1 (programmed death-ligand 1). Chez les patients atteints de cancer pulmonaire non à petites cellules, une augmentation de la concentration sérique de C5a a été également rapportée [33]. Cependant, cet effet immunomodulateur des anaphylatoxines sur le microenvironnement immunitaire reste, encore une fois, controversé en fonction des données de la littérature, particulièrement selon le type de tumeur concerné et la concentration des anaphylatoxines. Dans différents modèles murins de sarcome du sein, de cancer de l’ovaire et de lymphome [34], l’expression par les cellules tumorales du C5a ralentit la croissance tumorale, en comparaison à celle observée chez des souris n’exprimant pas cette anaphylatoxine. Plusieurs hypothèses ont été émises afin d’expliquer cet effet anti-tumoral de la protéine. Le C5a rendrait les cellules plus susceptibles à l’apoptose, limitant ainsi leur capacité de prolifération. Il pourrait aussi participer à l’élimination des cellules tumorales en attirant les macrophages et les granulocytes par chimiotactisme. Dans le modèle de lymphome, en particulier, la concentration locale de C5a aurait un effet direct sur la croissance tumorale [34] : les tumeurs sécrétant de fortes quantités de C5a voient leur croissance accélérée alors qu’une quantité moindre de la protéine lui confère des propriétés anti-tumorales. Dans ce modèle, les effets anti-tumoraux du C5a sont principalement liés à une augmentation de la production d’IFN-γ (interféron gamma) par les lymphocytes T CD4 et CD8 dans la rate et les ganglions. Effets du complément sur l’angiogenèse L’angiogenèse est un mécanisme clé de la carcinogenèse. Il est relié directement à l’agressivité des tumeurs [ 35]. Certaines protéines du complément comme le C1q et les anaphylatoxines C3a et C5a, peuvent participer à ce processus. Ainsi, dans le modèle de mélanome B16/F10 [ 26], les souris déficientes pour le gène codant le C1q présentent une croissance tumorale ralentie qui peut être reliée, notamment, à une densité du réseau vasculaire des tumeurs diminuée. Cet effet du C1q sur la vascularisation a également été rapporté dans des modèles in vitro utilisant des cellules endothéliales, mais également in vivo, dans le cadre de la pré-éclampsie [ 36] ou de la cicatrisation des plaies [ 37]. De même, dans un modèle de cancer épithélial ovarien murin, la déficience en C3 ou en C5aR est à l’origine d’une diminution de la vascularisation tumorale en lien avec une réduction de l’expression du VEGF ( vascular endothelial growth factor) [ 38]. Cet effet pro-angiogénique des anaphylatoxines n’a cependant pas pu être mis en évidence dans d’autres modèles de cancer murins comme le cancer cervical [ 32, 33]. |
Le complément en immunothérapie par anticorps monoclonaux Lorsque l’utilisation des anticorps monoclonaux a été proposée pour la lutte contre les tumeurs, des stratégies visant à activer le mécanisme de cytotoxicité dépendant du complément (CDC), fondée sur la capacité d’opsonisation du complément et l’activité du CAM sur la mort cellulaire, ont été développées. Le mécanisme de CDC repose sur l’activation de la voie classique du complément par les immunoglobulines (via leur fragment Fc) qui, in fine, conduit à la formation du CAM à la surface des cellules ciblées par les anticorps, provoquant leur mort [39]. Certaines méthodes permettent d’amplifier cet effet cytotoxique : le blocage des mécanismes de résistance des cellules au CDC, en utilisant des inhibiteurs des protéines régulatrices (CD46, CD55 et CD59), ou des techniques d’ingénierie des anticorps afin de potentialiser leur capacité à activer le complément [40], notamment en jouant sur la cinétique de dissociation ou encore le site de liaison de l’anticorps. La modulation des activités du complément nécessite cependant quelques précautions en raison, comme nous l’avons exposé, de cette capacité qu’il a à induire des réactions pro-tumorales. Son activation n’est bénéfique que dans le cas où elle est suffisamment importante pour entraîner la formation des complexes d’attaque membranaire à la surface de la cellule afin de la déstabiliser et induire sa mort. À l’inverse, s’ils n’induisent pas une activation suffisante pour permettre la formation des complexes d’attaque membranaire et la mort des cellules, les anticorps pourraient favoriser la génération d’anaphylatoxines à l’origine d’une inflammation chronique permettant ainsi la progression tumorale. |
Les études récentes que nous rapportons ont permis de repositionner le rôle du système du complément dans la progression tumorale et révèlent son importante implication dans de nombreux cancers. Elles pourraient conduire à l’identification de nouveaux biomarqueurs diagnostiques ou pronostiques ainsi qu’à de nouvelles cibles thérapeutiques. Le complément ayant des effets divergents selon les types de cancer, il reste néanmoins essentiel de considérer le type de tumeur afin de développer ces stratégies. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
|
Footnotes |
1.
Merle NS, Church SE, Fremeaux-Bacchi V, et al. Complement system part I. Molecular mechanisms of activation and regulation . Front Immunol. 2015;; 6 : :262.. 2.
Merle NS, Noe R, Halbwachs-Mecarelli L, et al. Complement system part II: role in immunity . Front Immunol. 2015; ; 6 : :257.. 3.
Gaboriaud C, Ling WL, Thielens NM, et al. Deciphering the fine details of c1 assembly and activation mechanisms: “mission impossible”? . Front Immunol. 2014; ; 5 : :565.. 4.
Bonavita E, Gentile S, Rubino M, et al. PTX3 is an extrinsic oncosuppressor regulating complement-dependent inflammation in cancer . Cell. 2015; ; 160 : :700.–714. 5.
Nauta AJ, Trouw LA, Daha MR, et al. Direct binding of C1q to apoptotic cells and cell blebs induces complement activation . Eur J Immunol. 2002; ; 32 : :1726.–1736. 6.
Dobó J, Pál G, Cervenak L, et al. The emerging roles of mannose-binding lectin-associated serine proteases (MASPs) in the lectin pathway of complement and beyond . Immunol Rev. 2016; ; 274 : :98.–111. 7.
Ricklin D, Reis ES, Mastellos DC, et al. Complement component C3 - The “Swiss Army Knife” of innate immunity and host defense . Immunol Rev. 2016; ; 274 : :33.–58. 8.
Morgan BP, Walters D, Serna M, et al. Terminal complexes of the complement system: new structural insights and their relevance to function . Immunol Rev. 2016; ; 274 : :141.–151. 9.
Chauvet S, Marinozzi MC, Le Quintrec M, et al. Spectre des anomalies du complément associées aux glomérulopathies à dépôts de C3: quoi de neuf en 2014 ? . Néphrologie Thérapeutique. 2014; ; 10 : :280.–281. 10.
Ricklin D, Reis ES, Lambris JD. Complement in disease: a defence system turning offensive . Nat Rev Nephrol. 2016; ; 12 : :383.–401. 11.
Ajona D, Pajares MJ, Corrales L, et al. Investigation of complement activation product C4d as a diagnostic and prognostic biomarker for lung cancer . J Natl Cancer Inst. 2013; ; 105 : :1385.–1393. 12.
Imamura T, Yamamoto-Ibusuki M, Sueta A, et al. Influence of the C5a–C5a receptor system on breast cancer progression and patient prognosis . Breast Cancer Tokyo Jpn. 2016; ; 23 : :876.–885. 13.
Chen J, Wu W, Chen L, et al. Expression and clinical significance of AHSG and complement C3 in pancreatic ductal adenocarcinoma . Zhonghua Yi Xue Za Zhi. 2014; ; 94 : :2175.–2179. 14.
Xi W, Liu L, Wang J, et al. High level of anaphylatoxin C5a predicts poor clinical outcome in patients with clear cell renal cell carcinoma . Sci Rep. 2016; ; 6 : :29177.. 15.
Chang IW, Lin VCH, Wu WJ, et al. Complement component 1, s subcomponent overexpression is an independent poor prognostic indicator in patients with urothelial carcinomas of the upper urinary tract and urinary bladder . J Cancer. 2016; ; 7 : :1396.–1405. 16.
Riihilä PM, Nissinen LM, Ala-aho R, et al. Complement factor H: a biomarker for progression of cutaneous squamous cell carcinoma . J Invest Dermatol. 2014; ; 134 : :498.–506. 17.
Fishelson Z, Donin N, Zell S, et al. Obstacles to cancer immunotherapy: expression of membrane complement regulatory proteins (mCRPs) in tumors . Mol Immunol. 2003; ; 40 : :109.–123. 18.
Cho MS, Vasquez HG, Rupaimoole R, et al. Autocrine effects of tumor-derived complement . Cell Rep. 2014; ; 6 : :1085.–1095. 19.
Hong Q, Sze CI, Lin SR, et al. Complement C1q activates tumor suppressor WWOX to induce apoptosis in prostate cancer cells . PLoS One. 2009; ; 4 : :e5755.. 20.
Maeda Y, Kawano Y, Wada Y, et al. C5aR is frequently expressed in metastatic renal cell carcinoma and plays a crucial role in cell invasion via the ERK and PI3 kinase pathways . Oncol Rep. 2015; ; 33 : :1844.–1850. 21.
Lu Y, Hu XB. C5a stimulates the proliferation of breast cancer cells via Akt-dependent RGC-32 gene activation . Oncol Rep. 2014; ; 32 : :2817.–2823. 22.
Cho MS, Rupaimoole R, Choi HJ, et al. Complement component 3 is regulated by TWIST1 and mediates epithelial-mesenchymal transition . J Immunol. 2016; ; 196 : :1412.–1418. 23.
Piao C, Cai L, Qiu S, et al. Complement 5a enhances hepatic metastases of colon cancer via monocyte chemoattractant protein-1-mediated inflammatory cell infiltration . J Biol Chem. 2015; ; 290 : :10667.–10676. 24.
Kaida T, Nitta H, Kitano Y, et al. C5a receptor (CD88) promotes motility and invasiveness of gastric cancer by activating RhoA . Oncotarget. 2016; ; 7 : :84798.–84809. 25.
Nitta H, Murakami Y, Wada Y, et al. Cancer cells release anaphylatoxin C5a from C5 by serine protease to enhance invasiveness . Oncol Rep. 2014; ; 32 : :1715.–1719. 26.
Bulla R, Tripodo C, Rami D, et al. C1q acts in the tumour microenvironment as a cancer-promoting factor independently of complement activation . Nat Commun. 2016; ; 7 : :10346.. 27.
Rozanov DV, Sikora S, Godzik A, et al. Non-proteolytic, receptor/ligand interactions associate cellular membrane type-1 matrix metalloproteinase with the complement component C1q . J Biol Chem. 2004; ; 279 : :50321.–50328. 28.
Vlaicu SI, Tegla CA, Cudrici CD, et al. Role of C5b–9 complement complex and response gene to complement-32 (RGC-32) in cancer . Immunol Res. 2013; ; 56 : :109.–121. 29.
Kaur A, Sultan SHA, Murugaiah V, et al. Human C1q induces apoptosis in an ovarian cancer cell line via tumor necrosis factor pathway . Front Immunol. 2016;; 7. 30.
Nabizadeh JA, Manthey HD, Steyn FJ, et al. The Complement C3a receptor contributes to melanoma tumorigenesis by inhibiting neutrophil and CD4+ T cell responses . J Immunol. 2016; ; 196 : :4783.–4792. 31.
Janelle V, Langlois M-P, Tarrab E, et al. Transient complement inhibition promotes a tumor-specific immune response through the implication of natural killer cells . Cancer Immunol Res. 2014; ; 2 : :200.–206. 32.
Markiewski MM, DeAngelis RA, Benencia F, et al. Modulation of the antitumor immune response by complement . Nat Immunol. 2008; ; 9 : :1225.–1235. 33.
Corrales L, Ajona D, Rafail S, et al. Anaphylatoxin C5a creates a favorable microenvironment for lung cancer progression . J Immunol. 2012; ; 189 : :4674.–4683. 34.
Gunn L, Ding C, Liu M, et al. Opposing roles for complement component C5a in tumor progression and the tumor microenvironment . J Immunol. 2012; ; 189 : :2985.–2994. 35.
Carmeliet P. Angiogenesis in health and disease . Nat Med. 2003; ; 9 : :653.–660. 36.
Singh J, Ahmed A, Girardi G. Role of complement component C1q in the onset of preeclampsia in mice . Hypertension. 2011; ; 58 : :7162.–7164. 37.
Bossi F, Tripodo C, Rizzi L, et al. C1q as a unique player in angiogenesis with therapeutic implication in wound healing . Proc Natl Acad Sci USA. 2014; ; 111 : :420914.. 38.
Nunez-Cruz S, Gimotty PA, Guerra MW, et al. Genetic and pharmacologic inhibition of complement impairs endothelial cell function and ablates ovarian cancer neovascularization . Neoplasia. 2012;; 14 : 994-IN1.. 39.
Rogers LM, Veeramani S, Weiner GJ. Complement in monoclonal antibody therapy of cancer . Immunol Res. 2014; ; 59 : :203.–210. 40.
Meyer S, Leusen JH, Boross P. Regulation of complement and modulation of its activity in monoclonal antibody therapy of cancer . mAbs. 2014;; 6 : :1133.–1144. |