| |
| Med Sci (Paris). 33(10): 878–886. doi: 10.1051/medsci/20173310020.Lymphocytes T folliculaires helper et VIH Unis pour le meilleur et pour le pire Angeline Rouers,1* Raphaël Jeger-Madiot,1 Arnaud Moris,1 and Stéphanie Graff-Dubois1 1Sorbonne universités, UPMC Univ Paris 06, Inserm U1135, CNRS ERL 8255, Centre d’immunologie et des maladies infectieuses, CIMI-Paris, 91, boulevard de l’Hôpital, 75013Paris, France |
Vignette (Photo © Delphine Sauce). Les lymphocytes T exprimant CD4 (LT CD4) jouent un rôle central dans la réponse immunitaire. On les nomme classiquement LT « helper » (LTh) ou LT auxiliaires car ils potentialisent des cellules du système immunitaire présentant diverses fonctions. Pendant longtemps, la réponse lymphocytaire T CD4 auxiliaire a été définie de façon restrictive. Il était en effet considéré qu’un LT CD4 naïf se différenciait à la suite de son interaction avec une cellule dendritique (DC, pour dendritic cells), soit en LTh1 (lymphocyte T helper de type 1), pouvant soutenir la réponse cellulaire, soit en LTh2, impliqué dans la réponse humorale [1]. Outre leurs fonctions auxiliaires, les LT CD4 peuvent aussi avoir des fonctions cytotoxiques [55], souvent oubliées et généralement attribuées aux LT CD8. Aujourd’hui, nous avons une vision plus complète de la diversité des LTh. On distingue les LTh effecteurs (acteurs de la réponse immune) et les LTh régulateurs (qui contrôlent cette réponse). Les LTh effecteurs regroupent, en plus des classiques Th1 et Th2, les lymphocytes Th17, Th9, Th22 [2] et les Tfh, pour lymphocytes T folliculaires helper [3]. Les LTh régulateurs comprennent les Treg naturels (nTreg), les Treg induits (iTreg) et les Tfh régulateurs (Tfr) [3, 4]. Les Tfh, interagissent avec les lymphocytes B (LB) dans les organes lymphoïdes secondaires1 (OLII). Ces interactions permettent aux LB de se différencier en cellules produisant des anticorps de haute affinité qui constituent une barrière efficace et durable contre différents pathogènes. Les LB se différencient ensuite en cellules mémoires ou en plasmocytes, cellules sécrétrices d’anticorps. On distingue les plasmocytes à courte durée de vie (appelés plasmablastes) qui sécrètent d’importantes quantités d’anticorps dans les OLII et dans le sang, et les plasmocytes à longue durée de vie qui se différencient dans la moelle osseuse [5]. Les LB peuvent également se différencier en LB mémoires, une population de cellules quiescentes à longue durée de vie rapidement mobilisables lors d’une seconde rencontre avec l’antigène pour lequel ils ont été sélectionnés, ou d’une réinfection par un pathogène par exemple [6]. Il existe des sous-populations distinctes de LB mémoires qui, lors de leur remobilisation, forment des centres germinatifs2 (CG) secondaires ou se différencient en plasmablastes [7, 8]. L’infection par le virus de l’immunodéficience humaine (VIH) est associée à un dysfonctionnement des LB mémoires et une altération de la production d’anticorps [9]. Sachant le rôle déterminant que jouent les Tfh dans la différenciation et la maturation des LB, comprendre l’origine et la dynamique des populations de Tfh, ainsi que la nature des interactions entre ces cellules et les LB, en particulier dans le contexte de l’infection par le VIH, est donc d’une importance primordiale. Des cellules présentant des caractéristiques communes à celles des Tfh ont été observées dans le sang. Ces Tfh sanguins correspondraient au versant mémoire des Tfh des ganglions. Ils pourraient être le reflet des événements qui se produisent dans les OLII. Un intérêt particulier est donc donné aujourd’hui à ces populations de Tfh sanguines dont l’étude est plus aisée que celle des cellules des organes lymphoïdes chez l’homme. |
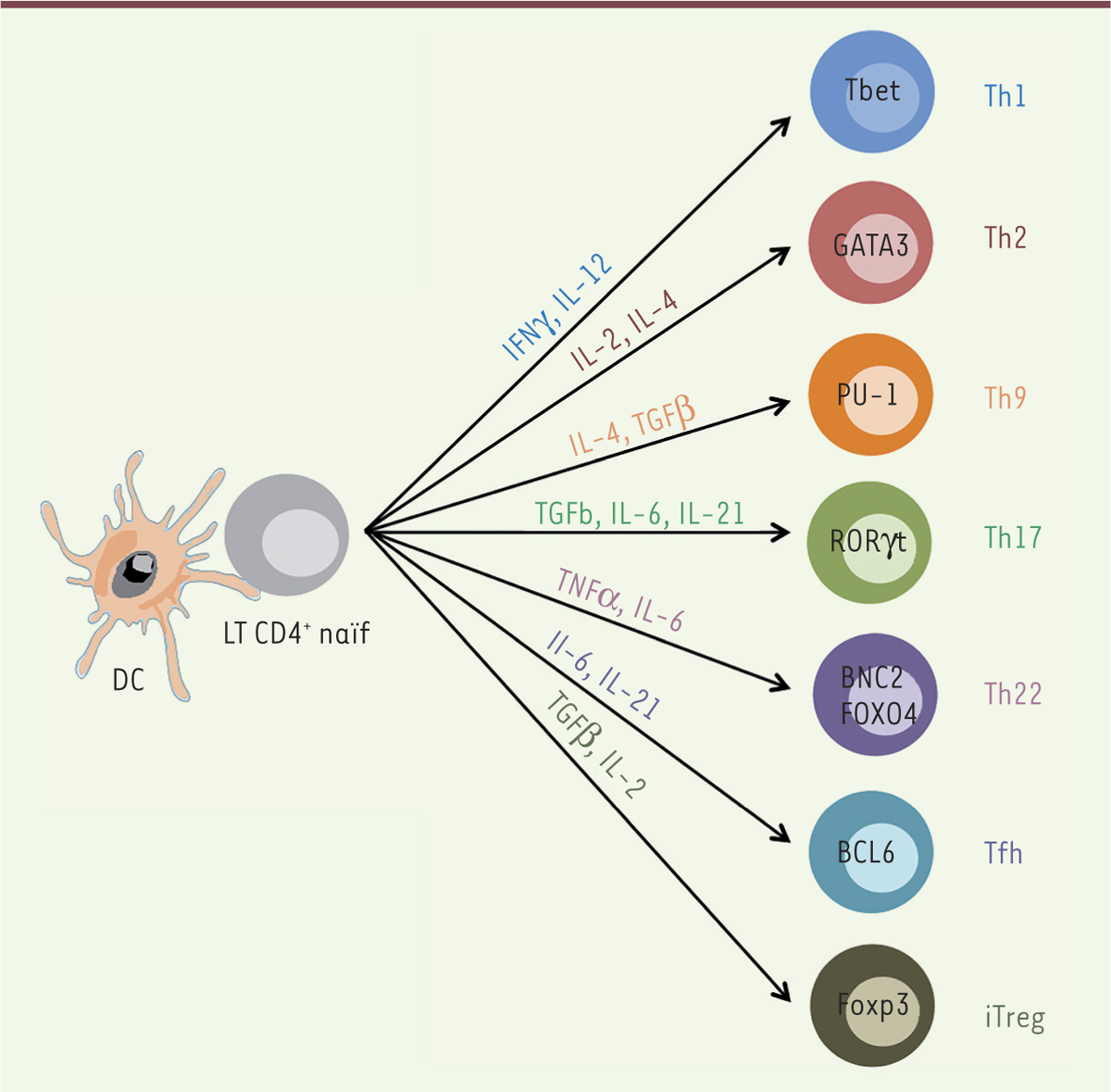
Les lymphocytes T folliculaires helper : origine(s), différenciation(s) et fonctions La différenciation d’un LT CD4 en LTh effecteur est conditionnée par un environnement cytokinique propre à chaque filiation. La sécrétion d’interleukine (IL-) 6 et d’IL-21 par les DC favorise la différenciation des lymphocytes en Tfh chez la souris [10]. Chez l’homme, c’est l’IL-12 qui joue un rôle majeur [11]. La différenciation vers l’un ou l’autre des sous-types de LTh est associée à l’expression de facteurs de transcription spécifiques de la voie de différenciation (Figure 1). Au cours de l’initiation de la différenciation des lymphocytes en Tfh, le répresseur transcriptionnel Bcl-6 (B-cell lymphoma 6), dont l’expression est nécessaire et suffisante à la différenciation des Tfh, est exprimé précocement [12].
 | Figure 1.
Différenciation d’un lymphocyte CD4+ naïf en lymphocyte T « helper ». Selon l’environnement cytokinique imposé par la cellule dendritique (DC), le LT CD4 se différencie en un LTh particulier. Chaque LTh est associé à l’expression d’un facteur de transcription « signature ». Les lymphocytes T régulateurs naturels ne sont pas représentés dans cette figure car ils sont initiés dès leur développement dans le thymus. Bcl6 : B-cell lymphoma 6 ; BNC2 : Basonuclin 2 ; DC : cellule dendritique ; FOXO4 : Forkhead Box O4 ; Foxp3 : forkhead box P3 ; GATA3 : GATA binding protein 3 ; IFN : interferon ; IL : interleukin ; iTreg : induced T regulatory cell ; LT : lymphocyte T ; Tbet : T-box transcription factor ; Tfh : T follicular helper cell ; TGF : transforming growth factor ; Th : T helper ; TNF : tumor necrosis factor ; ROR : RAR-related orphan receptors.
|
La différenciation en Tfh est multifactorielle. Elle se déroule dans les OLII en plusieurs étapes successives aussi bien chez la souris que chez l’homme [13]. Les LT CD4 naïfs interagissent d’abord avec des cellules dendritiques - cellules présentatrices d’antigènes (CPA) dites professionnelles - par l’intermédiaire de leur TCR (T-cell receptor). Le TCR reconnaît à la surface de la cellule dendritique un peptide, issu de la phagocytose et de la dégradation de l’antigène, présenté par les molécules du complexe majeur d’histocompatibilité de classe II (CMH-II). L’affinité de liaison du TCR au complexe CMH-II/peptide joue un rôle déterminant dans la différenciation des LT CD4 [14]. Une forte affinité du TCR combinée à l’interaction des molécules de co-stimulation, comme B7-H2 (ou ICOS-L), le ligand d’ICOS (inducible costimulator) exprimé par les DC, induisent une signalisation permettant la différenciation du lymphocyte en lymphocyte T précurseur de Tfh (ou pré-Tfh) [14, 15]. La différenciation en pré-Tfh s’accompagne également de l’expression par les cellules d’un facteur de relocalisation vers la zone B des OLII (ou cortex) : le récepteur CXCR5 (chemokine C-X-C motif receptor 5) qui lie la chimiokine CXCL13 produite essentiellement par les cellules dendritiques folliculaires localisées au niveau de la zone B. La zone B présente donc de fortes concentrations de CXCL13, attirant ainsi les pré-Tfh situés initialement dans la zone T des OLII (ou paracortex) [16] (Figure 2). À noter que les Tfh produisent également la chimiokine CXCL13 qui présente alors une activité autocrine [17].
 | Figure 2.
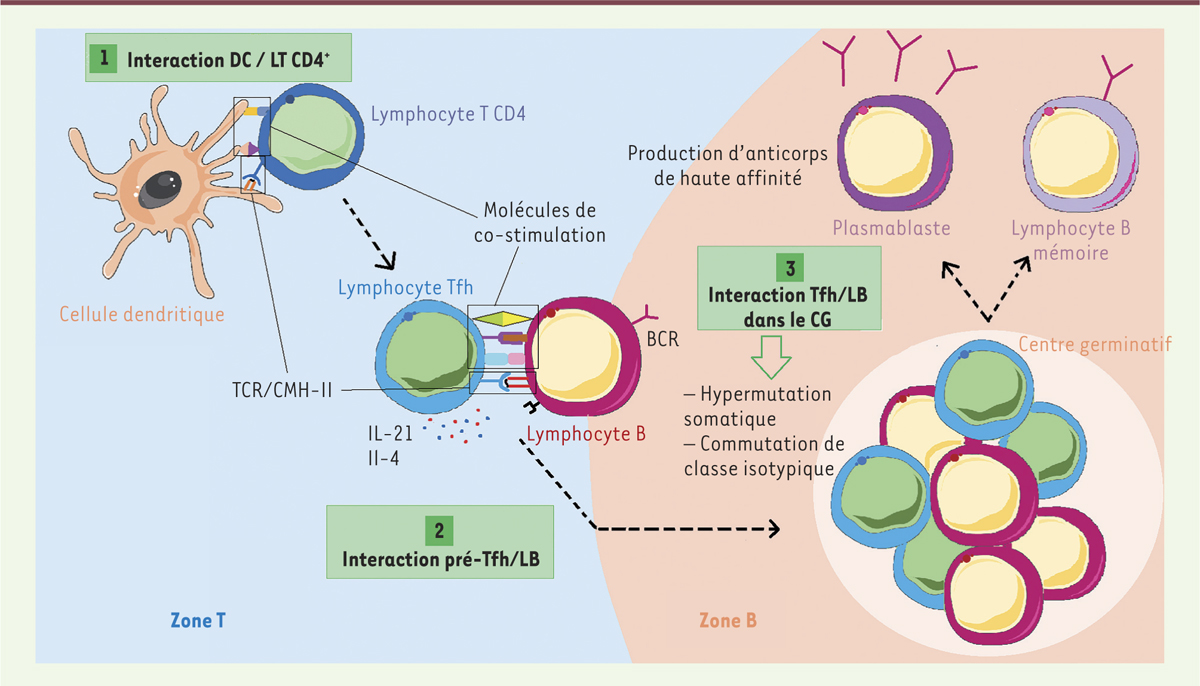
Différenciation des Tfh et réaction du centre germinatif. Une première interaction entre un LT CD4 et une DC dans la zone T permet d’initier la différenciation vers un profil Tfh. En bordure de la zone B, les pré-Tfh interagissent avec des LB pré-activés. Les LB retournent dans la zone B accompagnés des Tfh pour former un CG. Des contacts répétés entre les LB et les Tfh dans le centre germinatif permettent la maturation des anticorps grâce à l’hypermutation somatique et la commutation de classe isotypique. Les anticorps produits ont une haute affinité pour l’antigène. Suite à leurs inter-actions avec les Tfh, les LB se différencient en LB mémoires ou en plasmablastes. BCR : B cell receptor ; CG : centre germinatif ; CMH : complexe majeur d’histocompatibilité ; DC : cellule dendritique ; IL : interleukin ; LB : lymphocyte B ; TCR : T cell receptor, Tfh : T follicular helper cell. |
À la bordure entre les zones T et B, les pré-Tfh interagissent avec des LB activés par une interaction spécifique entre leur TCR et la molécule du CMH-II présentant un peptide exposé à la surface du LB. En effet, les LB sont aussi des CPA qui capturent les antigènes natifs via leurs BCR (B-cell receptor) conduisant à leur internalisation, leur dégradation et à leur présentation sous forme de fragments peptidiques par les molécules du CMH-II. L’interaction TCR/CMH-II est renforcée par la liaison de molécules de co-stimulation comme ICOS/ICOSL, PD-1(programmed cell death 1)/PD-L1(programmed cell death-ligand 1), CD40L/CD40 et OX40 (CD134)/OX40L(CD252) exprimées respectivement par les Tfh et les LB. Les Tfh sécrètent également de l’IL-21 et de l’IL-4 permettant la différenciation des LB [17] (Figure 2). Les LB retournent dans la zone B accompagnés des Tfh pour former un CG. À ce niveau, des contacts répétés entre LB et Tfh (appelés, à ce stade, Tfh du centre germinatif : CG-Tfh) permettent la maturation des LB et leur différenciation en LB mémoires ou en plasmablastes. Les plasmablastes rejoindront ensuite la moelle osseuse pour se différencier en plasmocytes à longue durée de vie. Lors de la maturation des LB, l’hypermutation somatique3, et la commutation de classe isotypique4 du BCR conduisent in fine à l’augmentation de l’affinité et au changement de classe isotypique des anticorps. L’apparition de mutants suivie d’un processus de sélection des LB permettront ensuite la diversification du répertoire (Figure 2)
|
Les lymphocytes T folliculaires régulateurs Des LT folliculaires régulateurs (Tfr) ont été décrits récemment. Ils permettent le contrôle de la production d’anticorps et le retour à un état de repos une fois l’antigène éliminé. Ce contrôle s’exerce sur les interactions entre Tfh et LB. Un défaut de contrôle de la réaction du CG peut ainsi conduire à l’émergence de phénomènes auto-immuns [4]. Les Tfr se différencient à partir de LT régulateurs naturels (Treg) [4]. Leur localisation dans les follicules dépend de l’expression par ces lymphocytes de NFAT2 (nuclear factor of activated T-cells), ce qui n’est pas le cas des Tfh. L’expression de NFAT2 par les Tfr est essentielle pour amorcer l’expression de CXCR5 et donc leur migration dans les follicules. Ces cellules régulatrices expriment les marqueurs classiques des Tfh ainsi que CTLA-4 (cytotoxic T-lymphocyte-associated protein 4) et Foxp3 (forkhead box P3), marqueurs caractéristiques des lymphocytes Treg [4]. Selon une étude récente, les Tfr pourraient également se différencier à partir de LT CD4 naïfs en contexte inflammatoire [18]. |
Un peu d’histoire… La découverte de la coopération entre les LT et les LB conduisant à la production d’anticorps remonte aux années 1960. Parmi les travaux princeps, une étude a montré que la production d’anticorps dirigés contre des globules rouges de mouton était diminuée chez des souris dépourvues de thymus, mettant en évidence le rôle des LT dans la production d’anticorps. Ce rôle des LT dans la production d’anticorps a été confirmé quelques années plus tard par des expériences d’interactions spécifiques réalisées in vitro. Cependant, à cette époque, il était suggéré que les antigènes s’accumulaient à la surface du LT pour être présentés au LB. Au début des années 1970, avec la découverte du rôle des molécules du complexe majeur d’histocompatibilite de classe II (CMH-II) dans la présentation des antigènes, les mécanismes d’interactions entre LT et LB ont été élucidés. Depuis, il est clairement établi que les antigènes sont reconnus de façon spécifique par le récepteur des LT CD4 (le TCR) sous la forme de peptides qui sont associés aux molécules du CMH-II et présentés à la surface du LB. Cette interaction conduit à la maturation et à la différenciation des LB. (d’après N.A. Mitchison [51]) |
|
Tfh et infection par le VIH Dans des pathologies humaines aussi diverses que les maladies auto-immunes, les cas d’immunodéficiences primaires et acquises, ou les cancers, la réponse humorale est altérée. Ces pathologies sont associées à un dysfonctionnement des Tfh à l’origine d’une perturbation de la différenciation des LB et donc à une dérégulation de la production d’anticorps [19]. L’infection par le VIH Dans le cas de l’infection par le VIH, les Tfh ont été étudiés chez les personnes infectées, sous traitement ou non, et chez des patients infectés mais contrôlant naturellement l’infection [ 5]. Le modèle d’infection expérimental des macaques par le SIV (virus de l’immunodéficience simienne) permet aussi d’étudier la dynamique des Tfh dans le contexte infectieux. L’infection par le VIH se décline en trois phases : la primo-infection, la phase chronique et la phase Sida (syndrome de l’immunodéficience acquise). Lors de la phase de primo-infection (entre 2 et 4 semaines), le nombre de LT CD4 (cibles principales du virus) chute et la charge virale augmente de façon exponentielle pour atteindre un pic 3 à 4 semaines après l’exposition. La charge virale est ensuite progressivement contrôlée par l’activité antivirale des LT CD8+. Le nombre de LT CD4 se stabilise alors, marquant l’entrée dans la phase chronique qui peut parfois durer plus de 10 ans. Cette phase peut aussi être appelée « latente », bien que le virus continue de se répliquer. Lors de la phase chronique, en l’absence de traitement, la destruction des LT CD4 qui touche particulièrement les cellules des ganglions et de la rate, est progressive [20]. Une chute des LT CD4 en dessous de 200 cellules/μL de sang entraîne l’apparition de maladies opportunistes et caractérise l’entrée dans la phase Sida. Les Tfh au cours de l’infection La proportion de Tfh dans le contexte de l’infection par le VIH ou le SIV dépend du stade de l’infection (primo-infection ou chronique), de la population de Tfh étudiée (définie par l’expression d’une combinaison de marqueurs), ou de la vitesse de progression vers le stade Sida (patients progresseurs ou contrôleurs
5) (Tableau I) Dans les ganglions, les Tfh constituent des cibles privilégiées de l’infection. Ils représentent d’ailleurs un compartiment majeur pour la réplication et la production de particules virales [ 21]. In vitro, les CG-Tfh issus des ganglions humains non infectés sont hautement susceptibles à l’infection par le VIH [ 22]. Les Tfh sont également des cibles pour le SIV chez les macaques [ 23].
Tableau I.
| Virus |
Stade |
Progression |
Organe |
Phénotype |
Dynamique |
Réf. |
| VIH |
Chronique |
N.D. |
Ganglions |
CXCR5+PD-1+ Bcl-6+
|
Accumulation |
[21] |
|
| VIH |
Chronique |
N.D. |
Ganglions |
CXCR5+PD-1+ Bcl-6+ (CCR7-CD45RA-) |
Accumulation |
[26] |
|
| SIV |
Précoce |
Progresseurs |
Rate |
CXCR5+PD-1+
|
Perte |
[31] |
|
| SIV |
Précoce |
Progresseurs lents |
Ganglions |
CXCR5+PD-1+
|
Accumulation |
[32] |
|
| SIV |
Précoce |
Progresseurs rapides |
Ganglions |
CXCR5+PD-1+
|
Pas
d’accumulation |
[32] |
|
| SIV |
Chronique |
Progresseurs lents |
Ganglions |
CXCR5+PD-1+
|
Accumulation |
[30] |
|
| SIV |
Chronique |
Progresseurs lents |
RateGanglions |
CD45RA-CD62L+ CXCR5+PD-1+
|
Accumulation |
[31] |
|
| SIV |
Chronique |
Progresseurs rapides |
Ganglions |
CXCR5+PD-1+
|
Perte |
[31] |
|
| SIV |
Sida |
Progresseurs |
Ganglions |
CXCR5+PD-1+
|
Perte |
[52] |
|
| SIV |
Chronique |
Contrôleurs |
Ganglions |
CXCR5+PD-1+
|
Préservation |
[52] |
|
| SIV |
Chronique |
Progresseurs |
Ganglions |
CXCR5+PD-1+
|
Accumulation |
[28] |
|
| SIV |
Chronique |
ND |
Ganglions |
CD28fortCD95fort CCR7faiblePD-1fort
|
Accumulation |
[29] |
Dynamique des Tfh observée dans différentes études. Bcl-6 : B-cell lymphoma 6 ; CCR : chemokine (C-C motif) receptor ; CXCR : chemokine (C-X-C motif) receptor ; PD-1 : programmed cell death 1 ; ND : non déterminé. « + » : le marqueur est exprimé ; « - » : le marqueur n’est pas exprimé. |
Les virus VIH ou SIV présentent la particularité de former des réservoirs : intégré dans le génome de la cellule hôte qu’il infecte, le virus peut persister à l’état latent. Les traitements antirétroviraux contrôlent la réplication du virus et la charge virale, mais ne permettent pas l’élimination du virus de l’organisme. Chez les patients, une fraction importante de Tfh porte dans leur génome des copies d’ADN intégrées du VIH [21, 24]. Il est maintenant clairement établi que le virus persiste dans les cellules mémoires, particulièrement dans les Tfh [25]. De façon intéressante, quelques rares patients contrôlent l’infection en l’absence de traitement sans pour autant éliminer le virus (il s’agit des patients contrôleurs naturels). Malgré ce contrôle naturel, le VIH persiste chez ces individus en particulier dans les Tfh des ganglions [25]. Paradoxalement, alors que l’infection des LT CD4 par le VIH conduit à la mort de la cellule en moins de 48h, de nombreuses études ont mis en évidence une augmentation de la proportion de Tfh dans les ganglions des patients traités au stade chronique de l’infection [21, 26]. L’accumulation des Tfh est plus marquée lorsque les patients ne reçoivent pas de traitements antirétroviraux, suggérant un lien avec la persistance du virus. La fréquence des Tfh est en effet corrélée positivement avec la charge virale mesurée dans le plasma [21, 26]. Les OLII concentrent d’importantes quantités de virus [27], notamment dans les cellules dendritiques folliculaires, ce qui pourrait expliquer l’accumulation des Tfh. Cette accumulation de Tfh lors de la phase chronique de l’infection a également été observée dans les ganglions et la rate de macaques infectés par le SIV [28–30]. Cependant, lors de la primo-infection, la proportion de Tfh diffère selon la vitesse à laquelle les macaques progresseront plus tard vers le stade Sida [31, 32]. Ainsi, l’établissement précoce des CG lors de l’infection est un marqueur de bon pronostic chez le macaque [32]. Plusieurs hypothèses pourraient expliquer ce paradoxe entre une proportion de Tfh plus élevée et leur infection préférentielle par le virus (Tableau II) : (a) les Tfh pourraient avoir une capacité de survie ou de prolifération plus importante que les LT CD4 ; (b) l’infection pourrait favoriser la différenciation des LT CD4 en Tfh ; (c) les mécanismes de régulation par les Tfr de l’interaction Tfh/LB pourraient être altérés ; (d) la balance d’expression de facteurs pro et anti-viraux dans les Tfh favoriserait l’intégration du virus et une faible réplication virale. De façon intéressante, le facteur de restriction SAMHD1 (SAM domain and HD domain-containing protein 1), qui limite la réplication virale, est moins exprimé dans les Tfh que dans les LT CD4, rendant ainsi cette population particulièrement susceptible à l’infection [33].
Tableau II.
|
(a) Prolifération/Survie
|
|
|
Observation
|
Population cellulaire VIH+
|
Interprétation
|
En faveur de l’expansion ? |
En faveur de l’infection ? |
Réf.
|
|
| Sous-expression du marqueur de prolifération Ki-67 |
Tfh spléniques |
Pas de meilleure prolifération des Tfh VIH+
|
Non |
Non |
[24] |
|
| Surexpression du marqueur anti-apoptotique Bcl2 |
Lymphocytes CXCR5+
|
Meilleure survie des Tfh VIH+
|
Oui |
Non |
[53] |
|
| Surexpression de PD-L2 |
CG-Tfh |
Tfh VIH+ plus sensible à l’apoptose |
Non |
Non |
[52] |
|
(b) Différenciation en Tfh
|
|
Observation
|
Population cellulaire VIH+
|
Interprétation
|
En faveur de l’expansion ? |
En faveur de l’infection ? |
Réf.
|
|
| Surexpression des gènes codant pour CXCL13 et IL-21 |
Tfh spléniques |
Différenciation poussée en Tfh |
Oui |
Non |
[24] |
|
| Surexpression du gène codant pour le récepteur de l’IL-6 |
LT CD4 VIH+ plus sensibles à une différenciation en TfhLT CD4 naïfs spléniques |
|
Oui |
Non |
Non
publié |
|
(c) Contrôle du CG
|
|
Observation
|
Population cellulaire VIH+
|
Interprétation
|
En faveur de l’expansion ? |
En faveur de l’infection ? |
Réf.
|
|
| Diminution du ratio Tfr/Tfh |
Ratio Tfh/Tfr de macaques SIV+
|
Nombre insuffisant de Tfr pour contrôler les Tfh |
Oui |
Non |
[54] |
|
| Sous-expression des gènes codant pour CTLA4 et IL-10 et diminution de la sécrétion d’IL-10 |
Tfh VIH+ spléniques |
Suggère un défaut fonctionnel des Tfr VIH+ (parmi les Tfh) |
Oui |
Non |
[24] |
|
| Sous-expression du gène codant pour le récepteur de l’IL-2 |
Défaut fonctionnel des Tfr SIV+
|
Tfr SIV+
|
Oui |
Non |
[54] |
|
|
(d) Expression des facteurs de restriction et co-facteurs
|
|
|
Observation
|
Population cellulaire VIH+
|
Interprétation
|
En faveur de l’expansion ? |
En faveur de l’infection ? |
Réf.
|
|
| Expression préférentielle du co-facteur LEDGF/p75 et des facteurs de restriction BST2/tetherin et TRIM5 |
Tfh et CG-Tfh |
Meilleure survie des Tfh VIH+ couplée à une limitation de la réplication du virus dans ces cellules |
Oui |
Oui |
Non publié |
|
| Sous-expression du facteur de restriction SAMHD1 |
Tfh |
Plus forte susceptibilité à l’infection par le VIH |
Non |
Oui |
[33] |
Éléments de la littérature pouvant expliquer le paradoxe entre accumulation et infection préférentielle des Tfh lors de l’infection par le VIH. Bcl2 : B-cell lymphoma 2 ; BST2 : bone marrow stromal cell antigen 2 ; CTLA-4 : cytotoxic T-lymphocyte-associated protein 4 ; CXCL13 : chemokine (C-X-C motif) ligand 13 ; IL : interleukin ; LEDGF/p75 : lens epithelium-derived growth factor ; PD-L2 : Programmed cell-death ligand 2 ; SAMHD1 : SAM domain and HD domain-containing protein 1 ; Tfh : T follicular helper cell ; Tfr : T follicular regulatory cell ; TRIM5 : tripartite motif-containing 5.
|
L’infection par le VIH pourrait aussi altérer les fonctions des Tfh, notamment leur capacité à interagir avec les LB. Ainsi, in vitro, les Tfh des ganglions ou des amygdales de patients infectés par le VIH ont perdu leur capacité à aider les LB pour la production d’IgG [34]. Ce défaut pourrait être lié à une surexpression de PD-L1 à la surface des LB qui inhiberait la sécrétion d’IL-21 par les Tfh via la signalisation PD-1 [34]. Plus récemment, nous avons démontré, par une analyse du profil transcriptionnel, que les Tfh issus de la rate de patients chroniquement infectés ont un défaut d’expression de gènes codant les molécules de co-stimulation OX40, CD40L et ICOS nécessaires aux interactions Tfh/LB et à la maturation des LB [24]. |
Des LT exprimant la molécule CD4 et le récepteur CXCR5 (CD4+CXCR5+) ont été identifiés dans le sang [35]. Ils expriment également la L-selectine (CD62L) et le récepteur CCR7. Ils correspondraient à une sous-population de LT « central mémoire » (les Tcm). Sur le plan fonctionnel, la co-culture de LB isolés du sang avec des LT CD4 CXCR5+ conduit à une plus forte sécrétion d’anticorps par les LB que la co-culture avec des LT n’exprimant pas CXCR5 [36]. Ainsi, Les LT CD4 CXCR5+ circulants correspondraient au versant mémoire périphérique des Tfh, les pTfh [37]. Comparée à celle des Tfh, l’expression de CXCR5 et d’ICOS à la surface des pTfh est moins intense et celle de Bcl-6 est perdue [35, 36]. Les pTfh semblent également sécréter moins de cytokines que les Tfh des OLII [35]. Chez des patients présentant un défaut d’expression d’ICOS, la formation des CG et la production d’anticorps sont altérées, ce qui s’accompagne d’une réduction des pTfh. Cette observation suggère l’existence d’une corrélation positive entre les pTfh et les Tfh des OLII [38]. Les pTfh sont hétérogènes et peuvent être distingués en pTfh1, pTfh2 et pTfh17 selon leur capacité à sécréter les mêmes cytokines que les LT CD4 Th1, Th2 et Th17 [36]. Cette hétérogénéité peut s’expliquer par le contexte cytokinique imposé aux LT CD4 naïfs lors de leur différenciation en LTh. Ainsi, en plus de l’IL-6, l’IL-21 et de l’engagement d’ICOS, indispensables à la différenciation en Tfh, la présence d’IL-12/IFN(interféron)-γ ou d’IL-4 ou d’IL-6/ IL-1β/TGFβ (transforming growth factor β) influencerait respectivement l’apparition de Tfh1, Tfh2 ou Tfh17.
In vitro, chaque population de pTfh présente des aptitudes différentes à promouvoir la production d’anticorps par les LB : Les pTfh1 semblent être moins efficaces que les pTfh2 et pTfh17. De plus, les sous-populations de pTfh sécrètent des cytokines spécifiques qui orientent différemment la commutation de classe isotypique des anticorps [36]. Les pTfh2, par exemple, vont plutôt induire la production d’IgG et d’IgE, tandis que les pTfh17 favorisent la sécrétion d’IgG et d’IgA [36]. Enfin, les pTfh sécrétant de l’IL-21 semblent les plus proches des Tfh des OLII, que ce soit phénotypiquement (expression de Maf et de CXCR5) ou sur le plan fonctionnel [39]. L’expression des marqueurs ICOS, CCR7 et PD-1 témoigne de l’état activé (ICOS+PD-1+CCR7-) ou quiescent (ICOS-PD-1+/-CCR7+) des populations de pTfh. Une sous-population de pTfh CCR7-PD-1hiCXCR5+CD4+ semble provenir de LT n’étant jamais entrés dans les CG [40]. Ces pTfh peuvent induire une réponse anticorps rapide lors d’une réexposition à l’antigène, suggérant l’existence d’une réponse mémoire établie à partir des Tfh [40]. |
pTfh et infection par le VIH Les pTfh, comme les Tfh des OLII, sont préférentiellement infectés par le VIH. Ils constituent un réservoir viral dans le sang [41]. Récemment, l’expression de CD32a, un récepteur pour la région Fc des immunoglobulines (Fc gamma RIIA), a été identifiée comme un marqueur des LT CD4 porteurs de virus intégré latent, c’est-à-dire un marqueur du réservoir [42]. Cette découverte ouvre des perspectives fascinantes quant à la possibilité d’éliminer par immunothérapie le réservoir du virus chez les personnes traitées. à l’heure actuelle, la population de LT CD4 exprimant CD32a n’a pas été précisément caractérisée mais il est fort à parier que les Tfh infectés par le VIH expriment également ce marqueur. Selon l’agent infectieux rencontré, les molécules inflammatoires produites par les cellules immunitaires sont différentes. Le contexte inflammatoire ainsi engendré influence l’apparition dans le sang de pTfh aux profils fonctionnels variés. L’étude du phénotype, de la fréquence et des fonctions des pTfh dans le sang permettrait donc d’apprécier la qualité de l’établissement de la réponse humorale [36]. Les pTfh semblent en effet être de bons marqueurs de l’efficacité vaccinale [39]. En ce qui concerne l’infection par le VIH, un seul essai vaccinal (RV144)6 a conduit, à ce jour, à une protection, bien que limitée, contre l’infection par le virus avec une réduction de 31,2 % du nombre de personnes infectées chez les individus vaccinés par rapport à ceux ayant reçu un placebo [43]. Dans cet essai, les personnes exposées mais non-infectées présentaient une proportion plus élevée de pTfh spécifiques du VIH, produisant de l’IL-21, que des individus participant à d’autres protocoles de vaccination qui n’ont pas permis d’obtenir de protection [39]. Chez les individus vaccinés lors de l’essai, la protection a pu être corrélée à la présence d’anticorps pouvant induire la lyse des cellules infectées par le virus par la réaction d’ADCC (antibody-dependent cellular cytotoxicity)7 [44]. Ces observations suggèrent un rôle important de la réponse anticorps, et donc des Tfh, dans l’établissement de la protection induite par la vaccination. Des résultats similaires ont été obtenus au cours d’un essai vaccinal dans le modèle d’infection par le SIV de primates non humains [45]. Ces différentes études suggèrent que les pTfh pourraient participer à la mise en place d’une réponse anticorps efficace et/ou protectrice contre le virus. L’expansion des pTfh pourrait également être utilisée comme un marqueur de l’efficacité vaccinale. |
Tfh et induction d’anticorps neutralisants : vers de nouvelles stratégies vaccinales ? La découverte récente d’anticorps capables de neutraliser un large spectre d’isolats du VIH (les bnAb pour broadly neutralizing antibodies) qui sont produits par une poignée de patients infectés par le VIH, a relancé l’espoir de pouvoir développer un vaccin efficace. La plupart de ces anticorps présentent un taux important de modifications résultant de mutations somatiques dans les gènes codant les domaines variables des immunoglobulines. Ces modifications sont certainement apportées par les LB lors de leur maturation, grâce à leurs interactions répétées avec les Tfh. Ce taux important de mutations somatiques des nAbs suggère que les LB à l’origine de leur production ont subi plusieurs cycles de maturation. L’hypothèse selon laquelle les Tfh sont importants pour le développement de ces bnAb a donc rapidement été posée. La capacité de neutralisation du VIH par les anticorps serait en fait corrélée à la proportion de pTfh [46]. Une étude plus récente a confirmé ce lien chez des patients contrôleurs naturels, c’est à dire contrôlant naturellement l’infection. Chez ces patients, les DC polarisent la différenciation des LT CD4 en Tfh sécréteurs d’IL-21 qui expriment fortement ICOS et sont capables d’induire la production d’importantes quantités d’IgG par les LB [47]. Ces résultats soulignent donc l’importance du lien existant entre les premières étapes de différenciation en Tfh et la production, plus tardive, d’anticorps à forte capacité de neutralisation. Les réponses au sein des centres germinatifs des OLII sont également importantes à considérer. Il a en effet été montré, chez le singe, que le développement d’anticorps neutralisants dépendait de la proportion des CG-Tfh [48]. La quantité, mais aussi la qualité, des Tfh induits semblent donc déterminer l’efficacité de la réponse anticorps dirigée contre le virus. Seul l’essai vaccinal RV144 a donné lieu à une réduction modérée du taux d’infection par le VIH [43]. La conception d’un vaccin fondé sur la réponse anticorps est complexe à mettre en place en raison des capacités exceptionnelles du virus à s’adapter, par mutation, à la réponse immune de l’hôte. Durant la dernière décennie, des vaccins permettant d’induire une réponse immunitaire cytotoxique dépendant des LT CD8 spécifiques du VIH ont été développés sans succès [49]. Désormais, la découverte des bnAb a changé le paradigme de la vaccination anti-VIH. Un vaccin universel permettant la production de bnAb, reposera nécessairement sur sa capacité à induire la différenciation de Tfh qui soient spécifiques du virus. La preuve de concept de la possibilité d’induire des bnAb contre le VIH a été réalisée chez la souris. Une stratégie d’immunisation en « prime-boost » (c’est à dire avec plusieurs stimulations) utilisant différents antigènes produits à partir de la protéine d’enveloppe du virus a en effet permis de générer des bnAb spécifiques [50]. |
Les Tfh sont indispensables pour la différenciation des LB et la production d’anticorps. Leur différenciation à partir de LT CD4 se déroule en trois étapes successives dans les OLII : (1) un premier contact avec une DC dans la zone T ; (2) une interaction entre un pré-Tfh et un LB à la bordure de la zone T et de la zone B ; (3) une liaison soutenue entre Tfh et LB dans le CG permettant la maturation complète des LB et la production d’anticorps de haute affinité. Une population mémoire des Tfh (pTfh), dont l’origine reste à confirmer, est détectable dans le sang. Ces cellules semblent être de bons marqueurs de l’efficacité vaccinale. Aujourd’hui, nous avons une meilleure compréhension de la biologie des Tfh : leur processus de différenciation, leurs mécanismes d’interaction avec les LB et leur rôle dans la réaction du CG. Cependant, dans des pathologies comme l’infection par le VIH, certains aspects restent mal compris. Plusieurs hypothèses ont été émises concernant l’augmentation des Tfh chez les patients infectés par le VIH mais il s’agit vraisemblablement d’un phénomène multifactoriel. Nous n’avons, à ce jour, aucune donnée concernant l’impact possible de l’infection par le VIH sur les fonctions des Tfh. Il reste donc à déterminer si les perturbations des fonctions des Tfh sont directement dues à leur infection par le VIH, ou si elles sont le résultat de modifications du microenvironnement, ou d’autres acteurs cellulaires, impliqués dans la réaction du CG. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Mosmann T, Coffman R. TH1 and TH2 cells: different patterns of lymphokine secretion lead to different functional properties . Annu Rev Immunol. 1989; ; 7 : :145.–173. 2.
Eyerich S, Eyerich K, Pennino D, et al. Th22 cells represent a distinct human T cell subset involved in epidermal immunity and remodeling . J Clin Invest. 2009; ; 119 : :3573.–3585. 3.
Zhu J, Yamane H, Paul W. Differentiation of effector CD4 T cell populations . Annu Rev Immunol. 2010; ; 28 : :445.–489. 4.
Linterman MA, Pierson W, Lee SK, et al. Foxp3+ follicular regulatory T cells control the germinal center response . Nat Med. 2011; ; 17 : :975.–982. 5.
Kometani K, Kurosaki T. Differentiation and maintenance of long-lived plasma cells . Curr Opin Immunol. 2015; ; 33 : :64.–69. 6.
Kurosaki T, Kometani K, Ise W. Memory B cells . Nat Rev Immunol. 2015; ; 15 : :149.–159. 7.
Dogan I, Bertocci B, Vilmont V, et al. Multiple layers of B cell memory with different effector functions . Nat Immunol. 2009; ; 10 : :129.–129. 8.
Zuccarino-catania G V, Sadanand S, Weisel FJ, et al. CD80 and PD-L2 define functionally distinct memory B cell subsets that are independent of antibody isotype . Nat Immunol. 2014; ; 15 : :631.–637. 9.
Moir S, Fauci AS. Insights into B cells and HIV-specific B-cell responses in HIV-infected individuals . Immunol Rev. 2013; ; 254 : :207.–224. 10.
Karnowski A, Chevrier S, Belz GT, et al. B and T cells collaborate in antiviral responses via IL-6, IL-21, and transcriptional activator and coactivator, Oct2 and OBF-1 . J Exp Med. 2012;; 209 : :2049.–2064. 11.
Schmitt N, Morita R, Bourdery L, et al. Human dendritic cells induce the differentiation of interleukin-21- producing T follicular helper-like cells through interleukin-12 . Immunity. 2009; ; 31 : :158.–169. 12.
Baumjohann D, Okada T, Ansel KM. Cutting edge: distinct waves of BCL6 expression during T follicular helper cell development . J Immunol. 2011; ; 187 : :2089.–2092. 13.
Crotty S. T follicular helper cell differentiation, function, and roles in disease . Immunity. 2014; ; 41 : :529.–542. 14.
Fazilleau N, Mcheyzer-williams LJ, Rosen H, et al. The function of follicular helper T cells is regulated by the strength of T cell antigen receptor binding . Nat Immunol. 2009; ; 10 : :375.–384. 15.
Choi YS, Kageyama R, Eto D, et al. ICOS receptor instructs T follicular helper cell versus effector cell differentiation via induction of the transcriptional repressor Bcl6 . Immunity. 2011; ; 34 : :932.–946. 16.
Nurieva RI, Chung Y, Hwang D, et al. Generation of T follicular helper cells is mediated by interleukin-21 but independent of T helper 1, 2, or 17 cell lineages . Immunity. 2008; ; 29 : :138.–149. 17.
Crotty S. Follicular helper CD4 T cells (TFH) . Annu Rev Immunol. 2011; ; 29 : :621.–663. 18.
Aloulou M, Carr EJ, Gador M, et al. Follicular regulatory T cells can be specific for the immunizing antigen and derive from naive T cells . Nat Commun. 2016; ; 7 : :10579.. 19.
Tangye SG, Ma CS, Brink R, et al. The good, the bad and the ugly - TFH cells in human health and disease . Nat Rev Immunol. 2013; ; 13 : :412.–426. 20.
Pantaleo G, Graziosi C, Demarest JF, et al. HIV infection is active and progressive in lymphoid tissue during the clinically latent stage of disease . Nature. 1993; ; 362 : :355.–358. 21.
Perreau M, Savoye AL, De Crignis E, et al. Follicular helper T cells serve as the major CD4 T cell compartment for HIV-1 infection, replication, and production . J Exp Med. 2013; ; 210 : :143.–156. 22.
Kohler SL, Pham MN, Folkvord JM, et al. Germinal center T follicular helper cells are highly permissive to HIV-1 and alter their phenotype during virus replication . J Immunol. 2016; ; 196((6)) :2711.–2722. 23.
Fukazawa Y, Lum R, Okoye A, et al. B cell follicle sanctuary permits persistent productive simian immunodeficiency virus infection in elite controllers . Nat Med. 2015;; 21 : :132.–139. 24.
Colineau L, Rouers A, Yamamoto T, et al. HIV-infected spleens present altered follicular helper T Cell (Tfh) subsets and skewed B cell maturation . PLoS One. 2015; ; 10 : :e0140978.. 25.
Boritz EA, Darko S, Swaszek L, et al. Multiple origins of virus persistence during natural control of HIV infection . Cell. 2016; ; 166 : :1004.–1015. 26.
Lindqvist M, Van Lunzen J, Soghoian DZ, et al. Expansion of HIV-specific T follicular helper cells in chronic HIV infection . J Clin Invest. 2012; ; 122 : :3271.–3280. 27.
Embretson J, Zupancic M, Ribas JL, et al. Massive covert infection of helper T lymphocytes and macrophages by HIV during the incubation period of AIDS . Nature. 1993; ; 362 : :359.–362. 28.
Xu H, Wang X, Malam N, et al. Persistent SIV infection drives differentiation, aberrant accumulation, and latent infection of germinal center follicular T helper cells . J Virol. 2015;; 90 : JVI.02471-15.. 29.
Petrovas C, Yamamoto T, Gerner MY, et al. CD4 T follicular helper cell dynamics during SIV infection . J Clin Invest. 2012; ; 122 : :3281.–3294. 30.
Hong JJ, Amancha PK, Rogers K, et al. Spatial alterations between CD4+ T follicular helper, B, and CD8+ T cells during simian immunodeficiency virus infection: T/B cell homeostasis, activation, and potential mechanism for viral escape . J Immunol. 2012; ; 188 : :3247.–3256. 31.
Moukambi F, Rabezanahary H, Rodrigues V, et al. Early loss of splenic Tfh cells in SIV-Infected rhesus macaques . PLoS Pathog. 2015; ; 11 : :e1005287.. 32.
Hong JJ, Amancha PK, Rogers KA, et al. Early lymphoid responses and germinal center formation correlate with lower viral load set points and better prognosis of simian immunodeficiency virus infection . J Immunol. 2014; ; 193 : :797.–806. 33.
Ruffin N, Brezar V, Ayinde D, et al. Low SAMHD1 expression following T-cell activation and proliferation renders CD4+ T cells susceptible to HIV-1 . Aids. 2015; ; 1 : 34.
Cubas R, Mudd JC, Savoye A-L, et al. Inadequate T follicular cell help impairs B cell immunity during HIV infection . Nat Med. 2013;; 19 : :494.–499. 35.
Schaerli P, Willimann K, Lang B, et al. CXC chemokine receptor 5 expression defines follicular homing T cells with B cell helper function . J Exp Med. 2000; ; 192 : :1553.–1562. 36.
Morita R, Schmitt N, Bentebibel S-E, et al. Human blood CXCR5+CD4+ T cells are counterparts of T follicular cells and contain specific subsets that differentially support antibody secretion . Immunity. 2011; ; 34 : :108.–121. 37.
Chevalier N, Jarrossay D, Ho E, et al. CXCR5 expressing human central memory CD4 T cells and their relevance for humoral immune responses . J Immunol. 2011; ; 186 : :5556.–5568. 38.
Bossaller L, Burger J, Draeger R, et al. ICOS deficiency is associated with a severe reduction of CXCR5+CD4 germinal center Th cells . J Immunol. 2006; ; 177 : :4927.–4932. 39.
Schultz BT, Teigler JE, Pissani F, et al. Circulating HIV-specific interleukin-21+CD4+ T cells represent peripheral Tfh cells with antigen-dependent helper functions . Immunity. 2016; ; 44 : :167.–178. 40.
He J, Tsai LM, Leong YA, et al. Circulating precursor CCR7loPD-1hi CXCR5+ CD4+ T cells indicate Tfh cell activity and promote antibody responses upon antigen reexposure . Immunity. 2013; ; 39 : :770.–781. 41.
Pallikkuth S, Sharkey M, Babic DZ, et al. Peripheral T follicular helper cells are the major HIV reservoir within central memory CD4 T cells in peripheral blood from chronic HIV infected individuals on cART . J Virol. 2015; JVI.02883-15.. 42.
Descours B, Petitjean G, López-Zaragoza J-L, et al. CD32a is a marker of a CD4 T-cell HIV reservoir harbouring replication-competent proviruses . Nature. 2017; ; 543 : :564.–567. 43.
Rerks-Ngarm Supachai, Punnee Pitisuttithum SN, Kaewkungwal Jaranit, et al. Vaccination with ALVAC and AIDSVAX to prevent HIV-1 infection in Thailand . N Engl J Med. 2009; ; 361 : :2209.–2220. 44.
Bonsignori M, Pollara J, Moody MA, et al. Antibody-dependent cellular cytotoxicity-mediating antibodies from an HIV-1 vaccine efficacy trial target multiple epitopes and preferentially use the VH1 gene family . J Virol. 2012; ; 86 : :11521.–11532. 45.
Vargas-inchaustegui DA, Demers A, Julia M, et al. Vaccine induction of lymph node: resident simian immunodeficiency virus Env-specific T follicular helper clls in Rhesus macaques . J Immunol. 2016; ; 196 : :1700.–1710. 46.
Locci M, Havenar-Daughton C, Landais E, et al. Human circulating PD-1+CXCR3−CXCR5+ memory Tfh cells are highly functional and correlate with broadly neutralizing HIV antibody responses . Immunity. 2013; ; 39 : :758.–769. 47.
Martin-Gayo E, Cronin J, Hickman T, et al. Circulating CXCR5+CXCR3+PD-1lo Tfh-like cells in HIV-1 controllers with neutralizing antibody breadth . JCI Insight. 2017; ; 2 : :412.–425. 48.
Havenar-Daughton C, Carnathan DG, Torrents de la Pena A, et al. Direct probing of germinal center responses reveals immunological features and bottlenecks for neutralizing antibody responses to HIV Env trimer . Cell Rep. 2016; ; 17 : :2195.–2209. 49.
Koup RA, Douek DC. Vaccine design for CD8 T lymphocyte responses . Cold Spring Harb Perspect Med. 2011 ; :1.–15. 50.
Mouquet H. Tailored immunogens for rationally designed antibody-based HIV-1 vaccines . Trends Immunol. 2015 ; :1.–3. 51.
Mitchison NA. T-cell–B-cell cooperation . Nat Rev Immunol. 2004; ; 4 : :1599.–1601. 52.
Xu H, Wang X, Malam N, et al. Persistent simian immunodeficiency virus infection causes ultimate depletion of follicular Th cells in AIDS . J Immunol. 2015; ; 195 : :43517.. 53.
Haas MK, Levy DN, Folkvord JM, et al. Distinct patterns of Bcl-2 expression occur in R5- and X4-tropic HIV-1-producing lymphoid tissue cells infected ex vivo . AIDS Res Hum Retrovir. 2014; ; 30 : :1.–7. 54.
Chowdhury A, Del Rio PME, Tharp GK, et al. Decreased T follicular regulatory cell/T follicular helper cell (TFH) in simian immunodeficiency virus-infected Rhesus macaques may contribute to accumulation of TFH in chronic infection . J Immunol. 2015; ; 195 : :3237.–3247. 55.
Marshall NB, Swain SL. Cytotoxic CD4 T cells in antiviral immunity . J Biomed Biotechnol. 2011; ; 2011 : :954602.. |