Afin d’explorer les mécanismes impliqués dans la formation des CN, nous avons étudié la possibilité que le virus de la rage puisse détourner une structure cellulaire pour former ses usines. Nous avons recherché la présence, au sein des CN, de marqueurs de compartiments cellulaires, notamment des granules ARN (comme les processing bodies ou granules de stress [GS]). Les granules ARN sont des compartiments composés d’ARN et de protéines, dépourvus de membrane et comparables aux CN [6]. Nous n’avons pas pu mettre en évidence de co-localisation entre les granules ARN cellulaires et les CN, indiquant ainsi que ces derniers ne correspondent à aucune structure cellulaire connue. En revanche, nous avons observé l’apparition de GS dans le cytoplasme des cellules infectées (
Figure 1A
) [7]. Les GS sont des structures qui sont impliquées dans la réponse cellulaire au stress. La cellule s’adapte, en effet, afin de supporter les stress qui l’agressent et qui sont de natures variées (stress oxydant, rayons ultra-violet, stress thermique, etc.). L’une des conséquences de ces agressions peut être l’arrêt global de la traduction au profit de la production de certains ARNm (messagers) qui codent des protéines de réponse au stress comme les protéines HSP (heat shock protein). Les ARNm réprimés peuvent être dégradés ou stockés jusqu’à la levée du stress. Des structures spécifiques sont impliquées dans ces processus, plus particulièrement les GS, qui concentrent les ARNm en attente de traduction. Leur apparition fait suite au blocage de l’initiation de la traduction, principalement via la phosphorylation du facteur d’initiation de la traduction eIF2α [8]. L’inhibition générale de la traduction est un moyen, pour la cellule, de lutter contre les infections virales, et l’apparition de GS a été observée en réponse à différentes infections. Certains virus sont capables d’inhiber la formation de ces granules, d’autres les détournent à leur profit [9]. Dans la majorité des cas, l’induction des GS est transitoire et des mécanismes d’échappement ont été développés par les virus.
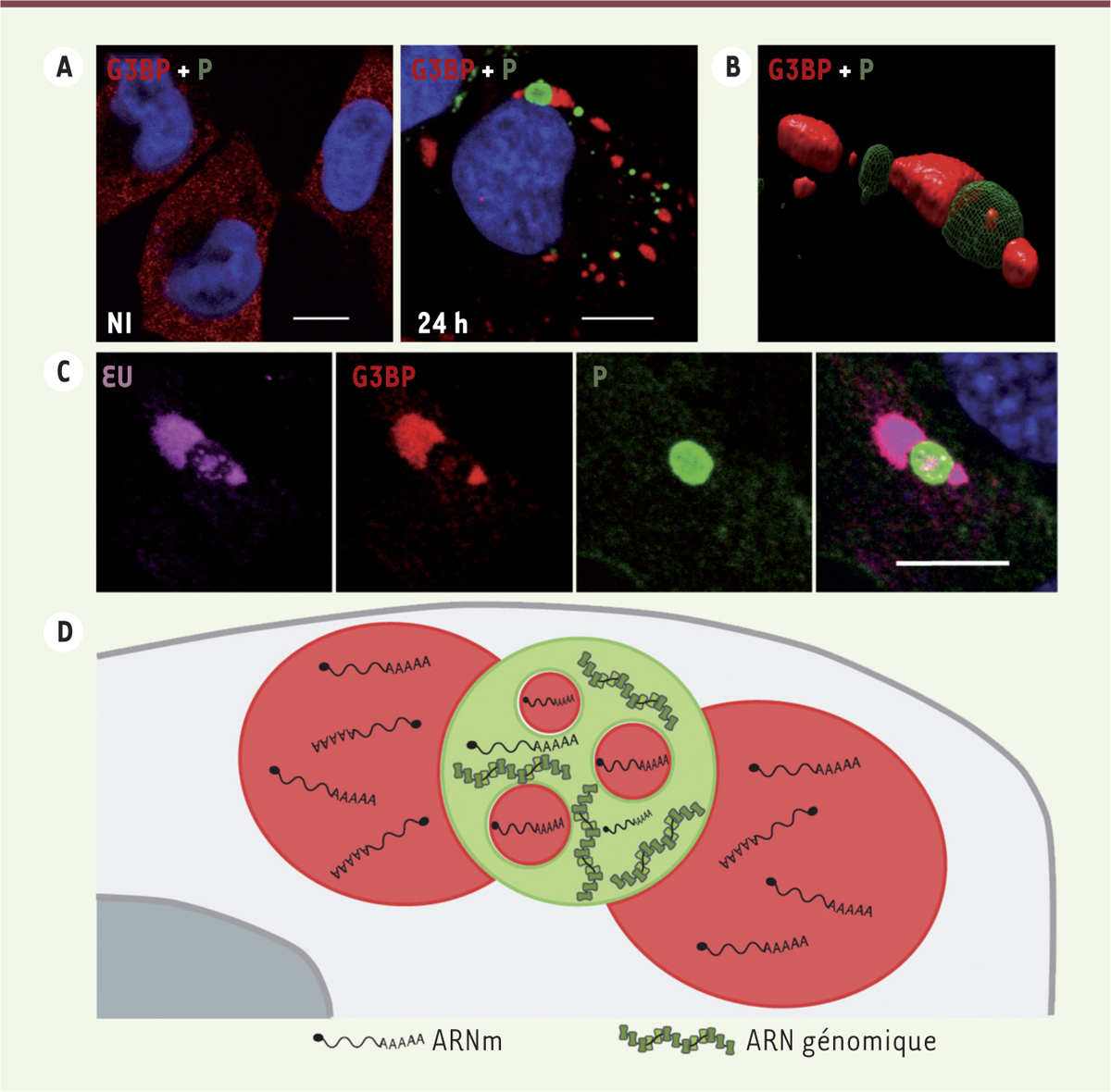
 | Figure 1.
Les granules de stress détectés à proximité des corps de Negri dans les cellules infectées par le virus de la rage recrutent les ARN messagers viraux. A. Les granules de stress (GS) visualisés par marquage fluorescent (G3BP1 [Ras GTPase-activating protein-binding protein 1] en rouge) sont présents en nombre important dans le cytoplasme des cellules infectées. Les GS sont souvent proches des corps de Negri (CN) qui sont détectés par la phosphoprotéine (P en vert). Les noyaux sont colorés en bleu. L’échelle correspond à 10 µm. B. Reconstruction tridimensionnelle montrant que les GS (rouge) et les CN (vert) sont des structures distinctes mais juxtaposées. On peut aussi visualiser des inclusions de GS à l’intérieur des CN. C. Les ARN viraux (marquage magenta par le 5-éthynyl uridine - EU) synthétisés dans les CN (vert) sont ensuite recrutés dans les GS (rouge). D. Schéma récapitulant les caractéristiques des GS et la localisation des ARN viraux. |
Plusieurs souches de virus rabique peuvent induire la formation de GS dans différents types cellulaires, notamment au cours de l’infection de cultures de neurones primaires. Dès 8 h après l’infection, les GS apparaissent dans un faible pourcentage de cellules. La quasi-totalité des cellules deviennent positives pour les GS 24 h après l’infection. Tous les marqueurs conventionnels des GS - TIA-1 (T-cell intracellular antigen 1), G3BP1 (Ras-GTPase-activating protein-binding protein 1), PABP (poly[A]-binding protein) - sont présents dans les granules induits par le virus, indiquant qu’il s’agit vraisemblablement de GS canoniques.
Les granules de stress sont très dynamiques et intimement liés aux corps de Negri
Des expériences de vidéo-microscopie en temps réel réalisées sur des cellules infectées ont montré que les GS induits par le virus de la rage sont des structures dynamiques. Leur taille augmente grâce à des évènements de fusion, et ils se concentrent à proximité des usines virales [
7]. Les GS subissent des cycles d’assemblage/désassemblage et la fraction de cellules infectées qui en présentent est en fait le résultat d’un équilibre dynamique entre leur formation et leur disparition.
Une reconstruction tridimensionnelle d’une cellule infectée, réalisée à partir d’images obtenues par microscopie confocale, a montré que les GS et les CN sont deux structures distinctes mais qui sont intimement liées. Il est en effet possible de visualiser des inclusions de GS au sein des usines virales (
Figure 1B
). En raison de cette grande proximité, nous avons recherché s’il existait des échanges de matériels entre les deux structures. Un marquage métabolique court, à l’aide d’un analogue de nucléotide (5-éthynyl uridine - EU), suivi d’une « chasse », a montré que les ARN viraux, synthétisés dans les CN, s’accumulent ensuite dans les GS (
Figure 1C
). La nature des ARN viraux présents dans les GS a été précisée par la technique d’hybridation fluorescente in situ (fluorescent in situ hybridation - FISH) : les ARNm viraux sont présents dans les CN et les GS, alors que les ARN génomiques restent strictement localisés dans les usines virales (
Figure 1D
) [7]. L’ensemble de ces données révèle ainsi l’existence d’un transport spécifique d’ARN viraux entre les CN et les GS, et d’une connexion entre les deux compartiments.
Rôle antiviral des GS
Le recrutement des ARNm viraux dans les GS suggère qu’ils pourraient avoir un rôle dans la réponse antivirale. Les ARN présents dans ces structures sont en effet dans un état réprimant leur traduction. Une étude, réalisée par ARN interférence, montre en parallèle, que l’inhibition de l’expression de la protéine kinase dépendante de l’ARN (PKR), qui diminue significativement la formation des GS, favorise la multiplication du virus en augmentant la traduction des ARNm viraux [
7]. La PKR est une kinase activée par les ARN double brins, intermédiaires réplicatifs de nombreux virus, qui a pour substrat le facteur d’initiation de la traduction eIF2α [
10]. L’inhibition de l’enzyme s’accompagne également d’une réduction de l’expression du gène codant l’interféron-β en réponse à l’infection [
7]. Ces résultats confortent donc le rôle antiviral des GS dans le cadre de l’infection rabique. Un lien entre GS et induction de la réponse immunitaire innée a d’autre part été décrit [
11]. Les GS pourraient ainsi être impliqués dans la détection de pathogènes, comme le suggère la présence dans ces structures de récepteurs de l’immunité innée (RIG-I [
retinoic acid-inducible gene I] et MDA5 [
melanoma differentiation-associated protein 5], deux ARN hélicases). PKR semble avoir également un rôle pivot dans la détection du virus de la rage : elle est nécessaire à la formation des GS et à l’induction de la réponse immunitaire innée, qui reste toutefois insuffisante pour prévenir la réplication virale.
Le virus de la rage induit la formation des GS dont il tolère la présence tout au long de son cycle sans pour autant avoir développé de mécanismes d’échappement. Ceci n’a, à notre connaissance, été décrit pour aucun autre virus. La présence des GS pourrait permettre au virus de la rage de se répliquer à bas bruit. Il n’entraîne pas, en effet, la mort des cellules qu’il infecte, ce qui lui permet de persister longtemps au sein des neurones infectés in vivo. La présence des GS pourrait donc représenter pour le virus un avantage au vu de sa physiopathologie.