| |
| Med Sci (Paris). 33(11): 924–926. doi: 10.1051/medsci/20173311003.Du cyclope à la réalité Un nouveau regard sur la génétique de l’holoprosencéphalie Valérie Dupé,1 Christèle Dubourg,1,2 Marie de Tayrac,1,2 and Véronique David1,2* 1UMR 6290 CNRS, institut de génétique et développement de Rennes, université de Rennes1, France 2Service de génétique moléculaire et génomique, CHU Pontchaillou, 2, rue Henri Le Guilloux, 35033Rennes, France MeSH keywords: Facteurs de croissance fibroblastique, Génotype, Holoprosencéphalie, Humains, Mutation, Pénétrance, Phénotype, Diagnostic prénatal, génétique |
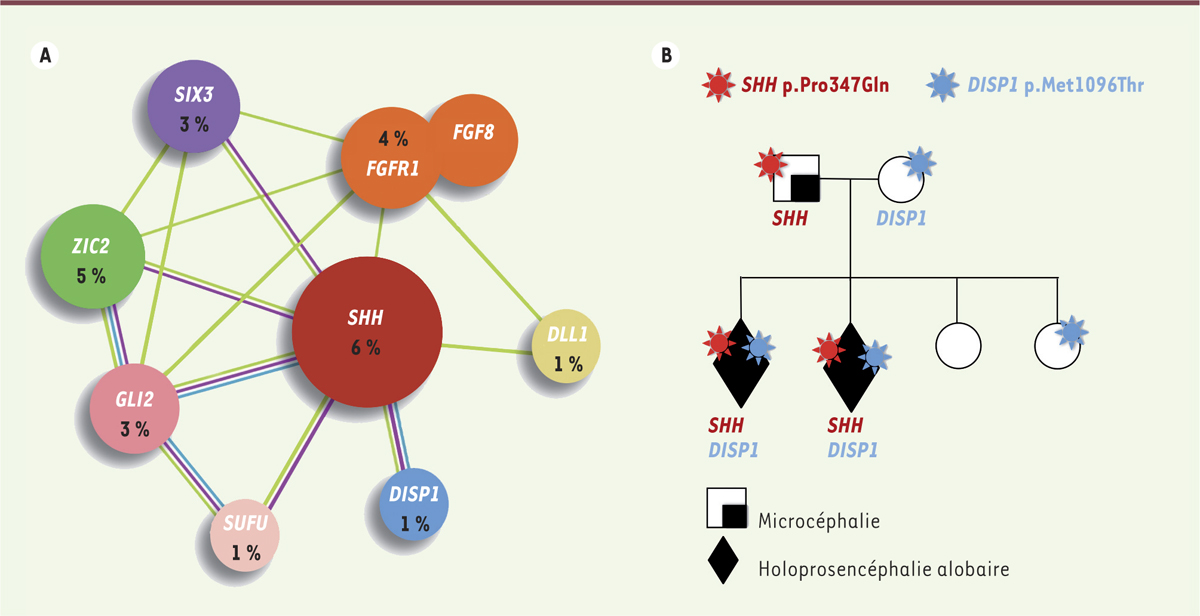
L’holoprosencéphalie, une pathologie hétérogène La division anormale des deux hémisphères du cerveau pendant les premières semaines de la grossesse entraîne la survenue d’une maladie appelée holoprosencéphalie (HPE). C’est une maladie rare… toutefois pas si rare ! En effet, cette pathologie est la malformation cérébrale congénitale la plus fréquente chez l’homme [1]. Elle est caractérisée par des altérations du clivage du cerveau antérieur et des anomalies faciales de la ligne médiane. Une holoprosencéphalie se développe lorsque la séparation des deux hémisphères cérébraux se réalise anormalement entre la 3e et la 6e semaine de la vie intra-utérine. L’holoprosencéphalie peut présenter différents degrés de sévérité : la forme alobaire1, caractérisée par une absence complète de séparation des hémisphères cérébraux jusqu’à la présence d’un œil unique (communément appelée « cyclopie ») ; la forme semi-lobaire ; la forme lobaire, moins sévère ; et enfin, des microformes, avec parfois une simple malformation labiale ou palatine, ou une incisive médiane unique, mais présentant toujours une déficience intellectuelle. La sévérité de la malformation cérébrale est corrélée à la précocité de l’apparition de l’anomalie au cours du développement. L’holoprosencéphalie peut avoir pour origine des facteurs environnementaux comme le diabète insulino-dépendant et l’alcoolisme maternels. Elle peut également être la conséquence d’importantes anomalies chromosomiques (les trisomies 13 et 18), ou faire partie intégrante de syndromes polymalformatifs (comme ceux de Smith-Lemli-Opitz, Pallister-Hall et Hartsfield). Enfin, dans 40 % des cas, elle peut être d’origine génétique. Cette pathologie présente une importante variabilité clinique qui résulte probablement de sa grande hétérogénéité génétique. Plusieurs gènes ont été impliqués dans l’HPE depuis 1996 et, à ce jour, des mutations ont été décrites dans 16 gènes différents : des gènes dits « majeurs » car impliqués dans plus de 1 % des cas, et des gènes dits « mineurs » car mutés dans moins de 1 % des cas [2]. Globalement, tout ces gènes appartiennent aux principales voies de signalisation orchestrant la formation du cerveau au cours du développement embryonnaire (comme SHH [sonic hedgehog], NODAL [membre de la famille du transforming growth factor b], FGF [fibroblastic growth factor] ou NOTCH [signalisation inter-cellulaire]) [2, 3]. Parmi ces gènes, l’un d’eux se distingue : sonic hedgehog. SHH est un gène qui code une molécule qui diffuse selon un gradient de concentration dans le tube neural pour permettre la différenciation des structures ventrales [4, 5] (→). (→) Voir la Nouvelle de J. Ferent et al., m/s n° 6-7, juin-juillet 2014, page 705 La régulation de sa concentration est cruciale pour un développement cérébral correct et, lorsqu’elle n’est pas optimale, une holoprosencéphalie apparaît [6]. Tous les autres gènes impliqués dans cette pathologie interagissent fonctionnellement et ils sont, de près ou de loin, impliqués dans la régulation de la concentration de SHH (
Figure 1A
). L’hypothèse de notre équipe est qu’en régulant l’activité de SHH, les gènes impliqués dans l’holoprosencéphalie participent de façon concertée à l’apparition de la maladie. L’holoprosencéphalie serait donc une maladie du dosage de l’activité de SHH.
 | Figure 1.
Génétique et transmission de l’holoprosencéphalie. A. Représentation simplifiée du réseau de gènes impliqués dans l’holoprosencéphalie. La fréquence des mutations délétères retrouvées chez 270 patients atteints d’holoprosencéphalie est indiquée pour chaque gène. DISP1 : dispatched RND transporter family member 1 ; DLL1 : delta-like canonical notch ligand 1 ; FGF : fibroblast growth factor ; FGFR : fibroblast growth factor receptor ; GLI2 : zinc -finger protein ; SHH : sonic hedgehog ; SIX3 : six homeobox-3 ; SUFU : negative regulator of hedgehog signaling ; ZIC2 : zinc-finger protein-2.
B. Exemple de transmission digénique chez une famille atteinte d’holoprosencéphalie. SHH p.Pro347Gln : protéine sonic hedgehog mutée, la proline 347 est remplacée par une glutamine ; DISP1 p.Met1096Thr : protéine DISP1 (dispatched RND transporter family member 1) mutée, le résidu méthionine 1096 est remplacé par une thréonine. |
|
FGF, une nouvelle voie de signalisation majeure Grâce aux centres labellisés « anomalies du développement », le CHU de Rennes a recruté la plus grande cohorte existant au niveau mondial, de patients atteints d’holoprosencéphalie. La mise à disposition de cette cohorte pour la recherche rend possible l’exploration des bases moléculaires de l’holoprosencéphalie d’origine génétique. Auparavant, seuls les gènes considérés comme majeurs (SHH, SIX3 [six homeobox-3], ZIC2 [zinc-finger protein-2] et TGIF [TGFB-induced factor homeobox]) étaient examinés, pour le diagnostic, de façon séquentielle par la technique de séquençage de Sanger. L’arrivée des techniques de séquençage à haut débit (NGS, next generation sequencing) nous a permis d’étudier systématiquement 20 gènes déjà impliqués, ou suspectés de l’être, dans l’apparition de l’holoprosencéphalie [7]. (→).
(→) Voir la Nouvelle de D. Stoppa-Lyonnet et C. Houdayer, m/s n° 2, février 2012, page 123
Cette étude, menée sur 270 patients, nous a permis d’affiner la fréquence des mutations pour chacun de ces gènes [8]. Ainsi, des mutations à effets délétères ont été identifiées dans environ 25 % des cas et ont été retenues pour le diagnostic ; des variants moins significatifs ont également été observés dans 10 % des cas, tous à l’état hétérozygote. Ces travaux, revisitant l’importance relative des gènes responsables de l’holoprosencéphalie, ont confirmé la complexité génétique de cette maladie. Dans cette nouvelle classification, SHH, ZIC2 et SIX3 restent les gènes majeurs en termes de fréquence. Ils sont suivis de près par GLI2 (zinc-finger protein), FGF8 (fibroblastic growth factor-8) et FGFR1 (fibroblastic growth factor receptor-1), tandis que DLL1 (delta-like canonical notch ligand 1), DISP1 (dispatched RND transporter family member 1) et SUFU (negative regulator of hedgehog signaling) conservent leur statut de gènes mineurs (
Figure 1A
). Nous avons montré que les gènes codant les facteurs de croissance des fibroblastes (FGF) sont bien plus impliqués dans l’apparition de l’holoprosencéphalie que ce qui était attendu, très certainement parce qu’ils contrôlent la concentration de SHH disponible au niveau du cerveau. Ces résultats montrent l’importance de la voie de signalisation FGF et soulignent la nécessité de la considérer comme une voie majeure impliquée dans cette pathologie. Nous proposons que l’analyse des gènes codant le récepteur FGFR1 et son ligand FGF8 soient systématiquement inclus dans la démarche diagnostique. |
Nouveaux modes de transmission pour l’holoprosencéphalie Les travaux que nous avons réalisés nous ont également permis de reconsidérer le mode de transmission de cette pathologie, initialement décrit comme dominant dans les études épidémiologiques [9]. Des études familiales ont montré que la plupart des mutations, identifiées chez les patients porteurs d’une forme sévère, étaient héritées d’un parent atteint d’une forme mineure voire asymptomatique (70 % des mutations SHH et SIX3, et 30 % de celles de ZIC2 sont héritées). La pénétrance de la maladie s’avère ainsi incomplète y compris au sein d’une même famille, ce qui suggère qu’au moins un évènement génétique supplémentaire est nécessaire à l’apparition de l’holoprosencéphalie. En accord avec cette possibilité, dans de nombreux modèles de souris transgéniques, les animaux ne développent pas d’holoprosencéphalie sévère lorsqu’un seul gène est inactivé, l’inactivation de deux gènes étant nécessaire pour entraîner un phénotype de cyclopie [10]. Chez l’homme, des cas de digénisme2, ont également été rapportés [1]. Ces différentes observations convergent vers l’existence d’une transmission digénique voire multigénique de l’holoprosencéphalie. De nouveaux arguments en faveur de ce modèle ont été apportés grâce aux techniques de NGS. Notre équipe a ainsi montré que 16 % des mutations étaient en fait associées à une deuxième altération (par exemple, les associations : SHH/DISP1, FGF8/FGFR1, FGF8/DLL1, DLL1/SHH, DISP1/DISP1 ou DISP1/SUFU). Pour certaines familles, une parfaite co-ségrégation des deux mutations avec la forme sévère de la pathologie a pu être mise en évidence, tandis que la présence d’une seule de ces mutations n’était associée qu’à une forme mineure, comme une microcéphalie isolée (
Figure 1B
) [11]. Plusieurs modes de transmission existent donc pour l’holoprosencéphalie. Le mode autosomique dominant se vérifie pour les mutations qui surviennent de novo (70 % des mutations de ZIC2, 30 % des mutations de SHH et de SIX3). Mais nous avons pu identifier, dans les familles consanguines, un mode de transmission autosomique récessif pour certaines mutations, essentiellement au niveau de gènes mineurs [12]. Dans la plupart des familles, cependant, il s’agirait très certainement d’une hérédité multigénique où les effets des mutations engendreraient collectivement une diminution de la concentration de SHH en-deçà d’une valeur critique, ou valeur seuil, à partir de laquelle l’holoprosencéphalie apparaîtrait. Nos résultats présagent ainsi des répercussions importantes sur le conseil génétique de l’holoprosencéphalie, qui repose aujourd’hui principalement sur l’imagerie fœtale. Ils doivent donc inciter à une grande prudence pour le diagnostic prénatal. À l’exception des mutations de novo, le diagnostic moléculaire ne peut plus se contenter de l’identification d’une seule mutation causative, mais doit considérer la possibilité d’une transmission multigénique. La démonstration d’un tel mode de transmission ne peut cependant s’appuyer uniquement sur des études familiales et nécessitera la mise en œuvre de tests fonctionnels dédiés. |
Pour l’holoprosencéphalie, et plus généralement pour toutes les pathologies multigéniques, le NGS présente un intérêt majeur. L’étude simultanée d’un grand nombre de gènes a permis l’identification de plusieurs mutations chez un même patient. Ces mutations ont des répercussions délétères et elles seraient collectivement nécessaires pour provoquer l’apparition de l’anomalie. C’est l’existence d’une cohorte importante, constituée depuis plus de 20 ans au CHU de Rennes, qui rend exploitable ces données de la génétique moderne. Cette cohorte nous a permis d’évaluer à nouveau l’implication des gènes cibles et de mettre en évidence une nouvelle voie de signalisation dans l’holoprosencéphalie. Malgré ces avancées notables, 70 % des cas d’holoprosencéphalie d’origine génétique n’ont pas de diagnostic moléculaire. Il est donc important de poursuivre la recherche de nouveaux gènes candidats pour cette pathologie. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Nos travaux sont soutenus par l’Agence de la biomédecine, le projet innovation du CHU de Rennes, la Fondation maladies rares et l’Agence nationale de la recherche. Nous remercions les cliniciens, les fœtopathologistes, le laboratoire de génétique moléculaire du CHU de Rennes et l’ensemble de l’équipe Génétique des pathologies liées au développement de l’Institut de génétique et développement de Rennes (IGDR). Ce travail est dédié aux malades et à leurs familles.
|
Footnotes |
1.
Mercier S, Dubourg C, Garcelon N, et al. New findings for phenotype-genotype correlations in a large European series of holoprosencephaly cases . J Med Genet. 2011; ; 48 : :752.–760. 2.
Roessler E, Muenke M. The molecular genetics of holoprosencephaly . Am J Med Genet C Semin Med Genet. 2010;; 154C : :52.–61. 3.
Dupé V, Rochard L, Mercier S, et al. NOTCH, a new signaling pathway implicated in holoprosencephaly . Hum Mol Genet. 2011; ; 20 : :1122.–1131. 4.
Blaess S, Szabo N, Haddad-Tovolli R, et al. Sonic hedgehog signaling in the development of the mouse hypothalamus . Front Neuroanat. 2014; ; 8 : :156.. 5.
Ferent J, Ruat M, Traiffort E. Division symétrique ou division asymétrique : Sonic Hedgehog contrôle le destin des cellules souches neuronales adultes . Med Sci (Paris). 2014; ; 30 : :705.–708. 6.
Mercier S, David V, Ratié L, et al. NODAL and SHH dose-dependent double inhibition promotes an HPE-like phenotype in chick embryos . Dis Modes Mech. 2013; ; 6 : :537.–543. 7.
Stoppa-Lyonnet D, Houdayer C. Séquençage de nouvelle génération en génétique médicale; Du génotype au phénotype, un défi majeur . Med Sci (Paris). 2012; ; 28 : :123.–124. 8.
Dubourg C, Carré W, Hamdi-Rozé H, et al. Mutational spectrum in holoprosencephaly shows that FGF is a new major signaling pathway . Hum Mutat. 2016; ; 37 : :1329.–1339. 9.
Odent S, Le Marec B, Munnich A, et al. Segregation analysis in nonsyndromic holoprosencephaly . Am J Med Gene. 1998; ; 77 : :139.–143. 10.
Schachter KA, Krauss RS. Murine models of holoprosencephaly . Curr Top Dev Biol. 2008; ; 84 : :139.–170. 11.
Mouden C, Dubourg C, Carré W, et al. Complex mode of inheritance in holoprosencephaly revealed by whole exome sequencing . Clin Genet. 2016; ; 89 : :659.–668. 12.
Mouden C, de Tayrac M, Dubourg C, et al. Homozygous STIL mutation causes holoprosencephaly and microcephaly in two siblings . PLoS One. 2015; ; 10 : :e0117418.. |