Les synapses sont les unités de « codage élémentaire » du système nerveux. Elles réalisent des connexions microscopiques entre neurones. La transmission synaptique est régulée par exocytose, ou fusion de vésicules avec la membrane plasmique, et par endocytose, formation et internalisation de vésicules à partir de cette même membrane plasmique. Lors de la première étape de la transmission, les vésicules présynaptiques libèrent, par exocytose, les neurotransmetteurs qu’elles contiennent. Pour chaque passage d’information d’un neurone à un autre, une ou plusieurs vésicules synaptiques fusionnent. Elles sont ensuite recyclées par endocytose.
Ces processus, connus depuis plus de quarante ans, font toujours l’objet de recherches intensives, qui ont révélé, encore très récemment, de grandes surprises [1, 2]. Lors de la deuxième étape de la transmission, les neurotransmetteurs libérés sont reconnus par des récepteurs post-synaptiques, qui génèrent les courants synaptiques. En effet le nombre de récepteurs à la surface de la cellule est corrélé à l’intensité du courant induit par les neurotransmetteurs et, par conséquent, à la force de la synapse. Ces récepteurs sont concentrés face aux sites de fusion des vésicules synaptiques, dans une zone nommée densité post synaptique (DPS). Cependant, ils ne restent pas immobiles dans cette zone : ils diffusent dans la membrane externe des neurones et ils sont constamment endocytés et stockés dans des structures intracellulaires appelées endosomes. Ils sont ensuite recyclés par exocytose, ou sont dégradés dans les lysosomes [3] (→).
(→) Voir la Dernière heure de D. Choquet et B. Lounis, m/s n° 5, mai 2008, page 548
Ce trafic de récepteurs n’est pas mineur : une inhibition spécifique de l’endocytose dans un neurone post-synaptique induit une augmentation de la transmission synaptique de plus de 50 %, en dix minutes [4], reflétant une accumulation de récepteurs. De plus, si l’endocytose est inhibée, la plasticité synaptique, c’est-à-dire la capacité d’une synapse à moduler l’amplitude des courants qu’elle transmet, l’est également. Par exemple, la dépression synaptique à long terme (DLT) est totalement bloquée lorsque l’endocytose est inhibée [4]. Inversement, la potentialisation à long terme (PLT) est abolie lorsque l’exocytose des endosomes de recyclage est bloquée [5].
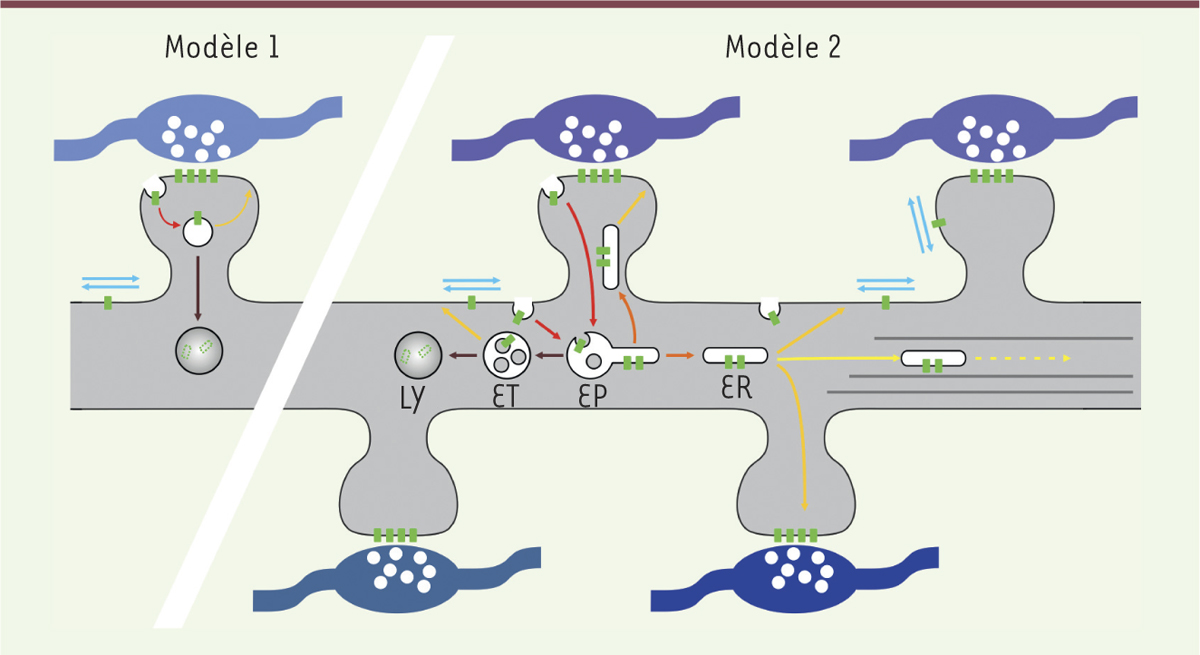
Ces phénomènes de plasticité synaptique sont à la base de nos fonctions cognitives comme la mémoire et l’apprentissage. À l’échelle cellulaire, ils se caractérisent par leur très grande spécificité : si une synapse individuelle est stimulée, elle peut être potentialisée ou réprimée, sans que les synapses voisines, pourtant distantes de seulement quelques micromètres, ne soient affectées. L’une des questions qui se posent actuellement est donc : le trafic membranaire des récepteurs contribue-t-il à cette spécificité ? On peut envisager deux scénarios extrêmes ( Figure 1 ) : soit les différentes étapes du trafic des récepteurs sont localisées à proximité de la DPS, dans l’épine dendritique, à l’instar du trafic des vésicules synaptiques dans le bouton présynaptique ; soit le trafic membranaire est distribué sur l’ensemble de la dendrite et il ne contribue pas à la spécificité synaptique. Diverses observations permettent d’argumenter en faveur de l’un ou l’autre de ces modèles. La présence de zones d’endocytose directement dans les épines dendritiques [6] suggère en effet que leur activité pourrait être spécifiquement régulée pour moduler localement le nombre de récepteurs, qui sont présents dans une synapse stimulée (modèle 1). À l’inverse, les récepteurs peuvent eux-mêmes diffuser à la surface des neurones sur de grandes distances [7] et une modulation de leurs propriétés de diffusion pourrait donc leur permettre d’atteindre des zones d’endocytose, même éloignées, sans que les mécanismes de l’endocytose ne soient affectés (modèle 2). Pour pouvoir trancher entre ces deux scénarios, ou définir un modèle intermédiaire, il est nécessaire de visualiser avec précision les différentes étapes du trafic membranaire ou, alternativement, de pouvoir inhiber spécifiquement et localement les différentes étapes.
| Figure 1.
Deux modèles du trafic des récepteurs dans les dendrites. Les récepteurs postsynaptiques, en vert, sont concentrés dans les densités postsynaptiques (DPS), en face des boutons présynaptiques (en bleu). Les récepteurs quittent la DPS et ils diffusent dans la membrane plasmique (flèches bleu clair). Ils peuvent ensuite être concentrés dans les puits d’endocytose et internalisés (flèches rouges). Après internalisation ils sont triés dans les endosomes précoces (EP) et ils sont envoyés dans les endosomes tardifs (ET), qui maturent en lysosomes (LY) dans lesquels les récepteurs sont dégradés. Les récepteurs peuvent aussi être envoyés dans les endosomes de recyclage (ER), qui vont fusionner avec la membrane (flèches orange). Certaines organelles peuvent migrer rapidement sur les microtubules (flèches jaunes). Deux synapses voisines sont en général en face de neurones présynaptiques différents (différentes nuances de bleus) et elles peuvent subir des plasticités indépendamment l’une de l’autre. Le trafic des récepteurs pourrait contribuer à cette spécificité en étant restreint à une seule synapse, ou à l’inverse pour distribuer les récepteurs vers les synapses voisines. |
Pour détecter l’exocytose des vésicules contenant différents types de récepteurs, des sondes composées de la « pHluorine », une protéine naturellement fluorescente de type GFP (green fluorescent protein) sensible au pH, fusionnée à une protéine membranaire, ont été utilisées depuis plusieurs années. La pHluorine est localisée du côté extracellulaire de la membrane plasmique (donc tournée soit vers la surface, quand le récepteur est présent sur la membrane plasmique, soit vers l’intérieur, dans les vésicules après endocytose). Elle n’est pas fluorescente à pH acide (inférieur à 6), elle le devient à pH neutre. Le pH des endosomes de recyclage est acide, alors que celui du milieu extracellulaire est neutre. Ainsi, lorsqu’une vésicule d’exocytose fusionne avec la membrane, son pH change rapidement de 5,5 à 7,4, et des événements d’exocytose peuvent être détectés tout au long des dendrites neuronales. Après leur libération, les récepteurs diffusent rapidement dans la membrane plasmique, ou restent agrégés, selon un mécanisme que nous avons élucidé il y a quelques années [8]. Grâce à ces méthodes, différents groupes ont détecté l’exocytose de vésicules uniques et leur modulation pendant la plasticité synaptique [9]. La localisation des phénomènes d’exocytose, au regard des synapses, est cependant sujette à controverse selon les différentes études, peut-être à cause des différents modes de stimulation utilisés.
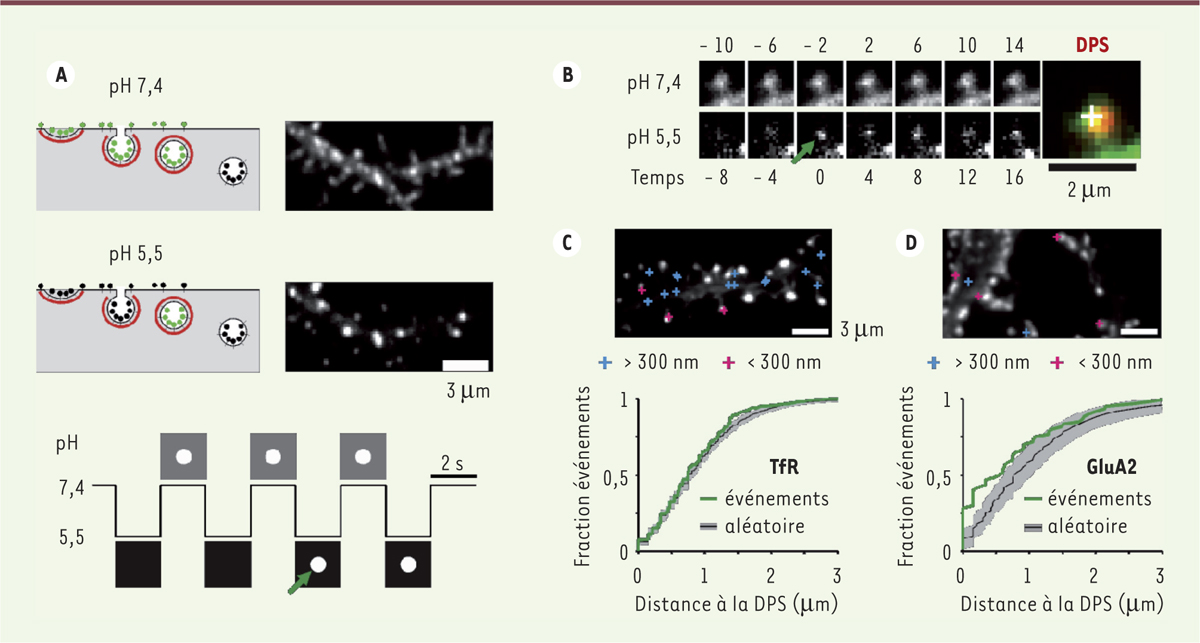
La détection des vésicules d’endocytose pose en revanche un problème plus complexe. La formation d’une vésicule d’endocytose ne s’accompagne, en effet, pas d’un changement brutal de l’environnement, comme le pH au voisinage des protéines membranaires. Pour résoudre ce problème, nous avons récemment publié une étude [10] dans laquelle nous avons adapté aux neurones un protocole que nous avions mis au point sur des lignées cellulaires de fibroblastes [11]. Ce protocole permet de détecter sans ambiguïté, et avec une grande résolution spatiale et temporelle, la formation des vésicules d’endocytose dans les dendrites neuronales. Comme illustré dans la Figure 2A , nous imposons aux cultures de cellules un changement de pH extracellulaire de 5,5 à 7,4, toutes les deux secondes. Les récepteurs de surface, marqués avec la pHluorine, sont bien sûr sensibles aux changements imposés, ils deviennent donc « invisibles » à pH 5,5. En revanche, les récepteurs internalisés dans des vésicules sont insensibles aux changements rapides de pH ; ils restent donc fluorescents même quand le pH extracellulaire est acide. Les vésicules d’endocytose s’acidifient progressivement, ce qui se traduit par une diminution de la fluorescence de la pHluorine, mais ce laps de temps, de plusieurs dizaines de secondes, est suffisant pour détecter leur formation ( Figure 2B ). Ainsi, après avoir vérifié que ce protocole n’affecte pas les neurones, nous avons pu dresser une carte des lieux de formation des vésicules d’endocytose par rapport aux synapses. Ceci nous a permis de montrer que des récepteurs non synaptiques, comme le récepteur de la transferrine, étaient internalisés dans toutes les zones d’endocytose, mais sans préférence détectable pour les zones proches ou lointaines des synapses ( Figure 2C ). En revanche, les récepteurs synaptiques de type AMPA (α-amino-3-hydroxy-5-methyl-4-isoxazolepropionic acid), activés par le glutamate, sont internalisés préférentiellement, mais pas exclusivement, dans des zones d’endocytose proches des synapses ( Figure 2D ). Enfin, pour répondre à la question initiale, la stimulation de l’endocytose des récepteurs AMPA, dans un protocole de dépression synaptique à long terme (DLT), augmente significativement la fréquence de formation de vésicules, mais les cartes de localisation montrent que l’on perd la préférence pour les zones d’endocytose proches des synapses. Ainsi, l’activité des zones d’endocytose proches des synapses n’est pas spécifiquement stimulée pendant une DLT, ce qui suggère que l’endocytose ne contribue pas à la spécificité de la plasticité synaptique.
| Figure 2.
Visualisation de l’endocytose des récepteurs marqués par la pHluorine. A.illustration du protocole. Les neurones expriment des récepteurs marqués grâce à la pHluorine. À un pH extracellulaire de 7,4, les récepteurs présents sur la membrane plasmique et dans des vésicules non acides sont fluorescents. À un pH extracellulaire de 5,5, uniquement les récepteurs dans les vésicules non acides sont visibles. En changeant le pH toutes les deux secondes on peut détecter la formation de nouvelles vésicules d’endocytose (flèche verte). B. images successives d’une épine dendritique à pH 7,4 (images du haut) et 5,5 (images du bas). Au temps 0, une vésicule apparaît, signe d’une endocytose. (flèche verte). À droite, superposition de l’image au temps 0 (vert) et de l’image d’un marqueur des DPS, Homer (rouge). C. carte des événements d’endocytose détectés comme en B pour le récepteur de la transferrine (TfR), non synaptique. En bas, la distribution des distances entre les densités postsynaptiques (DPS) et les événements d’endocytose (courbe verte) montre que ces derniers ne se concentrent pas vers les DPS, car cette distribution est superposée à une distribution d’événements répartis aléatoirement sur la surface dendritique (la courbe noire et les zones grisées représentent la médiane et les intervalles 5 %-95 % de 200 répartitions aléatoires). D. carte des événements d’endocytose pour le récepteur synaptique au glutamate GluA2. L’analyse des distances effectuée comme pour C montre que les événements d’endocytose sont enrichis vers les DPS (d’après [9]). |
Ces résultats montrent qu’une localisation précise des zones d’endocytose proches des synapses suffit à internaliser préférentiellement les récepteurs synaptiques in situ. Ils confirment, de plus, que l’endocytose est importante pour la régulation de la DLT tout en suggérant qu’elle ne contribue pas directement à la spécificité synaptique. Il est ainsi essentiel que les récepteurs AMPA soient internalisés au cours de la DLT, mais la machinerie de l’endocytose elle-même n’est pas localement régulée. Quels autres facteurs pourraient alors expliquer cette spécificité ? L’endocytose n’est pas l’unique étape du trafic membranaire qui régule la transmission synaptique. L’augmentation d’endocytose des récepteurs AMPA, que nous avons observée, dure moins de dix minutes alors que la dépression des synapses perdure plus longtemps. Les étapes ultérieures de l’endocytose, comme le mouvement des endosomes dans la dendrite, notamment grâce aux moteurs moléculaires, ou le trafic des récepteurs vers les endosomes tardifs, qui empêche leur recyclage vers la membrane, pourraient être également modulées ( Figure 1 ). Pour étudier avec précision ces étapes, il est nécessaire de suivre les récepteurs, après l’acidification des vésicules d’endocytose, avec de nouvelles sondes fluorescentes. De plus, dans cette étude, l’application généralisée d’agoniste a induit l’activation de tous les récepteurs stimulant l’endocytose, contrairement à une stimulation physiologique où seuls les récepteurs d’un petit nombre de synapses sont stimulés. Dans la mesure où nous avons montré que la visualisation directe de la formation de vésicules uniques était possible, nous pourrons utiliser des protocoles plus précis pour décrire la régulation locale de l’endocytose. Toutefois, cette étude illustre comment la description détaillée des étapes du trafic membranaire et leurs modulations peut permettre de mieux comprendre comment les neurones organisent les différentes connexions synaptiques et régulent indépendamment leur plasticité. L’altération de ces processus, qui intervient probablement chez les sujets ayant des prédispositions génétiques aux maladies neurodégénératives [12, 13], pourrait compromettre le trafic de nombreux récepteurs mais également la capacité des neurones à ségréger les différentes entrées synaptiques, qui sont essentielles pour l’activité neuronale.