Activité physique et fonctions physiologiques
2008
11-
Capital osseux
L’activité physique, par les contraintes mécaniques qu’elle exerce sur le squelette, induit la formation du tissu osseux. Ce phénomène est maintenant bien établi depuis les années 1970. L’activité physique exerce un effet ostéogénique d’autant plus fort que les contraintes mécaniques varient et s’éloignent des contraintes habituelles de la marche ou de la course. Cet effet est particulièrement observé chez l’enfant pré-pubère et plus en début qu’en fin de puberté. Une pratique sportive multi-activités semble donc correspondre au meilleur bénéfice attendu à cette période de la vie. Ce type de pratique peut permettre de maximaliser le pic de masse osseuse atteint chez l’adulte jeune, et ainsi prévenir l’apparition ultérieure de l’ostéoporose.
Cependant, une spécialisation précoce et un entraînement intensif pourraient altérer les processus de croissance et de maturation du squelette. Cette question, toujours débattue, a conduit les instances médicales à éditer des recommandations concernant l’entraînement intensif précoce.
Réponses et adaptations osseuses au cours de la croissance
Le squelette est constitué de pièces osseuses articulées qui, sous l’action des muscles, permettent à l’être humain de se déplacer. Cette fonction soumet le squelette à des contraintes mécaniques qui s’intensifient avec la croissance, du fait de l’augmentation des dimensions corporelles (et donc de l’action de la gravité) et de la masse musculaire (Carter et coll., 1996

; Rauch et Schoenau, 2002

; Bass et coll., 2005

).
Le développement du squelette ne se résume pas à l’augmentation de la masse minérale (Rauch et Schoenau, 2002

) ; la taille et la morphologie des pièces osseuses évoluent afin de s’adapter aux contraintes mécaniques et ainsi conserver l’intégrité du squelette (Parfitt et coll., 2000

).
Minéralisation du squelette
La masse squelettique représente 15 % de la masse corporelle totale chez le nouveau-né, contre 16 à 17 % chez l’adulte de moins de 50 ans et 13 à 14 % chez la personne âgée (Malina et coll., 1991

). Environ 65 % du poids sec du squelette dégraissé est composé de minéral, c’est-à-dire des cristaux d’hydroxyapatite (Malina et coll., 1991

).
La petite enfance est caractérisée par une accrétion osseuse rapide du fait d’une croissance staturale importante (Specker et coll., 1999

). Le deuxièmepic d’accrétion osseuse a lieu lors de la puberté. À peu près un quart de la masse osseuse adulte est acquis durant les deux années qui encadrent le second pic d’accrétion osseuse (stades de Tanner II à IV chez la fille et III à V chez le garçon), c’est-à-dire le moment où le taux de minéralisation osseuse est le plus important (Bailey et coll., 1999

). Selon Martin et coll. (1997

), près de 320 g de minéral osseux (dont un tiers de calcium) sont accumulés pendant l’année du pic d’accrétion osseuse chez les garçons, contre 240 g chez les filles.
Une ménarche tardive est associée à une plus faible densité minérale osseuse (DMO) au corps entier et au rachis (Rice et coll., 1993

; Ito et coll., 1995

; Boot et coll., 1997

), faisant de cette caractéristique un facteur de risque de l’ostéoporose (Chevalley et coll., 2005

).
Le pic de minéralisation osseuse intervient 6 mois à 18 mois après le pic de croissance staturale (Matkovic et coll., 1994

; Martin et coll., 1997

; Bailey et coll., 1999

). Ce décalage est à l’origine d’une période de relative fragilité du squelette (Bailey et coll., 1999

), ce qui explique en partie l’incidence élevée des fractures vers 12-14 ans chez les garçons (Blimkie et coll., 1993

) et 10,5-11,5 ans chez les filles (Hagino et coll., 2000

; Yeh et coll., 2006

).
Lors de la fusion des cartilages de conjugaison, la DMO atteint 90 à 95 % de sa valeur maximale (Riggs et coll., 2002

). L’âge du pic de masse osseuse intervient entre 20 et 30 ans (Teegarden et coll., 1995

; Heaney et coll., 2000

; New, 2001

) et varie en fonction du sexe et du site considéré (Bonjour et coll., 1991

; Slemenda et coll., 1994

; Heaney et coll., 2000

).
L’augmentation du contenu minéral osseux au cours de la croissance est davantage le résultat d’une augmentation des dimensions des pièces osseuses que d’une augmentation de la DMO volumique.
Facteurs régulant la formation du tissu osseux
La formation du tissu osseux est régulée par des facteurs mécaniques, hormonaux et énergétiques. Parmi les facteurs non mécaniques susceptibles de moduler la réponse du tissu osseux aux contraintes, les hormones jouent un rôle prépondérant (Rizzoli et coll., 2001

). Avant la puberté, la croissance est surtout régulée par l’hormone de croissance et l’IGF-I (
Insulin-like Growth Factor-I) alors que pendant et après la puberté, ce sont les stéroïdes sexuels qui exercent une influence prédominante (Bass et coll., 2005

). Les œstrogènes (dans les deux sexes), associés à l’hormone de croissance et l’IGF-I, initient les trois ou quatre années de forte croissance osseuse pendant lesquelles le squelette double sa masse (Riggs et coll., 2002

). Le rôle des œstrogènes dans la maturation osseuse serait plus important que celui des androgènes (Arisaka et coll., 2001

; Riggs et coll., 2002

).
Selon Riggs et coll. (2002

), les hommes atteignent un pic de masse osseuse plus élevé que celui des femmes (+25 %) : leurs os sont plus grands (croissance longitudinale pré-pubertaire plus longue et meilleure apposition périostée) et l’os cortical est plus épais.
Outre l’hormone de croissance, l’IGF-I et les hormones sexuelles, d’autres hormones sont impliquées dans la régulation du métabolisme osseux : la parathormone (PTH) et le calcitriol ou 1,25-dihydroxyvitamine D, qui stimulent la résorption osseuse (Rizzoli et Bonjour, 1998

) ; la vitamine D, qui influence le processus de maturation des chondrocytes épiphysaires (Klaus et coll., 1991

) ; la calcitonine, qui inhiberait la résorption osseuse mais n’aurait pas d’effet sur la formation osseuse (Canalis, 1996

) ; les hormones thyroïdiennes, qui ont un effet anabolique pendant la croissance (Bassett et Williams, 2003

; Lakatos, 2003

).
Enfin, l’apport énergétique total ainsi que les apports protéiques et calciques sont des régulateurs-clés du développement musculo-squelettique, plus précisément dans le cas de carences (Bass et coll., 2005

). Le polymorphisme génique est susceptible de moduler l’influence des apports nutritionnels sur le développement osseux (Dawson-Hughes et coll., 1995

). Une restriction énergétique et/ou protéique peut retarder la croissance longitudinale et périostée. Les enfants et adolescents dont les apports calciques sont insuffisants risquent d’atteindre un pic de masse osseuse plus faible (Heaney et coll., 2000

). En France, les apports calciques recommandés pour des personnes de 10 à 18 ans s’élèvent à 1 200 mg/j (Guéguen, 2001

). Les effets d’une supplémentation calcique sur la DMO de jeunes enfants se sont révélés positifs (Lloyd et coll., 1996

; Bonjour et coll., 1997

; Cameron et coll., 2004

) ou nuls (Courteix et coll., 2005

). La minéralisation varierait selon les sites considérés, les apports calciques initiaux, le stade pubertaire des sujets (Johnston et coll., 1992

; Bonjour et coll., 1999

). L’influence d’une supplémentation calcique serait surtout améliorée en étant associée à une activité physique régulière (Courteix et coll., 2005

). D’une manière générale, la quantité de calcium consommée n’est que modérément corrélée à la santé osseuse de l’enfant ou de l’adulte (Lanou et coll., 2005

) car le calcium est un nutriment-seuil : au-delà d’une valeur oscillant entre 800 et 1 200 mg/j, toute augmentation supplémentaire de la consommation calcique ne semble pas avoir d’effet sur le tissu osseux (Matkovic et Heaney, 1992

; Coxam, 2005

). La sensibilité du tissu osseux à l’exercice physique serait influencée par le polymorphisme génique du récepteur de la vitamine D (Blanchet et coll., 2002

) et celui des récepteurs alpha-œstrogéniques (Suuriniemi et coll., 2004

).
Effets de l’exercice physique pendant la croissance
La sensibilité du tissu osseux aux contraintes mécaniques appliquées lors de l’exercice physique serait plus élevée pendant la croissance, période pendant laquelle le
turnover osseux est particulièrement rapide (Ruff et coll., 1994

; Turner et Robling, 2005

). Ces contraintes modifient l’environnement mécanique de l’os et donc influencent les processus de croissance longitudinale et de minéralisation osseuse. Dès les années 1950, Buskirk et coll. (1956

) ont noté que l’ulna et le radius étaient plus longs du côté dominant que du côté non dominant chez des joueurs de tennis ayant débuté leur pratique dès l’enfance ou l’adolescence.
Exercice physique et minéralisation osseuse
L’effet de l’exercice physique sur la minéralisation osseuse a été étudié en fonction de l’intensité de l’exercice, de l’âge et du sexe.
Entraînement intensif
Dans cette partie sur l’entraînement intensif, les études sont réalisées sur des populations de sportifs de haut niveau.
La pratique régulière d’une activité physique est associée à une augmentation de la DMO surfacique chez l’enfant, à condition que l’activité pratiquée induise des contraintes mécaniques sur le tissu osseux. L’effet ostéogénique du sport s’exerce grâce à l’action des muscles et à celle de la gravité, par l’intermédiaire de la force de réaction du sol (lors des activités où le poids du corps est mis en jeu) et des forces appliquées au niveau des articulations (Turner, 2000

; Blimkie et Högler, 2003

). D’après de nombreux auteurs, ce sont les contractions musculaires, et non le poids du corps, qui exerceraient les plus larges contraintes sur le squelette lors de la vie courante (Burr, 1997

; Schoenau et Frost, 2002

). Elles expliqueraient 50 % de la variabilité du développement de la masse et de la résistance osseuses (Schoenau et coll., 2002

).
Générés lors des phases de course, de saut (impulsion et réception), ou bien lors d’un contact avec une balle ou un ballon (frappe au tennis, shoot en football), les impacts sont à l’origine d’une déformation des structures osseuses qui stimule la minéralisation.
L’importance des impacts se manifeste notamment dans les sports où le poids du corps est porté («
weight-bearing activities »), par opposition aux activités comme la natation ou le cyclisme pendant lesquelles le squelette ne subit que l’action des contractions musculaires («
non weight-bearing activities »). Ainsi, la DMO de jeunes nageuses est inférieure à celle de jeunes gymnastes (Courteix et coll., 1998

). L’augmentation de la DMO rapportée à l’augmentation de la masse corporelle au cours de la croissance est également supérieure chez des gymnastes comparativement à des nageuses (Cassell et coll., 1996

) ou des enfants normo-actifs (Nurmi-Lawton et coll., 2004

; Ward et coll., 2005

). Lima et coll. (2001

) ont noté de plus fortes DMO surfaciques à plusieurs sites osseux (rachis lombaire, col fémoral) chez des garçons de 12 à 18 ans pratiquant des sports avec impacts (gymnastique, athlétisme, basketball et tennis) par rapport à ceux pratiquant des activités sans impacts (natation, water-polo). Chez 128 garçons de 16-18 ans, Ginty et coll. (2005

) ont observé que le CMO (contenu minéral osseux) au corps entier était supérieur dès lors que la pratique d’activités physiques avec impacts dépassait un volume horaire de 8 heures par semaine.
Les effets positifs des impacts sur la minéralisation ont surtout été mis en évidence par l’étude des sports unilatéraux. En effet, l’élimination d’un éventuel biais de sélection des sujets sportifs dans les études transversales est obtenue en comparant, chez un même sujet, un site osseux sollicité (le bras dominant au tennis ou au squash) avec un site osseux peu ou pas sollicité (le bras non dominant). Les différences de CMO et de DMO entre les deux bras atteignent 10 à 15 % après seulement quelques années de pratique (Kannus et coll., 1995

; Haapasalo et coll., 1998

; Bass et coll., 2002a

).
Cependant, si l’entraînement intensif exerce des effets positifs sur la minéralisation, on peut se demander si l’exercice physique reste bénéfique pour des volumes et des intensités d’entraînement plus faibles (Modlesky et Lewis, 2002

).
Entraînement modéré
L’accrétion osseuse observée pendant la croissance est améliorée de 1 à 3 % suite à un programme d’entraînement réalisé trois fois par semaine pendant sept mois, dans le cadre scolaire, à raison de 10 à 12 minutes d’exercices avec des impacts allant de 3,5 à 5 G (MacKelvie et coll., 2001

, 2002a

et b

) (un G étant équivalent à la force exercée par le poids du corps lors de la station debout). Les gains sont site-spécifiques, c’est-à-dire qu’ils sont visibles aux sites osseux soumis aux contraintes mécaniques (rachis lombaire, col fémoral) et ils doublent si l’entraînement est poursuivi sur vingt mois (MacKelvie et coll., 2003

). Le bénéfice est sensiblement le même lorsque l’entraînement est plus intensif, avec des contraintes atteignant 8 G (Fuchs et coll., 2001

) ou lorsque les séances sont plus longues (Bradney et coll., 1998

; Heinonen et coll., 2000

; McKay et coll., 2000

; Valdimarsson et coll., 2006

). Il augmente légèrement (>5 % sur dix mois) lorsque des exercices avec charges additionnelles sont inclus au programme d’entraînement (Morris et coll., 1997

). L’efficacité de ces programmes repose en partie sur l’augmentation progressive du volume (nombre de sauts par séance) et de l’intensité (hauteur des sauts) de l’entraînement (Heinonen et coll., 2000

; Fuchs et coll., 2001

; MacKelvie et coll., 2001

, 2002a

, 2003

et 2004

). L’importance de ce critère a été soulevée lors d’une étude réalisée chez des jumelles homozygotes (van Langendonck et coll., 2003a

). Ces auteurs ont montré qu’un entraînement ostéogénique d’une durée de 9 mois (10 minutes, 3 fois par semaine) avait un effet bénéfique sur la minéralisation osseuse du fémur proximal chez des jeunes filles ne pratiquant pas d’activités à impacts, mais pas chez celles déjà engagées dans une pratique sportive ostéogénique. De même, la réponse à l’entraînement est moins bonne chez des enfants en surcharge pondérale (MacKelvie et coll., 2002b

). Outre le fait que ces enfants s’impliquent peut-être moins dans l’entraînement que des enfants de poids normal, le seuil de sensibilité de leur squelette aux impacts est sans doute plus élevé compte tenu de la contrainte mécanique quotidienne que représente leur surpoids (MacKelvie et coll., 2002b

). La réponse osseuse du squelette est donc étroitement dépendante des caractéristiques du programme d’entraînement et des enfants (Heinonen et coll., 2000

; Petit et coll., 2002

). Dans l’optique d’une amélioration de la santé osseuse des jeunes populations, il faut noter que la réalisation de dix
counter-movement jumps (saut avec élan, mains sur les hanches), trois fois par jour pendant 8 mois (soit un volume d’entraînement raisonnable), permet d’augmenter la minéralisation au fémur proximal chez des enfants d’une dizaine d’années (McKay et coll., 2005

).
Âge et sexe
La principale limite à l’efficacité des exercices ostéogéniques est l’âge des sujets entraînés. Certaines études n’ont trouvé des résultats positifs qu’à partir du stade II ou III de Tanner, correspondant au début et au milieu de la puberté (Haapasalo et coll., 1998

; MacKelvie et coll., 2001

; Petit et coll., 2002

). Cependant, un grand nombre d’études ont montré la capacité d’un entraînement ostéogénique à augmenter la minéralisation osseuse dès la prépuberté (Cassell et coll., 1996

; Bass et coll., 1998

et 2002a

; Fuchs et coll., 2001

; MacKelvie et coll., 2004

; Valdimarssön et coll., 2006

). Les effets bénéfiques de l’exercice physique ont même été observés avant l’âge de 8 ans, qu’il s’agisse d’une activité gymnique récréative (Laing et coll., 2005

) ou plus intensive (Zanker et coll., 2003

).
En revanche, un consensus semble prévaloir concernant la plus faible efficacité d’une activité physique ostéogénique chez les adolescents en fin de puberté (stades IV et V de Tanner). Chez les jeunes filles, la vitesse de l’acquisition osseuse est plus importante avant la ménarche (McKay et coll., 1998

), période pendant laquelle on observe de fortes concentrations en hormone de croissance, IGF-I, œstrogènes et androgènes (Kannus et coll., 1996

; Morris et coll., 1997

; Heinonen et coll., 2000

). Ceci pourrait expliquer la relative inefficacité des programmes d’entraînement après la ménarche (Heinonen et coll., 2000

), y compris pour des activités comme la musculation (Blimkie et coll., 1996

) ou la pliométrie (Witzke et Snow, 2000

), pourtant à fort potentiel ostéogénique. Les asymétries osseuses relevées entre les deux bras étaient deux à quatre fois plus importantes chez des jeunes filles ayant débuté le tennis avant ou au moment de la ménarche, comparativement à celles ayant débuté après quinze ans (Kannus et coll., 1995

). Chez les garçons, on dispose de peu de données à l’adolescence concernant la réponse du tissu osseux aux contraintes mécaniques. Le
turnover osseux, évalué grâce à des marqueurs biologiques, semble augmenter après 5 semaines d’un entraînement intensif en endurance, à raison de 2 heures par jour, 5 jours par semaine (Eliakim et coll., 1997

). Mais la durée trop courte de l’entraînement ne permet pas d’établir le lien entre une accélération du
turnover osseux et une augmentation significative de la DMO chez ces adolescents.
Effet ostéogénique de l’exercice
L’activité physique exerce un effet ostéogénique d’autant plus fort que :
• les contraintes mécaniques sont variées, d’une amplitude supérieure à 3 ou 4 G, et différentes des contraintes habituelles imposées lors de la marche ou la course ;
• les contraintes sont appliquées sur le squelette d’un enfant pré-pubère (stade I de Tanner) ou en début de puberté (stades II et III de Tanner) (Bass, 2000

; Khan et coll., 2000

; MacKelvie et coll., 2002a

).
L’efficacité d’une session d’entraînement peut être estimée grâce au calcul d’un index ostéogénique, qui prend en compte l’amplitude et la fréquence des contraintes mais aussi les périodes de récupération nécessaires pour rétablir 100 % de la sensibilité du squelette aux stimuli mécaniques (Turner et Robling, 2003

). Il semblerait également que plus la direction des contraintes varie, plus l’activité est ostéogénique (Nikander et coll., 2005

). L’augmentation de la minéralisation reste site-spécifique (Ehrlich et Lanyon, 2002

), ce qui pourrait expliquer les déficits osseux observés chez les sportifs aux sites non sollicités : le crâne chez les gymnastes (Courteix et coll., 1999a

), les athlètes, danseurs ou culturistes (Karlsson et coll., 1996

), ou bien le bras non dominant chez les joueurs de tennis (Haapasalo et coll., 1998

et 2000

). Il s’agirait d’un phénomène de redistribution du pool calcique dont dispose tout individu, au profit des sites osseux soumis à des fortes contraintes mécaniques (Smith et coll., 1984

).
Compte tenu de l’effet site-spécifique de l’exercice physique sur le tissu osseux, une pratique sportive multi-activités doit être encouragée, et ce dès la pré-puberté. Pour qu’un bénéfice significatif soit observé en terme de minéralisation osseuse, cette pratique doit induire sur le squelette des contraintes mécaniques de l’ordre de 3 à 4 G. Des séances courtes (environ dix minutes), réalisées trois fois par semaine, ont la capacité d’augmenter la minéralisation chez l’enfant. Ce type de programme peut permettre de maximaliser le pic de masse osseuse atteint chez l’adulte jeune, et ainsi de prévenir l’apparition ultérieure de l’ostéoporose. Cette maladie dégénérative, qui se caractérise par une diminution de la masse osseuse et des altérations micro-architecturales du squelette, fragilise le tissu osseux. Atteindre un pic de masse osseuse élevé, puis conserver ce capital osseux à l’âge adulte grâce à une bonne hygiène de vie, constitue un facteur de protection contre les fractures ostéoporotiques (Beck et Snow, 2003

).
Exercice physique et géométrie osseuse
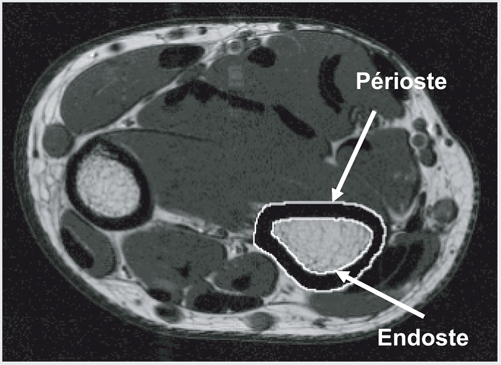
En plus du contenu minéral et de la densité osseuse, la résistance mécanique de l’os dépend également de ses dimensions (Van Der Meulen et coll., 2001

), celles-ci étant déterminées par la surface osseuse sur laquelle le minéral se dépose (Seeman, 2001

; Bass et coll., 2002a

). S’il s’agit de la surface périostée, la taille de l’os augmente, ce qui lui confère une meilleure résistance mécanique ; s’il s’agit de la surface endostée, la taille globale de l’os n’évolue pas et le gain en terme de résistance est moindre (figure 11.1

). En effet, un os est d’autant plus résistant que le minéral osseux est situé loin de l’axe longitudinal de l’os (Turner et Burr, 1993

).
Or, pendant la croissance, la surface périostée serait plus sensible aux contraintes mécaniques en début de puberté alors que la surface endostée répondrait mieux aux stimuli en fin de puberté (Ruff et coll., 1994

). Une augmentation de la taille des os sollicités par la pratique sportive a été rapportée par plusieurs études chez des enfants pré-pubères ou en début de puberté (Dyson et coll., 1997

; Petit et coll., 2002

; MacKelvie et coll., 2004

). De même, Bass et coll. (2002a

) ont observé une expansion périostée sur l’humérus dominant de joueuses de tennis pré-pubères. Chez des joueuses péri- ou post-pubères, une réduction de la taille du canal médullaire est observée à l’humérus dominant, suggérant une apposition du minéral osseux sur la surface endostée ou bien une diminution de la résorption osseuse au niveau de l’endoste. Ainsi, l’exercice physique amplifierait les adaptations macro-architecturales observées pendant la croissance (Bass et coll., 2002a

). Aucune expansion périostée n’a été mise en évidence au niveau des membres inférieurs, que ce soit au fémur (Duncan et coll., 2002

) ou au tibia (Heinonen et coll., 2000

; Greene et coll., 2005

; Ward et coll., 2005

) chez de jeunes sportives pratiquant la course à pied, le triathlon, le cyclisme ou bien la gymnastique. En revanche, une augmentation de la taille de l’os a été observée sur le membre supérieur à l’humérus (Bass et coll., 2002

) ou au radius (Dyson et coll., 1997

; Ward et coll., 2005

) chez des joueuses de tennis et des gymnastes. L’adaptation de la géométrie osseuse à l’exercice chez de jeunes garçons sportifs est encore peu connue mais elle est sans doute différente de celle observée chez les sportives (Ward et coll., 2005

).
La natation, de par son environnement de pratique « hypogravitaire », exerce un effet sur la géométrie osseuse. Par exemple, deux études réalisées chez le rat ont montré que cette activité était susceptible de modifier la géométrie de l’os (Hart et coll., 2001

; Huang et coll., 2003

), sans forcément exercer d’effet sur la DMO (Huang et coll., 2003

). Par ailleurs, il a été montré que la cavité médullaire du fémur moyen était plus large chez des adolescentes nageuses et cyclistes que chez des coureuses à pied ou des triathlètes (Duncan et coll., 2002

).
En cas d’arrêt de la pratique sportive, le bénéfice osseux, lorsqu’il a été acquis pendant la croissance, serait conservé en majeure partie (Bass et coll., 1998

; Fuchs et Snow, 2002

; Kontulainen et coll., 2002

), ce qui ne serait pas le cas d’un bénéfice acquis à l’âge adulte (Parfitt, 1994

). Le squelette immature réagit aux contraintes mécaniques par des modifications architecturales, ce que le squelette mature est moins capable de faire (Nara-Ashizawa et coll., 2002

). Cette spécificité de la réponse du tissu osseux immature aux stimuli mécaniques serait un élément déterminant du maintien des bénéfices osseux chez le jeune sportif qui stopperait sa pratique (Karlsson, 2003

). Cependant, des individus ayant stoppé leur activité sportive après la croissance ont des valeurs de DMO plus faibles que ceux qui pratiquent encore (Bass et coll., 1998

; Van Langendonck, 2002

), d’où l’intérêt de rester actif.
En terme de résistance mécanique, il semble donc préférable de pratiquer une activité physique alors que le squelette n’est pas encore mature car ses capacités d’expansion périostée sont beaucoup plus élevées que celles du squelette mature (Parfitt, 1994

; Forwood et Turner, 1995

; Modlesky et Lewis, 2002

).
Effets délétères d’une pratique sportive intensive sur la croissance et la minéralisation osseuse
L’existence possible d’un seuil au-delà duquel l’entraînement intensif pourrait altérer les processus de croissance et de maturation du squelette est une question qui suscite un large débat (Baxter-Jones et coll., 2003

; Caine et coll., 2003

; Stokstad, 2004

; Daly et coll., 2005

; Beunen et coll., 2006

). La spécialisation précoce qui prévaut dans certaines disciplines (gymnastique, tennis, patinage artistique…) a conduit les instances médicales à éditer des recommandations concernant l’entraînement intensif précoce (
American Academy of Pediatrics et
Committee on Sports, Medecine and Fitness, 2000

; Commission médicale du comité international et olympique, 2005

).
Effets sur la croissance
L’entraînement intensif (>20 h/semaine) est suspecté de ralentir la croissance et d’induire à terme une taille adulte inférieure à celle qui aurait été atteinte par l’enfant s’il n’avait pas participé à ce programme d’entraînement. Les principales études sur le sujet se sont focalisées sur les effets de la gymnastique (Caine et coll., 2001 et 2003


; Baxter-Jones et coll., 2003

; Claessens et coll., 2006

) car les jeunes gymnastes sont habituellement plus petits et plus légers que les enfants ou adolescents du même âge (Claessens et coll., 1992

; Courteix et coll., 1999b

; Bass et coll., 2000

). Leur âge osseux est également plus faible pour un âge chronologique donné (Bass et coll., 2000

; Weimann et coll., 2000

; Maïmoun, 2005

; Thomis et coll., 2005

). La ménarche est retardée d’un à deux ans au minimum chez les filles pratiquant la gymnastique de façon intensive (Peltenburg et coll., 1984

; Claessens et coll., 1992

; Weimann, 2000

; Thomis et coll., 2005

) par rapport à des jeunes filles normo-actives atteignant la ménarche en moyenne entre 12,3 et 13,5 ans (Malina et coll, 2004

). Le retard pubertaire des jeunes gymnastes s’explique en partie par le fait que les enfants de petite taille sont plus performants lors des exercices gymniques (Ackland et coll., 2003

). Cet effet de sélection a été confirmé par plusieurs observations : les gymnastes étaient plus petits que la moyenne avant même de commencer leur pratique gymnique (Peltenburg et coll., 1984

), les parents des gymnastes étaient eux-aussi plus petits que la moyenne (Theintz et coll., 1989

; Baxter-Jones et coll., 1995

) et les gymnastes qui persistent dans l’activité étaient plus petits que les gymnastes arrêtant leur pratique (Tonz et coll., 1990

).
Cependant, l’effet de sélection n’exclut pas que l’entraînement intensif en gymnastique puisse altérer les mécanismes de croissance et de maturation (Bass et coll., 2000

et 2002b

; Caine et coll., 2001

; Daly et coll., 2005

). Il a été montré que le décalage entre âge osseux et âge chronologique augmente au fur et à mesure que l’entraînement se poursuit (Bass et coll., 2000

). De plus, l’âge de la ménarche est positivement corrélé au volume d’entraînement chez de jeunes gymnastes rythmiques (Georgopoulos et coll., 1999

). Le pic de croissance statural est décalé dans le temps et atteint des valeurs plus faibles (5,5 à 6,4 cm/an ; Theintz et coll., 1993

; Daly et coll., 2005

) que celles observées habituellement chez les jeunes filles normoactives (7,3 à 9,1 cm/an ; Malina et coll., 2004

). Alors que les membres inférieurs des gymnastes sont moins longs que ceux d’enfants normo-actifs dès le début de la pratique sportive (effet de sélection), la vitesse de croissance du tronc semble altérée durant l’entraînement (Bass et coll., 2000

; Daly et coll., 2000

). Ce ralentissement de la croissance du tronc est plus marqué chez des gymnastes s’entraînant de 20 à 27 heures par semaine que chez des gymnastes pratiquant 7,5 à 22 heures par semaine (Daly et coll., 2005

). La concentration de certaines hormones impliquées dans les processus de croissance et de maturation est plus faible chez les jeunes gymnastes : IGF-I (Jahreis et coll., 1991

; Bass et coll., 1998

), hormones thyroïdiennes (Jahreis et coll., 1991

), androstènedione (Jaffré et coll., 2001

), déhydroépiandrostérone (Warren et coll., 2002a

) et leptine (Weimann et coll., 1999

; Warren et coll., 2002b

; Courteix et coll., 2007

). Les effets délétères de l’entraînement seraient réversibles, tout du moins en partie, lorsque le volume de pratique diminue (Lindholm et coll., 1994

) ou après l’arrêt de la pratique (Tveit-Milligan et coll., 1993

; Constantini et coll., 1997

; Bass, 2000

).
Malgré ces observations, aucun lien de cause à effet n’a encore été clairement établi entre entraînement intensif et ralentissement de la croissance (Caine et coll., 2001

; Bass et coll., 2002b

).
Relations entre comportement alimentaire, troubles de la puberté et masse osseuse
Il est difficile de distinguer les effets de l’entraînement physique de ceux d’autres facteurs qui peuvent lui être associés, notamment la restriction calorique. Non seulement une restriction énergétique sévère peut retarder la croissance longitudinale (Bass et coll., 2005

), mais elle est aussi reconnue comme étant la principale cause des perturbations de l’axe hypothalamohypophyso-gonadique observées chez certaines sportives (Loucks et coll., 1998

; Williams et coll., 2001

; Warren et coll., 2002a

et b ; Eliakim et Beyth, 2003

; Loucks, 2003

). Le risque est particulièrement grand dans les sports où la prise de poids affecte la performance, en augmentant le coût énergétique et/ou en ne répondant plus aux exigences esthétiques de l’activité (Warren et coll., 2002b

). Le comportement alimentaire de certaines danseuses et coureuses de fond est parfois comparable à l’anorexie (Yates et coll., 1983

) alors que les gymnastes et les nageuses peuvent avoir un comportement assez proche de la boulimie avec des périodes de vomissements (Lefebvre et coll., 2005

). Un fort déséquilibre entre apports et dépenses énergétiques serait à l’origine de la suppression de l’activité de l’hormone gonadotrope GnRH (
Gonadotropin Releasing Hormone), sécrétée par l’hypothalamus (Loucks et coll., 1998

). Cette hormone stimule la production de FSH (hormone folliculostimulante) et LH (hormone lutéïnisante) par l’hypophyse, qui à son tour stimule la sécrétion des hormones sexuelles par les gonades (œstrogènes et progestérone chez la fille, testostérone chez le garçon). La perturbation de ces sécrétions hormonales conduit à des troubles du cycle menstruel chez la jeune fille (Warren et Perlroth, 2001

). Ainsi, la prévalence des aménorrhées dites « athlétiques » est 4 à 20 fois plus importante chez les athlètes féminines de haut niveau que dans la population générale (Eliakim et Beyth, 2003

). Le pourcentage de masse grasse, qui est un facteur déterminant pour déclencher le début de la puberté (Frisch et McArthur, 1974

; Georgopoulos et coll., 1999

) est souvent très faible chez ces athlètes. Le stress de la compétition et d’un entraînement intensif peut aussi contribuer à l’apparition de troubles du cycle menstruel (Lefebvre et coll., 2005

). L’état d’aménorrhée est associé à une diminution de la DMO trabéculaire, notamment au rachis (Khan et coll., 2002

; Warren et coll., 2002a

). On parle alors de « triade de l’athlète féminine », associant troubles nutritionnels, aménorrhée et ostéopénie (DMO comprise entre -2,5 et -1 déviations standards par rapport à la moyenne d’adultes jeunes) (Rutherford, 1999

; Khan et coll., 2002

). Les risques d’apparition de déviations vertébrales pathologiques telles que la scoliose augmentent (Warren et coll., 1986

; Warren et Perlroth, 2001

). Les fractures de fatigue sont également fréquentes chez les athlètes aménorrhéiques (Warren et Perlroth, 2001

). Elles naissent de l’accumulation de microfissures (ou micro-cracks) qui se forment dans le tissu osseux suite à l’application de contraintes mécaniques répétées (David et coll., 2005

).
Même après plusieurs années de normalisation des menstruations, la DMO vertébrale d’anciennes athlètes aménorrhéiques reste toujours plus faible que celle d’anciennes athlètes euménorrhéiques (Keen et Drinkwater, 1997

). Les altérations du métabolisme osseux chez des jeunes sportives aménorrhéiques sont attribuées à un hypo-œstrogénisme, qui entraîne une augmentation de la résorption et du
turnover osseux (Warren et Perlroth, 2001

; Lefebvre et coll., 2005

). Cependant, la prescription d’un traitement œstroprogestatif ne semble pas suffisant pour améliorer la DMO (Warren MP et coll., 2003

) car d’autres hormones sont impliquées dans la régulation du métabolisme osseux, notamment la leptine (Welt et coll., 2004

), l’IGF-I (Laughlin et coll., 1998

) et l’hormone thyroïdienne T3 (Warren et Perlroth, 2001

). L’hypo-œstrogénisme, lorsqu’il intervient chez la jeune fille, peut entraîner une diminution du pic de masse osseuse, ce qui augmente les risques d’apparition de l’ostéoporose à plus long terme (Warren et Perlroth, 2001

; Khan et coll., 2002

; Warren et coll., 2002a

).
Chez le jeune garçon sportif, on retrouve un effet de sélection en fonction du morphotype, avec un retard de maturation dans les activités gymniques et une avance pubertaire en natation (Baxter-Jones et coll., 1995

; Damsgaard et coll., 2001

; Georgopoulos et coll., 2004

). Les cas d’hypogonadisme semblent plus rares chez le garçon et le retard de maturation squelettique est plus marqué chez les gymnastes féminines que chez les gymnastes masculins (Georgopoulos et coll., 2004

). Ces différences pourraient notamment s’expliquer par une meilleure adéquation entre apports et dépenses énergétiques chez le garçon que chez la fille (Daly et coll., 2000

).
Les interactions entre profil hormonal et minéralisation osseuse ont été beaucoup moins étudiées chez le garçon que chez la fille, sans doute du fait de l’absence d’un marqueur tel que la ménarche chez le garçon. De faibles valeurs de DMO ont été observées chez l’adulte entraîné en endurance mais aucun lien n’a pu être établi avec le faible taux de testostérone chez ces athlètes (MacDougall et coll., 1992

; Maïmoun et coll., 2003

). Aucune diminution des taux de testostérone et d’IGF-I n’a été relevée chez des garçons pratiquant la gymnastique de 10 à 29 heures par semaine et dont les apports énergétiques étaient normaux (Daly et coll., 2000

). Les effets d’un entraînement intensif précoce sur la testostérone – dans le cas d’une balance énergétique négative – méritent cependant d’être analysés, car en stimulant l’apposition périostée, cette hormone favorise l’augmentation des dimensions osseuses chez le garçon et donc la résistance de son squelette (Riggs et coll., 2002

).
Il est fréquent d’observer une croissance tardive (
timing) et lente (
tempo) chez les jeunes sportifs dans les activités où la petite taille est un facteur de réussite, comme la gymnastique (Baxter-Jones et Maffulli, 2002

; Baxter-Jones et coll., 2003

) ou bien dans les activités où la prise de poids affecte la performance (d’un point de vue énergétique et/ou esthétique) : course à pied, ski de fond, patinage artistique (Skierska, 1998

). Inversement, les jeunes sportifs qui sont en avance pubertaire réussissent dans les sports qui favorisent les individus de grande taille, comme la natation (Skierska, 1998

; Damsgaard et coll., 2001

).
Dans les disciplines à dominante esthétique (gymnastique, danse, patinage artistique) ou les disciplines d’endurance (course à pied, cyclisme), qui sont toutes caractérisées par un volume d’entraînement important, les jeunes sportives constituent une population à risque de pathologies ostéopéniques (Pigeon et coll., 1997

; Warren et coll., 2002a

; Georgopoulos et coll., 2004

). Les effets négatifs des perturbations hormonales sur la minéralisation osseuse peuvent être compensés, sur les sites osseux porteurs, par les impacts dus à l’activité. C’est le cas de la gymnastique (Robinson et coll., 1995

; Markou et coll., 2004

; Maïmoun, 2005

) mais pas des sports où le poids du corps est porté (cyclisme).
Il semble que la réponse physiologique de l’organisme à l’entraînement intensif soit très variable selon les individus (Daly et coll., 2002

). Dans ces conditions, le suivi régulier des jeunes sportifs est recommandé (Bass et coll., 2002b

; Daly et coll., 2002

), en particulier en ce qui concerne les apports énergétiques dans le cadre de la prévention de la triade de l’athlète féminine (
Medical Commission of the International Olympique and Committee, 2006

).
Pratique physique et risque fracturaire de l’enfant
Le rôle préventif d’une pratique physique durant l’enfance sur le risque de fracture est difficile à mettre en évidence dans la population générale en raison des difficultés à mener des enquêtes sur de grandes populations. Cependant, une étude de cohorte récente effectuée sur 6 213 enfants âgés de 9,9 ans pendant deux ans (Clark et coll., 2006

) a montré une relation inverse entre la masse osseuse et le risque de fracture avec un OR de 1,4 pour le risque de fracture chez les enfants appartenant au tercile le plus faible en densité osseuse mesurée au corps entier. Si l’on considère qu’il existe une relation entre la pratique physique et la densité de l’os, on peut attribuer en partie cet effet protecteur à la pratique. Un résultat similaire a été observé sur l’humérus (OR=1,6) lors de l’étude de la densité volumique.
Une analyse transversale concernant 5 461 jeunes filles âgées de 11 à 17 ans (
Growing Up Today Study) (Loud et coll., 2005

) a montré que, parmi les 2,7 % de sujets ayant une histoire de fracture de stress, les filles qui participaient à des activités plus de 16 h par semaine avaient davantage (OR=1,88) de fractures que celles qui s’entraînaient au plus 4 h par semaine. Par ailleurs, ces mêmes sujets avaient une probabilité plus grande (4,8 %
versus 2,8 %) de présenter des désordres alimentaires et ces désordres étaient liés à la fracture de fatigue (OR=1,33). Chaque heure d’activité à impact pratiquée au-delà de 4 h par semaine augmentait significativement le risque de fracture (OR=1,5). La pratique intensive lorsqu’elle est associée à des désordres alimentaires augmente le risque de fracture de stress spécialement chez les adolescents.
Relation entre pratique physique durant l’enfance et capital osseux durant la vie adulte
Les premières études concernant l’intérêt de la pratique physique durant l’enfance étaient de type rétrospectif et associaient une plus grande densité osseuse à la quantité d’activité physique pratiquée durant l’enfance (McCulloch et coll., 1990

). Il a été montré que le gain osseux qui persistait à l’âge adulte était lié à l’âge de début de pratique (Kontulainen et coll., 2002

), aux caractéristiques de l’activité ainsi qu’à la durée de l’entraînement (Modlesky et Lewis, 2002

). L’arrêt de l’activité n’entraînait pas la perte de ce gain (Kudlac et coll., 2004

; Zanker et coll., 2004

).
Certains auteurs ont cependant montré l’intérêt de maintenir l’activité pour potentialiser le bénéfice (van Langendonck et coll., 2003b

).
On peut aborder ici l’intérêt, pour la jeune femme, de pratiquer un exercice physique avant et pendant la gestation. En effet, il a été montré l’existence d’une ostéoporose gravidique (Smith et coll., 1985

et 1995

; Smith et Phillips, 1998

; Kaur et coll., 2003a

et b

; Kabi et coll., 2006

). La densité osseuse diminue pendant la période de gestation au niveau de la colonne lombaire et de la hanche (Pearson et coll., 2004

). Ceci semble être une pathologie rare mais qui peut aboutir à des complications fracturaires (Sarikaya et coll., 2004

).
Effet préventif de l’activité physique sur le risque fracturaire de l’adulte
Les méta-analyses de Kelley et coll. (2000

, 2001

et 2002

) ont montré que l’exercice physique peut maintenir voire améliorer la densité osseuse chez l’homme et qu’il fallait conseiller des pratiques variées pour préserver la masse osseuse chez les femmes âgées. Cependant, il existe un minimum d’intensité pour rendre la pratique physique efficace, la marche semblant peu efficace par rapport à des activités en force ou résistance (Kerr et coll., 1996

; Cussler et coll., 2003

).
Par ailleurs, l’activité à base de sauts semble moins efficace pour maintenir la masse osseuse chez la personne âgée que chez le jeune et un même programme d’entraînement en saut qui améliore la densité chez les femmes non ménopausées n’est efficace chez les femmes ménopausées que s’il est accompagné d’un traitement hormonal de substitution (THS) (Bassey et coll., 1998

).
Concernant l’effet de la pratique sur le risque fracturaire chez l’adulte, Sinaki et coll. (2002

) ont montré que chez des femmes ménopausées deux années de renforcement musculaire dorsal entraînaient une chute de la prévalence des fractures vertébrales, qui passe de 4,3 à 1,6 % et reste significative 8 ans après l’arrêt de l’entraînement. Le bilan de la
Finnish Twin Cohort a mis en évidence un risque relatif de fracture de hanche plus faible de 60 % chez des hommes vigoureusement actifs comparés à leurs pairs moins actifs (Kujala et coll., 2000

) et la
Nurses’ Health Study a démontré une réduction du risque relatif de fracture de hanche chez la femme ménopausée de 6 % pour une intensité d’exercice de 3 MET.h-1, ce qui correspond à 1 h de marche par semaine. La diminution du risque atteint 41 % pour une marche de 4 h et plus par semaine (Feskanich et coll., 2002

).
Enfin, l’effet de l’activité physique sur la réduction des fractures ostéoporotiques reste discutable, la présence d’un THS associé semblant une condition nécessaire pour mettre en évidence une réduction des fractures (Kohrt et coll., 1995

et 1998

).
Mécanismes d’action des contraintes mécaniques sur le tissu osseux
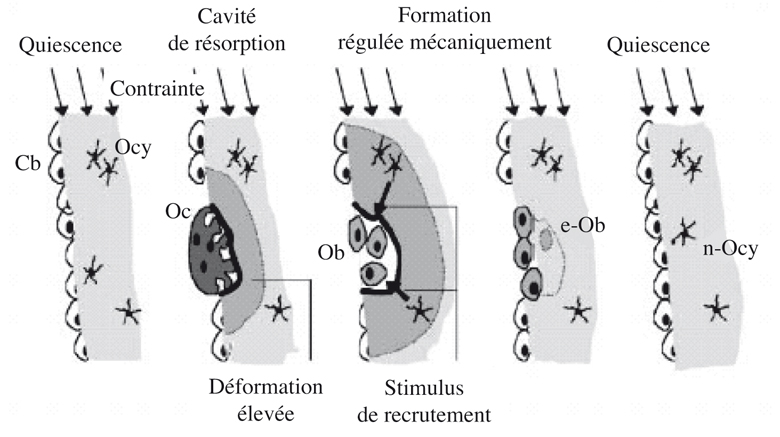
Les mécanismes par lesquels une charge agit sur le tissu osseux, dans son ensemble, et sur les ostéoblastes, en particulier, sont encore mal connus, et beaucoup d’hypothèses sont en concurrence. La contrainte entraîne des modifications de l’environnement mécanique cellulaire, la cellule adaptant sa réponse en fonction des changements perçus dans le cadre d’interactions cellules-cellules, cellules-matrice…
L’adaptation osseuse aux variations de contraintes a été conceptualisée par Frost (Frost, 1987

; Frost et coll., 1998

) sous la forme d’un « mécanostat » grâce auquel l’os adapte son niveau de modelage (ou de remodelage) lorsqu’il perçoit un changement de régime de contraintes. Cette adaptation est encadrée par des seuils correspondant à des niveaux de stress mécaniques en-deçà et au-delà desquels le changement de régime a un effet nul ou délétère sur la masse osseuse.
Théorie du « mécanostat » de Frost
Cette théorie nécessite la présence de récepteurs sensibles aux variations de contraintes. Les contraintes mécaniques appliquées sur l’os engendrent des réponses biochimiques site-spécifiques. Les modifications du fonctionnement cellulaire ainsi provoquées entraîneraient des adaptations de forme etde structure de l’os. À partir de cette théorie, il détermine les applications sur l’étiologie de l’ostéopénie ou de l’ostéoporose.
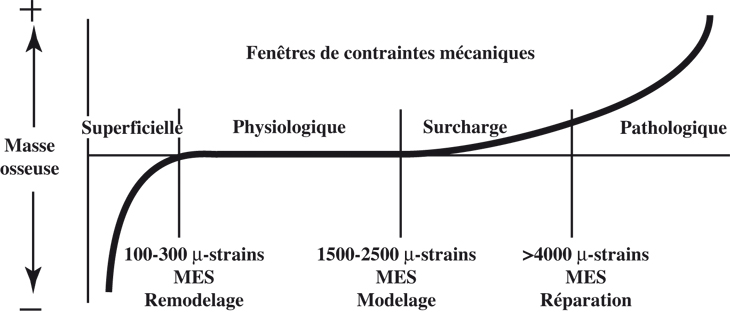
Dans son modèle, Frost a distingué différentes « fenêtres », correspondant à différents niveaux de déformation osseuse (figure 11.2

). La déformation est exprimée en microdéformations (microstrains ou µ∊), 1000 µ∊ correspondant à une modification de la longueur de l’os de 0,10 %.
Ce mécanostat serait en position «
off » lorsque les stimuli mécaniques sont d’ordre physiologique. Il existe alors un équilibre entre la formation et la résorption osseuse, le remodelage tend à conserver la masse osseuse. Il serait en position «
on » quand les sollicitations mécaniques sont en dehors de la fenêtre physiologique (Ehrlich et Lanyon, 2002

). Le remodelage est fortement activé en cas de contraintes trop faibles ou trop fortes de manière à ajuster la masse osseuse aux sollicitations mécaniques. L’application de contraintes mécaniques induisant un certain seuil de déformation entraîne une augmentation de la masse osseuse. Si ces contraintes sont de nouveau appliquées sur la structure osseuse, devenue plus solide, elles induiront une déformation plus faible et donc une réponse osseuse plus faible. Inversement, si les contraintes mécaniques diminuent, la masse osseuse diminuera elle aussi pour s’adapter au nouvel environnement mécanique. Pour Frost, le seuil du modelage se situe environ à 1 500-2 500 µ∊. Ce seuil est aussi appelé «
minimum effective strain ». Le seuil du remodelage est beaucoup plus faible (100-300 µ∊). Pour information, l’os risquerait de se fracturer pour des contraintes atteignant 25 000 µ∊ (Frost, 1987

).
Forces mécaniques
Le (re)modelage adaptatif est une réponse structurale influencée par la distribution des forces dynamiques sur un volume osseux. Ces forces peuvent être produites par étirement, compression, torsion et cisaillement. L’effet de ces forces sur les tissus implique des mouvements de fluides et l’association de ces forces induit une déformation au sein du tissu osseux.
In vivo, les premières expériences qui ont mesuré la déformation sur des os longs, montrent que celle-ci varie de 2 à 3 000 µ∊ (Rubin et Lanyon, 1982

; Biewener et Taylor, 1986

).
L’os est influencé par l’amplitude de la charge, la fréquence d’application, la distribution des déformations au sein de l’os et le nombre de cycles appliqués par jour (Lanyon, 1996

). Les contraintes statiques n’ont que peu d’effets sur l’accrétion minérale osseuse. En revanche, les contraintes dynamiques provoquent des adaptations de l’os (Lanyon, 1996

).
Rubin et Lanyon (1987

) ont montré qu’une série de stimulations mécaniques durant une seule minute par jour était suffisante pour prévenir la perte osseuse cubitale, tant que la fréquence efficace était appliquée. Cela suggère que c’est la fréquence de la charge et non la valeur absolue de cette charge qui est l’une des variables mécaniques les plus importantes dans les adaptations osseuses (Rubin et McLeod, 1994

; Turner et coll., 1994

). Dans tous les phénomènes décrits comme pouvant intervenir dans la perception du signal, la fréquence du signal mécanique représente un élément important dans la réponse cellulaire (Fischer et coll., 1986

) régulant le nombre d’événements mécaniques et leur amplitude dans le tissu trabéculaire (Barkhausen et coll., 2003

).
L’amplitude du signal semble avoir une importance également sur la réponse cellulaire (Tanaka et coll., 2003a

). Les études relativement récentes mettent cependant en évidence que ni la fréquence du mouvement, ni son amplitude, ne modulent la réponse à la contrainte, mais c’est le régime mécanique lui-même (dans toutes ces composantes définies par la forme du signal, l’amplitude, la fréquence), qui influence les activités cellulaires (Rubin et coll., 2001

; Tanaka et coll., 2003a

) et l’adaptation tissulaire (Rubin et coll., 2002

; Tanaka et coll., 2003b

). En effet, une stimulation mécanique entraîne une réponse tissulaire plus importante à basse amplitude et haute fréquence qu’à base fréquence et haute amplitude (l’application d’un signal à haute fréquence et haute amplitude étant impossible).
Rubin et McLeod (1994

) ont montré que des stimuli mécaniques de faible amplitude sont capables de maintenir la masse osseuse à 1 Hz et peuvent induire une ostéogenèse à 20 Hz. Il en est de même pour Turner et coll. (1994

) qui ont montré qu’une ostéogenèse peut être induite dans le tibia de rat seulement si la fréquence est supérieure à 0,2 Hz. Entre 0,2 et 2 Hz, la formation osseuse est proportionnelle à la fréquence d’application de la force de tension (Turner et Burr, 1993

). De plus, il a été montré que l’amplitude des potentiels électriques générés par les flux induits par le stress mécanique est, elle aussi, directement proportionnelle à la fréquence d’application de la force (Otter et coll., 1992

).
Ces théories impliquent donc que la contrainte mécanique agit sur les cellules et le tissu par d’autres phénomènes qu’une déformation directe du substrat et/ou de la surface cellulaire.
Mécanotransduction et mécanismes cellulaires
La déformation osseuse induite par les contraintes mécaniques crée des mouvements de liquides dans les espaces interstitiels (Forwood et Turner, 1995

; Burr et coll., 2002

). Ces flux liquidiens traversent la membrane des ostéocytes et créent ainsi une contrainte (
fluid shear stress) à l’intérieur des cellules (figure 11.3

). Si cette contrainte est suffisamment forte et rapide, elle déclenche une réponse cellulaire. Les ostéocytes fonctionneraient ainsi comme des jauges de contraintes (Huiskes et coll., 2000

). En réponse aux gradients de flux liquidiens, ils libéreraient des messagers biochimiques tels les prostaglandines (Ehrlich et Lanyon, 2002

). Ces messagers envoient des signaux qui se dissipent jusqu’à la surface de l’os où a lieu le recrutement des ostéoblastes. La nature du signal est encore peu connue mais il pourrait s’agir de courants électriques et/ou de transports ioniques (Huiskes et coll., 2000

), provoqués par la vitesse de circulation des courants liquidiens intracanaliculaires (Mosley et Lanyon, 1998

). On parle de mécanotransduction car le signal mécanique (déformation de l’os) est transformé en message chimique.
Cette transformation du signal inclut quatre étapes :
• le couplage mécanique ou mécano couplage, la transformation de la force mécanique appliquée à l’os en un signal mécanique local perçu par une cellule cible ;
• le couplage biochimique, traduction du signal mécanique local en un signal biochimique et, finalement, soit en expression génique soit en activation protéique ;
• la transmission du signal de la cellule cible à la cellule effectrice, c’est-àdire la cellule qui va réellement former ou résorber le tissu osseux ;
• la réponse des cellules effectrices, réponse appropriée au niveau tissulaire.
La réponse cellulaire au signal dépend du type de force exercé mais aussi de la phase de la réponse (précoce et tardive). La réponse précoce fait intervenir au niveau des ostéoblastes des canaux membranaires activés ou inactivés par l’étirement. Ces canaux ioniques sont, en fait, des protéines transmembranaires facilitant le transport des ions à travers la membrane plasmique et celles des organites intracellulaires. Lanyon (1993

) a suggéré que les ostéoblastes, les ostéocytes et les lignées cellulaires osseuses, du fait de leurs nombreuses connexions, peuvent être morphologiquement sensibles aux variations mécaniques.
In vitro, la technique de
patch-clamp a permis de mettre en évidence différents canaux ioniques sur les cellules osseuses. La plupart sont voltage-dépendants (Ravesloot et coll., 1989

), mais certains sont sensibles à l’étirement membranaire (Duncan et Misler, 1989

) et répondent à une sollicitation mécanique (Duncan et Hruska, 1994

). De fait, les propriétés électriques et mécaniques de la membrane cellulaire peuvent sans doute contrôler l’activité des cellules osseuses (Ypey et coll., 1992

).
Les intégrines, récepteurs de la matrice extracellulaire et le cytosquelette dont certains éléments comme l’actine sont connectés aux intégrines, participent aussi à la mécano-transduction ostéoblastique (Ajubi et coll., 1996

; Pavalko et coll., 1998

). Ces molécules associées à l’actine et à la phosphokinase C (PKC) sont nécessaires à la fois à l’hyperpolarisation et à la dépolarisation consécutives à la stimulation mécanique (Salter et coll., 1997

). La prolifération cellulaire consécutive à la stimulation mécanique ferait aussi intervenir les récepteurs aux œstrogènes. En effet, l’utilisation du tamoxifène (antagoniste de l’œstradiol) élimine la prolifération ostéoblastique mécanico-dépendante d’os de rat (Damien et coll., 1998

). Enfin, le monoxyde d’azote (NO) et la NO synthase produits par les ostéoblastes pourraient également intervenir dans cette régulation comme ils le font au niveau vasculaire (Riancho et Mundy, 1995

).
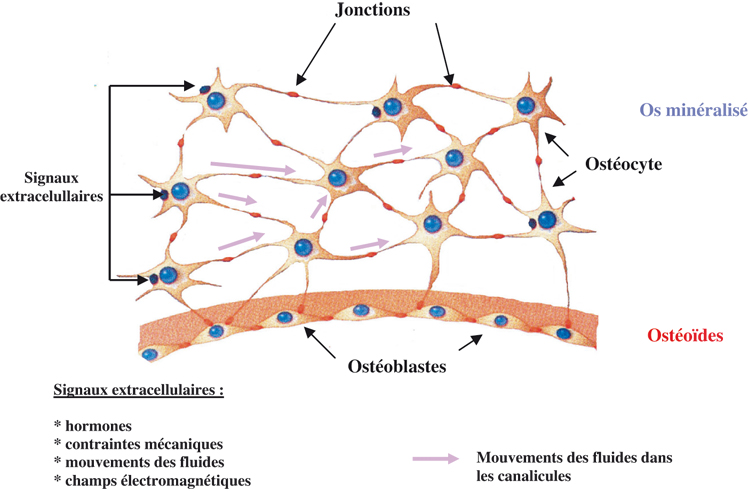
In vivo, les ostéocytes, en contact avec les ostéoblastes des canaux de Havers, semblent participer à la transmission des informations concernant les contraintes appliquées à l’os (figure 11.4

). Par l’intermédiaire du réseau de leurs prolongements cytoplasmiques et des jonctions (Donahue, 2000

), ils peuvent envoyer des messages chimiques aux ostéoblastes et/ou ostéoclastes. Les forces s’exerçant sur l’os pourraient donc provoquer des mouvements du fluide canaliculaire, enregistrés par les ostéocytes, qui y répondraient en libérant des cytokines régulant le métabolisme phosphocalcique (Klein-Nulend et coll., 1995

).
Lors d’une contrainte, le tissu osseux se déforme entraînant des déformations locales. Les gradients de pression que le tissu provoque en se déformant, créent un flux de fluide extracellulaire à travers le réseau ostéocytaire. Les ostéocytes sont de ce fait les premières cellules cibles de la contrainte. Cependant, la contrainte mécanique et les forces de cisaillement ne sont pas les seules conséquences de la déformation. En effet, la déformation crée un effet piézoélectrique et le flux liquidien entraîne la formation de champs électriques appelés « potentiels de flux » (Chakkalakal, 1989

). Plusieurs études ont montré que les cellules osseuses répondaient aux contraintes mécaniques (Somjen et coll., 1980

), au flux liquidiens (Reich et coll., 1990

), ainsi qu’aux champs électriques (Korenstein et coll., 1984

). Toutefois, dans ces études, la contrainte mécanique appliquée (en terme d’amplitude et de durée), pour activer les cellules osseuses
in vitro, est 10 à 100 fois supérieure à celle requise
in vivo, même si cette notion reste controversée (Han et coll., 2004

). L’ostéoformation dépend également de la vitesse de circulation des courants liquidiens intracanaliculaires (Mosley et Lanyon, 1998

), qui dépend elle-même de la vitesse de mise en charge de la structure osseuse (Lanyon, 1996

; Judex et Zernicke, 2000

). Chez l’animal, des corrélations ont été rapportées entre l’hypertrophie osseuse et la vitesse maximale de mise en charge (Mosley et Lanyon, 1998

).
Les activités physiques caractérisées par des appuis très dynamiques (sports collectifs par exemple) ou des mouvements réalisés à vitesse élevée (frappe au tennis, lancer) sont susceptibles d’être ostéogéniques. Durant ces activités, les modalités des contraintes mécaniques (compression, flexion ou torsion) influencent les caractéristiques du remodelage osseux (Ehrlich et Lanyon, 2002

; Heinonen et coll., 2002

).
La réponse ostéoblastique ou chondrocytaire aux contraintes mécaniques est très variable. Dans la plupart des expérimentations, l’augmentation des contraintes stimule la prolifération des cellules ostéoblastiques issues de cultures primaires et ce quels que soient l’espèce, le type de déformation (biaxiale, multiaxiale), l’amplitude (physiologique ou supra-physiologique) et la fréquence (inférieure ou supérieure à celle de la marche : 1 Hz) (Neidlinger-Wilke et coll., 1995

; Mikuni-Takagaki et coll., 1996

; Matsuda et coll., 1998

; Kaspar et coll., 2000

; Warren SM et coll., 2003

). Une prolifération cellulaire (Buckley et coll., 1988

), ainsi qu’une stimulation de la synthèse protéique (Hasegawa et coll., 1985

) ou d’ADN (Somjen et coll., 1980

) ont été démontrées. D’autres résultats mentionnent, au contraire, une diminution de la prolifération cellulaire (Burger et coll., 1992

). Fermor et coll. (1998

) montrent que les contraintes mécaniques d’ordre physiologique (4 000 µ∊, 1 Hz) n’ont pas d’effet sur la prolifération des ostéoblastes humaines.
Selon Carter (1987

), la maturation du cartilage pendant l’ossification endochondrale est respectivement accélérée ou ralentie par l’application intermittente de forces d’étirement ou de compression. Les forces mécaniques pourraient donc influencer la morphologie des os longs dès les premiers stades de croissance endochondrale. Dès que les centres d’ossification se développent, l’application intermittente de forces de compression produite par des cisaillements entre le cartilage calcifié et le non-calcifié et, entre la diaphyse et les épiphyses favorise la croissance. L’accélération de l’ostéogenèse dans les zones de cisaillement et la synthèse accrue de protéoglycanes dans les parties comprimées sont en accord avec la théorie de Wong et Carter (1990

).
Mécanismes d’un faible stimulus mécanique
Les données récentes sur les vibrations qui accompagnent les contraintes mécaniques ont modifié la théorie du mécanostat. Ces vibrations pourraientexpliquer la réponse d’un système à des signaux mécaniques faibles. Étant donné que des signaux de faible intensité influencent la réponse cellulaire et l’adaptation tissulaire, la théorie du mécanostat de Frost doit être modulée (David et coll., 2003

).
Le signal mécanique engendre des vibrations au niveau du substrat et de la surface cellulaire. Au moins deux théories se confrontent quant à la suite des phénomènes :
• soit le faible signal basal est amplifié par le bruit de fond, engendrant un signal secondaire capable de stimuler la cellule ;
• soit les vibrations cellulaires induites par le signal basal entraînent une résonance harmonique directe du cytosquelette.
Les deux théories font appel à la résonance harmonique, la première théorie étant connue sous le nom « résonance stochastique ».
La résonance stochastique est un effet non linéaire qui consiste en la possibilité d’améliorer la transmission d’un signal utile, au moyen d’une augmentation du bruit de fond dans le système. Cette théorie (Kamioka et coll., 2004

) implique l’existence et l’importance de signaux mécaniques aléatoires, associés au signal proprement dit. En effet, la forme d’onde des vibrations n’a pas toujours une structure aussi simple que celle des vibrations fondamentales et des vibrations harmoniques.
La résonance harmonique directe du cytosquelette peut expliquer la réponse à un signal mécanique de faible intensité, pourvu que ce signal puisse entraîner directement ou indirectement la résonance du cytosquelette. En effet, la structure des cellules dépend de différents éléments du cytosquelette (microfilaments, microtubules) mais aussi des forces extérieures qui s’exercent sur la cellule. Les réseaux du cytosquelette pourraient fonctionner comme des oscillateurs harmoniques couplés, capables de vibrer à l’unisson avec des fréquences caractéristiques.
Les deux théories précédentes peuvent cependant co-exister si l’on suppose l’existence d’un environnement vibratoire basal important que les cellules osseuses puissent détecter. En effet, à l’état basal, le fonctionnement cellulaire est assuré dans un environnement vibratoire défini d’une part par les signaux que les cellules et les tissus s’échangent en continu, et d’autre part par les signaux extérieurs s’exerçant sur le substrat et les cellules. Un signal extérieur au système considéré (tapis cellulaire, tissu, organe, organisme), ainsi qu’un dysfonctionnement cellulaire peuvent entraîner une perte de cohérence des phénomènes de résonance. Les cellules détectent la stimulation en tant que perturbation de cette « symphonie », et répondent en conséquence. Évidemment, d’aucuns prétendent que les cellules ont « l’oreille musicale », cependant cette « partition » peut-être retranscrite sous forme de différents niveaux énergétiques, que la cellule est capable d’amplifier. En effet, on peut imaginer que le réarrangement cytosquelettique qui intervient tout au long du cycle cellulaire soit en rapport avec cette perturbation. Les mêmes signaux appliqués sur le même type cellulaire peuvent entraîner des réponses différentes, selon le stade de détermination (la cellule osseuse est déterminée à partir d’un précurseur – ostéoprogéniteur – d’origine hématopoïétique ou mésenchymateuse) dans lequel se trouve la cellule (Han et coll., 2004

), le cytosquelette permettant d’amplifier des signaux extrêmement faibles. Par ailleurs, des études assez récentes (You et coll., 2000

) remettent notamment en cause l’hypothèse d’une influence majeure des forces de cisaillement dues aux mouvements liquidiens sur les ostéocytes (You et coll., 2001

). L’hypothèse plus probable est que le mécanisme d’excitation entraîne une amplification du signal par l’interaction matricecytosquelette.
En conclusion, l’activité physique, lorsqu’elle induit des contraintes mécaniques sur le squelette, exerce des effets positifs sur la minéralisation osseuse pendant la croissance. La définition d’un exercice ostéogénique suit cinq principes : la surcharge, la spécificité, la réversibilité, l’influence du capital de départ et l’entraînabilité. Le principe de surcharge précise que les contraintes doivent être d’une amplitude supérieure aux contraintes subies habituellement par le squelette (>3 G). La variété des contraintes est également un facteur déterminant, qu’elle concerne les sites osseux sur lesquels les forces s’appliquent (principe de spécificité) ou bien la direction de ces mêmes forces. Le principe de réversibilité fait référence à la perte du bénéfice osseux en cas d’arrêt de l’exercice. Ce principe s’appliquerait principalement aux bénéfices osseux obtenus à l’âge adulte, et beaucoup moins à ceux obtenus durant l’enfance.
Une pratique sportive multi-activités doit être encouragée dès l’enfance, et poursuivie tout au long de la vie afin de maximaliser puis de maintenir le capital osseux. La spécialisation précoce du jeune sportif doit faire l’objet d’une attention particulière, notamment dans les sports qui combinent un volume d’entraînement élevé (>20 h par semaine) et une restriction énergétique excessive.
Les mécanismes d’action des contraintes sur le tissu osseux sont nombreux et complexes. Certains restent encore mal expliqués et leur interaction avec des mécanismes hormonaux restent encore à préciser. Ceux-ci permettent néanmoins de comprendre les effets des contraintes diverses et variées engendrées par l’activité physique sur le squelette.
Bibliographie
[1] ackland t,
elliott b,
richards j. Growth in body size affects rotational performance in women’s gymnastics.
Sports Biomech. 2003;
2:163
-176

[2] ajubi ne,
klein-nulend j,
nijweide pj,
vrijheid-lammers t,
alblas mj,
burger eh. Pulsating fluid flow increases prostaglandin production by cultured chicken osteocytes--a cytoskeleton-dependent process.
Biochem Biophys Res Commun. 1996;
225:62
-68

[3]american academy of pediatrics, committee on sports medicine and fitness. Intensive training and sports specialization in young athletes.
Pediatrics. 2000;
106:154
-157

[4] arisaka o,
hoshi m,
kanazawa s,
numata m,
nakajima d, et coll.. Effect of adrenal androgen and estrogen on bone maturation and bone mineral density.
Metabolism. 2001;
50:377
-379

[5] bailey da,
mckay ha,
mirwald rl,
crocker pr,
faulkner ra. A six-year longitudinal study of the relationship of physical activity to bone mineral accrual in growing children: the university of Saskatchewan bone mineral accrual study.
J Bone Miner Res. 1999;
14:1672
-1679

[6] barkhausen t,
van griensven m,
zeichen j,
bosch u. Modulation of cell functions of human tendon fibroblasts by different repetitive cyclic mechanical stress patterns.
Exp Toxicol Pathol. 2003;
55:153
-158

[7] bass sl. The prepubertal years: a uniquely opportune stage of growth when the skeleton is most responsive to exercise?.
Sports Med. 2000;
30:73
-78

[8] bass s,
pearce g,
bradney m,
hendrich e,
delmas pd, et coll.. Exercise before puberty may confer residual benefits in bone density in adulthood: studies in active prepubertal and retired female gymnasts.
J Bone Miner Res. 1998;
13:500
-507

[9] bass s,
bradney m,
pearce g,
hendrich e,
inge k, et coll.. Short stature and delayed puberty in gymnasts: influence of selection bias on leg length and the duration of training on trunk length.
J Pediatr. 2000;
136:149
-155

[10] bass sl,
saxon l,
daly rm,
turner ch,
robling ag, et coll.. The effect of mechanical loading on the size and shape of bone in pre-, peri-, and postpubertal girls: a study in tennis players.
J Bone Miner Res. 2002a;
17:2274
-2280

[11] bass s,
daly r,
caine d. Intense training in elite female athletes: evidence of reduced growth and delayed maturation?.
Br J Sports Med. 2002b;
36:310

[12] bass sl,
eser p,
daly r. The effect of exercise and nutrition on the mechanostat.
J Musculoskelet Neuronal Interact. 2005;
5:239
-254

[13] bassett jhd,
williams gr. The molecular actions of thyroid hormone in bone.
Trends Endocrinol Metab. 2003;
4:356
-364

[14] bassey ej,
rothwell mc,
littlewood jj,
pye dw. Pre- and postmenopausal women have different bone mineral density responses to the same high-impact exercise.
J Bone Miner Res. 1998;
13:1805
-1813

[15] baxter-jones ad,
maffulli n. Intensive training in elite yound female athletes.
Br J Sports Med. 2002;
36:13
-15

[16] baxter-jones ad,
helms p,
maffulli n,
baines-preece jc,
preece m. Growth and development of male gymnasts, swimmers, soccer and tennis players: a longitudinal study.
Ann Hum Biol. 1995;
22:381
-394

[17] baxter-jones adg,
maffulli n,
mirwald rl. Does elite competition inhibit growth and delay maturation in some gymnasts? Probably not.
Pediatr Ex Sci. 2003;
15:373
-382

[18] beck br,
snow cm. Bone health across the lifespan - Exercising our options.
Exerc Sport Sci Rev. 2003;
31:117
-122

[19] beunen g,
malina rm,
baxter-jones a. Letter to the Editor: Blunted growth velocity in female artistic gymnasts.
Med Sci Sports Exerc. 2006;
38:605

[20] biewener aa,
taylor cr. Bone strain: a determinant of gait and speed?.
J Exp Biol. 1986;
123:383
-400

[21] blanchet c,
giguère y,
prud’homme d,
dumont m,
rousseau f,
dodin s. Association of physical activity and bone: influence of vitamin D receptor genotype.
Med Sci Sports Exerc. 2002;
34:24
-31

[22] blimkie cjr,
högler w. Muscle-bone mutualism, mechanical loading and the mechanostat theory: a pediatric perspective.
Revista Portuguesa de Ciencias do Desporto. 2003;
3:22
-25

[23] blimkie cj,
lefevre j,
beunen gp,
renson r,
dequeker j,
van damme p. Fractures, physical activity, and growth velocity in adolescent Belgian boys.
Med Sci Sports Exerc. 1993;
25:801
-808

[24] blimkie cjr,
rice s,
webber ce,
martin j,
levy d,
gordon cl. Effects of resistance training on bone mineral content and density in adolescent females.
Can J Physiol Pharmacol. 1996;
74:1025
-1033

[25] bonjour jp,
theintz g,
buchs b,
slosman d,
rizzoli r. Critical years and stages of puberty for spinal and femoral bone mass accumulation during adolescence.
J Clin Endocrinol Metab. 1991;
73:555
-563

[26] bonjour jp,
carrie al,
ferrari s,
clavien h,
slosman d, et coll.. Calcium-enriched foods and bone mass growth in prepubertal girls: a randomized, double-blind, placebo-controlled trial.
J Clin Invest. 1997;
99:1287
-1294

[27] bonjour jp,
ferrari s,
slosman d,
rizzoli r. Calcium and bone growth.
Nutrition and bone development. BONJOUR JP, TSANG RC (eds.);
Philadelphia: Lippincott-Raven:1999;
189197

[28] boot am,
de ridder ma,
pols ha,
krenning ep,
de muinck keizer-schrama sm. Bone mineral density in children and adolescents: relation to puberty, calcium intake, and physical activity.
J Clin Endocrinol Metab. 1997;
82:57
-62

[29] bradney m,
pearce g,
naughton g,
sullivan c,
bass s, et coll.. Moderate exercise during growth in prepubertal boys: changes in bone mass, size, volumetric density, and bone strength: a controlled prospective study.
J Bone Miner Res. 1998;
13:1814
-1821

[30] buckley mj,
banes aj,
levin lg,
sumpio be,
sato m, et coll.. Osteoblasts increase their rate of division and align in response to cyclic, mechanical tension in vitro.
Bone Miner. 1988;
4:225
-236

[31] burger eh,
klein-nulend j,
veldhuijzen jp. Mechanical stress and osteogenesis in vitro.
J Bone Miner Res. 1992;
7 (suppl 2):S397
-S401

[32] burr db. Muscle strength, bone mass, and age-related bone loss.
J Bone Miner Res. 1997;
12:1547
-1553

[33] burr db,
robling ag,
turner ch. Effects of biomechanical stress on bones in animals.
Bone. 2002;
30:781
-786

[34] buskirk er,
andersen kl,
brozek j. Unilateral activity and bone and muscle development in the forearm.
The Research Quarterly. 1956;
27:127
-131

[35] caine d,
lewis r,
o’connor p,
howe w,
bass s. Does gymnastics training inhibit growth of females?.
Clin J Sport Med. 2001;
11:260
-270

[36] caine d,
bass sl,
daly r. Does elite competition inhibit growth and delay maturation in some gymnasts? Quite possibly.
Pediatr Exerc Sci. 2003;
15:

[37] cameron ma,
paton lm,
nowson ca,
margerison c,
frame m,
wark jd. The effect of calcium supplementation on bone density in premenarcheal females: A cotwin approach.
J Clin Endocrinol Metab. 2004;
89:4916
-4922

[38] canalis e. Regulation of bone remodeling.
Primer on the metabolic bone diseases and disorders of mineral metabolism. FAVUS MJ (ed.);
Lippincott - Raven, Philadelphia, New York:1996;

[39] carter dr. Mechanical loading history and skeletal biology.
J Biomech. 1987;
20:1095
-1109

[40] carter dr,
van der meulen mc,
beaupre gs. Mechanical factors in bone growth and development.
Bone. 1996;
18:5S
-10S

[41] cassell c,
benedict m,
specker b. Bone mineral density in elite 7- to 9-yr-old female gymnasts and swimmers.
Med Sci Sports Exerc. 1996;
28:1243
-1246

[42] chakkalakal d. Mechanoelectric transduction in bone.
J Mater Res. 1989;
4:1034
-1046

[43] chevalley t,
rizzoli r,
hans d,
ferrari s,
bonjour jp. Interaction between calcium intake and menarcheal age on bone mass gain: an 8-year follow-up study from pre-puberty to post-menarche.
J Clin Endocrinol Metab. 2005;
90:44
-51

[44] claessens al,
malina rm,
lefevre j,
beunen g,
stijnen v, et coll.. Growth and menarcheal status of elite female gymnasts.
Med Sci Sports Exerc. 1992;
24:755
-763

[45] claessens al,
lefevre j,
beunen gp,
malina rm. Maturity-associated variation in the body proportions of elite female gymnasts 14-17 years of age.
Eur J Pediatr. 2006;
165:186
-192

[46] clark em,
ness ar,
bishop nj,
tobias jh. Association between bone mass and fractures in children: a prospective cohort study.
J Bone Miner Res. 2006;
21:1489
-1495

[47]commission médicale du comité international et olympique.Déclaration de consensus sur l’entraînement au sport d’élite chez l’enfant. 2005 : 1-3 (Site internet :
http://www.olympic.org/medical-commission).

[48] constantini nw,
brautber c,
manny n,
ish-shalom s. Differences in growth and maturation in twin athletes.
Med Sci Sports Exerc. 1997;
29:S150

[49] courteix d,
lespessailles e,
peres sl,
obert p,
germain p,
benhamou cl. Effect of physical training on bone mineral density in prepubertal girls: a comparative study between impact-loading and non-impact-loading sports.
Osteoporos Int. 1998;
8:152
-158

[50] courteix d,
lespessailles e,
obert p,
benhamou cl. Skull bone mass deficit in prepubertal highly-trained gymnast girls.
Int J Sports Med. 1999a;
20:328
-333

[51] courteix d,
lespessailles e,
jaffré c,
obert p,
benhamou cl. Bone material acquisition and somatic development in highly trained girl gymnasts.
Acta Paediatr. 1999b;
88:803
-808

[52] courteix d,
jaffré c,
lespessailles e,
benhamou cl. Cumulative effects of calcium supplementation and physical activity on bone accretion in premenarchal children: a double-blind randomised placebo-controlled trial.
Int J Sports Med. 2005;
26:332
-338

[53] courteix d,
rieth n,
thomas t,
van praagh e,
benhamou cl, et coll.. Preserved bone health in adolescent elite rhythmic gymnasts despite hypoleptinemia.
Horm Res. 2007;
68:20
-27

[54] coxam v. Données nouvelles sur la prévention nutritionnelle de l’ostéoporose.
Médecine/Sciences. 2005;
21:297
-301

[55] cussler ec,
lohman tg,
going sb,
houtkooper lb,
metcalfe ll, et coll.. Weight lifted in strength training predicts bone change in postmenopausal women.
Med Sci Sports Exerc. 2003;
35:10
-17

[56] daly rm,
bass s,
caine d,
howe w. Does training affect growth?.
Phys Sportsmed. 2002;
30:21
-29

[57] daly rm,
rich pa,
klein r,
bass sl. Short stature in competitive prepubertal and early pubertal male gymnasts: The result of selection bias or intense training?.
J Pediatr. 2000;
137:510
-516

[58] daly rm,
caine d,
bass sl,
pieter w,
broekhoff j. Growth of highly versus moderately trained competitive female artistic gymnasts.
Med Sci Sports Exerc. 2005;
37:1053
-1060

[59] damien e,
price js,
lanyon le. The estrogen receptor’s involvement in osteoblasts’ adaptive response to mechanical strain.
J Bone Miner Res. 1998;
13:1275
-1282

[60] damsgaard r,
bencke j,
matthiesen g,
petersen jh,
müller j. Body proportions, body composition and pubertal development of children in competitive sports.
Scand J Med Sci Sports. 2001;
11:54
-60

[61] david v,
laroche n,
boudignon b,
lafage-proust mh,
alexandre c,
ruegsegger p,
vico l. Noninvasive in vivo monitoring of bone architecture alterations in hindlimb-unloaded female rats using novel three-dimensional microcomputed tomography.
J Bone Miner Res. 2003;
18:1622
-1631

[62] david v,
vico l,
lafage-proust m-h. Existe-t-il un mécanostat osseux?.
Os, activité physique et ostéoporose. HÉRISSON C, FARDELLONE P (eds);
Masson, Paris:2005;
1033

[63] dawson-hughes b,
harris ss,
finneran s. Calcium absorption on high and low Ca intakes in relation to vitamin D receptor genotype.
J Clin Endocrinol Metab. 1995;
80:3657
-3661

[64] donahue hj. Gap junctions and biophysical regulation of bone cell differentiation.
Bone. 2000;
26:417
-422

[65] ducher g,
courteix d,
même s,
magni c,
viala jf,
benhamou cl. Bone geometry in response to long-term tennis playing and its relationship with muscle volume : A quantitative magnetic resonance imaging study in tennis players.
Bone. 2005;
37:457
-466

[66] duncan r,
misler s. Voltage-activated and stretch-activated Ba2+ conducting channels in an osteoblast-like cell line (UMR 106).
FEBS Lett. 1989;
251:17
-21

[67] duncan rl,
hruska ka. Chronic, intermittent loading alters mechanosensitive channel characteristics in osteoblast-like cells.
Am J Physiol. 1994;
267:F909
-916

[68] duncan cs,
blimkie cj,
kemp a,
higgs w,
cowell ct, et coll.. Mid-femur geometry and biomechanical properties in 15- to 18-yr-old female athletes.
Med Sci Sports Exerc. 2002;
34:673
-681

[69] dyson k,
blimkie cj,
davison ks,
webber ce,
adachi jd. Gymnastic training and bone density in pre-adolescent females.
Med Sci Sports Exerc. 1997;
29:443
-450

[70] ehrlich pj,
lanyon le. Mechanical strain and bone cell function: a review.
Osteoporos Int. 2002;
13:688
-700

[71] eliakim a,
beyth y. Exercise training, menstrual irregularities and bone development in children and adolescents.
J Pediatr Adolesc Gynecol. 2003;
16:201
-206

[72] eliakim a,
raisz lg,
brasel ja,
cooper dm. Evidence for increased bone formation following a brief endurance-type training intervention in adolescent males.
J Bone Miner Res. 1997;
12:1708
-1713

[73] fermor b,
gundle r,
evans m,
emerton m,
pocock a,
murray d. Primary human osteoblast proliferation and prostaglandin E2 release in response to mechanical strain in vitro.
Bone. 1998;
22:637
-643

[74] feskanich d,
willett w,
colditz g. Walking and leisure-time activity and risk of hip fracture in postmenopausal women.
Jama. 2002;
288:2300
-2306

[75] fischer ra,
arms sw,
pope mh,
seligson d. Analysis of the effect of using two different strain rates on the acoustic emission in bone.
J Biomech. 1986;
19:119
-127

[76] forwood mr,
turner ch. Skeletal adaptations to mechanical usage: results from tibial loading studies in rats.
Bone. 1995;
17:197S
-205S

[77] frisch re,
mcarthur jw. Menstrual cycles: fatness as a determinant of minimum weight for height necessary for their maintenance or onset.
Science. 1974;
185:949
-951

[78] frost hm. The mechanostat: a proposed pathogenic mechanism of osteoporoses and the bone mass effects of mechanical and nonmechanical agents.
Bone Miner. 1987;
2:73
-85

[79] frost hm,
ferretti jl,
jee ws. Perspectives: some roles of mechanical usage, muscle strength, and the mechanostat in skeletal physiology, disease, and research.
Calcif Tissue Int. 1998;
62:1
-7

[80] fuchs rk,
snow cm. Gains in hip bone mass from high-impact training are maintained: A randomized controlled trial in children.
J Pediatr. 2002;
141:357
-362

[81] fuchs rk,
bauer jj,
snow cm. Jumping improves hip and lumbar spine bone mass in prepubescent children: a randomized controlled trial.
J Bone Miner Res. 2001;
16:148
-156

[82] georgopoulos na,
markou k,
theodoropoulou a,
paraskevopoulou p,
varaki l, et coll.. Growth and pubertal development in elite female rythmic gymnasts.
J Clin Endocrinol Metab. 1999;
84:4525
-4530

[83] georgopoulos na,
theodoropoulou a,
leglise m,
vagenakis ag,
markou kb. Growth and skeletal maturation in male and female artistic gymnasts.
J Clin Endocrinol Metab. 2004;
89:4377
-4362

[84] ginty f,
rennie kl,
mills l,
stear s,
jones s,
prentice a. Positive, site-specific associations between bone mineral status, fitness, and time spent at high-impact activities in 16- to 18-year-old boys.
Bone. 2005;
36:101
-110

[85] greene da,
naughton ga,
briody jn,
kemp a,
woodhead h,
farpourlambert n. Bone and muscle geometry in female adolescent middle-distance runners.
Pediatr Ex Sci. 2005;
17:377
-389

[86] guéguen l. Calcium.
Apports nutritionnels conseillés pour la population française. MARTIN A (ed.) Éditions Tec et Doc;
Paris:2001;
131140

[87] haapasalo h,
kannus p,
sievanen h,
pasanen m,
uusi-rasi k, et coll.. Effect of long-term unilateral activity on bone mineral density of female junior tennis players.
J Bone Miner Res. 1998;
13:310
-319

[88] haapasalo h,
kontulainen s,
sievänen h,
kannus p,
järvinen m,
vuori i. Exercise-induced bone gain is due to enlargement in bone size without a change in volumetric bone density: a peripheral quantitative computed tomography study of the upper arms of male tennis players.
Bone. 2000;
27:351
-357

[89] hagino h,
yamamoto k,
ohshiro h,
nose t. Increasing incidence of distal radius fractures in Japanese children and adolescents.
J Orthop Sci. 2000;
5:356
-360

[90] han y,
cowin sc,
schaffler mb,
weinbaum s. Mechanotransduction and strain amplification in osteocyte cell processes.
Proc Natl Acad Sci USA. 2004;
101:16689
-16694

[91] hart kj,
shaw jm,
vajda e,
hegsted m,
miller sc. Swim-trained rats have greater bone mass, density, strength, and dynamics.
J Appl Physiol. 2001;
91:1663
-1668

[92] hasegawa s,
sato s,
saito s,
suzuki y,
brunette dm. Mechanical stretching increases the number of cultured bone cells synthesizing DNA and alters their pattern of protein synthesis.
Calcif Tissue Int. 1985;
37:431
-436

[93] heaney rp,
abrams s,
dawson-hughes b,
looker ac,
marcus r, et coll.. Peak bone mass.
Osteoporos Int. 2000;
11:885
-1009

[94] heinonen a,
sievänen h,
kannus p,
oja p,
pasanen m,
vuori i. High-impact exercise and bones of growing girls: a 9-month controlled trial.
Osteoporos Int. 2000;
11:1010
-1017

[95] heinonen a,
sievanen h,
kannus p,
oja p,
vuori i. Site-specific skeletal response to long-term weight-training seems to be attributable to principal loading modality: a pQCT study of female weightlifters.
Calcif Tissue Int. 2002;
70:469
-474

[96] huang th,
lin sc,
chang fl,
hsieh ss,
liu sh,
yang rs. Effects of different exercise modes on mineralization, structure, and biomechanical properties of growing bone.
J Appl Physiol. 2003;
95:300
-307

[97] huiskes r,
ruimerman r,
van lenthe gh,
janssen jd. Effects of mechanical forces on maintenance and adaptation of form in trabecular bone.
Nature. 2000;
405:704
-706

[98] ito m,
yamada m,
hayashi k,
ohki m,
uetani m,
nakamura t. Relation of early menarche to high bone mineral density.
Calcif Tissue Int. 1995;
57:11
-14

[99] jaffré c,
courteix d,
dine g,
lac g,
delamarche p,
benhamou l. High-impact loading training induces bone hyperresorption activity in young elite female gymnasts.
J Pediatr Endocrinol Metab. 2001;
14:75
-83

[100] jahreis g,
kauf e,
frohner g. Influence of intensive exercise on insulin-like growth factor 1, thyroid and steroid hormones in female gymnasts.
Growth regul. 1991;
1:95
-99

[101] johnston cc,
miller jrjz,
slemenda cw,
reister tk,
hui s, et coll.. Calcium supplementation and increases in bone mineral density in children.
N Engl J Med. 1992;
327:82
-87

[102] judex s,
zernicke rf. High-impact exercise and growing bone: relation between high strain rates and enhanced bone formation.
J Appl Physiol. 2000;
88:2183
-2191

[103] kabi f,
mkinsi o,
zrigui j. Pregnancy-associated osteoporosis. A new case.
Rev Med Interne. 2006;
27:558
-560

[104] kamioka h,
sugawara y,
honjo t,
yamashiro t,
takano-yamamoto t. Terminal differentiation of osteoblasts to osteocytes is accompanied by dramatic changes in the distribution of actin-binding proteins.
J Bone Miner Res. 2004;
19:471
-478

[105] kannus p,
haapasalo h,
sankelo m,
sievänen h,
pasanen m, et coll.. Effect of starting age of physical activity on bone mass in the dominant arm of tennis and squash players.
Ann Intern Med. 1995;
123:27
-31

[106] kannus p,
sievänen h,
vuori i. Physical loading, exercise, and bone.
Bone. 1996;
18:1S
-3S

[107] karlsson mk. The skeleton in a long-term perspective - Are exercise induced benefits eroded by time?.
J Musculoskelet Neuronal Interact. 2003;
3:348
-351

[108] karlsson mk,
hasserius r,
obrant kj. Bone mineral density in athletes during and after career: a comparison between loaded and unloaded skeletal regions.
Calcif Tissue Int. 1996;
59:245
-248

[109] kaspar d,
seidl w,
neidlinger-wilke c,
ignatius a,
claes l. Dynamic cell stretching increases human osteoblast proliferation and CICP synthesis but decreases osteocalcin synthesis and alkaline phosphatase activity.
J Biomech. 2000;
33:45
-51

[110] kaur m,
godber im,
lawson n,
baker pn,
pearson d,
hosking dj. Changes in serum markers of bone turnover during normal pregnancy.
Ann Clin Biochem. 2003a;
40:508
-513

[111] kaur m,
pearson d,
godber i,
lawson n,
baker p,
hosking d. Longitudinal changes in bone mineral density during normal pregnancy.
Bone. 2003b;
32:449
-454

[112] keen ad,
drinkwater bl. Irreversible bone loss in former amenorrheic athletes.
Osteoporos Int. 1997;
7:311
-315

[113] kelley ga,
kelley ks,
tran zv. Exercise and bone mineral density in men: a metaanalysis.
J Appl Physiol. 2000;
88:1730
-1736

[114] kelley ga,
kelley ks,
tran zv. Resistance training and bone mineral density in women: a meta-analysis of controlled trials.
Am J Phys Med Rehabil. 2001;
80:65
-77

[115] kelley ga,
kelley ks,
tran zv. Exercise and lumbar spine bone mineral density in postmenopausal women: a meta-analysis of individual patient data.
J Gerontol A Biol Sci Med Sci. 2002;
57:M599
-604

[116] kerr d,
morton a,
dick i,
prince r. Exercise effects on bone mass in postmenopausal women are site-specific and load-dependent.
J Bone Miner Res. 1996;
11:218
-225

[117] khan k,
mckay ha,
haapasalo h,
bennell kl,
forwood mr, et coll.. Does childhood and adolescence provide a unique opportunity to strengthen the skeleton?.
J Sci Med Sport. 2000;
3:150
-164

[118] khan km,
liu-ambrose t,
sran mm,
ashe mc,
donaldson mg,
wark jd. New criteria for female athlete triad syndrome?.
Br J Sports Med. 2002;
36:10
-13

[119] klaus g,
merke j,
eing h,
hugel u,
milde p, et coll.. 1,25(OH)2D3 receptor regulation and 1,25(OH)2D3 effects in primary cultures of growth cartilage cells of the rat.
Calcif Tissue Int. 1991;
49:340
-348

[120] klein-nulend j,
van der plas a,
semeins cm,
ajubi ne,
frangos ja, et coll.. Sensitivity of osteocytes to biomechanical stress in vitro.
Faseb J. 1995;
9:441
-445

[121] kohrt wm,
snead db,
slatopolsky e,
birge sjjr. Additive effects of weight-bearing exercise and estrogen on bone mineral density in older women.
J Bone Miner Res. 1995;
10:1303
-1311

[122] kohrt wm,
ehsani aa,
birge sjjr. HRT preserves increases in bone mineral density and reductions in body fat after a supervised exercise program.
J Appl Physiol. 1998;
84:1506
-1512

[123] kontulainen s,
kannus p,
pasanen m,
sievänen h,
heinonen a, et coll.. Does previous participation in high-impact training result in residual bone gain in growing girls.
Int J Sports Med. 2002;
23:575
-581

[124] korenstein r,
somjen d,
fischler h,
binderman i. Capacitative pulsed electric stimulation of bone cells. Induction of cyclic-AMP changes and DNA synthesis.
Biochim Biophys Acta. 1984;
803:302
-307

[125] kudlac j,
nichols dl,
sanborn cf,
dimarco nm. Impact of detraining on bone loss in former collegiate female gymnasts.
Calcif Tissue Int. 2004;
75:482
-487 Epub

[126] kujala um,
kaprio j,
kannus p,
sarna s,
koskenvuo m. Physical activity and osteoporotic hip fracture risk in men.
Arch Intern Med. 2000;
160:705
-708

[127] laing em,
wilson ar,
modlesky cm,
o’connor pj,
hall db,
lewis rd. Initial years of recreational artistic gymnastics training improves lumbar spine bone mineral accrual in 4- to 8-year-old females.
J Bone Miner Res. 2005;
20:509
-519

[128] lakatos p. Thyroid Hormones: Beneficial or Deleterious for Bone?.
Calcif Tissue Int. 2003;
73:205
-209

[129] lanou aj,
berkow se,
barnard nd. Calcium, dairy products, and bone health in children and young adults: a reevaluation of the evidence.
Pediatrics. 2005;
115:736
-743

[130] lanyon le. Osteocytes, strain detection, bone modeling and remodeling.
Calcif Tissue Int. 1993;
53:S102
-106, discussion S106-107

[131] lanyon le. Using functional loading to influence bone mass and architecture: objectives, mechanisms, and relationship with estrogen of the mechanically adaptive process in bone.
Bone. 1996;
18:37S
-43S

[132] laughlin ga,
dominguez ce,
yen ssc. Nutritional and endocrine-metabolic aberrations in women with functional hypothalamic amenorrhea.
J Clin Endocrinol Metab. 1998;
83:25
-32

[133] lefebvre p,
raingeard i,
renard e,
bringer j. Effet de l’exercice sur le système hormonal et ses conséquences sur l’os.
Os, activité physique et ostéoporose. HÉRISSON C, FARDELLONE P (eds);
Masson, Paris:2005;
7583

[134] lima f,
de falco v,
baima j,
carazzato jg,
pereira rmr. Effect of impact load and active load on bone metabolism and body composition of adolescent athletes.
Med Sci Sports Exerc. 2001;
33:1318
-1323

[135] lindholm c,
hagenfeldt k,
ringertz bm. Pubertal development in elite juvenile gymnasts: effects of physical training.
Acta Obstet Gynecol Scand. 1994;
73:269
-273

[136] lloyd t,
martel jk,
rollings n,
andon mb,
kulin h, et coll.. The effect of calcium supplementation and Tanner stage on bone density, content and area in teenage women.
Osteoporos Int. 1996;
6:276
-283

[137] loucks ab. Energy availability, not body fatness, regulates reproductive function in women.
Exerc Sport Sci Rev. 2003;
31:144
-148

[138] loucks ab,
verdun m,
heath em. Low energy availability, not stress of exercise, alters LH pulsatility in exercising women.
J Appl Physiol. 1998;
84:37
-46

[139] loud kj,
gordon cm,
micheli lj,
field ae. Correlates of stress fractures among preadolescent and adolescent girls.
Pediatrics. 2005;
115:e399
-e406

[140] macdougall jd,
webber c,
martin j,
ormerod s,
chesley a, et coll.. Relationship among running mileage, bone density, and serum testosterone in male runners.
J Appl Physiol. 1992;
73:1165
-1170

[141] mackelvie kj,
mckay ha,
khan km,
crocker pre. A school-based exercise intervention augments bone mineral accrual in early pubertal girls.
J Pediatr. 2001;
139:501
-508

[142] mackelvie kj,
khan km,
mckay ha. Is there a critical period for bone response to weight-bearing exercise in children and adolescents? a systematic review.
Br J Sports Med. 2002a;
36:250
-257

[143] mackelvie kj,
mckay ha,
petit ma,
moran o,
khan km. Bone mineral response to a 7-month randomized controlled, school-based jumping intervention in 121 prepubertal boys: associations with ethnicity and body mass index.
J Bone Miner Metab. 2002b;
17:834
-844

[144] mackelvie kj,
khan km,
petit ma,
janssen pa,
mckay ha. A school-based exercise intervention elicits substantial bone health benefits: a 2-year randomized controlled trials in girls.
Pediatrics. 2003;
112:e447
-e452

[145] mackelvie kj,
petit ma,
khan km,
beck tj,
mckay ha. Bone mass and structure are enhanced following a 2-year randomized controlled trial of exercise in prepubertal boys.
Bone. 2004;
34:755
-764

[146] maïmoun l. Sport de haut niveau et masse osseuse.
Os, activité physique et ostéoporose. HÉRISSON C, FARDELLONE P (eds);
Masson, Paris:2005;
98106

[147] maïmoun l,
lumbroso s,
manetta j,
paris f,
leroux jl,
sultan c. Testosterone is dramatically reduced in endurance athletes without impact on bone mineral density.
Horm Res. 2003;
59:285
-292

[148] malina rm,
bouchard c,
bar-or o. Growth, Maturation, and Physical Activity.
. 1
st edition ed Champaign;
Illinois:Human Kinetics;
1991;

[149] malina rm,
bouchard c,
bar-or o. Growth, maturation, and physical activity.
2
nd edition ed Champaign;
Illinois:Human Kinetics;
2004;
728 pp.

[150] markou kb,
mylonas p,
theodoropoulou a,
kontogiannis a,
leglise m, et coll.. The influence of intensive physical exercise on bone acquisition in adolescent elite female and male artistic gymnasts.
J Clin Endocrinol Metab. 2004;
89:4383
-4387

[151] martin ad,
bailey da,
mckay ha,
whiting s. Bone mineral and calcium accretion during puberty.
Am J Clin Nutr. 1997;
66:611
-615

[152] matkovic v,
heaney rp. Calcium balance during human growth: evidence for a threshold behavior.
Am J Clin Nutr. 1992;
55:992
-996

[153] matkovic v,
jelic t,
wardlaw gm,
ilich jz,
goel pk, et coll.. Timing of peak bone mass in caucasian females and its implication for the prevention of osteoporosis - Inference from a cross-sectional model.
J Clin Invest. 1994;
93:799
-808

[154] matsuda n,
morita n,
matsuda k,
watanabe m. Proliferation and differentiation of human osteoblastic cells associated with differential activation of MAP kinases in response to epidermal growth factor, hypoxia, and mechanical stress in vitro.
Biochem Biophys Res Commun. 1998;
249:350
-354

[155] mcculloch rg,
bailey da,
houston cs,
dodd bl. Effects of physical activity, dietary calcium intake and selected lifestyle factors on bone density in young women.
Cmaj. 1990;
142:221
-227

[156] mckay ha,
bailey da,
mirwald rl,
davison ks,
faulkner ra. Peak bone mineral accrual and age at menarche in adolescent girls: a 6- year longitudinal study.
JPediatr. 1998;
133:682
-687

[157] mckay ha,
petit ma,
schutz rw,
prior jc,
barr si,
khan km. Augmented trochanteric bone mineral density after modified physical education classes: A randomized school-based exercise intervention study in prepubescent and early pubescent children.
J Pediatr. 2000;
136:156
-162

[158] mckay ha,
maclean l,
mackelvie-o’brien pmk,
janssen p,
beck t,
khan km. “Bounce at the bell”: a novel program of short bouts of exercise improves proximal femur bone mass in early pubertal children.
Br J Sports Med. 2005;
39:521
-526

[159]medical commission of the international olympique and committee. The female athlete triad.
Med Sci Tennis. 2006;
11:20

[160] mikuni-takagaki y,
suzuki y,
kawase t,
saito s. Distinct responses of different populations of bone cells to mechanical stress.
Endocrinology. 1996;
137:2028
-2035

[161] modlesky cm,
lewis rd. Does exercise during growth have a long-term effect on bone health?.
Exerc Sport Sci Rev. 2002;
30:171
-176

[162] morris fl,
naughton g,
gibbs jl,
carlson js,
wark jd. Prospective ten-month exercise intervention in premenarcheal girls: positive effects on bone and lean mass.
J Bone Miner Res. 1997;
12:1453
-1462

[163] mosley jr,
lanyon le. Strain rate as a controlling influence on adaptive modeling in response to dynamic loading of the ulna in growing male rats.
Bone. 1998;
23:313
-318

[164] nara-ashizawa n,
liu lj,
higuchi t,
tokuyama k,
hayashi k, et coll.. Paradoxical adaptation of mature radius to unilateral use in tennis playing.
Bone. 2002;
30:619
-623

[165] neidlinger-wilke c,
stalla i,
claes l,
brand r,
hoellen i, et coll.. Human osteoblasts from younger normal and osteoporotic donors show differences in proliferation and TGF beta-release in response to cyclic strain.
J Biomech. 1995;
28:1411
-1418

[166] new sa. The role of physical activity in development and maintenance of bone health throughout the lifecycle.
1st Joint Meeting of the International Bone and Mineral Society and the European Calcified Tissue Society. 2001;

[167] nikander r,
sievänen h,
heinonen a,
kannus p. Femoral neck structure in adult female athletes subjected to different loading modalities.
J Bone Miner Res. 2005;
20:520
-528

[168] nurmi-lawton ja,
baxter-jones ad,
mirwald rl,
bishop ja,
taylor p, et coll.. Evidence of sustained skeletal benefits from impact-loading exercise in young females: a 3-year longitudinal study.
J Bone Miner Res. 2004;
19:314
-322

[169] otter mw,
palmieri vr,
wu dd,
seiz kg,
macginitie la,
cochran gv. A comparative analysis of streaming potentials in vivo and in vitro.
J Orthop Res. 1992;
10:710
-719

[170] parfitt am. The two faces of growth: benefits and risks to bone integrity.
Osteoporos Int. 1994;
4:382
-398

[171] parfitt am,
travers r,
rauch f,
glorieux fh. Structural and cellular changes during bone growth in healthy children.
Bone. 2000;
27:487
-494

[172] pavalko fm,
chen nx,
turner ch,
burr db,
atkinson s, et coll.. Fluid shear-induced mechanical signaling in MC3T3-E1 osteoblasts requires cytoskeletonintegrin interactions.
Am J Physiol. 1998;
275:C1591
-1601

[173] pearson d,
kaur m,
san p,
lawson n,
baker p,
hosking d. Recovery of pregnancy mediated bone loss during lactation.
Bone. 2004;
34:570
-578

[174] peltenburg al,
erich wbm,
zonderland ml. A retrospective growth study of female gymnasts and girl swimmers.
Int J Sports Med. 1984;
5:262
-267

[175] petit ma,
mckay ha,
mackelvie kj,
heinonen a,
kahn km,
beck tj. A randomized school-based jumping intervention confers site and maturity-specific benefits on bone structural properties in girls: a hip structural analysis study.
J Bone Miner Res. 2002;
17:363
-372

[176] pigeon p,
oliver i,
charlet jp,
rochiccioli p. Intensive dance practice repercussions on growth and puberty.
Am J Sports Med. 1997;
25:243
-247

[177] rauch f,
schoenau e. Skeletal development in premature infants: a review of bone physiology beyond nutritional aspects.
Arch Dis Child Fetal Neonatal Ed. 2002;
86:F82
-F85

[178] ravesloot jh,
ypey dl,
vrijheid-lammers t,
nijweide pj. Voltage-activated K+ conductances in freshly isolated embryonic chicken osteoclasts.
Proc Natl Acad Sci USA. 1989;
86:6821
-6825

[179] reich km,
gay cv,
frangos ja. Fluid shear stress as a mediator of osteoblast cyclic adenosine monophosphate production.
J Cell Physiol. 1990;
143:100
-104

[180] riancho ja,
mundy gr. The role of cytokines and growth factors as mediators of the effects of systemic hormones at the bone local level.
Crit Rev Eukaryot Gene Expr. 1995;
5:193
-217

[181] rice s,
blimkie cj,
webber ce,
levy d,
martin j, et coll.. Correlates and determinants of bone mineral content and density in healthy adolescent girls.
Can J Physiol Pharmacol. 1993;
71:923
-930

[182] riggs bl,
khosla s,
melton lJ. Sex steroids and the construction and conservation of the adult skeleton.
Endocr Rev. 2002;
23:279
-302

[183] rizzoli r,
bonjour jP. Calciotropic hormones and integrated regulation of calcemia and calcium balance.
Rev Prat. 1998;
48:1178
-1184

[184] rizzoli r,
bonjour jp,
ferrari sl. Osteoporosis, genetics and hormones.
J Mol Endocrinol. 2001;
26:79
-94

[185] robinson tl,
snow-harter c,
taaffe dr,
gillis d,
shaw j,
marcus r. Gymnasts exhibit higher bone mass than runners despite similar prevalence of amenorrhea and oligomenorrhea.
J Bone Miner Res. 1995;
10:26
-35

[186] rubin ct,
lanyon le. Limb mechanics as a function of speed and gait: a study of functional strains in the radius and tibia of horse and dog.
J Exp Biol. 1982;
101:187
-211

[187] rubin ct,
lanyon le. Kappa Delta Award paper. Osteoregulatory nature of mechanical stimuli: function as a determinant for adaptive remodeling in bone.
J Orthop Res. 1987;
5:300
-310

[188] rubin ct,
mcleod kj. Promotion of bony ingrowth by frequency-specific, low-amplitude mechanical strain.
Clin Orthop. 1994;
298:165
-174

[189] rubin c,
turner as,
bain s,
mallinckrodt c,
mcleod k. Anabolism. Low mechanical signals strengthen long bones.
Nature. 2001;
412:603
-604

[190] rubin c,
turner as,
muller r,
mittra e,
mcleod k,
lin w,
qin yx. Quantity and quality of trabecular bone in the femur are enhanced by a strongly anabolic, noninvasive mechanical intervention.
J Bone Miner Res. 2002;
17:349
-357

[191] ruff cb,
walker a,
trinkaus e. Postcranial robusticity in Homo III: Ontogeny.
Am J Phys Anthrop. 1994;
93:35
-54

[192] rutherford pm. Is there a role for exercise in the prevention of osteoporotic fractures?.
Br J Sports Med. 1999;
33:378
-386

[193] salter dm,
robb je,
wright mO. Electrophysiological responses of human bone cells to mechanical stimulation: evidence for specific integrin function in mechanotransduction.
J Bone Miner Res. 1997;
12:1133
-1141

[194] sarikaya s,
ozdolap s,
acikgoz g,
erdem cz. Pregnancy-associated osteoporosis with vertebral fractures and scoliosis.
Joint Bone Spine. 2004;
71:84
-85

[195] schoenau e,
frost hm. The “muscle-bone unit” in children and adolescents.
Calcif Tissue Int. 2002;
70:405
-407

[196] schoenau e,
schwahn b,
rauch F. The muscle-bone relationship: methods and management - perspectives in glycogen storage disease.
Eur J Pediatr. 2002;
161:S50
-S52

[197] seeman e. Sexual dimorphism in skeletal size, density, and strength.
J Clin Endocrinol Metab. 2001;
86:4576
-4584

[198] sinaki m,
itoi e,
wahner hw,
wollan p,
gelzcer r, et coll.. Stronger back muscles reduce the incidence of vertebral fractures: a prospective 10 year follow-up of postmenopausal women.
Bone. 2002;
30:836
-841

[199] skierska e. Age at menarche and prevalence of oligo/amenorrhea in top polish athletes.
Am J Hum Biol. 1998;
10:511
-517

[200] slemenda cw,
reister tk,
hui sl,
miller jz,
christian jc,
johnston ccjr. Influences on skeletal mineralization in children and adolescents: evidence for varying effects of sexual maturation and physical activity.
J Pediatr. 1994;
125:201
-207

[201] smith el,
smith jrpe,
ensign cj,
shea mm. Bone involution decrease in exercising middle-aged women.
Calcif Tissue Int. 1984;
36:S129
-138

[202] smith r,
phillips aj. Osteoporosis during pregnancy and its management.
Scand J Rheumatol Suppl. 1998;
107:66
-67

[203] smith r,
stevenson jc,
winearls cg,
woods cg,
wordsworth bp. Osteoporosis of pregnancy.
Lancet. 1985;
1:1178
-1180

[204] smith r,
athanasou na,
ostlere sj,
vipond se. Pregnancy-associated osteoporosis.
Qjm. 1995;
88:865
-878

[205] somjen d,
binderman i,
berger e,
harell a. Bone remodelling induced by physical stress is prostaglandin E2 mediated.
Biochim Biophys Acta. 1980;
627:91
-100

[206] specker bl,
mulligan l,
ho m. Longitudinal study of calcium intake, physical activity, and bone mineral content in infants 6-19 months of age.
J Bone Miner Res. 1999;
14:569
-576

[207] stokstad e. Graceful, beautiful, and perilous.
Science. 2004;
305:641
-642

[208] suuriniemi m,
mahonen a,
kovanen v,
alen m,
lyytikäinen a, et coll.. Association between exercise and pubertal BMD is modulated by estrogen receptor and genotype.
J Bone Miner Res. 2004;
19:1758
-1765

[209] tanaka sm,
alam im,
turner ch. Stochastic resonance in osteogenic response to mechanical loading.
Faseb J. 2003a;
17:313
-314

[210] tanaka sm,
li j,
duncan rl,
yokota h,
burr db,
turner ch. Effects of broad frequency vibration on cultured osteoblasts.
J Biomech. 2003b;
36:73
-80

[211] teegarden d,
proulx wr,
martin br,
zhao j,
mccabe gp, et coll.. Peak bone mass in young women.
J Bone Miner Res. 1995;
10:711
-715

[212] theintz ge,
howald h,
allemann y,
sizonenko pc. Growth and pubertal development of young female gymnasts and swimmers: a correlation with parental data.
Int J Sports Med. 1989;
10:87
-91

[213] theintz ge,
howald h,
weiss u,
sizonenko pc. Evidence for a reduction of growth potential in adolescent female gymnasts.
J Pediatr. 1993;
122:306
-313

[214] thomis m,
claessens al,
lefevre j,
philippaerts r,
beunen gp,
malina rm. Adolescent growth spurts in female gymnasts.
J Pediatr. 2005;
146:239
-244

[215] tonz o,
stronski sm,
gmeiner cY. Growth and puberty in 7-to16-year-old female gymnasts: a prospective study.
Schweiz Med Wochenschr. 1990;
120:10
-20

[216] turner ch. Muscle-bone interactions, revisited.
Bone. 2000;
27:339
-340

[217] turner ch,
burr db. Basic biomechanical measurements of bone: a tutorial.
Bone. 1993;
14:595
-608

[218] turner ch,
robling ag. Designing exercise regimens to increase bone strength.
Exerc Sport Sci Rev. 2003;
31:45
-50

[219] turner ch,
forwood mr,
rho j-y,
yoshikawa t. Mechanical loading thresholds for lamellar and woven bone formation.
J Bone Miner Res. 1994;
9:87
-97

[220] tveit-milligan p,
spindler aa,
nichols jf. Genes and gymnastics: a case study of triplets.
Sports Med Train Rehab. 1993;
4:47
-52

[221] valdimarsson ö,
linden c,
johnell o,
gardsell p,
karlsson mk. Daily physical education in the school curriculum in prepubertal girls during 1 year is followed by an increase in bone mineral accrual and bone width - Data from the Prospective Controlled Malmö Pediatric Osteoporosis Prevention Study.
Calcif Tissue Int. 2006;
78:65
-71

[222] van der meulen mc,
jepsen kj,
mikic b. Understanding bone strength: size isn’t everything.
Bone. 2001;
29:101
-104

[223] van langendonck l. Influence of physical activity on bone relevance of high-impact loading, body composition and strength.
Thesis, Biomedical Sciences Katholieke Universiteit Leuven, Faculty of Physical Education and Physiotherapy. Leuven:2002;

[224] van langendonck l,
claessens al,
vlietinck r,
derom c,
beunen g. Influence of weight-bearing exercises on bone acquisition in prepubertal monozygotic female twins: a randomized controlled prospective study.
Calcif Tissue Int. 2003a;
72:666
-674

[225] van langendonck l,
lefevre j,
claessens al,
thomis m,
philippaerts r, et coll.. Influence of participation in high-impact sports during adolescence and adulthood on bone mineral density in middle-aged men: a 27-year follow-up study.
Am J Epidemiol. 2003b;
158:525
-533

[226] ward ka,
roberts sa,
adams je,
mughal mz. Bone geometry and density in the skeleton of pre-pubertal gymnasts and school children.
Bone. 2005;
36:1012
-1018

[227] warren mp,
perlroth ne. The effect of intense exercise on the female reproductive system.
J Endocrinol. 2001;
170:3
-11

[228] warren mp,
brooks-gunn j,
hamilton lh,
warren lf,
hamilton wg. Scoliosis and fractures in young ballet dancers relation to delayed menarche and secondary amenorrhea.
N Engl J Med. 1986;
314:1348
-1353

[229] warren mp,
brooks-gunn j,
fox rp,
holderness cc,
hyle ep,
hamilton wg. Osteopenia in exercise-associated amenorrhea using ballet dancers as a model: a longitudinal study.
J Clin Endocrinol Metab. 2002a;
87:3162
-3168

[230] warren mp,
ramos rh,
bronson em. Exercise-associated amenorrhea.
Phys Sportsmed. 2002b;
30:41
-46

[231] warren mp,
brooks-gunn j,
fox rp,
holderness cc,
hyle ep, et coll.. Persistent osteopenia in ballet dancers with amenorrhea and delayed menarche despite hormone therapy: a longitudinal study.
Fertil Steril. 2003;
80:398
-404

[232] warren sm,
greenwald ja,
nacamuli rp,
fong kd,
song hj, et coll.. Regional dura mater differentially regulates osteoblast gene expression.
J Craniofac Surg. 2003;
14:363
-370

[233] weimann e,
blum wf,
witzel c,
schwidergall s,
böhles hj. Hypoleptinemia in female and male elite gymnasts.
Eur J Clin Invest. 1999;
29:853
-860

[234] weimann e,
witzel c,
schwidergall s. Peripubertal perturbations in elite gymnasts caused by sport specific training regimes and inadequate nutrition intake.
Int J Sports Med. 2000;
21:210
-215

[235] welt ck,
chan jl,
bullen j,
murphy r,
smith p, et coll.. Recombinant human leptin in women with hypothalamic amenorrhea.
N Engl J Med. 2004;
351:987
-997

[236] williams ni,
helmreich dl,
parfitt db,
caston-balderrama a,
cameron jl. Evidence for a causal role of low energy availability in the induction of menstrual cycle disturbances during strenuous exercise training.
J Clin Endocrinol Metab. 2001;
86:5184
-5193

[237] witzke ka,
snow cm. Effects of plyometric jump training on bone mass in adolescent girls.
Med Sci Sports Exerc. 2000;
32:1051
-1057

[238] wong m,
carter dr. A theoretical model of endochondral ossification and bone architectural construction in long bone ontogeny.
Anat Embryol (Berl). 1990;
181:523
-532

[239] yates a,
leehey k,
shisslak cM. Running - an analogue of anorexia?.
N Engl J Med. 1983;
308:251
-255

[240] yeh fj,
grant am,
williams sm,
goulding a. Children who experience their first fracture at a young age have high rates of fracture.
Osteoporos Int. 2006;
17:267
-272

[241] you j,
yellowley ce,
donahue hj,
zhang y,
chen q,
jacobs cr. Substrate deformation levels associated with routine physical activity are less stimulatory to bone cells relative to loading-induced oscillatory fluid flow.
J Biomech Eng. 2000;
122:387
-393

[242] you l,
cowin sc,
schaffler mb,
weinbaum s. A model for strain amplification in the actin cytoskeleton of osteocytes due to fluid drag on pericellular matrix.
J Biomech. 2001;
34:1375
-1386

[243] ypey dl,
weidema af,
hold km,
van der laarse a,
ravesloot jh, et coll.. Voltage, calcium, and stretch activated ionic channels and intracellular calcium in bone cells.
J Bone Miner Res. 1992;
7 (suppl 2):S377
-S387

[244] zanker cl,
gannon l,
cooke cb,
gee kl,
oldroyd b,
truscott jg. Differences in bone density, body composition, physical activity, and diet between child gymnasts and untrained children 7-8 years of age.
J Bone Miner Res. 2003;
18:1043
-1050

[245] zanker cl,
osborne c,
cooke cb,
oldroyd b,
truscott jg. Bone density, body composition and menstrual history of sedentary female former gymnasts, aged 20-32 years.
steoporos Int. 2004;
15:145
-154 Epub

→ Aller vers SYNTHESE
 ; Rauch et Schoenau, 2002
; Rauch et Schoenau, 2002 ; Bass et coll., 2005
; Bass et coll., 2005 ).
). ) ; la taille et la morphologie des pièces osseuses évoluent afin de s’adapter aux contraintes mécaniques et ainsi conserver l’intégrité du squelette (Parfitt et coll., 2000
) ; la taille et la morphologie des pièces osseuses évoluent afin de s’adapter aux contraintes mécaniques et ainsi conserver l’intégrité du squelette (Parfitt et coll., 2000 ).
). ). Environ 65 % du poids sec du squelette dégraissé est composé de minéral, c’est-à-dire des cristaux d’hydroxyapatite (Malina et coll., 1991
). Environ 65 % du poids sec du squelette dégraissé est composé de minéral, c’est-à-dire des cristaux d’hydroxyapatite (Malina et coll., 1991 ).
). ). Le deuxièmepic d’accrétion osseuse a lieu lors de la puberté. À peu près un quart de la masse osseuse adulte est acquis durant les deux années qui encadrent le second pic d’accrétion osseuse (stades de Tanner II à IV chez la fille et III à V chez le garçon), c’est-à-dire le moment où le taux de minéralisation osseuse est le plus important (Bailey et coll., 1999
). Le deuxièmepic d’accrétion osseuse a lieu lors de la puberté. À peu près un quart de la masse osseuse adulte est acquis durant les deux années qui encadrent le second pic d’accrétion osseuse (stades de Tanner II à IV chez la fille et III à V chez le garçon), c’est-à-dire le moment où le taux de minéralisation osseuse est le plus important (Bailey et coll., 1999 ). Selon Martin et coll. (1997
). Selon Martin et coll. (1997 ), près de 320 g de minéral osseux (dont un tiers de calcium) sont accumulés pendant l’année du pic d’accrétion osseuse chez les garçons, contre 240 g chez les filles.
), près de 320 g de minéral osseux (dont un tiers de calcium) sont accumulés pendant l’année du pic d’accrétion osseuse chez les garçons, contre 240 g chez les filles. ; Ito et coll., 1995
; Ito et coll., 1995 ; Boot et coll., 1997
; Boot et coll., 1997 ), faisant de cette caractéristique un facteur de risque de l’ostéoporose (Chevalley et coll., 2005
), faisant de cette caractéristique un facteur de risque de l’ostéoporose (Chevalley et coll., 2005 ).
). ; Martin et coll., 1997
; Martin et coll., 1997 ; Bailey et coll., 1999
; Bailey et coll., 1999 ). Ce décalage est à l’origine d’une période de relative fragilité du squelette (Bailey et coll., 1999
). Ce décalage est à l’origine d’une période de relative fragilité du squelette (Bailey et coll., 1999 ), ce qui explique en partie l’incidence élevée des fractures vers 12-14 ans chez les garçons (Blimkie et coll., 1993
), ce qui explique en partie l’incidence élevée des fractures vers 12-14 ans chez les garçons (Blimkie et coll., 1993 ) et 10,5-11,5 ans chez les filles (Hagino et coll., 2000
) et 10,5-11,5 ans chez les filles (Hagino et coll., 2000 ; Yeh et coll., 2006
; Yeh et coll., 2006 ).
). ). L’âge du pic de masse osseuse intervient entre 20 et 30 ans (Teegarden et coll., 1995
). L’âge du pic de masse osseuse intervient entre 20 et 30 ans (Teegarden et coll., 1995 ; Heaney et coll., 2000
; Heaney et coll., 2000 ; New, 2001
; New, 2001 ) et varie en fonction du sexe et du site considéré (Bonjour et coll., 1991
) et varie en fonction du sexe et du site considéré (Bonjour et coll., 1991 ; Slemenda et coll., 1994
; Slemenda et coll., 1994 ; Heaney et coll., 2000
; Heaney et coll., 2000 ).
). ). Avant la puberté, la croissance est surtout régulée par l’hormone de croissance et l’IGF-I (Insulin-like Growth Factor-I) alors que pendant et après la puberté, ce sont les stéroïdes sexuels qui exercent une influence prédominante (Bass et coll., 2005
). Avant la puberté, la croissance est surtout régulée par l’hormone de croissance et l’IGF-I (Insulin-like Growth Factor-I) alors que pendant et après la puberté, ce sont les stéroïdes sexuels qui exercent une influence prédominante (Bass et coll., 2005 ). Les œstrogènes (dans les deux sexes), associés à l’hormone de croissance et l’IGF-I, initient les trois ou quatre années de forte croissance osseuse pendant lesquelles le squelette double sa masse (Riggs et coll., 2002
). Les œstrogènes (dans les deux sexes), associés à l’hormone de croissance et l’IGF-I, initient les trois ou quatre années de forte croissance osseuse pendant lesquelles le squelette double sa masse (Riggs et coll., 2002 ). Le rôle des œstrogènes dans la maturation osseuse serait plus important que celui des androgènes (Arisaka et coll., 2001
). Le rôle des œstrogènes dans la maturation osseuse serait plus important que celui des androgènes (Arisaka et coll., 2001 ; Riggs et coll., 2002
; Riggs et coll., 2002 ).
). ), les hommes atteignent un pic de masse osseuse plus élevé que celui des femmes (+25 %) : leurs os sont plus grands (croissance longitudinale pré-pubertaire plus longue et meilleure apposition périostée) et l’os cortical est plus épais.
), les hommes atteignent un pic de masse osseuse plus élevé que celui des femmes (+25 %) : leurs os sont plus grands (croissance longitudinale pré-pubertaire plus longue et meilleure apposition périostée) et l’os cortical est plus épais. ) ; la vitamine D, qui influence le processus de maturation des chondrocytes épiphysaires (Klaus et coll., 1991
) ; la vitamine D, qui influence le processus de maturation des chondrocytes épiphysaires (Klaus et coll., 1991 ) ; la calcitonine, qui inhiberait la résorption osseuse mais n’aurait pas d’effet sur la formation osseuse (Canalis, 1996
) ; la calcitonine, qui inhiberait la résorption osseuse mais n’aurait pas d’effet sur la formation osseuse (Canalis, 1996 ) ; les hormones thyroïdiennes, qui ont un effet anabolique pendant la croissance (Bassett et Williams, 2003
) ; les hormones thyroïdiennes, qui ont un effet anabolique pendant la croissance (Bassett et Williams, 2003 ; Lakatos, 2003
; Lakatos, 2003 ).
). ). Le polymorphisme génique est susceptible de moduler l’influence des apports nutritionnels sur le développement osseux (Dawson-Hughes et coll., 1995
). Le polymorphisme génique est susceptible de moduler l’influence des apports nutritionnels sur le développement osseux (Dawson-Hughes et coll., 1995 ). Une restriction énergétique et/ou protéique peut retarder la croissance longitudinale et périostée. Les enfants et adolescents dont les apports calciques sont insuffisants risquent d’atteindre un pic de masse osseuse plus faible (Heaney et coll., 2000
). Une restriction énergétique et/ou protéique peut retarder la croissance longitudinale et périostée. Les enfants et adolescents dont les apports calciques sont insuffisants risquent d’atteindre un pic de masse osseuse plus faible (Heaney et coll., 2000 ). En France, les apports calciques recommandés pour des personnes de 10 à 18 ans s’élèvent à 1 200 mg/j (Guéguen, 2001
). En France, les apports calciques recommandés pour des personnes de 10 à 18 ans s’élèvent à 1 200 mg/j (Guéguen, 2001 ). Les effets d’une supplémentation calcique sur la DMO de jeunes enfants se sont révélés positifs (Lloyd et coll., 1996
). Les effets d’une supplémentation calcique sur la DMO de jeunes enfants se sont révélés positifs (Lloyd et coll., 1996 ; Bonjour et coll., 1997
; Bonjour et coll., 1997 ; Cameron et coll., 2004
; Cameron et coll., 2004 ) ou nuls (Courteix et coll., 2005
) ou nuls (Courteix et coll., 2005 ). La minéralisation varierait selon les sites considérés, les apports calciques initiaux, le stade pubertaire des sujets (Johnston et coll., 1992
). La minéralisation varierait selon les sites considérés, les apports calciques initiaux, le stade pubertaire des sujets (Johnston et coll., 1992 ; Bonjour et coll., 1999
; Bonjour et coll., 1999 ). L’influence d’une supplémentation calcique serait surtout améliorée en étant associée à une activité physique régulière (Courteix et coll., 2005
). L’influence d’une supplémentation calcique serait surtout améliorée en étant associée à une activité physique régulière (Courteix et coll., 2005 ). D’une manière générale, la quantité de calcium consommée n’est que modérément corrélée à la santé osseuse de l’enfant ou de l’adulte (Lanou et coll., 2005
). D’une manière générale, la quantité de calcium consommée n’est que modérément corrélée à la santé osseuse de l’enfant ou de l’adulte (Lanou et coll., 2005 ) car le calcium est un nutriment-seuil : au-delà d’une valeur oscillant entre 800 et 1 200 mg/j, toute augmentation supplémentaire de la consommation calcique ne semble pas avoir d’effet sur le tissu osseux (Matkovic et Heaney, 1992
) car le calcium est un nutriment-seuil : au-delà d’une valeur oscillant entre 800 et 1 200 mg/j, toute augmentation supplémentaire de la consommation calcique ne semble pas avoir d’effet sur le tissu osseux (Matkovic et Heaney, 1992 ; Coxam, 2005
; Coxam, 2005 ). La sensibilité du tissu osseux à l’exercice physique serait influencée par le polymorphisme génique du récepteur de la vitamine D (Blanchet et coll., 2002
). La sensibilité du tissu osseux à l’exercice physique serait influencée par le polymorphisme génique du récepteur de la vitamine D (Blanchet et coll., 2002 ) et celui des récepteurs alpha-œstrogéniques (Suuriniemi et coll., 2004
) et celui des récepteurs alpha-œstrogéniques (Suuriniemi et coll., 2004 ).
). ; Turner et Robling, 2005
; Turner et Robling, 2005 ). Ces contraintes modifient l’environnement mécanique de l’os et donc influencent les processus de croissance longitudinale et de minéralisation osseuse. Dès les années 1950, Buskirk et coll. (1956
). Ces contraintes modifient l’environnement mécanique de l’os et donc influencent les processus de croissance longitudinale et de minéralisation osseuse. Dès les années 1950, Buskirk et coll. (1956 ) ont noté que l’ulna et le radius étaient plus longs du côté dominant que du côté non dominant chez des joueurs de tennis ayant débuté leur pratique dès l’enfance ou l’adolescence.
) ont noté que l’ulna et le radius étaient plus longs du côté dominant que du côté non dominant chez des joueurs de tennis ayant débuté leur pratique dès l’enfance ou l’adolescence. ; Blimkie et Högler, 2003
; Blimkie et Högler, 2003 ). D’après de nombreux auteurs, ce sont les contractions musculaires, et non le poids du corps, qui exerceraient les plus larges contraintes sur le squelette lors de la vie courante (Burr, 1997
). D’après de nombreux auteurs, ce sont les contractions musculaires, et non le poids du corps, qui exerceraient les plus larges contraintes sur le squelette lors de la vie courante (Burr, 1997 ; Schoenau et Frost, 2002
; Schoenau et Frost, 2002 ). Elles expliqueraient 50 % de la variabilité du développement de la masse et de la résistance osseuses (Schoenau et coll., 2002
). Elles expliqueraient 50 % de la variabilité du développement de la masse et de la résistance osseuses (Schoenau et coll., 2002 ).
). ). L’augmentation de la DMO rapportée à l’augmentation de la masse corporelle au cours de la croissance est également supérieure chez des gymnastes comparativement à des nageuses (Cassell et coll., 1996
). L’augmentation de la DMO rapportée à l’augmentation de la masse corporelle au cours de la croissance est également supérieure chez des gymnastes comparativement à des nageuses (Cassell et coll., 1996 ) ou des enfants normo-actifs (Nurmi-Lawton et coll., 2004
) ou des enfants normo-actifs (Nurmi-Lawton et coll., 2004 ; Ward et coll., 2005
; Ward et coll., 2005 ). Lima et coll. (2001
). Lima et coll. (2001 ) ont noté de plus fortes DMO surfaciques à plusieurs sites osseux (rachis lombaire, col fémoral) chez des garçons de 12 à 18 ans pratiquant des sports avec impacts (gymnastique, athlétisme, basketball et tennis) par rapport à ceux pratiquant des activités sans impacts (natation, water-polo). Chez 128 garçons de 16-18 ans, Ginty et coll. (2005
) ont noté de plus fortes DMO surfaciques à plusieurs sites osseux (rachis lombaire, col fémoral) chez des garçons de 12 à 18 ans pratiquant des sports avec impacts (gymnastique, athlétisme, basketball et tennis) par rapport à ceux pratiquant des activités sans impacts (natation, water-polo). Chez 128 garçons de 16-18 ans, Ginty et coll. (2005 ) ont observé que le CMO (contenu minéral osseux) au corps entier était supérieur dès lors que la pratique d’activités physiques avec impacts dépassait un volume horaire de 8 heures par semaine.
) ont observé que le CMO (contenu minéral osseux) au corps entier était supérieur dès lors que la pratique d’activités physiques avec impacts dépassait un volume horaire de 8 heures par semaine. ; Haapasalo et coll., 1998
; Haapasalo et coll., 1998 ; Bass et coll., 2002a
; Bass et coll., 2002a ).
). ).
). , 2002a
, 2002a et b
et b ) (un G étant équivalent à la force exercée par le poids du corps lors de la station debout). Les gains sont site-spécifiques, c’est-à-dire qu’ils sont visibles aux sites osseux soumis aux contraintes mécaniques (rachis lombaire, col fémoral) et ils doublent si l’entraînement est poursuivi sur vingt mois (MacKelvie et coll., 2003
) (un G étant équivalent à la force exercée par le poids du corps lors de la station debout). Les gains sont site-spécifiques, c’est-à-dire qu’ils sont visibles aux sites osseux soumis aux contraintes mécaniques (rachis lombaire, col fémoral) et ils doublent si l’entraînement est poursuivi sur vingt mois (MacKelvie et coll., 2003 ). Le bénéfice est sensiblement le même lorsque l’entraînement est plus intensif, avec des contraintes atteignant 8 G (Fuchs et coll., 2001
). Le bénéfice est sensiblement le même lorsque l’entraînement est plus intensif, avec des contraintes atteignant 8 G (Fuchs et coll., 2001 ) ou lorsque les séances sont plus longues (Bradney et coll., 1998
) ou lorsque les séances sont plus longues (Bradney et coll., 1998 ; Heinonen et coll., 2000
; Heinonen et coll., 2000 ; McKay et coll., 2000
; McKay et coll., 2000 ; Valdimarsson et coll., 2006
; Valdimarsson et coll., 2006 ). Il augmente légèrement (>5 % sur dix mois) lorsque des exercices avec charges additionnelles sont inclus au programme d’entraînement (Morris et coll., 1997
). Il augmente légèrement (>5 % sur dix mois) lorsque des exercices avec charges additionnelles sont inclus au programme d’entraînement (Morris et coll., 1997 ). L’efficacité de ces programmes repose en partie sur l’augmentation progressive du volume (nombre de sauts par séance) et de l’intensité (hauteur des sauts) de l’entraînement (Heinonen et coll., 2000
). L’efficacité de ces programmes repose en partie sur l’augmentation progressive du volume (nombre de sauts par séance) et de l’intensité (hauteur des sauts) de l’entraînement (Heinonen et coll., 2000 ; Fuchs et coll., 2001
; Fuchs et coll., 2001 ; MacKelvie et coll., 2001
; MacKelvie et coll., 2001 , 2002a
, 2002a , 2003
, 2003 et 2004
et 2004 ). L’importance de ce critère a été soulevée lors d’une étude réalisée chez des jumelles homozygotes (van Langendonck et coll., 2003a
). L’importance de ce critère a été soulevée lors d’une étude réalisée chez des jumelles homozygotes (van Langendonck et coll., 2003a ). Ces auteurs ont montré qu’un entraînement ostéogénique d’une durée de 9 mois (10 minutes, 3 fois par semaine) avait un effet bénéfique sur la minéralisation osseuse du fémur proximal chez des jeunes filles ne pratiquant pas d’activités à impacts, mais pas chez celles déjà engagées dans une pratique sportive ostéogénique. De même, la réponse à l’entraînement est moins bonne chez des enfants en surcharge pondérale (MacKelvie et coll., 2002b
). Ces auteurs ont montré qu’un entraînement ostéogénique d’une durée de 9 mois (10 minutes, 3 fois par semaine) avait un effet bénéfique sur la minéralisation osseuse du fémur proximal chez des jeunes filles ne pratiquant pas d’activités à impacts, mais pas chez celles déjà engagées dans une pratique sportive ostéogénique. De même, la réponse à l’entraînement est moins bonne chez des enfants en surcharge pondérale (MacKelvie et coll., 2002b ). Outre le fait que ces enfants s’impliquent peut-être moins dans l’entraînement que des enfants de poids normal, le seuil de sensibilité de leur squelette aux impacts est sans doute plus élevé compte tenu de la contrainte mécanique quotidienne que représente leur surpoids (MacKelvie et coll., 2002b
). Outre le fait que ces enfants s’impliquent peut-être moins dans l’entraînement que des enfants de poids normal, le seuil de sensibilité de leur squelette aux impacts est sans doute plus élevé compte tenu de la contrainte mécanique quotidienne que représente leur surpoids (MacKelvie et coll., 2002b ). La réponse osseuse du squelette est donc étroitement dépendante des caractéristiques du programme d’entraînement et des enfants (Heinonen et coll., 2000
). La réponse osseuse du squelette est donc étroitement dépendante des caractéristiques du programme d’entraînement et des enfants (Heinonen et coll., 2000 ; Petit et coll., 2002
; Petit et coll., 2002 ). Dans l’optique d’une amélioration de la santé osseuse des jeunes populations, il faut noter que la réalisation de dix counter-movement jumps (saut avec élan, mains sur les hanches), trois fois par jour pendant 8 mois (soit un volume d’entraînement raisonnable), permet d’augmenter la minéralisation au fémur proximal chez des enfants d’une dizaine d’années (McKay et coll., 2005
). Dans l’optique d’une amélioration de la santé osseuse des jeunes populations, il faut noter que la réalisation de dix counter-movement jumps (saut avec élan, mains sur les hanches), trois fois par jour pendant 8 mois (soit un volume d’entraînement raisonnable), permet d’augmenter la minéralisation au fémur proximal chez des enfants d’une dizaine d’années (McKay et coll., 2005 ).
). ; MacKelvie et coll., 2001
; MacKelvie et coll., 2001 ; Petit et coll., 2002
; Petit et coll., 2002 ). Cependant, un grand nombre d’études ont montré la capacité d’un entraînement ostéogénique à augmenter la minéralisation osseuse dès la prépuberté (Cassell et coll., 1996
). Cependant, un grand nombre d’études ont montré la capacité d’un entraînement ostéogénique à augmenter la minéralisation osseuse dès la prépuberté (Cassell et coll., 1996 ; Bass et coll., 1998
; Bass et coll., 1998 et 2002a
et 2002a ; Fuchs et coll., 2001
; Fuchs et coll., 2001 ; MacKelvie et coll., 2004
; MacKelvie et coll., 2004 ; Valdimarssön et coll., 2006
; Valdimarssön et coll., 2006 ). Les effets bénéfiques de l’exercice physique ont même été observés avant l’âge de 8 ans, qu’il s’agisse d’une activité gymnique récréative (Laing et coll., 2005
). Les effets bénéfiques de l’exercice physique ont même été observés avant l’âge de 8 ans, qu’il s’agisse d’une activité gymnique récréative (Laing et coll., 2005 ) ou plus intensive (Zanker et coll., 2003
) ou plus intensive (Zanker et coll., 2003 ).
). ), période pendant laquelle on observe de fortes concentrations en hormone de croissance, IGF-I, œstrogènes et androgènes (Kannus et coll., 1996
), période pendant laquelle on observe de fortes concentrations en hormone de croissance, IGF-I, œstrogènes et androgènes (Kannus et coll., 1996 ; Morris et coll., 1997
; Morris et coll., 1997 ; Heinonen et coll., 2000
; Heinonen et coll., 2000 ). Ceci pourrait expliquer la relative inefficacité des programmes d’entraînement après la ménarche (Heinonen et coll., 2000
). Ceci pourrait expliquer la relative inefficacité des programmes d’entraînement après la ménarche (Heinonen et coll., 2000 ), y compris pour des activités comme la musculation (Blimkie et coll., 1996
), y compris pour des activités comme la musculation (Blimkie et coll., 1996 ) ou la pliométrie (Witzke et Snow, 2000
) ou la pliométrie (Witzke et Snow, 2000 ), pourtant à fort potentiel ostéogénique. Les asymétries osseuses relevées entre les deux bras étaient deux à quatre fois plus importantes chez des jeunes filles ayant débuté le tennis avant ou au moment de la ménarche, comparativement à celles ayant débuté après quinze ans (Kannus et coll., 1995
), pourtant à fort potentiel ostéogénique. Les asymétries osseuses relevées entre les deux bras étaient deux à quatre fois plus importantes chez des jeunes filles ayant débuté le tennis avant ou au moment de la ménarche, comparativement à celles ayant débuté après quinze ans (Kannus et coll., 1995 ). Chez les garçons, on dispose de peu de données à l’adolescence concernant la réponse du tissu osseux aux contraintes mécaniques. Le turnover osseux, évalué grâce à des marqueurs biologiques, semble augmenter après 5 semaines d’un entraînement intensif en endurance, à raison de 2 heures par jour, 5 jours par semaine (Eliakim et coll., 1997
). Chez les garçons, on dispose de peu de données à l’adolescence concernant la réponse du tissu osseux aux contraintes mécaniques. Le turnover osseux, évalué grâce à des marqueurs biologiques, semble augmenter après 5 semaines d’un entraînement intensif en endurance, à raison de 2 heures par jour, 5 jours par semaine (Eliakim et coll., 1997 ). Mais la durée trop courte de l’entraînement ne permet pas d’établir le lien entre une accélération du turnover osseux et une augmentation significative de la DMO chez ces adolescents.
). Mais la durée trop courte de l’entraînement ne permet pas d’établir le lien entre une accélération du turnover osseux et une augmentation significative de la DMO chez ces adolescents. ; Khan et coll., 2000
; Khan et coll., 2000 ; MacKelvie et coll., 2002a
; MacKelvie et coll., 2002a ).
). ). Il semblerait également que plus la direction des contraintes varie, plus l’activité est ostéogénique (Nikander et coll., 2005
). Il semblerait également que plus la direction des contraintes varie, plus l’activité est ostéogénique (Nikander et coll., 2005 ). L’augmentation de la minéralisation reste site-spécifique (Ehrlich et Lanyon, 2002
). L’augmentation de la minéralisation reste site-spécifique (Ehrlich et Lanyon, 2002 ), ce qui pourrait expliquer les déficits osseux observés chez les sportifs aux sites non sollicités : le crâne chez les gymnastes (Courteix et coll., 1999a
), ce qui pourrait expliquer les déficits osseux observés chez les sportifs aux sites non sollicités : le crâne chez les gymnastes (Courteix et coll., 1999a ), les athlètes, danseurs ou culturistes (Karlsson et coll., 1996
), les athlètes, danseurs ou culturistes (Karlsson et coll., 1996 ), ou bien le bras non dominant chez les joueurs de tennis (Haapasalo et coll., 1998
), ou bien le bras non dominant chez les joueurs de tennis (Haapasalo et coll., 1998 et 2000
et 2000 ). Il s’agirait d’un phénomène de redistribution du pool calcique dont dispose tout individu, au profit des sites osseux soumis à des fortes contraintes mécaniques (Smith et coll., 1984
). Il s’agirait d’un phénomène de redistribution du pool calcique dont dispose tout individu, au profit des sites osseux soumis à des fortes contraintes mécaniques (Smith et coll., 1984 ).
). ).
). ), celles-ci étant déterminées par la surface osseuse sur laquelle le minéral se dépose (Seeman, 2001
), celles-ci étant déterminées par la surface osseuse sur laquelle le minéral se dépose (Seeman, 2001 ; Bass et coll., 2002a
; Bass et coll., 2002a ). S’il s’agit de la surface périostée, la taille de l’os augmente, ce qui lui confère une meilleure résistance mécanique ; s’il s’agit de la surface endostée, la taille globale de l’os n’évolue pas et le gain en terme de résistance est moindre (figure 11.1
). S’il s’agit de la surface périostée, la taille de l’os augmente, ce qui lui confère une meilleure résistance mécanique ; s’il s’agit de la surface endostée, la taille globale de l’os n’évolue pas et le gain en terme de résistance est moindre (figure 11.1 ). En effet, un os est d’autant plus résistant que le minéral osseux est situé loin de l’axe longitudinal de l’os (Turner et Burr, 1993
). En effet, un os est d’autant plus résistant que le minéral osseux est situé loin de l’axe longitudinal de l’os (Turner et Burr, 1993 ).
).
 )
) ). Une augmentation de la taille des os sollicités par la pratique sportive a été rapportée par plusieurs études chez des enfants pré-pubères ou en début de puberté (Dyson et coll., 1997
). Une augmentation de la taille des os sollicités par la pratique sportive a été rapportée par plusieurs études chez des enfants pré-pubères ou en début de puberté (Dyson et coll., 1997 ; Petit et coll., 2002
; Petit et coll., 2002 ; MacKelvie et coll., 2004
; MacKelvie et coll., 2004 ). De même, Bass et coll. (2002a
). De même, Bass et coll. (2002a ) ont observé une expansion périostée sur l’humérus dominant de joueuses de tennis pré-pubères. Chez des joueuses péri- ou post-pubères, une réduction de la taille du canal médullaire est observée à l’humérus dominant, suggérant une apposition du minéral osseux sur la surface endostée ou bien une diminution de la résorption osseuse au niveau de l’endoste. Ainsi, l’exercice physique amplifierait les adaptations macro-architecturales observées pendant la croissance (Bass et coll., 2002a
) ont observé une expansion périostée sur l’humérus dominant de joueuses de tennis pré-pubères. Chez des joueuses péri- ou post-pubères, une réduction de la taille du canal médullaire est observée à l’humérus dominant, suggérant une apposition du minéral osseux sur la surface endostée ou bien une diminution de la résorption osseuse au niveau de l’endoste. Ainsi, l’exercice physique amplifierait les adaptations macro-architecturales observées pendant la croissance (Bass et coll., 2002a ). Aucune expansion périostée n’a été mise en évidence au niveau des membres inférieurs, que ce soit au fémur (Duncan et coll., 2002
). Aucune expansion périostée n’a été mise en évidence au niveau des membres inférieurs, que ce soit au fémur (Duncan et coll., 2002 ) ou au tibia (Heinonen et coll., 2000
) ou au tibia (Heinonen et coll., 2000 ; Greene et coll., 2005
; Greene et coll., 2005 ; Ward et coll., 2005
; Ward et coll., 2005 ) chez de jeunes sportives pratiquant la course à pied, le triathlon, le cyclisme ou bien la gymnastique. En revanche, une augmentation de la taille de l’os a été observée sur le membre supérieur à l’humérus (Bass et coll., 2002
) chez de jeunes sportives pratiquant la course à pied, le triathlon, le cyclisme ou bien la gymnastique. En revanche, une augmentation de la taille de l’os a été observée sur le membre supérieur à l’humérus (Bass et coll., 2002 ) ou au radius (Dyson et coll., 1997
) ou au radius (Dyson et coll., 1997 ; Ward et coll., 2005
; Ward et coll., 2005 ) chez des joueuses de tennis et des gymnastes. L’adaptation de la géométrie osseuse à l’exercice chez de jeunes garçons sportifs est encore peu connue mais elle est sans doute différente de celle observée chez les sportives (Ward et coll., 2005
) chez des joueuses de tennis et des gymnastes. L’adaptation de la géométrie osseuse à l’exercice chez de jeunes garçons sportifs est encore peu connue mais elle est sans doute différente de celle observée chez les sportives (Ward et coll., 2005 ).
). ; Huang et coll., 2003
; Huang et coll., 2003 ), sans forcément exercer d’effet sur la DMO (Huang et coll., 2003
), sans forcément exercer d’effet sur la DMO (Huang et coll., 2003 ). Par ailleurs, il a été montré que la cavité médullaire du fémur moyen était plus large chez des adolescentes nageuses et cyclistes que chez des coureuses à pied ou des triathlètes (Duncan et coll., 2002
). Par ailleurs, il a été montré que la cavité médullaire du fémur moyen était plus large chez des adolescentes nageuses et cyclistes que chez des coureuses à pied ou des triathlètes (Duncan et coll., 2002 ).
). ; Fuchs et Snow, 2002
; Fuchs et Snow, 2002 ; Kontulainen et coll., 2002
; Kontulainen et coll., 2002 ), ce qui ne serait pas le cas d’un bénéfice acquis à l’âge adulte (Parfitt, 1994
), ce qui ne serait pas le cas d’un bénéfice acquis à l’âge adulte (Parfitt, 1994 ). Le squelette immature réagit aux contraintes mécaniques par des modifications architecturales, ce que le squelette mature est moins capable de faire (Nara-Ashizawa et coll., 2002
). Le squelette immature réagit aux contraintes mécaniques par des modifications architecturales, ce que le squelette mature est moins capable de faire (Nara-Ashizawa et coll., 2002 ). Cette spécificité de la réponse du tissu osseux immature aux stimuli mécaniques serait un élément déterminant du maintien des bénéfices osseux chez le jeune sportif qui stopperait sa pratique (Karlsson, 2003
). Cette spécificité de la réponse du tissu osseux immature aux stimuli mécaniques serait un élément déterminant du maintien des bénéfices osseux chez le jeune sportif qui stopperait sa pratique (Karlsson, 2003 ). Cependant, des individus ayant stoppé leur activité sportive après la croissance ont des valeurs de DMO plus faibles que ceux qui pratiquent encore (Bass et coll., 1998
). Cependant, des individus ayant stoppé leur activité sportive après la croissance ont des valeurs de DMO plus faibles que ceux qui pratiquent encore (Bass et coll., 1998 ; Van Langendonck, 2002
; Van Langendonck, 2002 ), d’où l’intérêt de rester actif.
), d’où l’intérêt de rester actif. ; Forwood et Turner, 1995
; Forwood et Turner, 1995 ; Modlesky et Lewis, 2002
; Modlesky et Lewis, 2002 ).
). ; Caine et coll., 2003
; Caine et coll., 2003 ; Stokstad, 2004
; Stokstad, 2004 ; Daly et coll., 2005
; Daly et coll., 2005 ; Beunen et coll., 2006
; Beunen et coll., 2006 ). La spécialisation précoce qui prévaut dans certaines disciplines (gymnastique, tennis, patinage artistique…) a conduit les instances médicales à éditer des recommandations concernant l’entraînement intensif précoce (American Academy of Pediatrics et Committee on Sports, Medecine and Fitness, 2000
). La spécialisation précoce qui prévaut dans certaines disciplines (gymnastique, tennis, patinage artistique…) a conduit les instances médicales à éditer des recommandations concernant l’entraînement intensif précoce (American Academy of Pediatrics et Committee on Sports, Medecine and Fitness, 2000 ; Commission médicale du comité international et olympique, 2005
; Commission médicale du comité international et olympique, 2005 ).
).
 ; Baxter-Jones et coll., 2003
; Baxter-Jones et coll., 2003 ; Claessens et coll., 2006
; Claessens et coll., 2006 ) car les jeunes gymnastes sont habituellement plus petits et plus légers que les enfants ou adolescents du même âge (Claessens et coll., 1992
) car les jeunes gymnastes sont habituellement plus petits et plus légers que les enfants ou adolescents du même âge (Claessens et coll., 1992 ; Courteix et coll., 1999b
; Courteix et coll., 1999b ; Bass et coll., 2000
; Bass et coll., 2000 ). Leur âge osseux est également plus faible pour un âge chronologique donné (Bass et coll., 2000
). Leur âge osseux est également plus faible pour un âge chronologique donné (Bass et coll., 2000 ; Weimann et coll., 2000
; Weimann et coll., 2000 ; Maïmoun, 2005
; Maïmoun, 2005 ; Thomis et coll., 2005
; Thomis et coll., 2005 ). La ménarche est retardée d’un à deux ans au minimum chez les filles pratiquant la gymnastique de façon intensive (Peltenburg et coll., 1984
). La ménarche est retardée d’un à deux ans au minimum chez les filles pratiquant la gymnastique de façon intensive (Peltenburg et coll., 1984 ; Claessens et coll., 1992
; Claessens et coll., 1992 ; Weimann, 2000
; Weimann, 2000 ; Thomis et coll., 2005
; Thomis et coll., 2005 ) par rapport à des jeunes filles normo-actives atteignant la ménarche en moyenne entre 12,3 et 13,5 ans (Malina et coll, 2004
) par rapport à des jeunes filles normo-actives atteignant la ménarche en moyenne entre 12,3 et 13,5 ans (Malina et coll, 2004 ). Le retard pubertaire des jeunes gymnastes s’explique en partie par le fait que les enfants de petite taille sont plus performants lors des exercices gymniques (Ackland et coll., 2003
). Le retard pubertaire des jeunes gymnastes s’explique en partie par le fait que les enfants de petite taille sont plus performants lors des exercices gymniques (Ackland et coll., 2003 ). Cet effet de sélection a été confirmé par plusieurs observations : les gymnastes étaient plus petits que la moyenne avant même de commencer leur pratique gymnique (Peltenburg et coll., 1984
). Cet effet de sélection a été confirmé par plusieurs observations : les gymnastes étaient plus petits que la moyenne avant même de commencer leur pratique gymnique (Peltenburg et coll., 1984 ), les parents des gymnastes étaient eux-aussi plus petits que la moyenne (Theintz et coll., 1989
), les parents des gymnastes étaient eux-aussi plus petits que la moyenne (Theintz et coll., 1989 ; Baxter-Jones et coll., 1995
; Baxter-Jones et coll., 1995 ) et les gymnastes qui persistent dans l’activité étaient plus petits que les gymnastes arrêtant leur pratique (Tonz et coll., 1990
) et les gymnastes qui persistent dans l’activité étaient plus petits que les gymnastes arrêtant leur pratique (Tonz et coll., 1990 ).
). et 2002b
et 2002b ; Caine et coll., 2001
; Caine et coll., 2001 ; Daly et coll., 2005
; Daly et coll., 2005 ). Il a été montré que le décalage entre âge osseux et âge chronologique augmente au fur et à mesure que l’entraînement se poursuit (Bass et coll., 2000
). Il a été montré que le décalage entre âge osseux et âge chronologique augmente au fur et à mesure que l’entraînement se poursuit (Bass et coll., 2000 ). De plus, l’âge de la ménarche est positivement corrélé au volume d’entraînement chez de jeunes gymnastes rythmiques (Georgopoulos et coll., 1999
). De plus, l’âge de la ménarche est positivement corrélé au volume d’entraînement chez de jeunes gymnastes rythmiques (Georgopoulos et coll., 1999 ). Le pic de croissance statural est décalé dans le temps et atteint des valeurs plus faibles (5,5 à 6,4 cm/an ; Theintz et coll., 1993
). Le pic de croissance statural est décalé dans le temps et atteint des valeurs plus faibles (5,5 à 6,4 cm/an ; Theintz et coll., 1993 ; Daly et coll., 2005
; Daly et coll., 2005 ) que celles observées habituellement chez les jeunes filles normoactives (7,3 à 9,1 cm/an ; Malina et coll., 2004
) que celles observées habituellement chez les jeunes filles normoactives (7,3 à 9,1 cm/an ; Malina et coll., 2004 ). Alors que les membres inférieurs des gymnastes sont moins longs que ceux d’enfants normo-actifs dès le début de la pratique sportive (effet de sélection), la vitesse de croissance du tronc semble altérée durant l’entraînement (Bass et coll., 2000
). Alors que les membres inférieurs des gymnastes sont moins longs que ceux d’enfants normo-actifs dès le début de la pratique sportive (effet de sélection), la vitesse de croissance du tronc semble altérée durant l’entraînement (Bass et coll., 2000 ; Daly et coll., 2000
; Daly et coll., 2000 ). Ce ralentissement de la croissance du tronc est plus marqué chez des gymnastes s’entraînant de 20 à 27 heures par semaine que chez des gymnastes pratiquant 7,5 à 22 heures par semaine (Daly et coll., 2005
). Ce ralentissement de la croissance du tronc est plus marqué chez des gymnastes s’entraînant de 20 à 27 heures par semaine que chez des gymnastes pratiquant 7,5 à 22 heures par semaine (Daly et coll., 2005 ). La concentration de certaines hormones impliquées dans les processus de croissance et de maturation est plus faible chez les jeunes gymnastes : IGF-I (Jahreis et coll., 1991
). La concentration de certaines hormones impliquées dans les processus de croissance et de maturation est plus faible chez les jeunes gymnastes : IGF-I (Jahreis et coll., 1991 ; Bass et coll., 1998
; Bass et coll., 1998 ), hormones thyroïdiennes (Jahreis et coll., 1991
), hormones thyroïdiennes (Jahreis et coll., 1991 ), androstènedione (Jaffré et coll., 2001
), androstènedione (Jaffré et coll., 2001 ), déhydroépiandrostérone (Warren et coll., 2002a
), déhydroépiandrostérone (Warren et coll., 2002a ) et leptine (Weimann et coll., 1999
) et leptine (Weimann et coll., 1999 ; Warren et coll., 2002b
; Warren et coll., 2002b ; Courteix et coll., 2007
; Courteix et coll., 2007 ). Les effets délétères de l’entraînement seraient réversibles, tout du moins en partie, lorsque le volume de pratique diminue (Lindholm et coll., 1994
). Les effets délétères de l’entraînement seraient réversibles, tout du moins en partie, lorsque le volume de pratique diminue (Lindholm et coll., 1994 ) ou après l’arrêt de la pratique (Tveit-Milligan et coll., 1993
) ou après l’arrêt de la pratique (Tveit-Milligan et coll., 1993 ; Constantini et coll., 1997
; Constantini et coll., 1997 ; Bass, 2000
; Bass, 2000 ).
). ; Bass et coll., 2002b
; Bass et coll., 2002b ).
). ), mais elle est aussi reconnue comme étant la principale cause des perturbations de l’axe hypothalamohypophyso-gonadique observées chez certaines sportives (Loucks et coll., 1998
), mais elle est aussi reconnue comme étant la principale cause des perturbations de l’axe hypothalamohypophyso-gonadique observées chez certaines sportives (Loucks et coll., 1998 ; Williams et coll., 2001
; Williams et coll., 2001 ; Warren et coll., 2002a
; Warren et coll., 2002a et b ; Eliakim et Beyth, 2003
et b ; Eliakim et Beyth, 2003 ; Loucks, 2003
; Loucks, 2003 ). Le risque est particulièrement grand dans les sports où la prise de poids affecte la performance, en augmentant le coût énergétique et/ou en ne répondant plus aux exigences esthétiques de l’activité (Warren et coll., 2002b
). Le risque est particulièrement grand dans les sports où la prise de poids affecte la performance, en augmentant le coût énergétique et/ou en ne répondant plus aux exigences esthétiques de l’activité (Warren et coll., 2002b ). Le comportement alimentaire de certaines danseuses et coureuses de fond est parfois comparable à l’anorexie (Yates et coll., 1983
). Le comportement alimentaire de certaines danseuses et coureuses de fond est parfois comparable à l’anorexie (Yates et coll., 1983 ) alors que les gymnastes et les nageuses peuvent avoir un comportement assez proche de la boulimie avec des périodes de vomissements (Lefebvre et coll., 2005
) alors que les gymnastes et les nageuses peuvent avoir un comportement assez proche de la boulimie avec des périodes de vomissements (Lefebvre et coll., 2005 ). Un fort déséquilibre entre apports et dépenses énergétiques serait à l’origine de la suppression de l’activité de l’hormone gonadotrope GnRH (Gonadotropin Releasing Hormone), sécrétée par l’hypothalamus (Loucks et coll., 1998
). Un fort déséquilibre entre apports et dépenses énergétiques serait à l’origine de la suppression de l’activité de l’hormone gonadotrope GnRH (Gonadotropin Releasing Hormone), sécrétée par l’hypothalamus (Loucks et coll., 1998 ). Cette hormone stimule la production de FSH (hormone folliculostimulante) et LH (hormone lutéïnisante) par l’hypophyse, qui à son tour stimule la sécrétion des hormones sexuelles par les gonades (œstrogènes et progestérone chez la fille, testostérone chez le garçon). La perturbation de ces sécrétions hormonales conduit à des troubles du cycle menstruel chez la jeune fille (Warren et Perlroth, 2001
). Cette hormone stimule la production de FSH (hormone folliculostimulante) et LH (hormone lutéïnisante) par l’hypophyse, qui à son tour stimule la sécrétion des hormones sexuelles par les gonades (œstrogènes et progestérone chez la fille, testostérone chez le garçon). La perturbation de ces sécrétions hormonales conduit à des troubles du cycle menstruel chez la jeune fille (Warren et Perlroth, 2001 ). Ainsi, la prévalence des aménorrhées dites « athlétiques » est 4 à 20 fois plus importante chez les athlètes féminines de haut niveau que dans la population générale (Eliakim et Beyth, 2003
). Ainsi, la prévalence des aménorrhées dites « athlétiques » est 4 à 20 fois plus importante chez les athlètes féminines de haut niveau que dans la population générale (Eliakim et Beyth, 2003 ). Le pourcentage de masse grasse, qui est un facteur déterminant pour déclencher le début de la puberté (Frisch et McArthur, 1974
). Le pourcentage de masse grasse, qui est un facteur déterminant pour déclencher le début de la puberté (Frisch et McArthur, 1974 ; Georgopoulos et coll., 1999
; Georgopoulos et coll., 1999 ) est souvent très faible chez ces athlètes. Le stress de la compétition et d’un entraînement intensif peut aussi contribuer à l’apparition de troubles du cycle menstruel (Lefebvre et coll., 2005
) est souvent très faible chez ces athlètes. Le stress de la compétition et d’un entraînement intensif peut aussi contribuer à l’apparition de troubles du cycle menstruel (Lefebvre et coll., 2005 ). L’état d’aménorrhée est associé à une diminution de la DMO trabéculaire, notamment au rachis (Khan et coll., 2002
). L’état d’aménorrhée est associé à une diminution de la DMO trabéculaire, notamment au rachis (Khan et coll., 2002 ; Warren et coll., 2002a
; Warren et coll., 2002a ). On parle alors de « triade de l’athlète féminine », associant troubles nutritionnels, aménorrhée et ostéopénie (DMO comprise entre -2,5 et -1 déviations standards par rapport à la moyenne d’adultes jeunes) (Rutherford, 1999
). On parle alors de « triade de l’athlète féminine », associant troubles nutritionnels, aménorrhée et ostéopénie (DMO comprise entre -2,5 et -1 déviations standards par rapport à la moyenne d’adultes jeunes) (Rutherford, 1999 ; Khan et coll., 2002
; Khan et coll., 2002 ). Les risques d’apparition de déviations vertébrales pathologiques telles que la scoliose augmentent (Warren et coll., 1986
). Les risques d’apparition de déviations vertébrales pathologiques telles que la scoliose augmentent (Warren et coll., 1986 ; Warren et Perlroth, 2001
; Warren et Perlroth, 2001 ). Les fractures de fatigue sont également fréquentes chez les athlètes aménorrhéiques (Warren et Perlroth, 2001
). Les fractures de fatigue sont également fréquentes chez les athlètes aménorrhéiques (Warren et Perlroth, 2001 ). Elles naissent de l’accumulation de microfissures (ou micro-cracks) qui se forment dans le tissu osseux suite à l’application de contraintes mécaniques répétées (David et coll., 2005
). Elles naissent de l’accumulation de microfissures (ou micro-cracks) qui se forment dans le tissu osseux suite à l’application de contraintes mécaniques répétées (David et coll., 2005 ).
). ). Les altérations du métabolisme osseux chez des jeunes sportives aménorrhéiques sont attribuées à un hypo-œstrogénisme, qui entraîne une augmentation de la résorption et du turnover osseux (Warren et Perlroth, 2001
). Les altérations du métabolisme osseux chez des jeunes sportives aménorrhéiques sont attribuées à un hypo-œstrogénisme, qui entraîne une augmentation de la résorption et du turnover osseux (Warren et Perlroth, 2001 ; Lefebvre et coll., 2005
; Lefebvre et coll., 2005 ). Cependant, la prescription d’un traitement œstroprogestatif ne semble pas suffisant pour améliorer la DMO (Warren MP et coll., 2003
). Cependant, la prescription d’un traitement œstroprogestatif ne semble pas suffisant pour améliorer la DMO (Warren MP et coll., 2003 ) car d’autres hormones sont impliquées dans la régulation du métabolisme osseux, notamment la leptine (Welt et coll., 2004
) car d’autres hormones sont impliquées dans la régulation du métabolisme osseux, notamment la leptine (Welt et coll., 2004 ), l’IGF-I (Laughlin et coll., 1998
), l’IGF-I (Laughlin et coll., 1998 ) et l’hormone thyroïdienne T3 (Warren et Perlroth, 2001
) et l’hormone thyroïdienne T3 (Warren et Perlroth, 2001 ). L’hypo-œstrogénisme, lorsqu’il intervient chez la jeune fille, peut entraîner une diminution du pic de masse osseuse, ce qui augmente les risques d’apparition de l’ostéoporose à plus long terme (Warren et Perlroth, 2001
). L’hypo-œstrogénisme, lorsqu’il intervient chez la jeune fille, peut entraîner une diminution du pic de masse osseuse, ce qui augmente les risques d’apparition de l’ostéoporose à plus long terme (Warren et Perlroth, 2001 ; Khan et coll., 2002
; Khan et coll., 2002 ; Warren et coll., 2002a
; Warren et coll., 2002a ).
). ; Damsgaard et coll., 2001
; Damsgaard et coll., 2001 ; Georgopoulos et coll., 2004
; Georgopoulos et coll., 2004 ). Les cas d’hypogonadisme semblent plus rares chez le garçon et le retard de maturation squelettique est plus marqué chez les gymnastes féminines que chez les gymnastes masculins (Georgopoulos et coll., 2004
). Les cas d’hypogonadisme semblent plus rares chez le garçon et le retard de maturation squelettique est plus marqué chez les gymnastes féminines que chez les gymnastes masculins (Georgopoulos et coll., 2004 ). Ces différences pourraient notamment s’expliquer par une meilleure adéquation entre apports et dépenses énergétiques chez le garçon que chez la fille (Daly et coll., 2000
). Ces différences pourraient notamment s’expliquer par une meilleure adéquation entre apports et dépenses énergétiques chez le garçon que chez la fille (Daly et coll., 2000 ).
). ; Maïmoun et coll., 2003
; Maïmoun et coll., 2003 ). Aucune diminution des taux de testostérone et d’IGF-I n’a été relevée chez des garçons pratiquant la gymnastique de 10 à 29 heures par semaine et dont les apports énergétiques étaient normaux (Daly et coll., 2000
). Aucune diminution des taux de testostérone et d’IGF-I n’a été relevée chez des garçons pratiquant la gymnastique de 10 à 29 heures par semaine et dont les apports énergétiques étaient normaux (Daly et coll., 2000 ). Les effets d’un entraînement intensif précoce sur la testostérone – dans le cas d’une balance énergétique négative – méritent cependant d’être analysés, car en stimulant l’apposition périostée, cette hormone favorise l’augmentation des dimensions osseuses chez le garçon et donc la résistance de son squelette (Riggs et coll., 2002
). Les effets d’un entraînement intensif précoce sur la testostérone – dans le cas d’une balance énergétique négative – méritent cependant d’être analysés, car en stimulant l’apposition périostée, cette hormone favorise l’augmentation des dimensions osseuses chez le garçon et donc la résistance de son squelette (Riggs et coll., 2002 ).
). ; Baxter-Jones et coll., 2003
; Baxter-Jones et coll., 2003 ) ou bien dans les activités où la prise de poids affecte la performance (d’un point de vue énergétique et/ou esthétique) : course à pied, ski de fond, patinage artistique (Skierska, 1998
) ou bien dans les activités où la prise de poids affecte la performance (d’un point de vue énergétique et/ou esthétique) : course à pied, ski de fond, patinage artistique (Skierska, 1998 ). Inversement, les jeunes sportifs qui sont en avance pubertaire réussissent dans les sports qui favorisent les individus de grande taille, comme la natation (Skierska, 1998
). Inversement, les jeunes sportifs qui sont en avance pubertaire réussissent dans les sports qui favorisent les individus de grande taille, comme la natation (Skierska, 1998 ; Damsgaard et coll., 2001
; Damsgaard et coll., 2001 ).
). ; Warren et coll., 2002a
; Warren et coll., 2002a ; Georgopoulos et coll., 2004
; Georgopoulos et coll., 2004 ). Les effets négatifs des perturbations hormonales sur la minéralisation osseuse peuvent être compensés, sur les sites osseux porteurs, par les impacts dus à l’activité. C’est le cas de la gymnastique (Robinson et coll., 1995
). Les effets négatifs des perturbations hormonales sur la minéralisation osseuse peuvent être compensés, sur les sites osseux porteurs, par les impacts dus à l’activité. C’est le cas de la gymnastique (Robinson et coll., 1995 ; Markou et coll., 2004
; Markou et coll., 2004 ; Maïmoun, 2005
; Maïmoun, 2005 ) mais pas des sports où le poids du corps est porté (cyclisme).
) mais pas des sports où le poids du corps est porté (cyclisme). ). Dans ces conditions, le suivi régulier des jeunes sportifs est recommandé (Bass et coll., 2002b
). Dans ces conditions, le suivi régulier des jeunes sportifs est recommandé (Bass et coll., 2002b ; Daly et coll., 2002
; Daly et coll., 2002 ), en particulier en ce qui concerne les apports énergétiques dans le cadre de la prévention de la triade de l’athlète féminine (Medical Commission of the International Olympique and Committee, 2006
), en particulier en ce qui concerne les apports énergétiques dans le cadre de la prévention de la triade de l’athlète féminine (Medical Commission of the International Olympique and Committee, 2006 ).
). ) a montré une relation inverse entre la masse osseuse et le risque de fracture avec un OR de 1,4 pour le risque de fracture chez les enfants appartenant au tercile le plus faible en densité osseuse mesurée au corps entier. Si l’on considère qu’il existe une relation entre la pratique physique et la densité de l’os, on peut attribuer en partie cet effet protecteur à la pratique. Un résultat similaire a été observé sur l’humérus (OR=1,6) lors de l’étude de la densité volumique.
) a montré une relation inverse entre la masse osseuse et le risque de fracture avec un OR de 1,4 pour le risque de fracture chez les enfants appartenant au tercile le plus faible en densité osseuse mesurée au corps entier. Si l’on considère qu’il existe une relation entre la pratique physique et la densité de l’os, on peut attribuer en partie cet effet protecteur à la pratique. Un résultat similaire a été observé sur l’humérus (OR=1,6) lors de l’étude de la densité volumique. ) a montré que, parmi les 2,7 % de sujets ayant une histoire de fracture de stress, les filles qui participaient à des activités plus de 16 h par semaine avaient davantage (OR=1,88) de fractures que celles qui s’entraînaient au plus 4 h par semaine. Par ailleurs, ces mêmes sujets avaient une probabilité plus grande (4,8 % versus 2,8 %) de présenter des désordres alimentaires et ces désordres étaient liés à la fracture de fatigue (OR=1,33). Chaque heure d’activité à impact pratiquée au-delà de 4 h par semaine augmentait significativement le risque de fracture (OR=1,5). La pratique intensive lorsqu’elle est associée à des désordres alimentaires augmente le risque de fracture de stress spécialement chez les adolescents.
) a montré que, parmi les 2,7 % de sujets ayant une histoire de fracture de stress, les filles qui participaient à des activités plus de 16 h par semaine avaient davantage (OR=1,88) de fractures que celles qui s’entraînaient au plus 4 h par semaine. Par ailleurs, ces mêmes sujets avaient une probabilité plus grande (4,8 % versus 2,8 %) de présenter des désordres alimentaires et ces désordres étaient liés à la fracture de fatigue (OR=1,33). Chaque heure d’activité à impact pratiquée au-delà de 4 h par semaine augmentait significativement le risque de fracture (OR=1,5). La pratique intensive lorsqu’elle est associée à des désordres alimentaires augmente le risque de fracture de stress spécialement chez les adolescents. ). Il a été montré que le gain osseux qui persistait à l’âge adulte était lié à l’âge de début de pratique (Kontulainen et coll., 2002
). Il a été montré que le gain osseux qui persistait à l’âge adulte était lié à l’âge de début de pratique (Kontulainen et coll., 2002 ), aux caractéristiques de l’activité ainsi qu’à la durée de l’entraînement (Modlesky et Lewis, 2002
), aux caractéristiques de l’activité ainsi qu’à la durée de l’entraînement (Modlesky et Lewis, 2002 ). L’arrêt de l’activité n’entraînait pas la perte de ce gain (Kudlac et coll., 2004
). L’arrêt de l’activité n’entraînait pas la perte de ce gain (Kudlac et coll., 2004 ; Zanker et coll., 2004
; Zanker et coll., 2004 ).
). ).
). et 1995
et 1995 ; Smith et Phillips, 1998
; Smith et Phillips, 1998 ; Kaur et coll., 2003a
; Kaur et coll., 2003a et b
et b ; Kabi et coll., 2006
; Kabi et coll., 2006 ). La densité osseuse diminue pendant la période de gestation au niveau de la colonne lombaire et de la hanche (Pearson et coll., 2004
). La densité osseuse diminue pendant la période de gestation au niveau de la colonne lombaire et de la hanche (Pearson et coll., 2004 ). Ceci semble être une pathologie rare mais qui peut aboutir à des complications fracturaires (Sarikaya et coll., 2004
). Ceci semble être une pathologie rare mais qui peut aboutir à des complications fracturaires (Sarikaya et coll., 2004 ).
). , 2001
, 2001 et 2002
et 2002 ) ont montré que l’exercice physique peut maintenir voire améliorer la densité osseuse chez l’homme et qu’il fallait conseiller des pratiques variées pour préserver la masse osseuse chez les femmes âgées. Cependant, il existe un minimum d’intensité pour rendre la pratique physique efficace, la marche semblant peu efficace par rapport à des activités en force ou résistance (Kerr et coll., 1996
) ont montré que l’exercice physique peut maintenir voire améliorer la densité osseuse chez l’homme et qu’il fallait conseiller des pratiques variées pour préserver la masse osseuse chez les femmes âgées. Cependant, il existe un minimum d’intensité pour rendre la pratique physique efficace, la marche semblant peu efficace par rapport à des activités en force ou résistance (Kerr et coll., 1996 ; Cussler et coll., 2003
; Cussler et coll., 2003 ).
). ).
). ) ont montré que chez des femmes ménopausées deux années de renforcement musculaire dorsal entraînaient une chute de la prévalence des fractures vertébrales, qui passe de 4,3 à 1,6 % et reste significative 8 ans après l’arrêt de l’entraînement. Le bilan de la Finnish Twin Cohort a mis en évidence un risque relatif de fracture de hanche plus faible de 60 % chez des hommes vigoureusement actifs comparés à leurs pairs moins actifs (Kujala et coll., 2000
) ont montré que chez des femmes ménopausées deux années de renforcement musculaire dorsal entraînaient une chute de la prévalence des fractures vertébrales, qui passe de 4,3 à 1,6 % et reste significative 8 ans après l’arrêt de l’entraînement. Le bilan de la Finnish Twin Cohort a mis en évidence un risque relatif de fracture de hanche plus faible de 60 % chez des hommes vigoureusement actifs comparés à leurs pairs moins actifs (Kujala et coll., 2000 ) et la Nurses’ Health Study a démontré une réduction du risque relatif de fracture de hanche chez la femme ménopausée de 6 % pour une intensité d’exercice de 3 MET.h-1, ce qui correspond à 1 h de marche par semaine. La diminution du risque atteint 41 % pour une marche de 4 h et plus par semaine (Feskanich et coll., 2002
) et la Nurses’ Health Study a démontré une réduction du risque relatif de fracture de hanche chez la femme ménopausée de 6 % pour une intensité d’exercice de 3 MET.h-1, ce qui correspond à 1 h de marche par semaine. La diminution du risque atteint 41 % pour une marche de 4 h et plus par semaine (Feskanich et coll., 2002 ).
). et 1998
et 1998 ).
). ; Frost et coll., 1998
; Frost et coll., 1998 ) sous la forme d’un « mécanostat » grâce auquel l’os adapte son niveau de modelage (ou de remodelage) lorsqu’il perçoit un changement de régime de contraintes. Cette adaptation est encadrée par des seuils correspondant à des niveaux de stress mécaniques en-deçà et au-delà desquels le changement de régime a un effet nul ou délétère sur la masse osseuse.
) sous la forme d’un « mécanostat » grâce auquel l’os adapte son niveau de modelage (ou de remodelage) lorsqu’il perçoit un changement de régime de contraintes. Cette adaptation est encadrée par des seuils correspondant à des niveaux de stress mécaniques en-deçà et au-delà desquels le changement de régime a un effet nul ou délétère sur la masse osseuse. ). La déformation est exprimée en microdéformations (microstrains ou µ∊), 1000 µ∊ correspondant à une modification de la longueur de l’os de 0,10 %.
). La déformation est exprimée en microdéformations (microstrains ou µ∊), 1000 µ∊ correspondant à une modification de la longueur de l’os de 0,10 %.
 )
) ). Le remodelage est fortement activé en cas de contraintes trop faibles ou trop fortes de manière à ajuster la masse osseuse aux sollicitations mécaniques. L’application de contraintes mécaniques induisant un certain seuil de déformation entraîne une augmentation de la masse osseuse. Si ces contraintes sont de nouveau appliquées sur la structure osseuse, devenue plus solide, elles induiront une déformation plus faible et donc une réponse osseuse plus faible. Inversement, si les contraintes mécaniques diminuent, la masse osseuse diminuera elle aussi pour s’adapter au nouvel environnement mécanique. Pour Frost, le seuil du modelage se situe environ à 1 500-2 500 µ∊. Ce seuil est aussi appelé « minimum effective strain ». Le seuil du remodelage est beaucoup plus faible (100-300 µ∊). Pour information, l’os risquerait de se fracturer pour des contraintes atteignant 25 000 µ∊ (Frost, 1987
). Le remodelage est fortement activé en cas de contraintes trop faibles ou trop fortes de manière à ajuster la masse osseuse aux sollicitations mécaniques. L’application de contraintes mécaniques induisant un certain seuil de déformation entraîne une augmentation de la masse osseuse. Si ces contraintes sont de nouveau appliquées sur la structure osseuse, devenue plus solide, elles induiront une déformation plus faible et donc une réponse osseuse plus faible. Inversement, si les contraintes mécaniques diminuent, la masse osseuse diminuera elle aussi pour s’adapter au nouvel environnement mécanique. Pour Frost, le seuil du modelage se situe environ à 1 500-2 500 µ∊. Ce seuil est aussi appelé « minimum effective strain ». Le seuil du remodelage est beaucoup plus faible (100-300 µ∊). Pour information, l’os risquerait de se fracturer pour des contraintes atteignant 25 000 µ∊ (Frost, 1987 ).
). ; Biewener et Taylor, 1986
; Biewener et Taylor, 1986 ).
). ). Les contraintes statiques n’ont que peu d’effets sur l’accrétion minérale osseuse. En revanche, les contraintes dynamiques provoquent des adaptations de l’os (Lanyon, 1996
). Les contraintes statiques n’ont que peu d’effets sur l’accrétion minérale osseuse. En revanche, les contraintes dynamiques provoquent des adaptations de l’os (Lanyon, 1996 ).
). ) ont montré qu’une série de stimulations mécaniques durant une seule minute par jour était suffisante pour prévenir la perte osseuse cubitale, tant que la fréquence efficace était appliquée. Cela suggère que c’est la fréquence de la charge et non la valeur absolue de cette charge qui est l’une des variables mécaniques les plus importantes dans les adaptations osseuses (Rubin et McLeod, 1994
) ont montré qu’une série de stimulations mécaniques durant une seule minute par jour était suffisante pour prévenir la perte osseuse cubitale, tant que la fréquence efficace était appliquée. Cela suggère que c’est la fréquence de la charge et non la valeur absolue de cette charge qui est l’une des variables mécaniques les plus importantes dans les adaptations osseuses (Rubin et McLeod, 1994 ; Turner et coll., 1994
; Turner et coll., 1994 ). Dans tous les phénomènes décrits comme pouvant intervenir dans la perception du signal, la fréquence du signal mécanique représente un élément important dans la réponse cellulaire (Fischer et coll., 1986
). Dans tous les phénomènes décrits comme pouvant intervenir dans la perception du signal, la fréquence du signal mécanique représente un élément important dans la réponse cellulaire (Fischer et coll., 1986 ) régulant le nombre d’événements mécaniques et leur amplitude dans le tissu trabéculaire (Barkhausen et coll., 2003
) régulant le nombre d’événements mécaniques et leur amplitude dans le tissu trabéculaire (Barkhausen et coll., 2003 ).
). ). Les études relativement récentes mettent cependant en évidence que ni la fréquence du mouvement, ni son amplitude, ne modulent la réponse à la contrainte, mais c’est le régime mécanique lui-même (dans toutes ces composantes définies par la forme du signal, l’amplitude, la fréquence), qui influence les activités cellulaires (Rubin et coll., 2001
). Les études relativement récentes mettent cependant en évidence que ni la fréquence du mouvement, ni son amplitude, ne modulent la réponse à la contrainte, mais c’est le régime mécanique lui-même (dans toutes ces composantes définies par la forme du signal, l’amplitude, la fréquence), qui influence les activités cellulaires (Rubin et coll., 2001 ; Tanaka et coll., 2003a
; Tanaka et coll., 2003a ) et l’adaptation tissulaire (Rubin et coll., 2002
) et l’adaptation tissulaire (Rubin et coll., 2002 ; Tanaka et coll., 2003b
; Tanaka et coll., 2003b ). En effet, une stimulation mécanique entraîne une réponse tissulaire plus importante à basse amplitude et haute fréquence qu’à base fréquence et haute amplitude (l’application d’un signal à haute fréquence et haute amplitude étant impossible).
). En effet, une stimulation mécanique entraîne une réponse tissulaire plus importante à basse amplitude et haute fréquence qu’à base fréquence et haute amplitude (l’application d’un signal à haute fréquence et haute amplitude étant impossible). ) ont montré que des stimuli mécaniques de faible amplitude sont capables de maintenir la masse osseuse à 1 Hz et peuvent induire une ostéogenèse à 20 Hz. Il en est de même pour Turner et coll. (1994
) ont montré que des stimuli mécaniques de faible amplitude sont capables de maintenir la masse osseuse à 1 Hz et peuvent induire une ostéogenèse à 20 Hz. Il en est de même pour Turner et coll. (1994 ) qui ont montré qu’une ostéogenèse peut être induite dans le tibia de rat seulement si la fréquence est supérieure à 0,2 Hz. Entre 0,2 et 2 Hz, la formation osseuse est proportionnelle à la fréquence d’application de la force de tension (Turner et Burr, 1993
) qui ont montré qu’une ostéogenèse peut être induite dans le tibia de rat seulement si la fréquence est supérieure à 0,2 Hz. Entre 0,2 et 2 Hz, la formation osseuse est proportionnelle à la fréquence d’application de la force de tension (Turner et Burr, 1993 ). De plus, il a été montré que l’amplitude des potentiels électriques générés par les flux induits par le stress mécanique est, elle aussi, directement proportionnelle à la fréquence d’application de la force (Otter et coll., 1992
). De plus, il a été montré que l’amplitude des potentiels électriques générés par les flux induits par le stress mécanique est, elle aussi, directement proportionnelle à la fréquence d’application de la force (Otter et coll., 1992 ).
). ; Burr et coll., 2002
; Burr et coll., 2002 ). Ces flux liquidiens traversent la membrane des ostéocytes et créent ainsi une contrainte (fluid shear stress) à l’intérieur des cellules (figure 11.3
). Ces flux liquidiens traversent la membrane des ostéocytes et créent ainsi une contrainte (fluid shear stress) à l’intérieur des cellules (figure 11.3 ). Si cette contrainte est suffisamment forte et rapide, elle déclenche une réponse cellulaire. Les ostéocytes fonctionneraient ainsi comme des jauges de contraintes (Huiskes et coll., 2000
). Si cette contrainte est suffisamment forte et rapide, elle déclenche une réponse cellulaire. Les ostéocytes fonctionneraient ainsi comme des jauges de contraintes (Huiskes et coll., 2000 ). En réponse aux gradients de flux liquidiens, ils libéreraient des messagers biochimiques tels les prostaglandines (Ehrlich et Lanyon, 2002
). En réponse aux gradients de flux liquidiens, ils libéreraient des messagers biochimiques tels les prostaglandines (Ehrlich et Lanyon, 2002 ). Ces messagers envoient des signaux qui se dissipent jusqu’à la surface de l’os où a lieu le recrutement des ostéoblastes. La nature du signal est encore peu connue mais il pourrait s’agir de courants électriques et/ou de transports ioniques (Huiskes et coll., 2000
). Ces messagers envoient des signaux qui se dissipent jusqu’à la surface de l’os où a lieu le recrutement des ostéoblastes. La nature du signal est encore peu connue mais il pourrait s’agir de courants électriques et/ou de transports ioniques (Huiskes et coll., 2000 ), provoqués par la vitesse de circulation des courants liquidiens intracanaliculaires (Mosley et Lanyon, 1998
), provoqués par la vitesse de circulation des courants liquidiens intracanaliculaires (Mosley et Lanyon, 1998 ). On parle de mécanotransduction car le signal mécanique (déformation de l’os) est transformé en message chimique.
). On parle de mécanotransduction car le signal mécanique (déformation de l’os) est transformé en message chimique. ) a suggéré que les ostéoblastes, les ostéocytes et les lignées cellulaires osseuses, du fait de leurs nombreuses connexions, peuvent être morphologiquement sensibles aux variations mécaniques. In vitro, la technique de patch-clamp a permis de mettre en évidence différents canaux ioniques sur les cellules osseuses. La plupart sont voltage-dépendants (Ravesloot et coll., 1989
) a suggéré que les ostéoblastes, les ostéocytes et les lignées cellulaires osseuses, du fait de leurs nombreuses connexions, peuvent être morphologiquement sensibles aux variations mécaniques. In vitro, la technique de patch-clamp a permis de mettre en évidence différents canaux ioniques sur les cellules osseuses. La plupart sont voltage-dépendants (Ravesloot et coll., 1989 ), mais certains sont sensibles à l’étirement membranaire (Duncan et Misler, 1989
), mais certains sont sensibles à l’étirement membranaire (Duncan et Misler, 1989 ) et répondent à une sollicitation mécanique (Duncan et Hruska, 1994
) et répondent à une sollicitation mécanique (Duncan et Hruska, 1994 ). De fait, les propriétés électriques et mécaniques de la membrane cellulaire peuvent sans doute contrôler l’activité des cellules osseuses (Ypey et coll., 1992
). De fait, les propriétés électriques et mécaniques de la membrane cellulaire peuvent sans doute contrôler l’activité des cellules osseuses (Ypey et coll., 1992 ).
). ; Pavalko et coll., 1998
; Pavalko et coll., 1998 ). Ces molécules associées à l’actine et à la phosphokinase C (PKC) sont nécessaires à la fois à l’hyperpolarisation et à la dépolarisation consécutives à la stimulation mécanique (Salter et coll., 1997
). Ces molécules associées à l’actine et à la phosphokinase C (PKC) sont nécessaires à la fois à l’hyperpolarisation et à la dépolarisation consécutives à la stimulation mécanique (Salter et coll., 1997 ). La prolifération cellulaire consécutive à la stimulation mécanique ferait aussi intervenir les récepteurs aux œstrogènes. En effet, l’utilisation du tamoxifène (antagoniste de l’œstradiol) élimine la prolifération ostéoblastique mécanico-dépendante d’os de rat (Damien et coll., 1998
). La prolifération cellulaire consécutive à la stimulation mécanique ferait aussi intervenir les récepteurs aux œstrogènes. En effet, l’utilisation du tamoxifène (antagoniste de l’œstradiol) élimine la prolifération ostéoblastique mécanico-dépendante d’os de rat (Damien et coll., 1998 ). Enfin, le monoxyde d’azote (NO) et la NO synthase produits par les ostéoblastes pourraient également intervenir dans cette régulation comme ils le font au niveau vasculaire (Riancho et Mundy, 1995
). Enfin, le monoxyde d’azote (NO) et la NO synthase produits par les ostéoblastes pourraient également intervenir dans cette régulation comme ils le font au niveau vasculaire (Riancho et Mundy, 1995 ).
). ). Par l’intermédiaire du réseau de leurs prolongements cytoplasmiques et des jonctions (Donahue, 2000
). Par l’intermédiaire du réseau de leurs prolongements cytoplasmiques et des jonctions (Donahue, 2000 ), ils peuvent envoyer des messages chimiques aux ostéoblastes et/ou ostéoclastes. Les forces s’exerçant sur l’os pourraient donc provoquer des mouvements du fluide canaliculaire, enregistrés par les ostéocytes, qui y répondraient en libérant des cytokines régulant le métabolisme phosphocalcique (Klein-Nulend et coll., 1995
), ils peuvent envoyer des messages chimiques aux ostéoblastes et/ou ostéoclastes. Les forces s’exerçant sur l’os pourraient donc provoquer des mouvements du fluide canaliculaire, enregistrés par les ostéocytes, qui y répondraient en libérant des cytokines régulant le métabolisme phosphocalcique (Klein-Nulend et coll., 1995 ).
). ). Plusieurs études ont montré que les cellules osseuses répondaient aux contraintes mécaniques (Somjen et coll., 1980
). Plusieurs études ont montré que les cellules osseuses répondaient aux contraintes mécaniques (Somjen et coll., 1980 ), au flux liquidiens (Reich et coll., 1990
), au flux liquidiens (Reich et coll., 1990 ), ainsi qu’aux champs électriques (Korenstein et coll., 1984
), ainsi qu’aux champs électriques (Korenstein et coll., 1984 ). Toutefois, dans ces études, la contrainte mécanique appliquée (en terme d’amplitude et de durée), pour activer les cellules osseuses in vitro, est 10 à 100 fois supérieure à celle requise in vivo, même si cette notion reste controversée (Han et coll., 2004
). Toutefois, dans ces études, la contrainte mécanique appliquée (en terme d’amplitude et de durée), pour activer les cellules osseuses in vitro, est 10 à 100 fois supérieure à celle requise in vivo, même si cette notion reste controversée (Han et coll., 2004 ). L’ostéoformation dépend également de la vitesse de circulation des courants liquidiens intracanaliculaires (Mosley et Lanyon, 1998
). L’ostéoformation dépend également de la vitesse de circulation des courants liquidiens intracanaliculaires (Mosley et Lanyon, 1998 ), qui dépend elle-même de la vitesse de mise en charge de la structure osseuse (Lanyon, 1996
), qui dépend elle-même de la vitesse de mise en charge de la structure osseuse (Lanyon, 1996 ; Judex et Zernicke, 2000
; Judex et Zernicke, 2000 ). Chez l’animal, des corrélations ont été rapportées entre l’hypertrophie osseuse et la vitesse maximale de mise en charge (Mosley et Lanyon, 1998
). Chez l’animal, des corrélations ont été rapportées entre l’hypertrophie osseuse et la vitesse maximale de mise en charge (Mosley et Lanyon, 1998 ).
). ; Heinonen et coll., 2002
; Heinonen et coll., 2002 ).
). ; Mikuni-Takagaki et coll., 1996
; Mikuni-Takagaki et coll., 1996 ; Matsuda et coll., 1998
; Matsuda et coll., 1998 ; Kaspar et coll., 2000
; Kaspar et coll., 2000 ; Warren SM et coll., 2003
; Warren SM et coll., 2003 ). Une prolifération cellulaire (Buckley et coll., 1988
). Une prolifération cellulaire (Buckley et coll., 1988 ), ainsi qu’une stimulation de la synthèse protéique (Hasegawa et coll., 1985
), ainsi qu’une stimulation de la synthèse protéique (Hasegawa et coll., 1985 ) ou d’ADN (Somjen et coll., 1980
) ou d’ADN (Somjen et coll., 1980 ) ont été démontrées. D’autres résultats mentionnent, au contraire, une diminution de la prolifération cellulaire (Burger et coll., 1992
) ont été démontrées. D’autres résultats mentionnent, au contraire, une diminution de la prolifération cellulaire (Burger et coll., 1992 ). Fermor et coll. (1998
). Fermor et coll. (1998 ) montrent que les contraintes mécaniques d’ordre physiologique (4 000 µ∊, 1 Hz) n’ont pas d’effet sur la prolifération des ostéoblastes humaines.
) montrent que les contraintes mécaniques d’ordre physiologique (4 000 µ∊, 1 Hz) n’ont pas d’effet sur la prolifération des ostéoblastes humaines. ), la maturation du cartilage pendant l’ossification endochondrale est respectivement accélérée ou ralentie par l’application intermittente de forces d’étirement ou de compression. Les forces mécaniques pourraient donc influencer la morphologie des os longs dès les premiers stades de croissance endochondrale. Dès que les centres d’ossification se développent, l’application intermittente de forces de compression produite par des cisaillements entre le cartilage calcifié et le non-calcifié et, entre la diaphyse et les épiphyses favorise la croissance. L’accélération de l’ostéogenèse dans les zones de cisaillement et la synthèse accrue de protéoglycanes dans les parties comprimées sont en accord avec la théorie de Wong et Carter (1990
), la maturation du cartilage pendant l’ossification endochondrale est respectivement accélérée ou ralentie par l’application intermittente de forces d’étirement ou de compression. Les forces mécaniques pourraient donc influencer la morphologie des os longs dès les premiers stades de croissance endochondrale. Dès que les centres d’ossification se développent, l’application intermittente de forces de compression produite par des cisaillements entre le cartilage calcifié et le non-calcifié et, entre la diaphyse et les épiphyses favorise la croissance. L’accélération de l’ostéogenèse dans les zones de cisaillement et la synthèse accrue de protéoglycanes dans les parties comprimées sont en accord avec la théorie de Wong et Carter (1990 ).
). ).
). ) implique l’existence et l’importance de signaux mécaniques aléatoires, associés au signal proprement dit. En effet, la forme d’onde des vibrations n’a pas toujours une structure aussi simple que celle des vibrations fondamentales et des vibrations harmoniques.
) implique l’existence et l’importance de signaux mécaniques aléatoires, associés au signal proprement dit. En effet, la forme d’onde des vibrations n’a pas toujours une structure aussi simple que celle des vibrations fondamentales et des vibrations harmoniques. ), le cytosquelette permettant d’amplifier des signaux extrêmement faibles. Par ailleurs, des études assez récentes (You et coll., 2000
), le cytosquelette permettant d’amplifier des signaux extrêmement faibles. Par ailleurs, des études assez récentes (You et coll., 2000 ) remettent notamment en cause l’hypothèse d’une influence majeure des forces de cisaillement dues aux mouvements liquidiens sur les ostéocytes (You et coll., 2001
) remettent notamment en cause l’hypothèse d’une influence majeure des forces de cisaillement dues aux mouvements liquidiens sur les ostéocytes (You et coll., 2001 ). L’hypothèse plus probable est que le mécanisme d’excitation entraîne une amplification du signal par l’interaction matricecytosquelette.
). L’hypothèse plus probable est que le mécanisme d’excitation entraîne une amplification du signal par l’interaction matricecytosquelette.