Activité physique et pathologies
2008
16-
Maladies cardiovasculaires
C’est dans le domaine des maladies cardiovasculaires que les preuves de l’intérêt de l’activité physique sont les plus importantes. Il s’agit d’effets variés à la fois sur les capacités physiques, la dimension psychologique, l’environnement physiopathologique, notamment les facteurs de risque. L’activité physique est efficace en prévention primaire comme en prévention secondaire et ces deux champs d’action seront abordés successivement.
Effet de l’activité physique sur la morbidité cardiovasculaire
Les maladies cardiovasculaires athéromateuses restent la première cause de mortalité dans les pays développés. Il s’agit essentiellement des coronaropathies athéromateuses, de la cardiopathie ischémique et de l’artériopathie des membres inférieurs. Il existe une relation inverse, démontrée par des études épidémiologiques, entre l’intensité de l’activité physique et l’incidence de ces maladies cardiovasculaires athéromateuses (Morris et coll., 1980

; Powell et coll., 1987

; Berlin et Colditz, 1990

; Morris et coll., 1990

; Haapanen et coll., 1997

; Lee et coll., 1997

; Lee et Paffenbarger, 2000

; Blair et Jackson, 2001

; Noda et coll., 2005

; Sundquist et coll., 2005

). Cela a été retrouvé pour les femmes (Lee et coll., 2001

; Manson et coll., 2002

; Oguma et Shinoda-Tagawa, 2004

) comme pour les hommes (Sesso et coll., 2000

).
La sédentarité fait partie des facteurs de risque des maladies cardiovasculaires (Lakka et coll., 1994

). Le niveau de capacité physique est un facteur prédictif indépendant de mortalité cardiovasculaire, même chez le sujet âgé (Ekelund et coll., 1988

; Myers et coll., 2002

; Spin et coll., 2002

).
La littérature est moins abondante concernant les effets en prévention primaire de l’activité physique sur la survenue d’accidents vasculaires cérébraux, 3
e cause de mortalité en France. Cependant, il existe un lien statistique entre l’hypoactivité et le risque d’accident vasculaire cérébral et le niveau de la consommation maximale d’O
2 (VO
2 max) est un bon facteur pronostique d’un tel accident (Kurl et coll., 2003

). L’activité physique réduit l’incidence d’accident vasculaire cérébral de 25 % (Lee IM et coll., 2003

; Wendel-Vos et coll., 2004

). Par ailleurs, la majorité des études effectuées mettent en évidence des résultats positifs liés au renforcement de l’activité physique (Hu et coll., 2000

; Alevizos et coll., 2005

), cet effet protecteur ayant été retrouvé chez les hommes comme chez les femmes (Lindestrom et coll., 1993

; Manson et coll., 1995

).
Cet impact de l’activité physique sur la morbi-mortalité cardiovasculaire n’est pas parfaitement expliqué car il est multifactoriel. Il repose en partie sur l’amélioration des anomalies physiopathologiques souvent liées aux affections athéromateuses (dysfonction endothéliale, hyperadrénergie...) et sur le meilleur contrôle des facteurs de risque cardiovasculaires avec pour résultante finale un ralentissement du processus athéromateux. D’ailleurs, la diminution de la mortalité est plus importante chez les sujets présentant le plus de facteurs de risque (Richardson et coll., 2004

).
Effet de l’activité physique sur les anomalies physiopathologiques liées aux maladies cardiovasculaires
La dysfonction endothéliale joue un rôle clé dans le développement de l’athérome. Elle intervient en particulier dans le développement initial de la plaque d’athérome, dans la fibrinolyse, dans la régulation de la pression sanguine artérielle et des phénomènes inflammatoires. L’activité physique améliore la vasodilatation endothélo-dépendante dont l’oxyde nitrique (NO) est un des principaux médiateurs. L’exercice favorise d’ailleurs l’expression des facteurs intervenant dans la production de NO (Fukai et coll., 2000

; Gokce et coll., 2002

; Dimmeler et Zeiher, 2003

; Green et coll., 2004

).
L’impact en prévention primaire de l’activité physique sur le système neurovégétatif, lorsqu’il est étudié par la variabilité sinusale, ne semble pas du même niveau chez le sujet sain que lorsqu’il est mesuré chez les patients coronariens symptomatiques (prévention secondaire) (Loimaala et coll., 2000

; Lucini et coll., 2002

), avec pour corollaire une diminution du risque de troubles du rythme (Billman, 2002

). L’effet sur la variabilité sinusale est en effet plus important chez les sujets symptomatiques (prévention secondaire) que chez ceux qui ne le sont pas (prévention primaire).
Les troubles hémorhéologiques et l’hypercoagulabilité sont améliorés par l’activité physique. Si l’activité fibrinolytique est augmentée, l’adhésivité plaquettaire et la viscosité plasmatique sont réduites (Koenig et coll., 1997

; Church et coll., 2002a

). Même une activité physique modérée permet une amélioration des capacités fibrinolytiques (Lee et Lip, 2003

). Il existe une relation linéaire entre le niveau d’activité physique et l’augmentation de l’activateur du plasminogène tissulaire qui, produit par la cellule endothéliale, se lie à la fibrine pour transformer le plasminogène en plasmine qui va lyser un thrombus en formation (Eliasson et coll., 1996

).
Le syndrome inflammatoire biologique est corrélé à la survenue plus fréquente des atteintes athéromateuses et associé aux troubles de la coagulation. Il est réduit par l’activité physique, avec amélioration des marqueurs que sont la protéine C réactive et le fibrinogène (Lakka et Salonen, 1993

; Montgomery et coll., 1996

; Wannamethee et coll., 2002

). Cet effet est indépendant des autres facteurs de risque (Geffken et coll., 2001

). Associée à cet effet sur l’inflammation, il existe une diminution de la concentration en cytokines athérogènes – tel que l’interféron-γ (IFN-γ) – qui interviennent dans l’initiation du processus d’athérogénèse, et une augmentation des cytokines athéroprotectrices – tel que le
Transforming Growth Factor (TGFβ) – (Smith et coll., 1999

).
Effet de l’activité physique sur les différents facteurs de risque cardiovasculaires
L’activité physique peut agir sur les différents facteurs de risque impliqués dans les maladies cardiovasculaires.
Hypertension artérielle
La pratique régulière d’une activité physique permet un meilleur contrôle de l’hypertension artérielle (Pescatello et coll., 1991

; Appelgate et coll., 1992

; Kokkinos et coll., 1995

; Paffenbarger et Lee, 1997; Turner et coll., 2000

). L’entraînement physique fait donc désormais partie des recommandations dans la prise en charge de l’hypertension, en association avec les traitements médicamenteux (
Guidelines Subcommittee, 1999

;
Guidelines Committee, 2003

).
Cet effet de l’activité physique sur l’hypertension artérielle a été mis en évidence initialement chez l’homme (Paffenbarger et coll., 1983

) puis secondairement chez la femme (Reaven et coll., 1991

). Il est également retrouvé lorsqu’une obésité est associée à l’hypertension (Fagard, 1999

). Les études concernant les sujets hypertendus âgés sont peu nombreuses. Il semble que l’impact soit moins important et qu’il porte uniquement sur la pression sanguine artérielle diastolique (Stewart et coll., 2005

), ceci pouvant être expliqué par la rigidité de la paroi artérielle du sujet âgé (Berry et coll., 2004

).
La relation inverse entre l’activité physique et la pression sanguine artérielle a été confirmée en utilisant l’eau doublement marquée, moyen plus fiable de mesure du niveau de dépense énergétique que les questionnaires. Elle est indépendante du contexte socioculturel (Luke et coll., 2005

).
Une méta-analyse, incluant à la fois des sujets normotendus et hypertendus, a montré qu’un entraînement physique modéré à une intensité correspondant à 40-50 % de la puissance maximale aérobie (PMA)
1
La puissance maximale aérobie (PMA) est la puissance de travail qui correspond à la consommation maximale d’oxygène.
et à raison de 5 séances par semaine permettait de réduire la pression sanguine artérielle de 3,4 mmHg pour la pression systolique et de 2,4 mmHg pour la pression diastolique (Fagard, 2001

; Fagard, 2006

). Cet effet est plus prononcé lorsqu’il est évalué uniquement chez des sujets hypertendus : diminution de 11 mmHg de la pression systolique et de 8 mmHg de la pression diastolique (Hagberg et coll., 2000

). Cette méta-analyse n’a pas montré d’efficacité supérieure d’un entraînement intensif par rapport à une activité physique modérée chez les patients hypertendus. Les femmes (
versus les hommes) et les sujets d’âge moyen (
versus les sujets jeunes et les sujets âgés) présentaient une diminution plus importante de la pression artérielle.
Si l’activité physique régulière est poursuivie suffisamment longtemps (au moins durant 3 ans), l’amélioration de l’hypertension persiste, à la fois au repos et au cours de l’effort (diminution de 9,2 % de la pression systolique). Son effet est comparable, voire supérieur, à celui d’une monothérapie médicamenteuse (Ketelhut et coll., 2004

). Cet effet sur l’hypertension au cours de l’effort est d’autant plus intéressant que cette dernière représente un facteur de risque indépendant de la pression de repos pour la survenue d’infarctus du myocarde et pour la mortalité globale (Mundal et coll., 1996

).
Par ailleurs, chez des sujets normotendus, le dépistage d’une hypertension d’effort est un facteur prédictif indépendant de développement d’une hypertension (Matthews et coll., 1998

; Pendey, 2003

). Ainsi, une élévation supérieure ou égale à 50 mmHg de la pression systolique, à un niveau d’effort correspondant à 50 % du pic de VO
2, est considérée comme anormale et est améliorée par un entraînement en endurance de 8 semaines (Bond et coll., 2005

). L’activité physique est donc susceptible de différer voire de rendre inutile le traitement médicamenteux chez un sujet hypertendu.
Les mécanismes sous-tendant cet effet restent mal élucidés. Une diminution des résistances artérielles périphériques a été retrouvée (Meredith et coll., 1990

), ainsi qu’une meilleure adaptation du débit cardiaque (Ketelhut et coll., 1994

). L’amélioration, déjà évoquée, du fonctionnement de l’endothélium vasculaire est probablement impliquée dans cet effet vasculaire avec meilleure vasodilatation réflexe (Kingwell et coll., 1995

; Higashi et coll., 1999

), de même que l’action sur le système neurovégétatif (Brown et coll., 2002

). Une augmentation de la capacité veineuse a été évoquée (Amaral et coll., 2001

). Si une amélioration de la compliance artérielle a été retrouvée après entraînement chez les sujets adultes normotendus (Cameron et Dart, 1994

), cette amélioration n’a pas été confirmée dans une étude récente menée chez des sujets jeunes (Rakobowchuk et coll., 2004

). De la même façon, la compliance artérielle n’a pas été modifiée chez des patients hypertendus, à l’issue d’un reconditionnement aérobie de durée brève (Ferrier et coll., 2001

) ainsi que chez des sujets âgés après un entraînement de 6 mois (Stewart et coll., 2005

). L’effet de l’entraînement sur le système rénine-angiotensine-aldostérone a été jugé longtemps comme négligeable (Hespel et coll., 1988

). Une méta-analyse récente a cependant retrouvé une diminution de 20 % de l’activité de la rénine plasmatique, associée à une diminution de 29 % de la noradrénaline et de 7,1 % des résistances vasculaires pour un entraînement en endurance d’au moins 4 semaines (Fagard, 2006

).
Les facteurs génétiques et environnementaux peuvent influencer les modifications de la pression sanguine artérielle au cours d’un programme d’entraînement physique. Cette dimension est mal connue car peu étudiée. À noter que la composante héréditaire dans l’adaptation tensionnelle à un entraînement endurant de 20 semaines est apparue comme faible pour la pression systolique et la fréquence cardiaque (17 à 30 % de la réduction) et négligeable pour la pression diastolique (Rice et coll., 2002

; An et coll., 2003

).
Au total, l’activité physique est désormais un élément incontournable de la prise en charge des patients atteints d’une hypertension artérielle.
Diabète
La sédentarité représente pour certains la première cause comportementale de la prévalence croissante du diabète (LaMonte et coll., 2005

). Il existe en effet des liens épidémiologiques bien établis entre l’existence d’un diabète non insulino-dépendant et l’insuffisance d’activité physique (Helmrich et coll., 1991

; Manson et coll., 1991

; Burchfiel et coll., 1995

; Paffenbarger et coll., 1997

; Wei et coll., 2000

; Hu et coll., 2003

; Zinman et coll., 2003

).
L’activité physique (le plus souvent associée à un régime) est efficace pour prévenir l’apparition du diabète de type 2 chez des sujets à risque, avec une diminution de moitié en moyenne de son incidence (Eriksson et Lindgarde, 1991

; Manson et coll., 1993

; Paffenbarger et coll., 1997

; Pan et coll., 1997

; Hu et coll., 1999

; Tuomilheto et coll., 2001

).
Ainsi, dans une population de patients non diabétiques mais avec une intolérance au glucose (glycémie inférieure à 1,25 g/l à jeun et comprise entre 1,4 et 2 g/l deux heures après une épreuve de charge en glucose), l’activité physique réduit de 58 % le risque de survenue d’un diabète, alors que la metformine ne le diminue que de 31 % (Knowler et coll., 2002

). Il existe une diminution IDEntique du risque cardiovasculaire (Bassuk et coll., 2005

). La réduction de l’incidence du diabète peut aller jusqu’à 65 % si le niveau d’activité physique est important (Laaksonen et coll., 2005

). L’étude de Framingham a montré que dans une population non sélectionnée de sujets âgés de 50 ans, l’espérance de vie sans diabète est augmentée de 2,3 ans pour des sujets modérément actifs et de 4 ans pour des sujets très actifs par rapport à des sujets sédentaires (Jonker et coll., 2006

).
Chez les diabétiques de type 2, il existe une amélioration des capacités aérobies avec en particulier une augmentation de 11,8 % du VO
2 max (Boule et coll., 2003

), mais sans modification significative de la masse corporelle (Boule et coll., 2001

). L’équilibre glycémique est amélioré par l’entraînement aérobie mais sans effet dose-réponse (Kelley et Goodpaster, 2001

). Il l’est également par le renforcement musculaire contre résistance (Castaneda et coll., 2002

; Dunstan et coll., 2002

; Cuff et coll., 2003

).
Au cours du diabète non insulino-dépendant, l’exercice physique favorise l’équilibre glycémique (Thomas et coll., 2006

) et entraîne une diminution de l’hémoglobine glyquée (HbA1c) de 0,66 % ; démontrée par une méta-analyse, cette amélioration est considérée comme suffisamment importante pour réduire la fréquence des complications dégénératives (Boule et coll., 2001

).
L’activité physique diminue l’incidence des maladies cardiovasculaires ainsi que la mortalité des patients diabétiques (Wei et coll., 2000

; Batty et coll., 2002

; Gregg et coll., 2003

; Tanasescu et coll., 2003

), indépendamment des autres facteurs de risque que sont la surcharge pondérale, l’hypertension, les dyslipidémies et l’intoxication tabagique (Hu et coll., 2005

). De plus, une obésité est souvent associée au diabète. L’effet protecteur de l’activité physique sur la survenue d’événements cardiovasculaires est indépendant du poids. En effet, la relation inverse avec le risque relatif de mortalité persiste, que les patients aient un poids normal (IMC<25 kg/m
2), qu’ils soient en surcharge pondérale (IMC=25-29,9 kg/m
2), ou qu’ils soient obèses (IMC>30 kg/m
2) (Hu et coll., 2001

; Church et coll., 2004

).
Ces effets de l’activité physique sur le diabète sont d’origine multiple :
• amélioration du transport et de l’utilisation du glucose musculaire (Goodyear et coll., 1998

) ;
• réduction de l’insulino-résistance avec une grande variabilité dans les résultats, puisque fluctuant de 10 à 60 % (Tonino, 1989

; Perseghin et coll., 1996

; Zinman et coll., 2003

), ceci étant probablement dû à la très grande hétérogénéité des populations étudiées. La réduction de l’insulino-résistance est associée à une diminution de l’intolérance au glucose, de l’hyperglycémie post-prandiale et de la production hépatique de glucose (Thompson et coll., 2001

). L’amélioration de l’insulino-résistance est également corrélée à la diminution de la graisse abdominale (Mourier et coll., 1997

) ainsi qu’aux modifications du profil lipidique (Corpeleijn et coll., 2006

).
L’insulino-résistance est diminuée chez des patients non diabétiques en surcharge pondérale, que l’activité physique pratiquée soit intense ou modérée (Houmard et coll., 2004

), avec un effet IDEntique chez des adolescents en surcharge pondérale (Shaibi et coll., 2006

). Les mêmes constatations ont été faites chez les sujets présentant un diabète de type 2 (Mayer-Davis et coll., 1998

). Cependant, chez des sujets euglycémiques mais présentant une résistance à l’insuline, un programme intensif d’intervention comportant notamment une activité physique élevée (au moins 20 minutes par jour à 80-90 % de la fréquence cardiaque maximale théorique) est nécessaire pour obtenir une amélioration moyenne de 26 % de la sensibilité à l’insuline (McAuley et coll., 2002

). Par ailleurs, il semble exister des liens entre l’activité physique et l’amélioration de l’insulino-résistance chez le sujet hypertendu (Zavaroni et coll., 1989

; Andersen et coll., 2003

). Il existe en effet une relation statistique entre la réduction d’une hypertension et de la noradrénaline induite par l’exercice d’une part et l’amélioration de la sensibilité à l’insuline d’autre part (Kohno et coll., 2000

).
À noter que l’entraînement physique améliore l’homéostasie glycémique de façon globale en limitant le risque d’hypoglycémie, mais que son impact semble transitoire sur l’insulino-résistance, avec retour à la situation préalable, 3 jours après l’arrêt de l’activité physique (Heath et coll., 1983

; Boule et coll., 2005

).
Par ailleurs, une dysfonction endothéliale est très souvent associée au diabète (McVeigh et coll., 1992

). Un entraînement physique de 8 semaines, combinant reconditionnement global aérobie et renforcement musculaire contre résistance, l’améliore. Cet impact ne se limite pas aux territoires musculaires entraînés mais diffuse à l’ensemble de l’arbre artériel de façon systémique (Maiorana et coll., 2001

).
A contrario, un travail récent n’a pas mis en évidence de modifications fonctionnelles microcirculatoires au décours d’un entraînement de 6 mois chez des diabétiques au bon équilibre glycémique (Middlebrooke et coll., 2006

).
La réduction de mortalité au cours du diabète de type 2 est multifactorielle. Elle est due également aux autres effets rapportés sur les anomalies neurovégétatives, hémorhéologiques et inflammatoires. L’activité physique a de plus l’intérêt de permettre un meilleur contrôle des autres facteurs de risque fréquemment associés au diabète, que ce soit la surcharge pondérale (Walker et coll., 1999

), la tension artérielle (Lehmann et coll., 1995

), le profil lipidique (Bourn et coll., 1994

). Une activité de marche de 45 minutes, 3 fois par semaine apparaît suffisante (Fritz et coll., 2006

).
Concernant les effets de l’exercice sur le diabète insulino-dépendant, les travaux sont rares et n’ont pas démontré un meilleur contrôle glycémique.
En résumé, l’activité physique permet une réduction du risque de survenue du diabète de type 2 et limite l’incidence des maladies cardiovasculaires lorsque le diabète est avéré (Batty et coll., 2002

). L’activité physique fait donc partie des recommandations des sociétés savantes (Albright et coll., 2000

;
American Diabetes Association, 2002

).
Dyslipidémies
L’activité physique entraîne une diminution des taux sériques des triglycérides et une augmentation du HDL
2
-cholestérol (Suter et coll., 1990

; Crouse et coll., 1997

; Durstine et coll., 2002

; Frasson et coll., 2003

; Sdringola et coll., 2003

). Une méta-analyse incluant 52 études (4 700 sujets) a montré une réduction moyenne de 3,7 % du taux de triglycérides sériques, de 5 % du LDL
3
-cholestérol et une augmentation moyenne de 4,6 % du HDL-cholestérol (Leon et Sanchez, 2001a

).
Surcharge pondérale
L’activité physique est recommandée, en association au régime, pour le contrôle de la surcharge pondérale et la conservation à moyen et long terme de la perte de poids ainsi obtenue (Wing et Hill, 2001). Elle permet une réduction de la graisse abdominale (Schwartz et coll., 1991

), facteur prédictif de diabète et d’hypertension (Haffner, 2000

). La participation dès le jeune âge à une activité physique régulière est un facteur de limitation de l’apparition de l’obésité abdominale à l’âge adulte (Yang et coll., 2006

).
Tabac
Le sevrage tabagique est facilité par l’entraînement physique (Ussher et coll., 2000

) qui améliore les résultats des programmes d’interventions comportementales (Marcus et coll., 1999

).
Dépression
La dépression est désormais un facteur de risque cardiovasculaire individualisé (Barefoot et coll., 1996

; Pennix et coll., 2001

). L’activité physique augmente la sensation de bien-être et réduit l’anxiété et le stress par des impacts multiples, psychologique, neuro-hormonaux, et métaboliques encore mal élucidés (Schnohr et coll., 2005

).
Au total, les différents impacts de l’activité physique sur les facteurs de risque cardiovasculaires expliquent au moins en partie l’efficacité de l’exercice en prévention primaire sur les maladies cardiovasculaires.
L’impact sur l’évolution de la plaque d’athérome est cependant plus difficile à mettre en évidence car il s’agit d’un processus lent, nécessitant donc des études morpho-anatomiques prolongées de la paroi artérielle, menées sur des populations importantes de patients, en limitant l’interférence de l’action sur les autres facteurs de risque (traitement par statine de l’hypercholestérolémie par exemple). Il semble bien cependant exister un tel effet, en prévention primaire, évalué sur l’évolution de l’épaisseur intima-média carotidienne (Rauramaa et coll., 2004

) et sur la rigidité de la paroi artérielle évaluée par la vélocité de l’onde de pouls (Vaitkevicius et coll., 1993

; Boreham et coll., 2004

).
Il reste que l’activité physique a des effets démontrés multiples, à la fois physiques, psychologiques, métaboliques, anti-thrombotiques, anti-arythmiques, et anti-ischémiques justifiant la mise en œuvre de stratégies de développement dans la population générale.
Modalités d’action de l’activité physique en prévention primaire
Compte tenu des effets démontrés, l’activité physique fait partie des principales préconisations faites par les sociétés savantes dans le cadre de la prévention primaire des maladies cardio- et cérébro-vasculaires (Pearson et coll., 2002

; Hack et coll., 2003

).
En conséquence, des programmes de développement de l’activité physique dans la population générale ont été mis en œuvre afin de prévenir ces maladies (Thompson et coll., 2003

) conduisant au lancement de véritables campagnes d’incitation à l’activité physique, essentiellement la marche, avec une certaine efficacité en pratique courante (Young et coll., 1993

; Staten et coll., 2004

; Stoddard et coll., 2004

). Cependant, les résultats restent limités compte tenu de la taille réduite des populations dans ces études (Bjaras et coll., 2001

).
Le maintien à long terme de l’activité physique est un problème essentiel car il conditionne l’efficacité préventive, les bénéfices étant neutralisés par son interruption (Kemi et coll., 2004

). Le taux d’abandon est en effet élevé, évalué à 50 % au bout de 6 mois, chez des sujets ayant débuté une modification de leur hygiène de vie (Dishman, 1982

). Un niveau élevé d’activité physique au cours de la jeunesse permet de présager d’une hygiène de vie adaptée au cours de l’âge adulte ce qui représente un argument supplémentaire pour la promotion de l’activité physique chez les jeunes (Conroy et coll., 2005

).
Une approche globale est proposée, visant à modifier les comportements, tant sur le plan de l’activité physique que des habitudes alimentaires. Fondée sur une revue de la littérature, elle préconise une politique d’action sur le contexte de vie, l’environnement et différentes mesures pratiques : privilégier l’utilisation des escaliers, faciliter l’accès aux lieux adaptés à l’exercice, notamment dans le milieu professionnel, développer des programmes éducatifs scolaires, augmenter le temps consacré à l’activité physique durant la scolarité (Matson-Koffman et coll., 2005

).
Niveau d’activité physique
La détermination du niveau d’activité physique efficace en terme de prévention primaire des maladies cardiovasculaires est une préoccupation déjà ancienne, avec des résultats discordants conduisant certains à préconiser des exercices de niveau élevé en intensité et en fréquence (Morris et coll., 1980

; Lakka et coll., 1994

; Sesso et coll., 2000

) et d’autres, au contraire, à proposer une activité physique modérée (Leon et coll., 1987

; Slattery et Jacobs, 1989

; Shaper et coll., 1991

; Wannamethee et Shaper, 1992

; Paffenbarger et coll., 1993

).
Les recommandations pour des exercices intenses remontent aux années 1970 et 1980 et au début des années 1990 (
American College of Sports Medicine, 1978

; Fletcher et coll., 1992

). Récemment, c’est une activité physique plus modérée qui est conseillée pendant au moins 30 minutes par séance et le plus de jours possible durant la semaine (Pate et coll., 1995

;
NIH Consensus Conference, 1996

; Thompson et coll., 2003

). L’exemple le plus habituel est la marche à vitesse libre qui, comparée à une activité physique plus intense dans une importante population de femmes, a présenté une efficacité préventive de même niveau (Manson et coll., 2002

). Par ailleurs, les effets psychologiques bénéfiques de l’activité physique sur le stress et la sensation de bien-être sont plus importants lorsque celle-ci est modérée plutôt qu’intense (Schnohr et coll., 2005

).
Cependant, une revue récente de la littérature prenant en compte à la fois les études épidémiologiques et les travaux prospectifs a retrouvé une efficacité supérieure de l’activité physique intense en prévention primaire des maladies cardiovasculaires (Swain et Franklin, 2006

), ce qui est cohérent avec la constatation déjà faite d’une relation inverse entre le niveau de capacité maximale évaluée par un test d’effort et la mortalité (Myers et coll., 2002

). L’hypothèse proposée pour expliquer cet effet plus marqué de l’activité physique intense est son impact supérieur sur le système neurovégétatif (Podolin et coll., 1991

) et sur l’insulino-résistance (Kang et coll., 1996

).
Il apparaît bien exister un effet dose-réponse entre le niveau d’activité physique et le bénéfice sur la morbi-mortalité (Kohl, 2001

), un niveau minimal d’exercice étant indispensable à un contrôle des facteurs de risque. Ce niveau a été fixé chez des sujets sains entre 30 et 55 ans à une dépense énergétique de 1 000 à 1 500 kcal/semaine, comportant des exercices 4 fois par semaine d’une durée de 20 à 60 minutes à un minimum de 50 % des capacités maximales aérobies (Drygas et coll., 1988

). L’efficacité apparaît renforcée si cette activité est supérieure à 2 000 kcal/semaine, notamment en ce qui concerne le profil lipidique (Drygas et coll., 2000

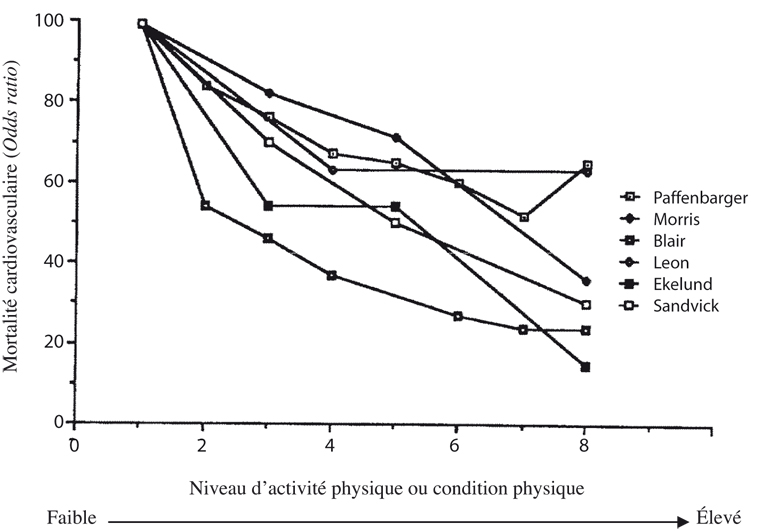
). La figure 16.1

présente les effets sur la mortalité cardiovasculaire en fonction de l’activité physique selon différents auteurs.
Les recommandations générales de sociétés savantes conseillent une activité modérée à moyenne, si possible quotidienne, durant au moins 30 minutes (Pate et coll., 1995

;
NIH Consensus Conference, 1996

), auto contrôlée par la perception de la fatigue et/ou la prise du pouls (Fletcher, 1997

). Si l’activité physique est plus intense (par exemple la marche rapide), il semble que la durée de l’exercice puisse être réduite de 30 à 10 minutes par jour, avec les mêmes effets sur le profil lipidique, le tour de taille, le VO
2 max et l’état psychologique (Murphy et coll., 2002

). Ceci apparaît intéressant en pratique, car levant une barrière habituelle à la pratique de l’activité physique qui est le manque de temps. Cependant, une évaluation plus récente des effets de la marche rapide 20 minutes, 3 jours par semaine n’a pas confirmé ces résultats (Murtagh et coll., 2005

).
Les mêmes constatations de relation inverse ont été faites entre l’activité physique et la survenue d’accidents vasculaires cérébraux (Lee CD et coll., 2003

), le gain étant supérieur chez les sujets les plus actifs mais sans gain supérieur au-delà d’une dépense énergétique de 2 000 kcal/semaine (Lee et Paffenbarger, 1998). Cet effet positif de l’activité physique modérée est retrouvé même lorsqu’il existe une hypertrophie ventriculaire associée (Pitsavos et coll., 2004

). Il faut noter qu’une activité physique soutenue, voire énergique, n’a pas entraîné d’effets délétères (Wannamethee et Shaper, 1992

) avec même un effet bénéfique additionnel comparativement à une activité modérée (Sacco et coll., 1998

). Les recommandations en prévention des accidents vasculaires cérébraux sont également d’une activité quotidienne, modérée, durant au moins 30 minutes (Pate et coll., 1995

; Golstein et coll., 2001

).
Recommandations spécifiques
Pour un meilleur contrôle des facteurs de risque cardiovasculaires, des recommandations spécifiques ont été proposées.
Sujets diabétiques
Pour le diabète, l’activité physique est recommandée en préventions primaire et secondaire (Albright et coll., 2000

;
American Diabetes Association, 2002

;
Working Party of the International Diabetes Federation, 2003

).
Compte tenu du risque cardiovasculaire chez les sujets diabétiques, un test d’effort préalable est conseillé afin de dépister ce risque et d’adapter la préconisation d’activité (Chipkin et coll., 2001

). Ces recommandations rejoignent celles déjà rapportées : au minimum une dépense énergétique de 1 000 kcal/semaine, avec activité aérobie et entraînement contre résistance, au moins 3 fois par semaine et si possible quotidienne (Di Loreto et coll., 2005

). Il est préconisé de débuter par un échauffement et terminer par une récupération active de 5 à 10 minutes. La durée de l’exercice (marche, vélo, natation...) doit augmenter progressivement de 30 à 45 minutes. Le contrôle de la fréquence cardiaque permet de contrôler de façon aisée l’intensité de l’effort. Cette approche est facilitée par l’utilisation d’un cardiofréquencemètre. Une fréquence cardiaque cible peut être proposée entre 60 et 80 % de la fréquence maximale. Pour les sujets n’ayant pas bénéficié d’un test d’effort et en l’absence d’une interaction médicamenteuse ou d’une neuropathie neurovégétative, la fréquence maximale peut être estimée par la formule : 220 – âge. Le renforcement musculaire contre résistance sera mis en œuvre au moins 2 fois par semaine. Si la force musculaire maximale est préalablement testée, on déterminera des charges correspondant à 30 à 50 % de celle-ci. Le sujet effectuera des séries de 12 à 15 répétitions en sollicitant successivement les plus volumineuses masses musculaires des 4 membres. Si un test de force n’est pas effectué, on choisira un poids pouvant être mobilisé facilement 10 à 15 fois (Stewart, 2002

).
Ces recommandations d’activité physique régulière (si possible quotidienne), d’intensité modérée et de durée minimale de 30 minutes ont été confortées par une méta-analyse récente (Bassuk et Manson, 2005

). Une activité physique de loisir plus soutenue a permis chez des sujets à risque de diminuer l’incidence du diabète de 65 % (Laaksonen et coll., 2005

). Cette constatation a été faite par plusieurs études qui utilisent un test d’effort comme moyen d’analyse de l’activité physique plutôt que les questionnaires qui sont le moyen le plus largement utilisé (Lynch et coll., 1996

; Wei et coll., 1999

). Une activité physique modérée est conseillée lorsque l’on veut privilégier l’utilisation des acides gras libres par rapport à celle du glucose qui représente l’unique source d’énergie au cours d’un effort maximal (Sato, 2000

).
Les recommandations doivent rester souples et adaptables à chaque individu en fonction de ses caractéristiques (âge, sexe, capacités...) et du contexte socioculturel et professionnel. Elles doivent pouvoir s’intégrer réellement au mode de vie car c’est le gage de leur pérennisation (Kriska, 2003

). Il semble par ailleurs que les effets bénéfiques d’un programme d’intervention sur le mode de vie se maintiennent dans le temps (Lindstrom et coll., 2006

). Ces modifications sont particulièrement importantes à mettre en œuvre car il s’agit de sujets plutôt sédentaires. Ainsi, près de 70 % des patients présentant un diabète de type 2 n’ont pas d’activité physique régulière de loisir (Ford et Herman, 1995

). L’impact de l’augmentation du niveau d’activité physique chez ces patients ne se limite pas au versant cardiovasculaire mais agit également sur leurs incapacités fonctionnelles qui sont fréquentes avec notamment une limitation à la marche (Gregg et coll., 2000

). Cependant, un obstacle est le peu de motivation souvent constaté de ces populations de patients pour des programmes contraignants d’activité physique (Survey et Ready, 1991

). Des interventions de sensibilisation, de modifications comportementales et d’éducation à une auto-prise en charge comportant un rétrocontrôle d’activité fondé sur l’utilisation de podomètres ont permis une augmentation significative du niveau d’activité physique mais avec une perte d’efficacité progressive justifiant la mise en place de stratégies de soutien (Tudor-Locke et coll., 2004

).
Par précaution, les efforts doivent être particulièrement modérés en cas de rétinopathie proliférative. Au cours de l’exercice et à des niveaux d’effort moyens en intensité et en durée, un apport nutritionnel supplémentaire est exceptionnellement nécessaire (Albright et coll., 2000

).
Sujets hypertendus
En ce qui concerne l’hypertension, des recommandations de même nature que pour les diabétiques ont été faites : pratique d’une activité aérobie régulière, comme de la marche rapide, au moins 30 minutes par jour, la plupart des jours de la semaine (
Guidelines Committee, 2003

; Pescatello et coll., 2004

). La diminution de la pression sanguine artérielle est peu différente entre une activité modérée (par exemple marche à vitesse modérée, 30 minutes 3 fois par semaine) et plus intense (60 minutes de marche rapide 5 jours par semaine) (Fagard, 2001

). À niveau d’intensité modérée (50 % de la VO
2 max), 30 à 60 minutes d’exercices par semaine sont suffisantes pour diminuer la pression systolique et diastolique, alors que 60 à 90 minutes apportent un gain supplémentaire, mais pas au-delà de 90 minutes (Ishikawa-Takata et coll., 2003

). Le volume d’exercice nécessaire apparaît donc comme peu important et raisonnablement atteignable dans cette population de patients. Le renforcement musculaire très en vogue actuellement lorsqu’il est dynamique et à charge modérée, intervient également dans l’amélioration des chiffres tensionnels (Cornelissen et Fagard, 2005

), bien qu’une altération de la compliance artérielle ait été mise en évidence (Miyachi et coll., 2004

). L’entraînement aérobie semble cependant plus efficace que le renforcement musculaire pour abaisser la tension artérielle (Halbert et coll., 1997

). Les activités aérobies sont donc à privilégier : marche, course à pied, vélo, à intensité basse à modérée plutôt qu’intense (Kokkinos et Papademetriou, 2000

). La pratique du vélo apparaît d’ailleurs la plus efficace (Whelton et coll., 2002

). En revanche, l’effet sur l’hypertension du renforcement musculaire uniquement statique n’a pas été évalué.
Les recommandations pour l’hypertension ont pu être synthétisées en termes de « FITT » (Fréquence, Intensité, Temps, Type) (tableau 16.I

).
Tableau 16.I Recommandations d’activité physique pour l’hypertension (d’après Pescatello, 2005 )
)
|
Caractéristiques de l’activité physique
|
Recommandations
|
|
Fréquence
|
Si possible tous les jours de la semaine
|
|
Intensité
|
Modérée (entre 40 et 60 % du VO2 max)
|
|
Temps
|
Supérieur à 30 minutes en continu ou en séquentiel
|
|
Type
|
Aérobie en premier lieu, complété par renforcement musculaire contre résistance
|
L’hypertension et le diabète sont associés dans près de 60 % des cas, indépendamment de l’âge et de l’obésité (Albrigth et coll., 2000

) ce qui pour certains double le risque de complications cardiovasculaires (Grossman et coll., 2000

). Les recommandations pratiques rapportées pour le diabète s’appliquent à cette situation (Stewart, 2002

).
Sujets en surcharge pondérale
Concernant la surcharge pondérale, l’effet dose-réponse lié à l’activité physique n’est pas actuellement clairement IDEntifié. La très grande hétérogénéité des situations conduit à retrouver une efficacité dans le contrôle du poids pour une activité physique modérée de 80 minutes par jour, ou bien pour une activité plus intense de 35 minutes par jour (Wing, 1999

). Par ailleurs, il semble que la moindre activité physique suffisamment régulière peut réduire la surcharge pondérale (Slentz et coll., 2004

), par exemple la pratique d’une activité de marche quotidienne de 15 minutes semble suffisante (Hill et coll., 2003

).
Sujets dyslipidémiques
Pour les dyslipidémies, il existe en revanche bien un lien dose-réponse fort entre le niveau de l’activité physique et les modifications du profil lipidique, plus particulièrement la diminution du taux sérique de triglycérides et l’augmentation du HDL-cholestérol (Leon et Sanchez, 2001b

). Il semble que cet effet soit plus lié à la durée de l’activité qu’à son intensité (Kraus et coll., 2002

).
À noter que cette relation dose-réponse a également été retrouvée entre le niveau de l’activité et les marqueurs de l’inflammation que sont la protéine C réactive et le fibrinogène, indépendamment des autres facteurs de risque cardiovasculaires (Geffken et coll., 2001

; Ford, 2002

). D’ailleurs, le niveau d’adaptation à l’effort (témoin des capacités aérobies du sujet) présente une corrélation inverse avec la protéine C réactive chez des sujets avec diabète (McGavock et coll., 2004

) et sans diabète (Church et coll., 2002b

).
Adaptation personnalisée du niveau et du type d’activité
L’utilisation de tables de correspondances énergétiques afin de fixer l’intensité des efforts effectués apparaît inappropriée. En effet, ces tables sont établies à partir d’activités développées par des adultes jeunes en bonne santé et ne sont pas applicables à des sujets âgés et/ou porteurs d’incapacités diverses (Howley, 2001

). Il est préférable de personnaliser le niveau d’effort aux capacités réelles des sujets, en tenant compte de la grande hétérogénéité des situations. Pour cela, le niveau d’effort ressenti par le sujet lui-même est un critère plus fiable et validé dans la prévention primaire pour des efforts modérés auto-contrôlés (Lee IM et coll., 2003

) et a permis une évolution dans les recommandations à une activité physique adaptée aux possibilités réelles de chaque sujet (
American College of Sports Medicine Position Stand, 1998

). La sensation de l’effort est transcrite à partir de scores spécifiques, dont celui de Borg est le plus utilisé car bien corrélé aux autres paramètres de l’adaptation à l’effort (Borg, 1982

).
Concernant les types d’exercices, ils peuvent être divers afin de s’adapter à chaque sujet. Cependant, pour les activités aérobies, la marche est la plus simple à mettre en œuvre et donc la plus utilisée (Vaz de Almeida et coll., 1999

). Elle ne nécessite pas d’apprentissage, ni d’équipement spécifique. Elle est par ailleurs rarement source de lésions musculo-squelettiques (Morris et Hardman, 1997

). Pratiquée 30 minutes par jour, 5 jours par semaine, durant 12 semaines, sans surveillance particulière, elle entraîne une réduction significative du risque cardiovasculaire (Tully et coll., 2005

). Les autres activités telles que la natation, le vélo, les différents sports, seront pratiquées en fonction des goûts de chacun et des possibilités offertes. De même, des exercices contre résistance, utilisant des poids à mobiliser ou différents ergomètres, seront préconisés deux à trois fois par semaine, incluant 8 à 10 types d’effort répétés 10 à 15 fois chacun (Fletcher, 1997

).
L’activité gymnique est souvent proposée, notamment chez les sujets âgés, dans une perspective de bien-être mais aussi de maintien fonctionnel, en particulier sur le plan de la coordination et de l’équilibre (prévention des chutes). Son impact en terme de prévention des maladies cardiovasculaires est peu étudié. Le tai chi est une technique gymnique d’origine chinoise, dont la pratique se développe dans les pays occidentaux, en particulier pour des sujets âgés car bien tolérée habituellement (mouvements lents, rythmés par la respiration, dans un contexte de détente). Il n’a pas été retrouvé d’effets significatifs du tai chi sur la pression sanguine artérielle, le profil glycémique et lipidique chez des sujets âgés, comparativement à des exercices contre résistance et à des habitudes de vie non modifiées, sur une durée de 1 an (Thomas et coll., 2005

). Cependant, la pratique durant 4 mois d’une autre gymnastique chinoise traditionnelle, le qi gong, a permis une amélioration de patients hypertendus avec une réduction des chiffres de pression sanguine artérielle IDEntique à celle d’un entraînement conventionnel (Cheung et coll., 2005

).
Effet de l’activité physique chez les patients
L’activité physique joue également un rôle dans la prévention secondaire des maladies cardiovasculaires en agissant sur la mortalité d’une part et sur les effets physiopathologiques liés à ces maladies d’autre part.
Impact sur la mortalité
L’intérêt de l’activité physique en prévention secondaire au cours des maladies cardiovasculaires est bien établi par des études randomisées de bonne qualité (grand nombre de patients inclus, suivi prolongé, randomisation, rapport des perdus de vue, évaluation aveugle des résultats, méthode statistique pertinente) ayant permis des méta-analyses mettant en évidence sur un grand nombre de patients une diminution de la mortalité cardiaque de 25 à 35 % chez les patients coronariens. Il s’agit majoritairement de patients intégrés dans des programmes de rééducation après infarctus du myocarde, revascularisation coronaire (chirurgicale ou par angioplastie), ou pour angor stable (Oldridge et coll., 1988

; O’Connor et coll., 1989

; Jolliffe et coll., 2002

; Taylor et coll., 2004

; Karmisholt et Gotzsche, 2005

). C’est cette démonstration d’efficacité qui a d’ailleurs été à l’origine du développement important de la réadaptation cardiaque à partir du début des années 1990.
Chez l’insuffisant cardiaque chronique, l’activité physique, longtemps contre-indiquée, est désormais préconisée comme faisant partie de la prise en charge conventionnelle des insuffisances cardiaques chroniques stables, correspondant aux stades 2 et 3 de la classification de la
New York Heart Association. L’impact sur la mortalité a été montré par une revue systématique de la littérature (Lloyd-Williams et coll., 2002

) et confirmé de façon récente par une méta-analyse (Piepoli et coll., 2004

).
Effets physiopathologiques
Les effets démontrés de l’activité physique sont multiples, recoupant fortement ceux déjà exposés au cours des prises en charge en prévention primaire. Ils expliquent au moins partiellement l’impact sur la mortalité.
Capacités physiques
Il existe chez les patients coronariens une incapacité d’effort dont l’origine est multiple. C’est l’altération du métabolisme oxydatif musculaire qui domine dans cette intolérance à l’effort. La spectroscopie en résonance magnétique nucléaire au phosphore 31 a permis d’en démontrer les conséquences : une acidose prématurée associée à une déplétion en phosphocréatine au cours de l’effort et un temps de re-synthèse anormalement long de cette phosphocréatine à la phase de récupération (Cottin et coll., 1996

). Ce déconditionnement à l’effort est souvent aggravé par la sédentarité, facteur de risque majeur des maladies cardiovasculaires (Lee IM et coll., 2003

). Il existe une diminution du volume sanguin, du remplissage ventriculaire, du volume d’éjection systolique, du retour veineux, du réseau capillaire musculaire et de la perfusion musculaire (Convertino, 1997

). Ces anomalies, combinées chez les patients coronariens, conduisent à une diminution des capacités aérobies et de l’endurance musculaire alors que la force musculaire maximale reste longtemps conservée (Gayda et coll., 2003

). Chez le patient coronarien avec insuffisance cardiaque, la dégradation du métabolisme oxydatif est particulièrement marquée (Mancini et coll., 1992

).
L’entraînement physique permet une augmentation en moyenne de 20 % des capacités aérobies maximales par un impact prédominant sur le métabolisme oxydatif musculaire : augmentation des performances oxydatives enzymatiques et de la densité capillaire au niveau des fibres musculaires striées chez les patients coronariens (Torres et coll., 1990

; Ades et coll., 1996

), avec un impact similaire démontré depuis longtemps au cours de l’artériopathie oblitérante des membres inférieurs (Holm et coll., 1973

).
Au cours de l’insuffisance cardiaque chronique, l’activité physique entraîne une amélioration des capacités oxydatives musculaires avec une augmentation moyenne de 20,5 % du pic de VO
2 (Pina et coll., 2003

). Une méta-analyse récente a retrouvé une augmentation moyenne de 2,16 ml/kg/min de ce pic de VO
2, associée à une amélioration de 15,1 watts de la puissance et de 2,38 minutes de la durée du test d’effort après rééducation, les performances étant d’autant meilleures que le programme est intense et prolongé (Rees et coll., 2004

). La spectroscopie en résonance magnétique nucléaire au phosphore 31 met en évidence une réduction de la déplétion en phosphocréatine et de la synthèse d’ADP au cours de l’exercice et une accélération de la re-synthèse de la phosphocréatine lors de la phase de récupération (Adamopoulos et coll., 1993

). Ceci est concordant avec les constatations histochimiques : augmentation de la densité en mitochondries (Hambrecht et coll., 1997

), amélioration du matériel enzymatique oxydatif (Gielen et coll., 2002

).
L’enjeu est souvent important chez le patient insuffisant cardiaque, l’amélioration des capacités physiques permettant un recul de la dyspnée et de la fatigue (Belardinelli et coll., 1999

) et se traduisant en gain sur l’autonomie et la qualité de vie (Tyni-Lenne et coll., 1998

). Ces différents effets sont retrouvés chez les patients coronariens stables (Goodman et coll., 1999

).
Fonction cardiaque
L’activité physique augmente la perfusion myocardique (Cinquegrana et coll., 2002

) par amélioration de la fonction endothéliale coronaire (Hambrecht et coll., 2000a

). Ceci permet une amélioration du débit cardiaque d’effort chez le coronarien stable (Goodman et coll., 1999

; McConnell et coll., 2003

; Motohiro et coll., 2005

) et une augmentation de la fraction d’éjection chez l’insuffisant cardiaque (Hambrecht et coll., 2000b

) mais qui n’apparaît pas constante (McConnell et coll., 2003

).
Il est à noter que la mesure au repos de la fraction d’éjection ventriculaire, largement utilisée dans le diagnostic de l’insuffisance cardiaque, n’est pas corrélée à l’incapacité d’effort (Wilson et coll., 1995

). La mesure des échanges gazeux au cours de l’effort est un témoin plus valide et un facteur pronostique fort (Mancini, 1995

). Utilisée dans la classification de Weber pour le diagnostic de gravité de l’insuffisance cardiaque, elle ne permet cependant pas de distinguer la composante centrale (débit cardiaque) et périphérique (différence artério-veineuse en oxygène) de la chaîne du transport et de l’utilisation de l’oxygène (Weber et Janicki, 1985

).
La tolérance myocardique à l’effort, avec recul du seuil ischémique, est meilleure chez les coronariens présentant un angor stable après réentraînement à l’effort (Ehsani et coll., 1982

), du fait en particulier d’une diminution du produit de la fréquence cardiaque par la pression systolique, à niveau d’effort égal (Clausen, 1976

).
Dysfonction endothéliale
Elle est à l’origine d’une dégradation de l’adaptation microcirculatoire au cours des maladies cardiovasculaires. L’altération de la vasodilatation NOdépendante vient limiter d’autant la tolérance à l’effort (Rush et coll., 2005

). La conjonction de l’atteinte musculaire métabolique et des troubles de la perfusion musculaire au cours de l’insuffisance cardiaque chronique prédomine sur l’insuffisance de débit cardiaque dans la pathogénie de la désadaptation à l’effort (Zeli et coll., 1986

; Wilson et coll., 1993

).
L’entraînement diminue les résistances artérielles périphériques par réduction de la dysfonction endothéliale avec meilleure perfusion musculaire (Gokce et coll., 2002

). La réactivation de la vasodilatation NO-dépendante participe à l’amélioration des performances aérobies chez les patients coronariens (Brendle et coll., 2001

) ainsi qu’au cours de l’insuffisance cardiaque chronique (Hambrecht et coll., 1998

).
Cet effet de l’exercice sur la cellule endothéliale dépasse probablement le seul aspect de l’amélioration de la vasomotion pour avoir un réel effet d’athéroprotection (Hambrecht et coll., 2000a

) passant en particulier par la modification des contraintes pariétales (Malek et coll., 1999

).
Perturbations neuro-hormonales
La stimulation des systèmes nerveux sympathique, rénine-angiotensine-aldostérone et arginine-vasopressine, est de plus en plus incriminée dans la pathogénie des maladies cardiovasculaires, en particulier au cours de l’insuffisance cardiaque. Cette stimulation est à l’origine d’effets délétères multiples qui vont influer sur la tolérance à l’effort : vasoconstriction, augmentation des résistances périphériques, augmentation du volume sanguin, remodelage ventriculaire (Re, 2004

; Chatterjee, 2005

).
L’activité physique réduit l’hyperadrénergie avec rééquilibration de la balance neurovégétative (Lucini et coll., 2002

), associée à une augmentation de la variabilité sinusale (Wood et coll., 1998

) et à un effet anti-arythmique (Billman, 2002

) chez le coronarien sans dysfonction ventriculaire comme chez l’insuffisant cardiaque (Adamopoulos et coll., 1995

). De plus, le niveau de la variabilité sinusale est corrélé chez l’insuffisant cardiaque à l’activité physique évaluée par questionnaire (Garet et coll., 2005

). Cet effet anti-arythmique est probablement potentialisé par l’amélioration secondaire des défenses anti-oxydantes myocardiques à l’exercice (Hamilton et coll., 2004

).
Atteinte respiratoire
L’atteinte respiratoire est fréquente au cours de l’insuffisance cardiaque sévère, liée aux anomalies du rapport ventilation/perfusion (Wasserman et coll., 1997

) à l’origine d’une hyperventilation réflexe délétère par probable mise en jeu excessive des chémorécepteurs et ergorécepteurs musculaires (Scott et coll., 2000

). La dyspnée est le plus souvent corrélée à une augmentation de la pression artérielle pulmonaire (Mancini et coll., 2000

). L’activité physique augmente de plus de 20 % les capacités respiratoires chez l’insuffisant cardiaque (McConnell et coll., 2003

) avec amélioration de la diffusion alvéolo-capillaire (Guazzi et coll., 2004

), participant à la régression de la dyspnée.
Pathologies métaboliques associées aux maladies cardiovasculaires
L’entraînement physique présente aussi un intérêt du fait de son impact sur les pathologies métaboliques associées aux maladies cardiovasculaires (dyslipidémies, diabète, obésité) dont elles influencent l’évolution en tant que facteurs de risque.
Le diabète, pour lequel on a vu l’intérêt de l’activité physique en prévention primaire, apparaît comme un facteur de résistance au reconditionnement en ce qui concerne les effets métaboliques attendus sur les capacités aérobies chez le patient coronarien, ce d’autant que l’équilibre glycémique est mauvais (Vergès et coll., 2004

). L’insulino-résistance est probablement impliquée dans cette spécificité du coronarien diabétique car elle est corrélée au déconditionnement musculaire au cours de l’insuffisance cardiaque (Coats et Anker, 2000

).
Le reconditionnement à l’effort améliore la dyslipidémie chez le coronarien (Vergès et coll., 1998

; Durstine et coll., 2002

), et participe au contrôle de l’obésité (Savage et coll., 2003

).
Troubles de l’humeur
Les troubles de l’humeur, au premier rang desquels la dépression, représentent un facteur de risque cardiovasculaire fort, venant grever le pronostic après un événement cardiovasculaire majeur (Frasure-Smith et coll., 1995

). L’entraînement physique, tel que mis en œuvre au cours de la réadaptation permet la réduction de l’anxiété et de la dépression, notamment par une remise en confiance (Kugler et coll., 1994

; Brosse et coll., 2002

; Scholz et coll., 2006

) mais sans démonstration à ce jour d’un impact sur la morbi-mortalité (
Writing Committee for the Enrichd Investigators, 2003

).
Modalités pratiques de la prescription d’une activité physique en fonction des indications
L’activité physique va être indiquée non pas pour remplacer un traitement, mais plutôt en association avec lui pour obtenir un résultat optimal dans les situations au cours desquelles le reconditionnement à l’effort a été validé : post-infarctus du myocarde, post-pontages aorto-coronaires, post-angioplastie, angor stable, insuffisance cardiaque chronique, post-transplantation cardiaque, artériopathie des membres inférieurs. Le reconditionnement à l’effort est un moyen validé et encore sous-utilisé (Cottin et coll., 2004

) de débuter une modification de l’hygiène de vie vers une activité physique renforcée (Williams et coll., 2006

). Le challenge est de toute façon à son issue d’en pérenniser les effets par la poursuite d’une activité physique régulière. Les préconisations sont proches de celles faites en prévention primaire, avec cependant en préalable la nécessité d’une stratification du risque comportant notamment une évaluation de l’adaptation à l’effort afin de guider l’intensité des exercices et de les sécuriser au maximum (Pedersen et Saltin, 2006

).
Le tableau 16.II

présente un exemple de recommandations d’activité physique chez un patient coronarien sans insuffisance cardiaque.
Tableau 16.II Recommandations d’activité physique chez un patient coronarien sans insuffisance cardiaque
| |
Entraînement global aérobie
|
Renforcement musculaire contre résistance
|
|
Fréquence
|
3-5 jours/semaine
|
2-3 jours/semaine
|
|
Intensité
|
55-80 % de la fréquence cardiaque maximale ou 40-80 % de la VO2 max
|
1-3 séries de 8-15 contractions
|
|
Durée
|
20-60 min
| |
|
Modalités
|
Membres inférieurs : marche, jogging, course, montée des escaliers
Membres supérieurs : ergomètres
Combiné : natation, ergomètre combiné, aviron, ski de fond, gymnastique...
|
Membres inférieurs : fléchisseurs et extenseurs du genou, presse, adducteurs et abducteurs de hanche, fléchisseurs et extenseurs de cheville
Membres supérieurs1
: fléchisseurs et extenseurs de coude, abaisseurs et élévateurs de bras, anté- et rétropulseurs de bras...
Une dépense énergétique de 1 000 kcal/semaine est conseillée2
|
| |
1Shephard et Balady, 1999 ;2Giannuzzi et coll., 2003
;2Giannuzzi et coll., 2003
Coronopathies
Chez le coronarien, l’entraînement physique après angioplastie coronaire permet un gain significatif, par rapport aux patients n’ayant pas bénéficié de rééducation, de la consommation d’O
2 (26 %), la qualité de vie (27 %), la réduction des événements cardiovasculaires (11,9 %
versus 32,2 %) et du taux de ré-hospitalisations (18,6 %
versus 46 %) (Belardinelli et coll., 2001

).
De plus, l’entraînement physique s’avère supérieur à l’angioplastie dans l’angor stable sur le plan de la survie à un an (88 %
versus 70 %), du gain en VO
2 max (16 %
versus 2 %), de la morbidité cardiovasculaire et des coûts (Hambrecht et coll., 2004

).
Il existe aussi en prévention secondaire des maladies cardiovasculaires un seuil – évalué à 50 % des capacités maximales – à partir duquel le niveau d’activité physique va, par ses critères d’intensité d’exercices et de fréquence, agir positivement à la fois sur les capacités physiques et sur les facteurs de risque (Drygas et coll., 1988

; Khol et coll., 2001

; Duncan et coll., 2005

).
Dans une revue récente (Powers et coll., 2007

), les auteurs montrent que l’entraînement physique assure une cardioprotection contre les lésions cardiaques résultant des épisodes d’ischémie reperfusion observés lors de la maladie coronaire. En effet, il a été démontré qu’une activité physique d’endurance (60 min par jour, à 60-70 % du VO
2 max) apporte, durant les 18 jours suivant la session d’entraînement physique, une protection contre les dommages myocardiques induits par l’ischémie reperfusion.
Insuffisance cardiaque chronique
Au cours de l’insuffisance cardiaque chronique, l’entraînement physique est conseillé de façon systématique à condition qu’elle soit stabilisée et après évaluation de l’adaptation à l’effort (Corra et coll., 2005

). Compte tenu du déconditionnement à l’effort souvent important, le renforcement musculaire contre résistance, est privilégié par rapport à l’entraînement global conventionnel, du moins initialement, car mieux toléré. Secondairement, les exercices aérobies plus globaux sont associés. L’entraînement aérobie se situe à des niveaux variables, entre 40 et 80 % de la consommation d’O
2 maximum selon les auteurs (Belardinelli et coll. 1999

). Un entraînement en «
internal training », alternant 30 secondes d’effort à 50 % de la VO
2 max avec 60 secondes à niveau supérieur de 20 %, permet d’obtenir un résultat comparable en 3 semaines (Meyer et coll. 1996

). Une amélioration de l’adaptation à l’effort apparaît à partir de la 3
e semaine d’un entraînement aérobie, pour atteindre un plateau entre la 16
e et la 26
e semaine (Kavanagh et coll. 1996

).
L’électrostimulation musculaire peut être une alternative à l’entraînement physique chez l’insuffisant cardiaque chronique car elle entraîne une amélioration des capacités physiques liée à une augmentation des performances du métabolisme aérobie musculaire (Maillefert et coll., 1998

; Quittan et coll., 2001

). La force musculaire, la résistance à la fatigue et la qualité de vie sont meilleures après électrostimulation (Nuhr et coll., 2004

). Lorsque l’électrostimulation est comparée à un entraînement aérobie conventionnel, les effets sont identiques sur l’augmentation des capacités aérobies (VO
2 max et seuil ventilatoire), sur la fonction évaluée par des tests de marche (test de 6 minutes, test de marche rapide) et sur la force musculaire (Deley et coll., 2005

). Cette technique peut donc être proposée au cours de l’insuffisance cardiaque, lorsque du fait de sa gravité les exercices sont difficiles à mettre en œuvre, voire à risque, ou en cas d’incapacité associée rendant l’entraînement conventionnel impossible (hémiplégie par exemple). Compte tenu de sa bonne tolérance et de son coût limité, elle pourrait être utilisée à domicile à visée d’entretien.
Artériopathie des membres inférieurs
Une méta-analyse récente démontre qu’en cas de claudication des membres inférieurs, l’entraînement physique en endurance permet d’augmenter la distance de marche en moyenne de 150 % (Leng, 2004

), voire de 180 % (Gardner et Poehlman, 1995

). Cet impact est supérieur à celui d’une revascularisation (angioplastie, pontage), mais sans amélioration des pressions artérielles périphériques (Perkins, 1996

; Whyman et Ruckley, 1998

).
Cette amélioration est liée à l’augmentation des capacités aérobies musculaires (Hiatt, 1990

) et à la meilleure perfusion musculaire par réduction de la dysfonction endothéliale (Brendle, 2001

). Elle est supérieure lorsque l’entraînement est contrôlé et personnalisé, comparativement à une activité libre non encadrée (Bendermacher et coll., 2006

). Elle se traduit par une élévation du niveau d’activité et de la qualité de vie (Gardner et coll., 2001

). Un meilleur contrôle des facteurs de risque (Izquierdo-Porrera, 2000

), une amélioration hémorhéologique (Arosio, 2001

) et une réduction du syndrome inflammatoire (Tisi, 1997

) sont associés à cette augmentation des capacités physiques.
Au cours de l’artériopathie des membres inférieurs, une intensité d’entraînement élevée, à 80 % de la PMA, ne s’est pas révélée supérieure à une intensité modérée correspondant à 40 % de la PMA, sur le plan de l’augmentation de la distance de marche, des capacités aérobies et de la qualité de vie (Garner et coll., 2005

). En revanche, les programmes d’entraînement doivent être prolongés au moins durant 6 mois, et au cours de l’activité de marche les patients doivent aller pour certains jusqu’à l’apparition des douleurs de claudication (Gardner et Poehlman, 1995

). En effet, la question de la provocation des manifestations cliniques d’ischémie musculaire au cours de l’entraînement du claudicant artériel reste posée. Pour certains, la recherche du passage en acidose musculaire est justifiée par la stimulation ainsi induite de la production du facteur endothélial de croissance vasculaire (Pedersen et coll., 2006

), alors que pour d’autres il est préférable de limiter le stress oxydatif et inflammatoire lié à l’acidose en restant dans les limites de l’indolence (Mika et coll., 2005

), sans parvenir à une ischémie d’effort (Rexroth et coll, 1989

).
L’impact sur la mortalité n’avait pas été à ce jour évalué. Cependant, un travail récent vient pour la première fois de montrer que les patients les plus actifs dans la vie quotidienne présentaient une mortalité et une morbidité cardiovasculaires significativement plus faibles que les sujets peu actifs (Garg et coll., 2006

).
Accident vasculaire cérébral
Après un accident vasculaire cérébral à l’origine d’une hémiplégie, la pratique d’un entraînement physique représente une proposition thérapeutique récente. En effet, il existe chez ces patients un déconditionnement à l’effort qui peut aggraver l’incapacité (Bohannon et coll., 1992

) et qui peut être amélioré par l’entraînement (Meek et coll., 2003

; van Peppen et coll., 2004

).
Le renforcement musculaire peut faire partie d’un programme de rééducation, visant à une meilleure récupération fonctionnelle en luttant contre la perte de force musculaire (Bourbonnais et Vanden Noven, 1989

). Ce reconditionnement peut être dynamique contre résistance (Teixeira-Salmela et coll., 1999

) ou bien isocinétique (Sharp et Brouwer, 1997

). L’amélioration induite des capacités semble se maintenir à 1 an d’autant plus s’il s’agit d’un programme d’entraînement développé en centre de rééducation plutôt qu’à domicile (Olney et coll., 2006

).
Lorsque cet entraînement est fondé uniquement sur un renforcement intensif contre résistance des membres inférieurs, il existe un gain de force significatif à la fois au niveau du membre inférieur paralysé et celui qui n’est pas atteint. Il existe une sensation d’amélioration fonctionnelle rapportée par les patients mais sans retentissement sur les capacités de marche, de montée d’escalier et de transferts (passage de la position assise à debout) (Ouelette et coll., 2004

).
Il est à noter qu’au stade de chronicité, il existe une amélioration spontanée de l’adaptation à l’effort mais qui ne s’accompagne pas d’une amélioration des capacités fonctionnelles (MacKay-Lyons et Makrides, 2004

).
Les travaux dans ce domaine sont encore insuffisants en nombre et en qualité et il n’existe pas actuellement de preuves suffisamment établies de l’efficacité du reconditionnement à l’effort dans la prise en charge après accident vasculaire cérébral (Saunders et coll., 2004

). Cependant, une méta-analyse récente met en évidence une amélioration de la vitesse et de la durée de marche associée à l’augmentation du VO
2 max secondaire à un entraînement aérobie (Pang et coll., 2006

).
La rééducation sur tapis roulant avec suspension par un harnais de soutien est une technique de plus en plus souvent proposée chez les patients hémiplégiques. Elle cherche à activer l’automatisme de la marche et n’a pas un objectif prioritaire de reconditionnement à l’effort. Elle a été évaluée par méta-analyse : aucun effet significatif supplémentaire n’a été démontré sur le plan de la récupération fonctionnelle (Moseley et coll., 2005

), mais le manque d’études multicentriques menées sur des populations suffisamment homogènes de patients doit faire relativiser ces données.
L’impact de l’activité physique sur la mortalité après accident vasculaire cérébral n’a pas à ce jour été étudié.
Critères de sexe et d’âge
L’âge et le sexe sont des facteurs forts qui conditionnent le niveau d’activité physique après un événement cardiovasculaire important, tel qu’un syndrome coronarien aigu. Les sujets âgés sont en effet moins actifs avec de plus fréquentes incapacités motrices (Ades, 1999

). Les femmes ont également un niveau d’activité inférieur (King, 2001

). L’anxiété et l’inconfort psychologique sont également des éléments défavorables (Yates et coll., 2003

).
Lorsque l’on évalue le profil des patients porteurs de maladies cardiovasculaires et ayant bénéficié d’un reconditionnement à l’effort, on constate que les femmes et les sujets âgés sont relativement exclus des programmes de rééducation. Ainsi en France, dans une étude multicentrique ayant analysé les suites de syndrome coronarien aigu, sur les 22 % de patients ayant été adressés à un centre de rééducation, la majorité était des hommes (82 %
versus 68 % de femmes), âgés de moins de 65 ans (Cottin et coll., 2004

). Pourtant, l’efficacité de l’entraînement physique est démontrée chez le sujet âgé (Lavie et Milani, 1995a

) comme chez la femme (Lavie et coll., 1995b

). Par ailleurs, les complications ne sont pas plus fréquentes chez les sujets âgés et ce sont eux qui présentent le déconditionnement préalable le plus important (Fletcher et coll., 1994

). De plus, l’impact sur la mortalité reste significatif chez le sujet âgé (Wannamethee et coll., 2000

).
Adhésion à un programme d’augmentation de l’activité physique au cours des maladies cardiovasculaires
Nos connaissances sont insuffisantes en ce qui concerne les critères d’adhésion. Cependant, une étude randomisée a montré que les patients présentant les facteurs de risque les plus importants (hypercholestérolémie, surcharge pondérale, intoxication tabagique, dépression) étaient les moins motivés dans la poursuite d’un programme d’activité physique (Dorn et coll., 2001

). Dans les suites de réadaptation cardiaque, le maintien d’une activité physique régulière semble meilleur si des techniques d’anticipation aux difficultés rencontrées («
coping ») sont mises en place (Sniehotta et coll., 2006

).
Au total, on retrouve au cours des maladies cardiovasculaires, comme en prévention primaire, des effets multiples de l’activité physique incluant des effets à la fois anti-thrombotiques, anti-arythmiques, anti-ischémiques et anti-athéromateux. Concernant la stabilisation, voire la régression de la plaque d’athérome, les preuves expérimentales de l’activité physique sont encore insuffisantes, car l’action de l’activité physique n’a pas été clairement isolée du contrôle des autres facteurs de risque (Niebauer et coll., 1997

). Quoiqu’il en soit, l’activité physique doit être désormais envisagée comme une thérapeutique à part entière au cours des maladies cardiovasculaires, sa prescription devant tenir compte des risques éventuels (Shephard et Balady, 1999

; Pedersen et Saltin, 2006

).
Risques cardiovasculaires liés à l’activité physique
Des effets délétères liés à l’activité physique peuvent survenir essentiellement dans deux circonstances : soit il existe une maladie cardiovasculaire connue et une complication au niveau d’une plaque athéromateuse est l’éventualité la plus probable, soit un événement majeur survient de façon inaugurale, le plus souvent au cours de l’activité sportive, et les possibilités diagnostiques sont alors diverses.
Risques liés à l’activité physique au cours des maladies cardiovasculaires
Les risques cardiovasculaires potentiels sont surtout liés à des efforts intenses, inappropriés à la situation du sujet (Siscovick et coll., 1984

) et à l’origine de complications souvent liées au caractère instable et vulnérable d’une plaque d’athérome, avec conjonction de facteurs thrombotiques et vasoconstricteurs (Muller, 1999

). Ces phénomènes peuvent conduire à une rupture de plaque d’athérome avec constitution d’un thrombus à l’origine d’un infarctus du myocarde (Willich et coll., 1993

), avec risque de mort subite (Burke et coll., 1999

; Albert et coll., 2000

). Le caractère instable de la plaque d’athérome apparaît comme essentiel dans la survenue d’un thrombus coronaire, plus que le caractère serré d’une sténose. En effet, ces lésions coronaires sévères ne sont pas les plus fréquemment retrouvées après nécrose myocardique chez le sujet sportif et c’est le caractère vulnérable de la plaque qui domine (Ciampricotti et coll., 1994

). Ceci complique l’évaluation du risque réel lié à l’activité physique chez le sportif vétéran qui présente souvent des lésions coronaires calcifiées non serrées, dépistées par les techniques récentes d’imagerie non invasive, telles que le scanner multi-barrettes. Ainsi, de telles anomalies sont retrouvées chez 41 % des hommes et 13 % des femmes entre 40 et 49 ans dans la population générale (Cheng et coll., 2003

). Ces techniques permettent l’établissement de scores qui pourront peut-être suppléer à l’avenir les carences actuelles dans le dépistage des sujets à risque (Church et coll., 2007

).
De façon à limiter ces risques, il faut de toute façon respecter les contre-indications à l’entraînement à l’effort que sont l’angor instable, l’insuffisance cardiaque décompensée, les troubles rythmiques ventriculaires complexes, l’hypertension artérielle non contrôlée, l’hypertension, l’hypertension artérielle pulmonaire (>60 mmHg), la présence de thrombus intra-cavitaire volumineux ou pédiculé, l’épanchement péricardique de moyenne à grande abondance, les antécédents récents de thrombophlébite avec ou sans embolie pulmonaire, les myocardiopathies obstructives sévères, le rétrécissement aortique serré et/ou symptomatique, toute affection inflammatoire et/ou infectieuse évolutive (Monpere et coll., 2002

).
La prudence est particulièrement de règle chez l’insuffisant cardiaque, au risque rythmique élevé. L’implantation de plus en plus fréquente de défibrillateurs représente un moyen de sécuriser la reprise d’activité (Davids et coll., 2005

), les incidents s’avérant rares au cours de la pratique du sport (Lampert et coll., 2006

). Un risque particulier pour ces patients est l’hypoperfusion cérébrale au cours de l’effort observée par le Doppler transcrânien (Hellstrom et coll., 1996

) et la spectroscopie infra-rouge (Koike et coll., 2004

), ces examens non invasifs pouvant représenter à l’avenir un moyen du dépistage au cours d’un test d’effort des patients les plus exposés.
Au cours de la réadaptation cardiaque, les accidents graves sont rares comme en attestent les registres des complications de la réadaptation cardiaque, ne relevant qu’un arrêt cardiaque (récupéré) pour 1,3 million d’heures d’entraînement (Meurin et Pavy, 2006

). Les contre-indications à l’entraînement physique adapté au cours des maladies cardiovasculaires doivent rester exceptionnelles, compte tenu des effets bénéfiques attendus.
En plus du risque cardiovasculaire, il existe également un risque de lésions musculo-squelettiques lié à l’activité physique, quand celle-ci est excessive (contractions contre résistance importante par exemple) ou dans le cas d’anomalies préalables (tendinopathie, arthrose par exemple). Il s’agit donc d’adapter l’activité physique aux capacités réelles des sujets et de dépister les pathologies susceptibles d’être aggravées. À ces conditions, les lésions s’avèrent rares, même chez les sujets âgés (Buchner et Coleman, 1994

). L’activité physique devient alors un moyen de prévenir les traumatismes notamment liés aux chutes (
Guideline for the prevention of falls in older persons, 2001

).
Ces considérations doivent conduire à une évaluation médicale préalable chez tout patient porteur d’une maladie cardiovasculaire et envisageant une activité physique (Thompson et coll., 2003

). Un test d’effort fera partie le plus souvent de ce bilan, cependant les modalités précises en seront appréciées au cas par cas.
Mort subite du sportif
Chez l’adulte, le décès survenant au cours ou à l’issue du sport est très majoritairement lié à une atteinte coronarienne athéromateuse et provoqué le plus souvent par un effort intense (Ragosta et coll., 1984

; Siscovick et coll., 1984

), tout particulièrement chez les sportifs âgés de plus de 35 ans (Weaver et coll., 1982

). Cependant, ce sont les sujets les plus sédentaires, effectuant un effort violent inhabituel qui sont les plus exposés (Giri et coll., 1999

).
Les critères prédictifs d’un tel événement provoqué par la pratique sportive sont :
• la fraction d’éjection échocardiographique inférieure à 50 % ;
• l’ischémie myocardique
4
Sous-décalage du segment ST de l’ECG (repolarisation ventriculaire)>1 mm sur deux dérivations
apparaissant à une faible puissance d’un test d’effort ;
• la dyspnée prématurée (équivalent d’angor) ou syncope au cours d’un test d’effort ;
• la tachyarythmie ventriculaire au repos et/ou au cours d’un test d’effort ;
• la sténose >70 % d’un important tronc coronaire (Hecht, 2001

).
Le risque de survenue d’un arrêt cardio-circulatoire doit être mis en balance avec le bénéfice attendu. Des études déjà anciennes ont en effet rapporté que l’activité physique avait une efficacité en prévention de la mort subite seulement si elle se situait à un niveau d’intensité élevé (Paffenberg et Hale, 1975

; Morris et coll., 1980

). Des travaux plus récents ont en revanche montré qu’une diminution significative (40 %) du risque de mort subite liée à une activité modérée mais régulière (30 à 60 minutes/jour) (Leon et coll., 1987

; Lemaitre et coll., 1999

; Whang et coll., 2006

).
La mort subite du sportif jeune est le plus souvent secondaire à une pathologie cardiaque avec une prédominance de la cardiomyopathie hypertrophique, devant les autres causes telles que les anomalies coronaires constitutionnelles et le rétrécissement aortique (Maron et coll., 1996

).
Les maladies cardiovasculaires génétiques posent un problème particulier, car elles peuvent devenir symptomatiques de façon inaugurale au cours d’un effort, avec des risques de syncope ou de mort subite chez des sujets jeunes (Maron, 2003

), essentiellement par troubles du rythme. Elles sont responsables d’au moins 40 % des morts subites chez les jeunes sportifs (Maron et coll., 1996

).
Il s’agit de :
• la cardiomyopathie hypertrophique ;
• la dysplasie arythmogène du ventricule droit ;
• les anomalies des canaux ioniques, tels que le syndrome du QT long et le syndrome de Brugada ;
• tout particulièrement la tachycardie ventriculaire polymorphe catécholergique ;
• le syndrome de Marfan qui, au-delà des problèmes valvulaires et aortiques, peut être à l’origine de troubles du rythme.
L’exercice intense a des effets délétères au cours de ces affections, par la conjonction de nombreux facteurs : stress, hyperadrénergie, modifications hémodynamiques, modifications environnementales (température, pression, humidité...). L’exercice est à l’origine d’une aggravation de l’affection et de la libération de substrats arythmogènes. Ceci a été montré au cours de la cardiomyopathie hypertrophique, avec involution fibreuse du myocarde aggravant l’instabilité électrique (Basso et coll., 2000

). Chez les sujets porteurs d’une dysplasie arythmogène du ventricule droit, un exercice important et prolongé peut entraîner une hyperpression ventriculaire droite avec augmentation du volume du ventricule et accélération de la dégénérescence adipeuse pariétale (Corrado et coll., 1997

). Au cours du syndrome de Marfan, c’est l’augmentation de la pression sanguine dans l’aorte, associée à l’effort intense, qui est incriminée dans l’aggravation de l’anévrysme (Pyeritz, 2000

).
La suspicion d’un tel diagnostic impose un bilan en milieu spécialisé et conduit, en cas de confirmation, à l’interdiction de participation aux compétitions sportives (Maron et Mitchell, 1994

). Le dépistage systématique des cardiopathies à risque chez les athlètes s’est en effet montré efficace dans la prévention de la mort subite avec notamment, au cours d’une étude menée sur 10 ans en Italie, une réduction de 89 % du nombre de décès par l’interdiction de la compétition chez 2 % des sportifs chez lesquels avait été dépistée une cardiomyopathie (Corrado et coll., 2006

). Cependant, ces jeunes patients peuvent vouloir bénéficier des effets, déjà décrits, d’une activité physique adaptée, au moins dans sa dimension psychologique. L’objectif prioritaire est, par l’association de l’adaptation du mode de vie et des différents moyens thérapeutiques (anti-arythmiques, défibrillateur implantable...), de réduire au maximum le risque de troubles du rythme graves (tachycardie et fibrillation ventriculaire). Cependant, compte tenu de la grande variabilité dans l’expression phénotypique et génotypique de ces affections, il s’avère très délicat de formuler des recommandations générales. Des recommandations personnalisées ont donc été proposées, fondées sur un réel dialogue entre le patient et le praticien (Maron et coll., 2004

; Heidbuchel et coll., 2006

). Dans cette communication avec le patient, l’accent doit être mis sur l’intérêt de l’activité physique de loisir par opposition à la compétition. Certains sports de loisir peuvent induire un réel effet de compétition entre les participants en conduisant à un excès de sollicitation cardiovasculaire. C’est par exemple le cas des sports collectifs tels que le foot, le rugby, le basket, le handball, le volley, mais ce peut être le cas aussi du squash, du tennis et du badminton. Ils devront être le plus souvent déconseillés.
Le tableau 16.III

classe les activités sportives en fonction de leur niveau d’intensité et donne les recommandations de pratiques pour les différentes maladies cardiovasculaires génétiques (Maron et coll., 2004

).
Tableau 16.III Activités sportives en fonction de leur intensité et recommandations de pratiques dans le cas de maladies cardiovasculaires génétiques (d’après Maron et coll., 2004 )
)
|
Intensité de l’effort
|
Cardiomyopathie hypertrophique
|
Syndrome du QT Long
|
Syndrome de Marfan
|
Dysplasie arythmogène du ventricule droit
|
Syndrome de Brugada
|
|
Importante
| | | | | |
|
Basket
|
0
|
0
|
2
|
1
|
2
|
|
Musculation
|
1
|
1
|
0
|
1
|
1
|
|
Hockey sur glace
|
0
|
0
|
1
|
0
|
0
|
|
Squash
|
0
|
2
|
2
|
0
|
2
|
|
Escalade
|
1
|
1
|
1
|
1
|
1
|
|
Course rapide
|
0
|
0
|
2
|
0
|
2
|
|
Ski de descente
|
2
|
2
|
2
|
1
|
1
|
|
Ski de fond
|
2
|
3
|
2
|
1
|
4
|
|
Football
|
0
|
0
|
2
|
0
|
2
|
|
Tennis (simple)
|
0
|
0
|
3
|
0
|
2
|
|
Planche à voile
|
1
|
0
|
1
|
1
|
1
|
|
Moyenne
| | | | | |
|
Base-ball
|
2
|
2
|
2
|
2
|
4
|
|
Vélo
|
4
|
4
|
3
|
2
|
5
|
|
Randonnée légère
|
4
|
5
|
5
|
2
|
4
|
|
Motocyclisme
|
3
|
1
|
2
|
2
|
2
|
|
Jogging
|
3
|
3
|
3
|
2
|
5
|
|
Voile
|
3
|
3
|
2
|
2
|
4
|
|
Surf
|
2
|
0
|
1
|
1
|
1
|
|
Natation
|
5
|
0
|
3
|
3
|
4
|
|
Tennis (double)
|
4
|
4
|
4
|
3
|
4
|
|
Tapis roulant/ergocycle
|
5
|
5
|
4
|
3
|
5
|
|
Poids légers
|
1
|
1
|
0
|
1
|
1
|
|
Randonnée
|
3
|
3
|
3
|
2
|
4
|
|
Légère
| | | | | |
|
Bowling
|
5
|
5
|
5
|
4
|
5
|
|
Golf
|
5
|
5
|
5
|
4
|
5
|
|
Équitation
|
3
|
3
|
3
|
3
|
3
|
|
Plongée
|
0
|
0
|
0
|
0
|
0
|
|
Patinage
|
5
|
5
|
5
|
4
|
5
|
|
Nage avec tuba
|
5
|
0
|
5
|
4
|
4
|
|
Marche rapide
|
5
|
5
|
5
|
5
|
5
|
|
Pour chaque pathologie et chaque activité est affecté un score de 0 à 5 : 0 à 1 : activité déconseillée ; 2 à 3 : nécessité d’une évaluation individuelle avant la pratique ; 4 à 5 : activité probablement permise
|
Le tableau 16.III

ne représente qu’un élément d’orientation générale qui ne tient pas compte des différents niveaux d’intensité de chaque activité, des conditions psychologiques et environnementales de chaque situation, des effets des traitements et des spécificités pathologiques de chaque sujet. Il faut donc chaque fois évaluer le rapport bénéfice/risque.
Ces recommandations ne s’appliquent pas aux patients ayant déjà présenté des syncopes, ayant bénéficié d’un traitement chirurgical (myomectomie au cours de la cardiomyopathie hypertrophique, reconstruction de la racine aortique au cours du syndrome de Marfan, transplantation cardiaque), porteurs d’un défibrillateur implantable ou d’un pacemaker, ou à haut risque car ayant en particulier déjà présenté des troubles du rythme graves. Le bilan spécialisé doit permettre dans ces situations d’adapter ces recommandations.
À ces recommandations sont associés des conseils dans la pratique de l’exercice (Maron et coll., 2004

) :
• éviter les efforts « explosifs » à début et à fin brutale et privilégier les exercices à niveau stable et suffisamment prolongé ;
• éviter les conditions environnementales extrêmes sur le plan de la température ambiante (t>27°C ou t<0°C), de l’humidité ou de l’altitude ;
• adapter le niveau d’effort à ses capacités en terme d’intensité et de durée afin de prévenir la survenue des symptômes tels que la dyspnée et la fatigue physique ;
• éviter les situations de stress au cours de l’exercice (stress émotionnel, bruit...) pouvant provoquer une synthèse accrue de catécholamines, en particulier ne pas pratiquer des sports tels que le parapente ;
• éviter les efforts statiques (par exemple soulèvement de poids) entraînant l’équivalent d’une manœuvre de Vasalva et une gêne supplémentaire à l’éjection ventriculaire au cours de la cardiomyopathie hypertrophique ou une augmentation des contraintes pariétales aortiques au cours du syndrome de Marfan en cas d’anévrysme (Kinoshita et coll., 2000

) ;
• tenir compte du risque de malaise ou de syncope qui pour certains sports peut être source de traumatismes (ski de descente, plongée, escalade, équitation, motocyclisme...) ;
• éviter les stimulants de l’effort qui majorent l’effet de stress et peuvent avoir des effets arythmogènes (stéroïdes anabolisants, éphédrine, cocaïne...).
La pratique du sport en compétition chez un sujet porteur d’une maladie cardiovasculaire pose un problème particulier, compte tenu des risques de décès ou de progression de l’affection. En effet, la compétition est souvent à l’origine d’efforts importants et elle justifie un entraînement régulier. Il existe par ailleurs une pression psychologique liée aux enjeux sociaux et financiers que l’on ne retrouve pas au cours des activités de loisir. Compte tenu du manque de données scientifiques dans le domaine, un document de consensus a été établi par la Société européenne de cardiologie, abordant successivement les cardiopathies congénitales, les atteintes valvulaires, les cardiopathies génétiques, la cardiomyopathie dilatée, l’hypertension artérielle, les cardiopathies ischémiques, les troubles du rythme et de la conduction : un bilan cardiologique spécialisé est le plus souvent justifié afin d’établir un conseil personnalisé et prévenir la mort subite (Pelliccia et coll., 2005

).
En l’absence de pathologie patente, la survenue d’accidents graves est liée à des efforts intenses. Plusieurs facteurs peuvent être incriminés : anomalies thrombotiques artérielles aiguës (Cadroy et coll., 2002

) par augmentation de l’agrégation plaquettaire liée à l’action des catécholamines (Ikarugi et coll., 1999

), augmentation associée de la production de thrombine (Weiss et coll., 1998

), du fibrinogène et du facteur von Willebrand (Wang et coll., 1997

).
En conclusion, l’activité physique est un moyen puissant de prévenir les maladies cardiovasculaires ou bien d’en limiter les conséquences sur le plan de la morbidité et de la mortalité. Par des impacts multiples, elle augmente les capacités physiques et la qualité de vie. Elle représente un facteur d’insertion ou de réinsertion sociale et professionnelle. Les risques sont limités à condition de proscrire les efforts excessifs et de dépister préalablement les sujets les plus exposés par un bilan médical. Les connaissances devraient être améliorées à l’avenir sur la médiation moléculaire de ces effets, sur les modalités d’activité physique les plus appropriées en termes d’intensité et de type d’exercices et sur les moyens d’améliorer l’adhésion à des modifications de l’hygiène de vie concernant des populations de plus en plus nombreuses de patients.
Bibliographie
[1] adamopoulos s,
coats aj,
brunotte f,
arnolda l,
meyer t. Physical training improves skeletal muscle metabolism in patients with chronic heart failure.
J Am Coll Cardiol. 1993;
21:1101
-1106

[2] adamopoulos s,
ponikowski p,
cerquejani e,
piepoli m,
rosano g. Circadian pattern of heart rate variability in chronic heart failure. Effects of physical training.
Eur Heart J. 1995;
16:1380
-1386

[3] ades pa. Cardiac rehabilitation in older coronary patients.
J Am Geriatr Soc. 1999;
47:98
-105

[4] ades pa,
waldmann ml,
meyer wl,
brown ka,
poehlman et. Skeletal muscle and cardiovascular adaptations to exercise conditioning in older coronary patients.
Circulation. 1996;
94:323
-330

[5] albert cm,
mittleman ma,
chac cu,
lee im,
hennekens ch,
mason je. Triggering of sudden death from cardiac causes by vigorous exertion.
N Engl J Med. 2000;
343:1355
-1361

[6] albright a,
franz m,
hornsby g,
kriska a,
marrero d. American College of Sports Medicine position stand : exercise and type 2 diabetes.
Med Sci Sports Exerc. 2000;
32:1345
-1360

[7] alevizos a,
lentzas j,
kokkoris s,
mariolis a,
korantzopoulos p. Physical activity and stroke risk.
Int J Clin Pract. 2005;
59:922
-930

[8] amaral sl,
silveira np,
zorn tm,
michelini lc. Exercise training causes skeletal muscle veinular growth and alters hemodynamic responses in spontaneously hypertensive rats.
J Hypertens. 2001;
19:931
-940

[9]american college of sports medicine. Position statement on the recommended quantity and quality of exercise for developing and maintaining fitness in healthy adults.
Med Sci. 1978;
10: vii
-x

[10]american college of sports medicine position stand. The recommended quantity and quality of exercise for developing and maintaining cardiorespiratory and muscular fitness, and flexibility in healthy adults.
Med Sci Sports Exerc. 1998;
30:975
-991

[11]american diabetes association. Clinical practice recommendations 2002.
Diabetes Care. 2002;
25:S64
-S68

[12]american geriatrics society,
british geriatrics society,
american academy of orthopaedic surgeons panel on falls prevention. Guideline for the prevention of falls in older persons.
J Am Geriatr Soc. 2001;
49:664
-672

[13] an p,
perusse l,
rankinen t,
borecki ib,
gagnon j. Familial aggregation of exercise heart rate and blood pressure in response to 20 weeks of endurance training : the HERITAGE Family Study.
Int J Sports Med. 2003;
24:57
-62

[14] andersen ub,
olsen mh,
dige-petersen h,
ibsen h. Exercise blood pressure is related to insulin resitance in subjects with two hyoertensive parents.
Blood Pressure. 2003;
12:314
-318

[15] appelgate wb,
miller st,
elam jt. Nonpharmacologic intervention to reduce blood pressure in older patients with mild hypertension.
Arch Intern Med. 1992;
152:1162
-1166

[16] arosio e. Vascular adhesion molecule-1 and markers of platelet function before and after a treatment with iloprost or a supervised physical exercise program in patients with peripheral arterial disease.
Life Sci. 2001;
15:421
-433

[17] barefoot jc,
helms mj,
mark db,
blumenthal ja,
califf rr. Depression and long-term mortality risk in patients with coronary artery disease.
Am J Cardiol. 1996;
78:613
-617

[18] basso c,
thiene g,
corrado d,
buja g,
melacini p,
nava a. Hypertrophic cardiomyopathy and sudden death in the young: pathologic evidence of myocardial ischemia.
Hum Pathol. 2000;
31:988
-998

[19] bassuk ss,
manson je. Epidemiological evidence for the role of physical activity in reducing risk of type 2 diabetes and cardiovascular disease.
J Appl Physiol. 2005;
99:1193
-1204

[20] batty gd,
shipley mj,
marmot m,
smith gd. Physical activity and cause-specific mortality in men with type 2 diabetes/impaired glucose tolerance : evidence from the Whitehall study.
Diabet Med. 2002;
19:580
-588

[21] belardinelli r,
georgiou d,
cianci g,
purcaro a. Randomized, controlled trial of long-term moderate exercise training in chronic heart failure. Effects on functional capacity, quality of life, and clinical outcome.
Circulation. 1999;
99:1173
-1182

[22] belardinelli r,
paolini i,
cianci g,
piva r,
georgiou d,
purcaro a. Exercise training intervention after coronary angioplasty : the ETICA trial.
J Am Coll Cardiol. 2001;
37:1891
-1900

[23] bendermacher blw,
willigendael em,
teijink jaw,
prins mh. Supervised exercise therapy versus non-supervised exercise therapy for intermittent claudication.
Cochrane Database of Systematic Reviews. 2006;
:Issue 2. Art. No.: CD005263.pub2. D01: 10.1002/14651858. CD005263.pub2
-

[24] berlin ja,
colditz ga. A meta-analysis of physical activity in the prevention of coronary heart disease.
Am J Epidemiol. 1990;
132:612
-628

[25] berry kl,
cameron jd,
dart am,
dewar em,
gatzka cd. Large-artery stiffness contributes to the grater prevalence of systolic hypertension in elderly women.
J Am Geriatr Soc. 2004;
52:368
-373

[26] billman ge. Aerobic exercise conditioning: a nonpharmacological antiarrhytmic intervention.
J Appl Physiol. 2002;
92:446
-454

[27] bjaras g,
harberg lk,
sydhoff j,
ostenson cg. Walking campaign: a model for developing participation in physical activity ? Experiences from three campaign perods of the Stockolm Diabetes Prevention Program (SDPP).
Patient Educ Couns. 2001;
42:9
-14

[28] blair sn,
jackson as. Physical fitness and activity as separate heart disease risk factors: a meta-analysis.
Med Sci Sports Exerc. 2001;
33:762
-764

[29] blair sn,
kohl hw,
paffenbarger rs,
clark dg,
cooper h. Physical fitness and all-cause mortality: a prospective study in health men and women.
JAMA. 1989;
262:2395
-2401

[30] bohannon rw,
walsh s. Nature, reliability, and predictive value of muscle performance measures in patients with hemiparesis following stroke.
Arch Phys Med Rehabil. 1992;
73:721
-725

[31] bond v,
millis rm,
adams rg,
oke lm,
enweze l,
blakely r. Attenuation of exaggerated exercise blood pressure response in African-American women by regular aerobic physical activity.
Etn Dis. 2005;
15:S5
-10-3

[32] boreham ca,
ferreira i,
twisk jw,
gallagher am,
savage mj,
murray lj. Cardiorespiratory fitness, physical activity, and arterial stiffness. The Northern Ireland Young Hearts Project.
Hypertension. 2004;
44:721
-726

[33] borg a. Psychophysical bases of perceived exertion.
Med Sci Sports Exerc. 1982;
14:377
-381

[34] boule ng,
haddad e,
kenny gp,
wells ga,
sigal rj. Effect of exercise on glycemic control and body mass in type 2 diabetes melitus. A meta-analysis of controlled clinical trials.
JAMA. 2001;
286:1218
-1227

[35] boule ng,
kenny gp,
haddad e,
wells ga,
sigal rj. Meta-analysis of the effect of structured exercise training on cardiorespiratory fitness in type 2 diabetes mellitus.
Diabetologia. 2003;
46:1071
-1081

[36] boule ng,
weisnagel sj,
lakka ta,
tremblay a,
bergman rn. Effects of exercise training on glucose homeostasis. The HERITAGE Family Study.
Diabetes Care. 2005;
28:108
-114

[37] bourbonnais d,
vanden noven s. Weakness in patients with hemiparesis.
Am J Occup Ther. 1989;
43:313
-319

[38] bourn dm,
mann ji,
mcskimming bj,
waldron ma,
wishart jd. Impaired glucose tolerance and NIDDM : does a lifestyle intervention program have an effect ?.
Diabetes Care. 1994;
17:1311
-1319

[39] brendle dc,
joseph lj,
corretti mc,
gardner aw,
katzel li. Effects of exercise rehabilitation on endothelial reactivity in older patients with peripheral arterial disease.
Am J Cardiol. 2001;
87:324
-329

[40] brosse al,
sheets es,
lett hs,
blumenthal ja. Exercise and the treatment of clinical depression in adults : recent findings and future directions.
Sports Med. 2002;
32:741
-760

[41] brown md,
dengel dr,
hogikyan rv,
supiano ma. Sympathetic activity and the heterogenous blood pressure response to exercise training in hypertensives.
J Appl Physiol. 2002;
92:1434
-1442

[42] buchner dm,
coleman ea. Exercise considerations in older adults : intensity, fall prevention and safety.
Phys Med Rehabil Clin N Am. 1994;
5:357
-375

[43] burchfiel cm,
sharp ds,
curb jd,
rodriguez bl,
hwang lj. Physical activity and incidence of diabetes: the Honolulu Heart Program.
Am J Epidemiol. 1995;
141:360
-368

[44] burke ap,
farb a,
malcom gt,
linag yh,
smialel je,
virmani r. Plaque rupture and sudden death related to exertion in men with coronary artery disease.
JAMA. 1999;
281:921
-926

[45] cadroy y,
pillard f,
sakariassen ks,
thalamas c,
boneu b,
rivière d. Strenuous but no moderate exercise increases the thrombotic tendency in healthy sedentary male volunteers.
J Appl Physiol. 2002;
93:829
-833

[46] cameron jd,
dart am. Exercise training increases total systemic arterial compliance in humans.
Am J Physiol. 1994;
266:693
-701

[47] castaneda c,
layne je,
munoz-orians l,
gordon pl,
walsmith j,
foldvari m. A randomized controlled trial of resistance exercise training to improve glycemic control in older adults with type 2 diabetes.
Diabetes Care. 2002;
25:2335
-2341

[48] chatterjee k. Neurohormonal activation in congestive heart failure and the role of vasopressin.
Am J Cardiol. 2005;
95:8
-13

[49] cheng yj,
church ts,
kimball te,
nichaman mz,
levine bd. Comparison of coronary artery calcium detected by electron beam tomography in patients with to those without symptomatic coronary heart disease.
Am J Cardiol. 2003;
92:498
-503

[50] cheung bmy,
lo jlf,
fong dyt,
chan my,
wong sh. Randomised controlled trial of quigong in the treatment of mild essential hypertension.
J Hum Hypertens. 2005;
19:697
-704

[51] chipkin sr,
klugh sa,
chasan-taber l. Exercise and diabetes.
Cardio Clin. 2001;
19:489
-505

[52] church ts,
lavie cj,
milani rv,
kirby gs. Improvements in blood rheology after cardiac rehabilitation and exercise training in patients with coronary heart disease.
Am Heart J. 2002a;
143:349
-355

[53] church ts,
barlow ce,
earnest cp,
kampert jb,
priest el,
blair sn. Association between cardiorespiratory fitness and C-reactive protein in men.
Arterioscler Thromb Vasc Biol. 2002b;
22:1869
-1876

[54] church ts,
cheng yg,
earnest cp,
barlow ce,
gibbons lw. Exercise capacity and body composition as predictors of mortality among men with diabetes.
Diabetes Care. 2004;
27:83
-88

[55] church ts,
levine bd,
mcguire dk,
lamonte mj,
fitzgerald sj. Coronary artery calcium score, risk factors, and incident coronary heart disease events.
Atherosclerosis. 2007;
190:224
-231. Epub 2006 Mar 15

[56] ciampricotti r,
deckers jw,
taverne r,
el gamal m,
relik-van wely l,
pool j. Characteristics of conditioned and sedentary men with acute coronary syndromes.
Am J Cardiol. 1994;
73:219
-222

[57] cinquegrana g,
spinelli l,
d’aniello l,
landi m,
d’aniello mt,
meccariello p. Exercise training improves diastolic perfusion time in patients with coronary artery disease.
Heart Dis. 2002;
4:13
-17

[58] clausen jp. Circulatory adjustments to dynamic exercise and effect of physical training in normal subjects and in patients with coronary disease.
Progr Cardiovasc Dis. 1976;
18:459
-495

[59] coats aj,
anker s. Insulin resistance in chronic heart failure.
J Cardiovasc Pharmacol. 2000;
35:9
-14

[60] conroy mb,
cook nr,
manson je,
buring je,
lee im. Past physical activity, current physical activity, and risk of coronary heart disease.
Med Sci Sports Exerc. 2005;
37:1251
-1256

[61] convertino va. Cardiovascular consequences of bed rest : effect on maximal oxygen uptake.
Med Sci Sports Exerc. 1997;
29:191
-196

[62] cornelissen va,
fagard rh. Effect of resistance training on resting blood pressure : a meta-analysis of randomized controlled trials.
J Hypertens. 2005;
23:251
-259

[63] corpeleijn e,
feskens ej,
jansen eh,
mensik m,
saris wh. Improvements in glucose tolerance and insulin sensitivity after lifestyle intervention are related to changes in serum fatty acid profile and desaturase activities: the SLIM study.
Diabetologia. 2006;
49:2392
-2401

[64] corra u,
giannuzzi p,
adamopoulos s,
bjornstad h,
bjarnason-weherhns b. Executive summary of the position paper of the working group on cardiac rehabilitation and exercise physiology of the European Society of Cardiology (ESC): core components of cardiac rehabilitation in chronic heart failure.
Eur J Cardiovasc Prev Rehabil. 2005;
12:321
-325

[65] corrado d,
basso c,
thiene g,
mckenna wj,
davies mj. Spectrum of clinicopathologic manifestations of arrhytmogenic right ventricular cardiomyopathy/dysplasia: a multicenter study.
J Am Coll Cardiol. 1997;
30:1512
-1520

[66] corrado d,
basso c,
pavei a,
michieli p,
schiavon m,
thiene g. Trends in sudden cardiovascular death in young competitive athletes after implementation of a preparticipation screening program.
JAMA. 2006;
296:1593
-1601

[67] cottin y,
walker p,
rouhier-marcer i,
cohen m,
louis p. Relationship between increased maximal oxygen consumption and modifications in skeletal muscle metabolism following rehabilitation after myocardial infarction.
J Cardiopulmonary Rehabil. 1996;
16:169
-174

[68] cottin y,
cambou jp,
casillas jm,
ferrieres j,
cantet c,
danchin n. Specific Profile and Referral Bias of Rehabilitated Patients after an Acute Coronary Syndrome.
J Cardiopulm Rehabil. 2004;
24:38
-44

[69] crouse sf,
o’brien bc,
grandjean pw,
lower c,
rohack jj,
green js. Effects of training and a single session of exercise on lipids and apolipoproteinss in hypercholesterolemic men.
J Appl Physiol. 1997;
83:2019
-2028

[70] cuff dj,
meneilly gs,
martin a,
ignaszewski a,
tildesley hd,
frohlich jj. Effective exercise modality to reduce insulin resistance in women with type 2 diabetes.
Diabetes Care. 2003;
26:2977
-2982

[71] davids js,
mcpherson ca,
earley c,
batsford wp,
lampert r. Benefits of cardiac rehabilitation in patients with implantable cardioverter-defibrillators : a patient survey.
Arch Phys Med Reahabil. 2005;
86:1924
-1928

[72] deley g,
kervio g,
vergès b,
hannequin a,
petitdant mf. Comparison of low-frequency electrical stimulation and conventional exercise training in patients with chronic heart failure.
Eur J Cardiovasc Prev Rehabil. 2005;
12:226
-233

[73] di loreto c,
fanelli c,
lucidi p,
murdolo g,
de cicco a. Make your diabetic patients walk: Long-term impact of different amounts of physical activity on type 2 diabetes.
Diabetes Care. 2005;
28:1295
-1302

[74] dimmeler s,
zeiher am. Exercise and cardiovascular health. Get active to ’AKTivate’ your endothelial nitric oxyde synthase.
Circulation. 2003;
107:3118
-3120

[75] dishman rk. Compliance/adherence in health related exercise.
Health Psychol. 1982;
1:237
-267

[76] dorn j,
naughton j,
imamura d,
trevisan m. Correlates of compliance in a randomized exercise trial in myocardial infarction patients.
Med Sci Sports Exerc. 2001;
33:1081
-1089

[77] drygas w,
jegier a,
kunski h. Study on threshold dose of physical activity in coronary heart disease prevention. Part I. Relationship between leisure time physical activity and coronary risk factors.
Int J Sports Med. 1988;
9:275
-278

[78] drygas w,
kostka t,
jegier a,
kunski h. Long-trem effects of different physical activity levels on coronary heart disease risk factors in middle-aged men.
Int J Sports Med. 2000;
21:235
-241

[79] duncan ge,
anton s,
sydeman sj,
newton rj jr,
corsica ja. Prescribing exercise at varied levels of intensity and frequency. A randomized trial.
Arch Intern Med. 2005;
165:2362
-2369

[80] dunstan dw,
daly rm,
owen n,
jolley d,
de courten m. High-intensity resistance training improves glycemic control in older patients with type 2 diabetes.
Diabetes Care. 2002;
25:1729
-1736

[81] durstine jl,
grandjean pw,
cox ca,
thompson pd. Lipids, lipoproteins, and exercise.
J Cardiopulm Rehabil. 2002;
22:385
-398

[82] ehsani aa,
martin wh,
heath gw,
coyle ef. Cardiac effects of prolonged and intense exercise training in patients with coronary artery disease.
Am J Cardiol. 1982;
50:246
-254

[83] ekelund lg,
haskell wl,
johson jl,
whaley fs,
criqui mh,
sheps ds. Physical fitness as a predictor of cardiovascular mortality in asymptomatic North American men. The Lipid Research clinics mortality follow-up study.
N Engl J Med. 1988;
319:1379
-1384

[84] eliasson m,
asplund k,
evrin pe. Regular leisure time physical activity predicts high activity of tissue plasminogen activator: the Northern Sweden MONICA Study.
Int J Epidemiol. 1996;
25:1182
-1188

[85] eriksson kf,
lindgarde fl. Prevention of type 2 (non-insulindependent) diabetes mellitus by diet and physical exercise.
Diabetologia. 1991;
34:891
-898

[86]european society of hypertension,
european society of cardiology guidelines committee. 2003 European Society of Hypertension – European Society of Cardiology guidelines for the management of arterial hypertension.
J Hypertens. 2003;
21:1011
-1053

[87] fagard rh. Physical activity in the prevention and treatment of hypertension in the obese.
Med Sci Sports Exerc. 1999;
31:624
-630

[88] fagard rh. Exercise characteristics and the blood pressure response to dynamic physical training.
Med Sci Sports Exerc. 2001;
33:484
-942

[89] fagard r. Exercise is good for your blood pressure : effects of endurance training and resistance training.
Clin Exp Pharmacol Physiol. 2006;
33:853
-856

[90] ferrier ke,
waddell tk,
gatzka d,
cameron jd,
dart am,
kingwell ba. Aerobic exercise training does not modify large-artery compliance in isolated systolic hypertension.
Hypertens. 2001;
38:222
-226

[91] fletcher bj,
dunbar sb,
felner jm,
jensen be,
almon l. Exercise testing and training in physically disabled men with clinical evidence of coronary disease.
Am J Cardiol. 1994;
73:170
-174

[92] fletcher g. How to implement physical activity in primary and secondary prevention. A statement for healthcare professionals from the task force on risk reduction, American Heart Association.
Circulation. 1997;
96:355
-357

[93] fletcher g,
blair sn,
blumenthal j,
caspersen c,
chaitman b. Statement on exercise. Benefits and recommendations for physical activity programs for all Americans. A statement for health professionals by the Commitee on Exercise and Cardiac Rehabilitation of the Council on Clinical Cardiology, American Heart Association.
Circulation. 1992;
86:340
-344

[94] ford es. Does exercise reduce inflammation ? Physical activity and C-reactive protein among U.S. adults.
Epidemiology. 2002;
13:561
-568

[95] ford es,
herman wh. Leisure-time physical activity patterns in the US diabetic population. Findings from the 1990 National Health Interview Survey – Health Promotion and Disease Prevention Supplements.
Diabetes Care. 1995;
18:27
-33

[96] frasson eim,
alfredsson ls,
de faire uh,
knutsson a,
westerholm pjm. Leisure time, occupational and household physical activity, and risk factors for cardiovascular disease in working men and women: the WOLF study.
Scand J Public Health. 2003;
31:324
-333

[97] frasure-smith n,
lesperance f,
talajic m. Depression and 18 month prognosis after myocardial infarction.
Circulation. 1995;
91:999
-1005

[98] fritz t,
wandell p,
aberg h,
engfeldt p. Walking for exercise-does three times per week influence risk factors in type 2 diabetes ?.
Diabetes Res Clin Pract. 2006;
71:21
-27

[99] fukai t,
siegfried mr,
ushio-fukai m,
cheng y,
kojda g,
harrison dg. Regulation of the vascular extracellular superoxyde dismutase by nitric oxyde ad exercise training.
J Clin Invest. 2000;
105:1631
-1639

[100] gardner aw,
poehlman et. Exercise rehabilitation programs for the treatment of claudication pain : a meta-analysis.
JAMA. 1995;
274:975
-980

[101] gardner aw,
katzel li,
sorkin jd,
bradham dd,
hochberg mc. Exercise rehabilitation improves functional outcomes and peripheral circulation in patients with intermittent claudication: a randomized controlled trial.
J Am Geriatr Soc. 2001;
49:755
-762

[102] garet m,
degache f,
pichot v,
duverney d,
costes f. Relationship between daily physical activity and ANS activity in patients with CHD.
Med Sci Sports Exerc. 2005;
37:1257
-1263

[103] garg pk,
tian l,
criqui mh,
liu k,
ferrucci l. Physical activity during daily life and mortality in patients with perpheral arterial disease.
Circulation. 2006;
18:242
-248

[104] garner aw,
montgomery ps,
flinn wr,
katzel li. The effect of exercise intensity on the response to exercise rehabilitation in patients with intermittent claudication.
J Vasc Surg. 2005;
42:702
-709

[105] gayda m,
merzouk a,
choquet d,
doutrellot pl,
ahmaidi s. Aerobic capacity and peripheral skeletal muscle function in coronary artery disease male patients.
Int J Sports Med. 2003;
24:258
-263

[106] geffken df,
cushman m,
burke gl,
polak jf,
sakkinen pa,
tracy rp. Association between physical activity and markers of inflammation in a healthy elderly population.
Am J Epidemiol. 2001;
153:242
-250

[107] giannuzzi p,
mezzani a,
saner h,
bjornstad h,
fioretti p. Physical activity for primary and secondary prevention. Position paper of the working group on cardiac rehabilitation and exercise physiology of the European society of cardiology.
Eur J Cardiovasc Prev Rehabil. 2003;
10:319
-327

[108] gielen s,
erbs s,
shuler g,
hambrecht r. Exercise training and endothelial dysfunction in coronary artery disease and chronic heart failure : from molecular biology to clinical benefits.
Minerva Cardioangiol. 2002;
50:95
-106

[109] giri s,
thompson pd,
kiernan fj,
clive j,
fram db. Clinical and angiographic characteristics of exertion-related acute myocardial infarction.
JAMA. 1999;
282:1731
-1736

[110] gokce n,
vita ja,
bader ds,
sherman dl,
hunter lm. Effect of exercise on upper and lower extremity endothelial function in patients with coronary artery disease.
Am J Cardiol. 2002;
15:127
-137

[111] golstein lb,
adams r,
becker k,
furberg cd,
gorelick pb. Primary prevention of ischemic stroke. A statement for healthcare professionals from the stroke council of the American Heart Association.
Circulation. 2001;
103:163
-82

[112] goodman jm,
pallandi dv,
reading jf,
plyley mj,
liu pp,
kavanagh t. Central and peripheral adaptations after 12 weeks of exercise training in post-coronary artery bypass surgery patients.
J Cardiopulmonary Rehabil. 1999;
19:144
-150

[113] goodyear lj,
kahn bb. Exercise, glucose transport, and insulin sensitivity.
Annu Rev Med. 1998;
49:235
-261

[114] green dj,
walsh jh,
maiorana a,
burke v,
taylor rr,
o’driscoll jg. Comparison of resistance and conduit vessel nitric oxide-mediated vascular function in vivo: effects of exercise training.
J Appl Physiol. 2004;
97:749
-755

[115] gregg ew,
beckles gl,
willimson df,
leveille sg,
langlois ja. Diabetes and physical disability among olders US adults.
Diabetes Care. 2000;
23:1272
-1277

[116] gregg ew,
gerzoff rb,
caspersen cj,
williamson df,
narayan km. Relationship of walking to mortality among US adults with diabetes.
Arch Intern Med. 2003;
163:1440
-1447

[117] grossman m,
messerli fh,
golbourt u. High blood pressure and diabetes mellitus : are all antihypertensive drugs created equal ?.
Arch Intern Med. 2000;
160:2447
-2452

[118] guazzi m,
reina g,
tumminello g,
guazzi md. Improvement of alveolar-capillary membrane diffusing capacity with exercise training in chronic heart failure.
J Appl Physiol. 2004;
97:1866
-1873

[119]guidelines subcommittee. World Health Organization-International Society of Hypertension Guidelines for the Management of Hypertension.
J Hypertens. 1999;
17:151
-183

[120] haapanen n,
miilunpalo s,
vuori i,
oja p,
pasanen m. Association of leisure time physical activity with the risk of coronary heart disease, hypertension and diabetes in middle-aged men and women.
Int J Epidemiol. 1997;
26:739
-747

[121] hack w,
kaste m,
bogousslavsky j,
brainin m,
chamorro a. European stroke initiative recommendations for stroke management- update.
Cerebrovasc Dis. 2003;
16:311
-337

[122] haffner sm. Obesity and the metabolic syndrome : the San Antonio Heart Study.
Br J Nutr. 2000;
83:S67
-S70

[123] hagberg jm,
park jj,
brown md. The role of exercise training in the treament of hypertension.
Sports Med. 2000;
30:193
-206

[124] halbert ja,
silagy ca,
finucane p,
withers rt,
hamdorf pa,
andrews gr. The effectiveness of exercise training in lowering blood pressure : a meta-analysis of randomised controlled trials of 4 weeks or longer.
J Hum Hypertens. 1997;
11:641
-649

[125] hambrecht r,
fiehn e,
yu j,
niebauer j,
weigl c. Effects of endurance training on mitochondrial ultrastructure and fiber type distribution in skeletal muscle of patients with stable chronic heart failure.
J Am Coll Cardiol. 1997;
29:1067
-1073

[126] hambrecht r,
fiehn e,
weigl c,
gielen s,
hamann c. Regular physical exercise corrects endothelial dysfunction and improves exercise capacity in patients with chronic heart failure.
Circulation. 1998;
98:2709
-2715

[127] hambrecht r,
wolf a,
gielen s,
linke a,
hofer j. Effect of exercise on coronary endothelial function in patients with coronary artery disease.
N Engl J Med. 2000a;
342:454
-460

[128] hambrecht r,
gielen s,
linke a,
fiehn e,
yu j. Effects of exercise training on left ventricular function and peripheral resistance in patients with chronic heart failure: a randomized trial.
JAMA. 2000b;
283:3095
-3101

[129] hambrecht r,
walther c,
mobius-winkler s,
gielen s,
linke a. Percutaneous coronary angioplasty compared with exercise training in patients with stable coronary artery disease. A randomized trial.
Circulation. 2004;
109:1371
-1378

[130] hamilton kl,
quindry jc,
french jp,
staib j,
hughes j. MnSOD antisense treatment and exercise-induced protection against arrhythmias.
Free Radic Biol Med. 2004;
37:1360
-1368

[131] heath gw,
gavin jr,
hinderliter jm,
hagberg jm,
bloomfield sa,
holloszy jo. Effects of exercise and lack of exercise on glucose tolerance and insuline sensitivity.
J Appl Physiol. 1983;
55:512
-517

[132] hecht hs. Recommendations for preparticipation screening and the assessment of cardiovascular disease in masters athletes.
Circulation. 2001;
104:e58

[133] heidbuchel h,
corrado d,
biffi a,
hoffmann e,
panhuysen-goedkoop n. Recommendations for participation in leisure-time physical activity and competitive sports of patients with arrhytmias and potentially arrhytmogenic conditions Part II : Ventricular arrhytmias, channelopathies and implantable defibrillators.
Eur J Cardiovasc Prev Rehabil. 2006;
13:676
-686

[134] hellstrom g,
magnusson g,
wahlgren ng,
gordon a,
sylven c,
saltin b. Physical activity may impair cerebral perfusion in patients with chronic heart failure.
Cardiol Elderly. 1996;
4:191
-194

[135] helmrich sp,
ragland dr,
leung rw,
paffenbarger rs jr. Physical activity and reduced occurence of non-insulin-dependent diabetes mellitus.
N Engl J Med. 1991;
325:147
-152

[136] hespel p,
lijnen r,
van hoof,
fagard r,
gossens w. Effects of physical endurance training on the plasma renin-angiotensin-aldostérone system in normal man.
J Endocrinol. 1988;
116:443
-449

[137] hiatt wr. Benefit of exercise conditionning for patients with peripheral arterial disease.
Circulation. 1990;
81:602
-609

[138] higashi y,
sasaki s,
sasaki n,
nakagawa k,
ueda t. Daily aerobic exercise improves reactive hyperemia in patients with essential hypertension.
Hypertens. 1999;
33:591
-597

[139] hill jo,
wyatt hr,
reed gw,
peters jc. Obesity and the environment : where do we go from here?.
Science. 2003;
299:853
-855

[140] holm j,
dahllof ag,
bjorntorp p,
schersten t. Enzyme studies in muscle of patients with intermittent claudication. Effect of training.
Scand J Clin Lab Invest. 1973;
31:201
-205

[141] houmard ja,
tanner cj,
slentz ca,
dusha bd,
mccarthney js,
kraus we. Effect of the volume and intensity of exercise training on insulin sensitivity.
J Appll Physiol. 2004;
96:101
-106

[142] howley et. Type of activity : resitance, aerobic and leisure versus occupational physical activity.
Med Sci Sports Exerc. 2001;
33:364
-369

[143] hu fb,
manson je. Walking: the best medicine for diabetes?.
Arch Intern Med. 2003;
163:1397
-1398

[144] hu fb,
sigal rj,
rich-edwards jw,
colditz ga,
solomon cg. Walking compared with vigorous physical activity and risk of type 2 diabetes in women: a prospective study.
JAMA. 1999;
282:1433
-1439

[145] hu fb,
stampfer mj,
colditz ga,
ascherio a,
rexrode km. Physical activity and risk of stroke in women.
JAMA. 2000;
283:2961
-2967

[146] hu fb,
stampfer mj,
solomon c,
liu s,
colditz ga. Physical activity and risk for cardiovascular events in diabetic women.
Ann Intern Med. 2001;
134:96
-105

[147] hu g,
jousilahti p,
barengo nc,
qiao q,
lakka ta,
tuomilehto j. Physical activity, cardiovascular risk factors, and mortality among Finnish adults with diabetes.
Diabetes Care. 2005;
28:799
-805

[148] ikarugi h,
taka t,
nakajima s,
noguchi t,
watanabe s. Nor-epinephrine, but not epinephrine, enhances platelet reactivity and coagulation after exercise in humans.
J Appl Physiol. 1999;
86:133
-138

[149] ishikawa-takata k,
ohta t,
tanaka h. How much exercise is required to reduce blood pressure in essential hypertensives : a dose-response study.
AJH. 2003;
16:629
-633

[150] izquierdo-porrera am. Effects of exercise rehabilitation on cardiovascular risk factors in older patients with peripheral arterial occlusive disease.
J Vasc Surg. 2000;
31:670
-677

[151] jolliffe ja,
rees k,
taylor rs,
thompson d,
oldridge n,
ebrahim s. Exercise-based rehabilitation for coronary heart disease.
In: , editors.
The Cochrane Library, issue 4, 2002.
Oxford:UK: Update Software;
.
p.
-

[152] jonker jt,
de laet c,
franco oh,
peeters a,
mackenbach j,
nusselder w. Physical activity and life expectancy with and without diabetes.
Diabetes Care. 2006;
29:38
-43

[153] kang j,
robertson rj,
hagberg jm. Effect of exercise intensity on glucose and insulin metabolism in obese individuals and obese NIDDM patients.
Diabetes Care. 1996;
19:341
-349

[154] karmisholt k,
gotzsche pc. Physical activity for secondary prevention of disease. Systematic review of randomised clinical trials.
Dan Med Bull. 2005;
52:90
-94

[155] kavanagh t,
myers mg,
baigrie rs,
mertens dj,
sawyer p,
shephard rj. Quality of life and cardiorespiratory function in chronic heart failure : effects of 12 months’ aerobic training.
Heart. 1996;
76:42
-49

[156] kelley de,
goodpaster bh. Effects of exercise on glucose homeostasis in type 2 diabetes mellitus.
Med Sci Sports Exerc. 2001;
33:S495
-S501

[157] kemi oj,
haram pm,
wisloff u,
ellingsen o. Aerobic fitness is associated with cardiomyocyte contractile capacity and endothelial function in exercise training and detraining.
Circulation. 2004;
109:2897
-2904

[158] ketelhut r,
losem cj,
messerli fh. Is a decrease in arterial pressure during long-term aerobic exercise caused by a fall in cardiac pump function ?.
Am Heart J. 1994;
127:567
-571

[159] ketelhut rg,
franz iw,
scholze j. Regular exercise as an effective approach in antihypertensive therapy.
Med Sci Sports Exerc. 2004;
36:4
-8

[160] king kb. Emotional and functional outcomes in women with coronary heart disease.
J Cardiovasc Nurs. 2001;
15:54
-70

[161] kingwell ba,
jennings gl,
dart am. Exercise training and basal endothelial nitric oxide production.
J Mol Cell Cardiol. 1995;
27:A 78

[162] kinoshita n,
mimura j,
obayashi c,
katsukawa f,
onishi s,
yamazaki h. Aortic root dilatation among young competitive athletes : echocardiographic screening of 1929 athletes between 15 and 34 years of age.
Am Heart J. 2000;
139:723
-728

[163] knowler wc barret-connor e,
fowler se,
hamman rf,
lachin jm. Reduction in the incidence of type 2 diabetes with lifestyle intervention or metformin.
N Engl J Med. 2002;
346:393
-403

[164] koenig w,
sund m,
doring a,
ernst e. Leisure-time physical activity but not work-related physical activity is associated with decreased plasma viscosity.
Circulation. 1997;
95:335
-341

[165]kohl hwiii. Physical activity and cardiovascular disease : evidence for dose reponse.
Med Sci Sports Exerc. 2001;
33:472
-483

[166] kohno k,
matsuoka h,
takenaka k,
miyake y,
okuda s. Depressor effect by exercise training is associated with amelioration of hyperinsulinemia and sympathetic overactivity.
Intern Med. 2000;
39:1013
-1019

[167] koike a,
hoshimoto m,
nagayama bs,
tajima a,
kubozono t. Cerebral oxygenation during exercise and exercise recovery in patients with idiopathic dilated cardiomyopathy.
Am J Cardiol. 2004;
94:821
-824

[168] kokkinos pf,
papademetriou v. Exercise and hypertension.
Coron Artery Dis. 2000;
11:99
-102

[169] kokkinos pf,
narayan p,
colleran ja,
pittaras a,
notargiacomo a. Effects of regular exercise on blood pressure and left ventricular hypertrophy in African-American men with severe hypertension.
N Engl J Med. 1995;
333:1462
-1467

[170] kraus we,
houmard ja,
dusha bd,
knetzger kj,
wharton mb. Effects of the amount and intensity of exercise on plasma lipoproteins.
N Engl J Med. 2002;
347:1483
-1492

[171] kriska a. Can a physically active lifestyle prevent type 2 diabetes ?.
Exerc Sport Sci Rev. 2003;
31:132
-137

[172] kugler j,
seelbach h,
krüskemper gm. Effects of rehabilitation exercise programmes on anxiety and depression in coronary patients: a meta-analysis.
Br J Clin Psychol. 1994;
33:401
-410

[173] kurl s,
laukkanen ja,
rauramaa r,
lakka ta,
sivenius j,
salonen jt. Cardiorespiratory fitness and the risk for stroke in men.
Arch Intern Med. 2003;
163:1682
-1688

[174] laaksonen de,
lindstrom j,
lakka ta,
eriksson jg,
niskanen l. Physical activity in the prevention of type 2 diabetes. The Finnish Diabetes Prevention Study.
Diabetes. 2005;
54:158
-165

[175] lakka ta,
salonen jt. Moderate to high intensity conditioning leisure time physical activity and high cardiorespiratory fitness are associated with reduced plasma fibrinogen in eastern Finnish men.
J Clin Epidemiol. 1993;
46:1119
-1127

[176] lakka ta,
venäläinen jm,
rauramaa r,
salonen r,
tuomilehto j,
salonen jt. Relation of leisure-time physical activity and cardiorespiratory fitness to the risk of acute myocardial infarction in men.
N Engl J Med. 1994;
330:1549
-1554

[177] lamonte mj,
blair sn,
church ts. Physical activity and diabetes prevention.
J Appl Physiol. 2005;
99:1205
-1213

[178] lampert r,
cannom d,
olshansky b. Safety of sports participation in patients with implantable cardioverter defibrillators : A Survey of Heart Rhythm Society Members.
J Cardiovasc Electrophysiol. 2006;
17:11
-15

[179] lavie cj,
milani rv. Effects of cardiac rehabilitation programs on exercise capacity, coronary risk factors, behavioral characteristics, and quality of life in a large elderly cohort.
Am J Cardiol. 1995a;
76:177
-179

[180] lavie cj,
milani rv. Effects of cardiac rehabilitation and exercise training on exercise capacity, coronary risk factors, behavorial characteristics, and quality of life in women.
Am J Cardiol. 1995b;
75:340
-343

[181] lee cd,
folsom ar,
blair sn. Physical activity and stroke risk. A meta-analysis.
Stroke. 2003;
34:2475
-2482

[182] lee im,
paffenbarger rs jr. Association of light, moderate and vigorous intensity physical activity with longevity: The Harvard Alumni Health Study.
Am J Epidemiol. 2000;
151:293
-299

[183] lee im,
paffenbarger rs,
hennekens ch. Physical activity, physical fitness and longevity.
Aging Clin Exp Res. 1997;
9:2
-11

[184] lee im,
rexrode k,
cook n,
manson je,
buring je. Physical activity and coronary heart disease in women : is “no pain, no gain” passé?.
JAMA. 2001;
285:1447
-1454

[185] lee im,
sesso hd,
oguma y,
paffenbarger rs jr. Relative intensity of physical activity and risk of coronary heart disease.
Circulation. 2003;
107:1110
-1116

[186] lee kw,
lip gy. Effects of lifestyle on hemostasis, fibrinolysis, and platelet reactivity : a systematic review.
Arch Intern Med. 2003;
163:2368
-2392

[187] lehmann r,
voka a,
niedermann k,
agosti k,
spina ga. Loss of abdominal fat and improvement of the cardiovascular risk profile by regular moderate exercise training in patients with NIDDM.
Diabetologia. 1995;
38:1313
-1319

[188] lemaitre rn,
siscovick ds,
raghunathan te,
veimann s,
arbogast p,
lin dy. Leisure-time physical activity and the risk of primary cardiac arrest.
Arch Intern Med. 1999;
159:686
-690

[189] leng gc. Exercise for intermittent claudication.
The Cochrane Library. 2004;
1:

[190] leon as,
sanchez oa. Meta-analysis of the effects of aerobic exercise training on blood lipids.
Circulation. 2001a;
104:414
-415

[191] leon as,
sanchez oa. Response of blood lipids to exercise training alone or combined with dietary intervention.
Med Sci Sports Exerc. 2001b;
33:502
-515

[192] leon as,
connett j,
jacobs dr,
rauramaa r. Leisure-time physical activity levels and risk of coronary heart disease and death: the Multiple Risk Factor Intervention Trial.
JAMA. 1987;
258:2388
-2395

[193] lindestrom e,
boysen g,
nyboe j. Lifestyle factors and risk of cerebrovascular disease in women : the Copenhagen City Heart Study.
Stroke. 1993;
24:1468
-1472

[194] lindstrom j,
ilanne-parikka p,
peltonen m,
aunola s,
eriksson jg. Sustained reduction in the incidence of type 2 diabetes by lifestyle intervention : follow-up of the Finnish Diabetes Prevention Study.
Lancet. 2006;
368:1673
-1679

[195] lloyd-williams f,
mair fs,
leitner m. Exercise training and heart failure : a systematic review of current evidence.
Br J Gen Pract. 2002;
52:47
-55

[196] loimaala a,
huikuri h,
oja p,
pasanen m,
vuori i. Controlled 5-mo aerobic training improves heart rate but not heart rate variability or baroreflex sensitivity.
J Appl Physiol. 2000;
80:1825
-1829

[197] lucini d,
milani rv,
costantino g,
lavie cj,
porta a,
pagani m. Effects of cardiac rehabilitation and exercise training on autonomic regulation in patients with coronary artery disease.
Am Heart J. 2002;
143:977
-983

[198] luke a,
kramer h,
adeyemo a,
forrester t,
wilks r. Relation between blood pressure and physical activity assessed with stable isotopes.
J Hum Hypertens. 2005;
19:127
-132

[199] lynch j,
helmrich sp,
lakka ta,
kaplan ga,
cohen rd. Moderately intense physical activities and high levels of cardiorespiratory fitness reduce the risk of non-insulin-dependent diabetes mellitus in middle-aged men.
Arch Intern Med. 1996;
156:1307
-1314

[200] mackay-lyons mj,
makrides l. Longitudinal changes in exercise capacity after stroke.
Arch Phys Med rehabil. 2004;
85:1608
-1612

[201] maillefert jf,
eicher jc,
walker p,
dulieu v,
rouhier-marcer i. Effects of low-frequency electrical stimulation of quadriceps and calf muscles in patients with chronic heart failure.
J Cardiopulm Rehabil. 1998;
18:277
-282

[202] maiorana a,
o’driscoll g,
cheetham c,
dembo l,
stanton k. The effect of combined aerobic and resistance exercise training on vascular function in type 2 diabetes.
J Am Coll Cardiol. 2001;
38:860
-866

[203] malek am,
alper sl,
izumo s. Hemodynamic shear stress and its role in atherosclerosis.
JAMA. 1999;
282:2035
-2042

[204] mancini d. Pulmonary factors limiting exercise capacity in patients with heart failure.
Prog Cardiovasc Dis. 1995;
56:347
-370

[205] mancini dm,
walter g,
reichek n,
lenkinski n,
mccully kk. Contribution of skeletal muscle atrophy to exercise intolerance and altered muscle metabolism in heart failure.
Circulation. 1992;
85:1364
-1373

[206] mancini d,
lejemtel t,
aaronson k. Peak VO2 : a simple yet enduring standard.
Circulation. 2000;
101:1080
-1082

[207] manson je,
rimm eb,
stampfer mj,
colditz ga,
willett wc. Physical activity and incidence of non-insulin-dependent diabetes mellitus in women.
Lancet. 1991;
338:774
-778

[208] manson je,
nathan dm,
krowlewski as,
stampfer mj,
willett wc,
hennekens ch. A prospective study of exercise and incidence of diabetes among US male physicians.
JAMA. 1993;
268:63
-67

[209] manson je,
stampfer mj,
willet wc. Physical activity and incidence of coronary heart disease and stroke in women.
Circulation. 1995;
91:5
-11

[210] manson je,
greenland p,
lacroix az,
stefanick ml,
mouton cp. Walking compared with vigorous exercise for the prevention of cardiovascular events in women.
N Engl J Med. 2002;
347:716
-725

[211] marcus bh,
albrecht ae,
king tk,
parisi af,
pinto bm. The efficacy of exercise as an aid for smoking cessation in women : a randomized controlled trial.
Arch Intern Med. 1999;
159:1229
-1234

[212] maron bj. Sudden death in young athletes.
N Engl J Med. 2003;
349:1064
-1075

[213] maron bj,
mitchell jh. 26th Bethseda Conference : recommendations for determining eligibility for competition in athletes with cardiovascular abnormalities.
J Am Coll Cardiol. 1994;
24:845
-899

[214] maron bj,
shirani j,
poliac lc,
mathenge r,
roberts wc,
mueller fo. Sudden death in young competitive athletes. Clinical, demographic, and pathological profiles.
JAMA. 1996;
276:199
-204

[215] maron bj,
chaitman br,
ackerman mj,
bayes de luna a,
corrado d. Recommendations for physical activity and recreational sports participation for young patients with genetic cardiovascular diseases.
Circulation. 2004;
109:2807
-2816

[216] matson-koffman dm,
brownstein jn,
neiner ja,
greaney ml. A site-specific literature review of policy and environmental interventions that promote physical activity and nutrition for cardiovascular health : what works ?.
Am J Health Promot. 2005;
19:167
-193

[217] matthews ce,
pate rr,
jackson ki,
ward ds,
macera ca. Exaggerated blood pressure response to dynamic exercise and risk of future hypertension.
J Clin Epidemiol. 1998;
51:29
-35

[218] mayer-davis ej,
d’agostino jr r,
karter aj,
haffner sm,
rewers mj. Intensity and amount of physical activity in relation to insulin sensitivity : the Insulin Resistance Atherosclerosis Study.
JAMA. 1998;
279:669
-674

[219] mcauley ka,
williams sm,
mann ji,
goulding a,
chisholm a. Intensive lifestyle changes are necessary to improve insulin sensitivity. A randomized controlled trial.
Diabetes Care. 2002;
25:445
-452

[220] mcconnell tr,
mandak js,
sykes js,
fesniak h,
dasgupta h. Exercise training for heart failure patients improves respiratory muscle endurance, exercise tolerance, breathlessness, and quality of life.
J Cardiopulm Rehabil. 2003;
23:10
-16

[221] mcgavock jm,
mandic s,
vonder muhll i,
lewanczuk rz,
quinney ha. Low cardiorespiratory fitness is associated with elevated C-reactive protein levels in women with type 2 diabetes.
Diabetes Care. 2004;
27:320
-325

[222] mcveigh ge,
brennan gm,
johnston gd,
mcdermott bj,
mcgrath lt. Impaired endothelium-dependent and independent vasodilatation in patient with type 2 (non-insulin-dependent) diabetes mellitus.
Diabetologia. 1992;
35:771
-776

[223] meek c,
pollock a,
potter j,
langhorne p. A systematic review of exercise trials post stroke.
Clin Rehabil. 2003;
17:6
-13

[224] meredith it,
jennings gl,
esler md,
dewar em,
bruce am,
fazio a. Time-course of the antihypertensive and autonomic effects of regular endurance exercise in human subjects.
J Hypertens. 1990;
8:859
-866

[225] meurin p,
pavy b. Benefits and risks of exercice training in coronary artery disease patients.
Ann Cardiol Angeiol. 2006;
55:171
-177

[226] meyer k,
schwaibold m,
westbrook s,
beneke r,
hajric r. Effects of short-term exercise training and activity restriction on functional capacity in patients with severe chronic congestive heart failure.
Am J Cardiol. 1996;
78:1017
-1022

[227] middlebrooke ar,
elston lm,
macleod km,
mawson dm,
ball ci. Six months of aerobic exercise does not improve microvascular function in type 2 diabetes mellitus.
Diabetologia. 2006;
49:2263
-2271

[228] mika p,
spodaryk k,
cencora a,
unnithan vb,
mika a. Experimental model of pain-free treadmill training in patients with claudication.
Am J Phys Med Rehabil. 2005;
84:756
-762

[229] miyachi m,
kawano h,
sugawara j,
takahashi k,
hayashi k. Unfavorable effects of resistance training on central arterial comliance : a randomized intervention study.
Circulation. 2004;
110:2858
-2863

[230] monpere c,
sellier p,
meurin p,
aeberhard p,
boiteux a. Recommandations de la Société Française de Cardiologie concernant la pratique de la réadaptation cardiovasculaire chez l’adulte.
Arch Mal Cœur Vaiss. 2002;
95:999
-1002

[231] montgomery he,
clarkson p,
nwose om,
mikailidis dp,
jagroop ia. The acute rise in plasma fibrinogen concentration with exercise is influenced by the G-453- A polymorphism of the β-fibrinogen gene.
Arterioscler Thromb Vasc Biol. 1996;
16:386
-391

[232] morris jn,
hardman ae. Walking for health.
Sports Med. 1997;
23:306
-332

[233] morris jn,
everitt mg,
pollard r,
chave sp,
semmence am. Vigorous exercise in leisure time: protection against coronary heart disease.
Lancet. 1980;
2:1207
-1210

[234] morris jn,
clayton dg,
everitt mg,
semmence am,
burgess eh. Exercise in leisure time: coronary attack and death rates.
Br Heart J. 1990;
63:325
-334

[235] moseley am,
stark a,
cameron id,
pollock a. Treadmill training and body weight support for walking after stroke.
The Cochrane Database of Systematic Reviews. 2005;
:Issue 4. Art. No.:CD002840.pub2. DOI: 10.1002/14651858.CD002840.pub2

[236] motohiro m,
yuasa f,
hattori t,
sumimoto t,
takeuchi m. Cardiovascular adaptations to exercise training after uncomplicated acute myocardial infarction.
Am J Phys Med Rehabil. 2005;
84:684
-691

[237] mourier a,
gautier jf,
de kerviler e,
bigard ax,
villette jm. Mobilization of visceral adipose tissue related to the improvement in insulin sensitivity in response to physical training in NIDDM : effects of branched-chain aminoacid supplements.
Diabetes Care. 1997;
20:385
-391

[238] muller je. Circadian variation in cardiovascular events.
Am J Hypertens. 1999;
12:35
-42

[239] mundal r,
kieldsen se,
sandvik l,
erikssen g,
thaulov e,
erikssen j. Exercise blood pressure predicts mortality from myocardial infarction.
Hypertension. 1996;
1:324
-329

[240] murphy m,
nevill a,
neville c,
biddle s,
hardman a. Accumulating brisk walking for fitness, cardiovascular risk, and psychoslogical health.
Med Sci Sports Exerc. 2002;
34:1468
-1474

[241] murtagh em,
boreham ca,
nevill a,
hare lg,
murphy mh. The effects of 60 minutes of brisk walking per week, accumulated in two different patterns, on cardiovascular risk.
Prev Med. 2005;
41:92
-97

[242] myers j,
prakash m,
froelicher v,
do d,
partington s,
atwood je. Exercise capacity and mortality among men referred for exercise testing.
N Engl J Med. 2002;
346:793
-801

[243] niebauer j,
hambrecht r,
velich t,
hauer k,
marburger c. Attenuated progression of coronary artery disease after 6 years of multifactorial risk intervention: role of physical exercise.
Circulation. 1997;
96:2534
-2541

[244]nih consensus conference. Physical activity and cardiovascular health.
JAMA. 1996;
276:241
-246

[245] noda h,
iso h,
toyoshima h,
date c,
yamamoto a. Walking and sports participation and mortality from coronary heart disease and stroke.
JACC. 2005;
46:1761
-1767

[246] nuhr mj,
pette d,
berger r,
quittan m,
crevenna r. Beneficial effects of chronic low-frequency stimulation of thigh muscles in patients with advanced chronic heart failure.
Eur Heart J. 2004;
25:136
-143

[247] o’connor g,
buring jf,
yusuf s,
goldhaber sz,
olmstead em. An overview of randomized trials of rehabilitation with exercise after myocardial infarction.
Circulation. 1989;
80:234
-244

[248] oguma y,
shinoda-tagawa t. Physical activity decreases cardiovascular disease risk in women. Review and meta-analysis.
Am J Prev Med. 2004;
26:407
-418

[249] oldridge n,
guyat gh,
fisher mf,
rimm aa. Cardiac rehabilitation after myocardial infarction. Combined experiences of randomized clinical trials.
JAMA. 1988;
260:945
-950

[250] olney sj,
nymark j,
brouwer b,
culham e,
day a,
heard j. A randomized controlled trial of supervised versus unsupervised exercise programs for ambulatory stroke survivors.
Stroke. 2006;
37:476
-481

[251] ouelette mm,
lebrasseur nk,
bean jf,
phillips e,
stein j. High-intensity resistance training improves muscle strength, self-reported fuction, and disability in long-term stroke survivors.
Stroke. 2004;
35:1404
-1409

[252] paffenberg rs,
hale we. Work activity and coronary heart mortality.
N Engl J Med. 1975;
292:545
-550

[253] paffenbarger rs,
lee im. Intensity of physical activity related to incidence of hypertension and all-cause mortality: an epidemiologic view.
Blood Press Monit. 1997;
2:115
-123

[254] paffenbarger rs,
wing al,
hyde r,
jung dl. Physical activity and incidence of hypertension in college alumni.
Am J Epidemiol. 1983;
117:247
-257

[255] paffenbarger rs,
hyde rt,
wing al,
hsieh c. Physical activity all-cause mortality, and longevity of college alumni.
N Engl J Med. 1986;
314:605
-613

[256] paffenbarger r,
hyde rt,
wing al,
lee im,
jung dl,
kampert jb. The association of changes in physical activity level and other lifestyle characteristics with mortality among men.
N Engl J Med. 1993;
328:538
-545

[257] paffenbarger rs jr,
lee im,
kampert jb. Physical activity in the prevention of non-insulin-dependent diabetes mellitus.
World Rev Nutr Diet. 1997;
82:210
-218

[258] pan xr,
li gw,
hu yh,
wang jx,
yang wy. Effects of diet and exercise in preventing NIDDM in people with impaired glucose tolerance: the Da Quing IGT and Diabetes Study.
Diabetes Care. 1997;
20:537
-544

[259] pang myc,
eng jj,
dawson as,
gylfadottir s. The use of aerobic exercise training in improving aerobic capacity in individual with stroke : a meta-analysis.
Clin Rehabil. 2006;
20:97
-111

[260] pate rr,
prat m,
blair sn,
haskell wl,
macera ca. Physical activity and public health. A recommendation from the Centers for Disease Control and Prevention and the American College of Sports Medicine.
JAMA. 1995;
273:402
-407

[261] pearson ta,
blair sn,
daniels sr,
eckel rh,
fair jm. American Heart Association Guidelines for primary prevention of cardiovascular diseases and stroke. update. Consensus panel guide to comprehensive risk reduction for adult patients without coronary or other atherosclerotic vascular diseases.
Circulation. 2002;
106:388
-391

[262] pedersen bk,
saltin b. Evidence for prescribing exercise as therapy in chronic disease.
Scand J Med Sci Sports. 2006;
16:5
-65

[263] shephard rj,
balady gj. Exercise as cardiovascular therapy.
Circulation. 1999;
99:963
-972

[264] pedersen bk,
saltin b. Evidence for prescribing exercise as therapy in chronic disease.
Scand J Med Sci Sports. 2006;
16:5
-65

[265] pelliccia a,
fagard rh,
bjornstad hh,
anastassakis a,
arbustini e. Recommendations for competitive sports participation in athletes with cardiovascular disease : a consensus document from the Study Group of Sports Cardiology of the Working Group of Cardiac Rehabilitation and Exercise Physiology and the Working Group of Myocardial and Pericardial Diseases of the European Society of Cardiology.
Eur Heart J. 2005;
26:1422
-1445

[266] pendey dk. Exaggerated blood pressure response to exercise predicts new-onset hypertension in women : Women Take Heart study, 1992-2001.
Am J Hypertens. 2003;
16:A261

[267] pennix bw,
beekman atf,
honig a,
deeg dl,
schoevers ra. Depression and cardiac mortality.
Arch Gen Psychiatry. 2001;
58:221
-227

[268] perkins jmt. Exercise training versus angioplasty for stable claudication; long and medium term results of a prospective randomised trial.
Eur J Vasc Endovasc Surg. 1996;
11:409
-413

[269] perseghin g,
price tb,
petersen kf,
roden m,
cline gw. Increased glucose transport-phosphorylation and muscle glycogen synthesis after exercise training in insulin-resistant subjects.
N Engl J Med. 1996;
335:1357
-1362

[270] pescatello ls. Exercise and hypertension : recent advances in exercise prescription.
Curr Hypertens Rep. 2005;
7:281
-286

[271] pescatello ls,
fargo ae,
leach cn jr,
scherzer hh. Short-term effect of dynamic exercise on arterial blood pressure.
Circulation. 1991;
83:1557
-1561

[272] pescatello ls,
franklin ba,
fagard r,
farquhar wb,
kelley ga,
ray ca. American College of Sports Medicine position stand: exercise and hypertension.
Med Sci Sports Exerc. 2004;
36:533
-553

[273] piepoli mf,
davos c,
francis dp,
coats aj. Exercise training meta-analysis of trials in patients with chronic heart failure (ExTraMATCH).
BMJ. 2004;
328:189

[274] pina il,
apstein cs,
balady gj,
belardinelli r,
chaitman br. Exercise and heart failure : a statement from the American Heart Association Committee on exercise, rehabilitation, and prevention.
Circulation. 2003;
107:1210
-1225

[275] pitsavos c,
panagiotakos db,
chrysohoou c,
kokkinos p,
menotti a,
singh s. Physical activity decreases the risk of stroke in middle-age men with left ventricular hypertrophy : 40-year follow-up (1961-2001) of the Seven Countries Study (the Corfu cohort).
J Hum Hypertens. 2004;
18:495
-501

[276] podolin da,
munger pa,
mazzeo rs. Plasma catecholamine and lactate response during graded exercise with varied glycogen conditions.
J Appl Physiol. 1991;
71:1427
-1433

[277] powell ke,
thompson pd,
caspersen cj,
kendrick js. Physical activity and the incidence of coronary heart disease.
Annu Rev Public Health. 1987;
8:253
-287

[278] powers sk,
murlasits z,
wu m,
kavazis an. Ischemia-reperfusion-induced cardiac injury : a brief review.
Med Sci Sports Exerc. 2007;
39:1529
-1536

[279] pyeritz re. The Marfan syndrome.
Annu Rev Med. 2000;
51:481
-510

[280] quittan m,
wiesinger gf,
sturm b,
puig s,
mayr w. Improvement of thigh muscles by neuromuscular electrical stimulation in patients with refractory heart failure: a single-blind, randomized, controlled trial.
Am J Phys Med Rehabil. 2001;
80:206 ; quiz 215-6, 224
-214

[281] ragosta m,
crabtree j,
sturner wq,
thompson pd. Death during recreational exercise in the state of Rhode Island.
Med Sci Sports Exerc. 1984;
16:339
-342

[282] rakobowchuk m,
mcgowan cl,
de groot pc. Effect of whole body resistance training on arterial comliance in youg men.
Exp Physiol. 2004;
90:645
-651

[283] rauramaa r,
halonen p,
vaisanen sb,
lakka ta,
schmidt-trucksass a. Effects of aerobic physical exercise on inflammation and atherosclerosis in men: the DNASCO study.
Ann Intern Med. 2004;
140:1007
-1014

[284] re rn. Mechanisms of disease: local renin-angiotensin-aldosterone systems and the pathogenesis and treatment of cardiovascular disease.
Nat Clin Pract Cardiovasc Med. 2004;
1:42
-47

[285] reaven pd,
barrett-connor e,
edelstein s. Relation between leisure-time physical activity and blood pressure in older women.
Circulation. 1991;
83:559
-565

[286] rees k,
taylor rs,
singh s,
coats ajs,
ebrahim s. Exercise based rehabilitation for heart failure.
The Cochrane Database of Systematic Review. 2004;
: issue 3. Art. No. : CDOO3331.pub2. DOI: 10.1002/

[287] rexroth w,
hild r. Regulation of ischemic muscle in peripheral arterial occlusive disease.
Vasa. 1989;
18:190
-196

[288] rice t,
an p,
gagnon j,
leon as,
skinner js. Heritability of heart rate and blood pressure response to exercise training in the HERITAGE Family Study.
Med Sci Sports Exerc. 2002;
34:972
-979

[289] richardson cr,
kriska a,
lantz p,
hayward ra. Physical activity and mortality across cardiovascular disease risk groups.
Med Sci Sports Exerc. 2004;
36:1923
-1929

[290] rush jw,
deniss sg,
graham da. Vascular nitric oxyde and oxydative stress: determinants of endothelial adaptations to cardiovascular disease and to physical activity.
Can J Appl Physiol. 2005;
30:442
-474

[291] sacco rl,
gan r,
boden-abdala b,
lin if,
kargman de. Leisure-time physical activity and ischemic stroke risk : the Northern Manhattan Stroke Study.
Stroke. 1998;
29:380
-387

[292] sandvik l,
erikssen j,
thaulow e,
erikssen g,
mundal r,
rodahm k. Physical fitness as a predictor of mortality among healthy, middle-aged Norwegian men.
N Engl J Med. 1993;
328:533
-537

[293] sato y. Diabetes and life-styles: role of physical exercise for primary prevention.
Br J Nutr. 2000;
84 (suppl 2):S187
-S190

[294] saunders dh,
greig ca,
young a,
mead ge. Physical fitness training for stroke patients.
The Cochrane Database of systematic Review. 2004;
:Issue 1. Art. N° CDOO3316.pub2. DOI: 10.1002/1465858.CDOO3316.pub2

[295] savage pd,
brochu m,
poehlman et,
ades pa. Reduction in obesity and coronary risk factors after high caloric exercise training in overweight coronary patients.
Am Heart J. 2003;
146:317
-23

[296] schnohr p,
kristensen ts,
prescott e,
scharling h. Stress and life dissatisfaction are inversely associated with jogging and other types of physical activity in leisure time – The Copenhagen City Heart Study.
Scand J Med Sci Sports. 2005;
15:107
-112

[297] scholz u,
knoll n,
sniehotta ff,
schwarzer r. Physical activity and depressive symptoms in cardiac rehabilitation: Long-term effects of self-management intervention.
Soc Sci Med. 2006;
62:3109
-3120

[298] schwartz rs,
shuman wp,
larson v,
cain kc,
fellingham gw. The effect of intensive endurance exercise training on body fat distribution in young and older men.
Metabolism. 1991;
40:545
-551

[299] scott ac,
darrel pf,
davies lc,
ponikowski p,
coats aj,
piepolo mf. Contribution of skeletal muscle ’ergoreceptors’ in the human leg to respiratory control in chronic heart failure.
Journal of Physiology. 2000;
529:863
-870

[300] sdringola s,
nakagawa k,
nakagawa y,
yusuf sw,
boccalandro f. Combined intensive lifestyle and pharmacologic lipid treatment further reduce coronary events and myocardial perfusion abnormalities compared with usual-care cholesterol-lowering drugs in coronary artery disease.
J Am Coll Cardiol. 2003;
41:263
-272

[301] sesso hd,
paffenbarger rs jr,
lee im. Physical activity and coronary heart disease in men. The Harvard Alumni Health Study.
Circulation. 2000;
102:975
-980

[302] shaibi gq,
cruz ml,
ball gd,
weigensberg mj,
salem gj. Effects of resistance training on insulin sensitivity in overweight Latino adolescent males.
Med Sci Sports Exerc. 2006;
38:1208
-1215

[303] shaper ag,
wannamethee g. Physical activity and ischaemic heart disease in middle-aged British men.
Br Heart. 1991;
66:384
-394

[304] sharp sa,
brouwer bj. Isokinetic strenght training of the hemiparetic knee : effects on function and spasticity.
Arch Phys Med Rehabil. 1997;
78:1231
-1236

[305] shephard rj,
balady gj. Exercise as cardiovascular therapy.
Circulation. 1999;
99:963
-972

[306] siscovick ds,
weiss ns,
fletcher rh,
lasky t. The incidence of primary cardiac arrest during vigorous exercise.
N Engl J Med. 1984;
311:874
-877

[307] slattery ml,
jacobs dr. Leisure time physical activity and CHD death: the US Railroad Study.
Circulation. 1989;
79:304
-311

[308] slentz ca,
duscha bd,
johnson jl,
ketchum k,
aiken lb. Effects of the amount of exercise on body weight, body composition, and measures of central obesity : STRRIDE-a randomized controlled study.
Arch Intern Med. 2004;
164:31
-39

[309] smith jk,
dykes r,
douglas je,
krishnaswamy g,
berk s. Long-term exercise and atherogenic activity of blood mononuclear cells in persons at risk of developing ischemic heart disease.
JAMA. 1999;
281:1722
-1727

[310] sniehotta ff,
scholz u,
schwarzer r. Action plans and coping plans for physical exercise : a longitudinal intervention study in cardiac rehabilitation.
Br J Health Psychol. 2006;
11:23
-37

[311] spin jm,
prakash m,
froelicher vf,
partington s,
marcus r. The prognostic value of exercise testing in elderly men.
Am J Med. 2002;
112:453
-459

[312] staten lk,
gregory-mercado ky,
ranger-moore j,
will jc,
giuliano ar. Provider counseling, health education, and community health workers : the Arizona WISEWOMAN Project.
J Wom Health. 2004;
13:547
-556

[313] stewart kj. Exercise training and the cardiovascular consequences of type 2 diabetes and hypertension. Plausible mechanisms for improving cardiovascular health.
JAMA. 2002;
288:1622
-1631

[314] stewart kj,
bacher ac,
turner kl,
fleg jl,
hees ps. Effect of exercise on blood pressure in older persons.
Arch Intern Med. 2005;
165:756
-762

[315] stoddard am,
palombo r,
troped pj,
sorensen g,
will jc. Cardiovascular disease risk reduction: the Massachussets WISEWOMAN Project.
J Wom Health. 2004;
13:539
-546

[316] sundquist k,
qvist j,
johansson se,
sundquist j. The long-term effect of physical activity on incidence of coronary heart disease: a 12-year follow-study.
Prev Med. 2005;
41:219
-225

[317] survey ms,
ready ae. Survey of exercise and dietetary knowledge and behaviour in persons with type II diabetes.
Can J Public Health. 1991;
82:344
-348

[318] suter e,
marti b,
tschopp a,
wanner hu,
wenk c,
gutzwiller f. Effects of self-monitored jogging on physical fitness, blood pressure and serum lipis: a controlled study in sedentary middle-aged men.
Int J Sports Med. 1990;
11:425
-432

[319] swain dp,
franklin ba. Comparison of cardioprotective benefits of vigorous versus moderate intensity aerobic exercise.
Am J Cardiol. 2006;
97:141
-147

[320] tanasescu m,
leitzmann mf,
rimm eb,
hu fb. Physical activity in relation to cardiovascular disease and total mortality among men with type 2 diabetes.
Circulation. 2003;
107:2435
-2439

[321] taylor s,
brown a,
ebrahim s,
jolliffe j,
noorani h. Exercise-based rehabilitation for patients with coronary heart disease: sytematic review and meta-analysis of randomized controlled trials.
Am J Med. 2004;
116:682
-692

[322] teixeira-salmela lf,
olney sj,
nadeau s,
brouwer b. Muscle strengthening and physical conditionning to reduce impairment and disability in chronic stroke survivors.
Arch Phys Med rehabil. 1999;
80:1211
-1218

[323] thomas de,
elliott ej,
naughton ga. Exercise for type 2 diabetes mellitus.
Cochrane Database of Systematic Reviews. 2006;
:Issue 3. Art. No.: CD002968.pub2. DOI: 10.1002/14651858.CD002968.pub2

[324] thomas gn,
hong awl,
tomlinson b,
laut e,
lam cw. Effects of Tai Chi and resistance training on cardiovascular risk factors in elderly Chinese subjects: a 12-month longitudinal, randomized, controlled intervention study.
Clin Endoc. 2005;
63:663
-669

[325] thompson pd,
crouse sf,
goodpaster b,
kelley d,
moyna n,
pescatello l. The acute versus the chronic response to exercise.
Med Sci Sports Exerc. 2001;
33 (suppl 6):S438
-S445

[326] thompson pd,
buchner d,
pina il,
balady gj,
williams ma. Exercise and physical activity in the prevention and treatment of atherosclerotic cardiovascular disease.
Circulation. 2003;
107:3109
-3116

[327] tisi pv. Exercise training for intermittent claudication: does it adversely affect biochemical markers of the exercise-induced inflammatory response?.
Eur J Vasc Endovasc Surgery. 1997;
14:344
-350

[328] tonino rp. Effect of physical training on the insulin resistance of aging.
Am J Physiol. 1989;
256:352
-356

[329] torres sh,
almeida d,
rosenthal j,
lozada-fernandez y,
hernandez n. Skeletal muscle changes with training in patients with coronary artery disease.
J Cardiopulmonary Rehabil. 1990;
10:271
-278

[330] tudor-locke c,
bell rc,
myers am,
harris sb,
ecclestone na. Controlled outcome evaluation of the First Step Program : a daily physical activity intervention for individuals with type II diabetes.
Int J Obes Relat Metab Disord. 2004;
28:113
-119

[331] tully ma,
cupples me,
chan ws,
mcglade k,
young is. Brisk walking, fitness, and cardiovascular risk : a randomized controlled trial in primary care.
Prev Med. 2005;
41:622
-628

[332] tuomilheto j,
lindstrom j,
eriksson t,
valle tt,
hamalainen h. For the Finnish Diabetes Prevention Study Group. Prevention of type 2 diabetes mellitus by changes in lifestyle among subjects with impaired glucose tolerance.
N Engl J Med. 2001;
344:1343
-1350

[333] turner mj,
spina rj,
kohrt wm,
ehsani a. Effects of endurance exercise training on left ventricular size and remodeling in older adults with hypertension.
J Gerontol A Biol Sci Med Sci. 2000;
55:245
-251

[334] tyni-lenne r,
gordon a,
europe e,
jansson e,
sylven c. Exercise-based rehabilitation improves skeletal muscle capacity, exercise tolerance, and quality of life in both women and men with chronic heart failure.
J Card Fail. 1998;
4:9
-17

[335] ussher mh,
taylor ah,
west r,
mcewen a. Does exercise aid smoking cessation ? A systematic review.
Addiction. 2000;
95:199
-208

[336] vaitkevicius pv,
fleg jl,
engel jh,
o’connor fc,
wright jg. Effects of age and aerobic capacity on arterial stiffness in healthy adults.
Circulation. 1993;
88:1456
-1462

[337] van peppen rp,
kwakkel g,
wood-dauphinee s,
hendriks hj,
van der wees pj,
dekker j. The impact of physical therapy on functional outcomes after stroke : what the evidence?.
Clin Rehabil. 2004;
18:833
-862

[338] vaz de almeida md,
graca p,
afonso c,
d’amicis a,
lappalainen r,
damkjaer s. Physical activity levels and body weight in a nationality representative sample in the European union.
Public Health Nutr. 1999;
1:105
-113

[339] vergès b,
patois-vergès b,
cohen m,
casillas jm. Comprehensive cardiac rehabilitation improves the control of dyslipidemia in secondary prevention.
J Cardiopulmonary Rehabil. 1998;
18:408
-415

[340] vergès b,
patois-vergès b,
cohen m,
lucas b,
galland-jos c,
casillas jm. Effects of cardiac rehabilitation on exercise capacity in Type 2 diabetic patients with coronary artery disease.
Diabetic Medicine. 2004;
21:889
-895

[341] walker kz,
piers ls,
putt rs,
jones ja,
o’dea k. Effects of regular walking on cardiovascular risk factors and body composition in normoglycemic women and women with type 2 diabetes.
Diabetes Care. 1999;
22:555
-561

[342] wang js,
jen cj,
lee hl,
chen hi. Effects of short-term exercise on female platelet function during different phases of the menstrual cycle.
Arterioscler thromb Vasc Biol. 1997;
17:1682
-1686

[343] wannamethee g,
shaper ag. Physical activity and stroke in British middle aged men.
BMJ. 1992;
304:597
-601

[344] wannamethee sg,
shaper ag,
walker m. Physical activity and mortality in older men with diagnosed coronary heart disease.
Circulation. 2000;
102:1358
-1363

[345] wannamethee sg,
lowe gd,
whincup ph,
rumley a,
walker m,
lennon l. Physical activity and hemostatic and inflammatory variables in elderly men.
Circulation. 2002;
105:1785
-1790

[346] wasserman k,
zhang yy,
gitt a,
belardinelli r,
koike a. Lung function and exercise gas exchange in chronic heart failure.
Circulation. 1997;
96:2221
-2227

[347] weaver wd,
cobb la,
hallstrom ap. Characteristics of survivors of exertion-non exertion related cardiac arrest : value of subsequent exercise testing.
Am J Cardiol. 1982;
50:671
-676

[348] weber kt,
janicki js. Cardiopulmonary exercise testing for evaluation of chronic cardiac failure.
Am J Cardiol. 1985;
55:22
-31

[349] wei m,
gibbons lw,
mitchell tl,
kampert jb,
lee cd,
blair sn. The association between cardiorespiratory fitness and impaired fasting glucose and type 2 diabetes mellitus in men.
An Intern Med. 1999;
130:89
-96

[350] wei m,
gibbsons lw,
kampert jb,
nichaman mz,
blair sn. Low cardiorespiratory fitness and physical inactivity as predictors of mortality in men with type 2 diabetes.
Ann Intern Med. 2000;
132:605
-611

[351] weiss c,
seitel g,
bartsch p. Coagulation and fibrinolysis after moderate and very heavy exercise in healthy male subjects.
Med Sci Sports Exerc. 1998;
30:246
-251

[352] wendel-vos gcv,
schuit aj,
feskens ejm,
boshuizen hc,
vershuren wmm,
saris whm. Physical activity and stroke. A meta-analysis of observational data.
Int J Epidemiol. 2004;
33:787
-798

[353] whang w,
manson je,
hu fb,
chae cu,
rexrode km. Physical exertion, exercise, and sudden death in women.
JAMA. 2006;
295:1399
-1403

[354] whelton sp,
chin a,
xin x,
he j. Effect of aerobic exercise on blood pressure : a meta-analysis of randomized, controlled trials.
Ann Intern Med. 2002;
136:493
-503

[355] whyman mr,
ruckley cv. Should claudicants receive angioplasty or just exercise training?.
Cardiovasc Surg. 1998;
6:226
-231

[356] williams ma,
ades pa,
hamm lr,
keteyian sj,
lafontaine tp. Clinical evidence for health benefit from cardiac rehabilitation : An update.
Am Heart J. 2006;
152:835
-841

[357] willich sn,
lewis m,
lowel h,
arntz hr,
schubert f,
schroder r. Physical exertion as a trigger of acute myocardial infarction. Triggers and mechanisms of myocardial infarction study group.
N Engl J Med. 1993;
329:1684
-1690

[358] wilson jr,
mancini dm,
dunkman wb. Exertional fatigue due to skeletal fatigue in patients with heart failure.
Circulation. 1993;
87:470
-475

[359] wilson jr,
rayos g,
yeoh tk,
gothard p,
bak k. Dissociation between exertional symptoms and circulatory function in patients with heart failure.
Circulation. 1995;
92:47
-53

[360] wing rr. Physical activity in the treatment of the adult overweight and obesity : current evidence and research issues.
Med Sci Sports Exerc. 1999;
31:547
-552

[361] wood rh,
wood wa,
welsch m,
avenal p. Physical activity, mental stress, and short-term heart rate variability in patients with ischemic heart disease.
J Cardiopulmonary Rehabil. 1998;
18:271
-276

[362]working party of the international diabetes federation (european region). Hypertension in people with type 2 diabetes: knowledge-based diabetes-specific guidelines.
Diabet Med. 2003;
20:972
-987

[363]writing committee for the enrichd investigators. Effects of treating depression and low perceived social support on clinical events after myocardial infarction.
JAMA. 2003;
289:3106
-3116

[364] yang x,
telama r,
leskinen e,
mansikkaniemi k,
viikari j,
raitakari ot. Testing a model of physical activity and obesity tracking from youth to adulthood: the cardiovascular risk in young Finns study.
International Journal of Obesity advance. ;
:online publication, 5 septembre 2006; doi:10.1038/sj.ijo.0803459

[365] yates bc,
price-fowlkes t,
agrawal s. Barriers and facilitators of self-reported physical activity in cardiac patients.
Res Nurs Health. 2003;
26:459
-469

[366] young dr,
haskell wl,
jatulis de,
fortmann sp. Associations between changes in physical activity and risk factors for coronary heart disease in a community-based sample of men and women: the Stanford Five-City Project.
Am J Epidemiol. 1993;
138:205
-216

[367] zavaroni i,
bonora e,
pagliara m. Risk factors for coronary artery disease in healthy persons with hyperinsulinemia and normal glucose tolerance.
N Engl J Med. 1989;
320:702
-706

[368] zeli r,
mason dt,
braunwald e. A comparison of the effects of vasodilatator stimuli on peripheral resistance vessels in normal subjects and in patients with congestive heart failure.
J Clin Invest. 1986;
47:960
-970

[369] zinman b,
ruderman n,
campaigne bn,
devlin jt,
schneider sh. American Diabetes Association. Physical activity/exercise and diabetes mellitus.
:Diabetes Care;
2003 , 26.
73-77p.

→ Aller vers SYNTHESE
 ; Powell et coll., 1987
; Powell et coll., 1987 ; Berlin et Colditz, 1990
; Berlin et Colditz, 1990 ; Morris et coll., 1990
; Morris et coll., 1990 ; Haapanen et coll., 1997
; Haapanen et coll., 1997 ; Lee et coll., 1997
; Lee et coll., 1997 ; Lee et Paffenbarger, 2000
; Lee et Paffenbarger, 2000 ; Blair et Jackson, 2001
; Blair et Jackson, 2001 ; Noda et coll., 2005
; Noda et coll., 2005 ; Sundquist et coll., 2005
; Sundquist et coll., 2005 ). Cela a été retrouvé pour les femmes (Lee et coll., 2001
). Cela a été retrouvé pour les femmes (Lee et coll., 2001 ; Manson et coll., 2002
; Manson et coll., 2002 ; Oguma et Shinoda-Tagawa, 2004
; Oguma et Shinoda-Tagawa, 2004 ) comme pour les hommes (Sesso et coll., 2000
) comme pour les hommes (Sesso et coll., 2000 ).
). ). Le niveau de capacité physique est un facteur prédictif indépendant de mortalité cardiovasculaire, même chez le sujet âgé (Ekelund et coll., 1988
). Le niveau de capacité physique est un facteur prédictif indépendant de mortalité cardiovasculaire, même chez le sujet âgé (Ekelund et coll., 1988 ; Myers et coll., 2002
; Myers et coll., 2002 ; Spin et coll., 2002
; Spin et coll., 2002 ).
). ). L’activité physique réduit l’incidence d’accident vasculaire cérébral de 25 % (Lee IM et coll., 2003
). L’activité physique réduit l’incidence d’accident vasculaire cérébral de 25 % (Lee IM et coll., 2003 ; Wendel-Vos et coll., 2004
; Wendel-Vos et coll., 2004 ). Par ailleurs, la majorité des études effectuées mettent en évidence des résultats positifs liés au renforcement de l’activité physique (Hu et coll., 2000
). Par ailleurs, la majorité des études effectuées mettent en évidence des résultats positifs liés au renforcement de l’activité physique (Hu et coll., 2000 ; Alevizos et coll., 2005
; Alevizos et coll., 2005 ), cet effet protecteur ayant été retrouvé chez les hommes comme chez les femmes (Lindestrom et coll., 1993
), cet effet protecteur ayant été retrouvé chez les hommes comme chez les femmes (Lindestrom et coll., 1993 ; Manson et coll., 1995
; Manson et coll., 1995 ).
). ).
). ; Gokce et coll., 2002
; Gokce et coll., 2002 ; Dimmeler et Zeiher, 2003
; Dimmeler et Zeiher, 2003 ; Green et coll., 2004
; Green et coll., 2004 ).
). ; Lucini et coll., 2002
; Lucini et coll., 2002 ), avec pour corollaire une diminution du risque de troubles du rythme (Billman, 2002
), avec pour corollaire une diminution du risque de troubles du rythme (Billman, 2002 ). L’effet sur la variabilité sinusale est en effet plus important chez les sujets symptomatiques (prévention secondaire) que chez ceux qui ne le sont pas (prévention primaire).
). L’effet sur la variabilité sinusale est en effet plus important chez les sujets symptomatiques (prévention secondaire) que chez ceux qui ne le sont pas (prévention primaire). ; Church et coll., 2002a
; Church et coll., 2002a ). Même une activité physique modérée permet une amélioration des capacités fibrinolytiques (Lee et Lip, 2003
). Même une activité physique modérée permet une amélioration des capacités fibrinolytiques (Lee et Lip, 2003 ). Il existe une relation linéaire entre le niveau d’activité physique et l’augmentation de l’activateur du plasminogène tissulaire qui, produit par la cellule endothéliale, se lie à la fibrine pour transformer le plasminogène en plasmine qui va lyser un thrombus en formation (Eliasson et coll., 1996
). Il existe une relation linéaire entre le niveau d’activité physique et l’augmentation de l’activateur du plasminogène tissulaire qui, produit par la cellule endothéliale, se lie à la fibrine pour transformer le plasminogène en plasmine qui va lyser un thrombus en formation (Eliasson et coll., 1996 ).
). ; Montgomery et coll., 1996
; Montgomery et coll., 1996 ; Wannamethee et coll., 2002
; Wannamethee et coll., 2002 ). Cet effet est indépendant des autres facteurs de risque (Geffken et coll., 2001
). Cet effet est indépendant des autres facteurs de risque (Geffken et coll., 2001 ). Associée à cet effet sur l’inflammation, il existe une diminution de la concentration en cytokines athérogènes – tel que l’interféron-γ (IFN-γ) – qui interviennent dans l’initiation du processus d’athérogénèse, et une augmentation des cytokines athéroprotectrices – tel que le Transforming Growth Factor (TGFβ) – (Smith et coll., 1999
). Associée à cet effet sur l’inflammation, il existe une diminution de la concentration en cytokines athérogènes – tel que l’interféron-γ (IFN-γ) – qui interviennent dans l’initiation du processus d’athérogénèse, et une augmentation des cytokines athéroprotectrices – tel que le Transforming Growth Factor (TGFβ) – (Smith et coll., 1999 ).
). ; Appelgate et coll., 1992
; Appelgate et coll., 1992 ; Kokkinos et coll., 1995
; Kokkinos et coll., 1995 ; Paffenbarger et Lee, 1997; Turner et coll., 2000
; Paffenbarger et Lee, 1997; Turner et coll., 2000 ). L’entraînement physique fait donc désormais partie des recommandations dans la prise en charge de l’hypertension, en association avec les traitements médicamenteux (Guidelines Subcommittee, 1999
). L’entraînement physique fait donc désormais partie des recommandations dans la prise en charge de l’hypertension, en association avec les traitements médicamenteux (Guidelines Subcommittee, 1999 ; Guidelines Committee, 2003
; Guidelines Committee, 2003 ).
). ) puis secondairement chez la femme (Reaven et coll., 1991
) puis secondairement chez la femme (Reaven et coll., 1991 ). Il est également retrouvé lorsqu’une obésité est associée à l’hypertension (Fagard, 1999
). Il est également retrouvé lorsqu’une obésité est associée à l’hypertension (Fagard, 1999 ). Les études concernant les sujets hypertendus âgés sont peu nombreuses. Il semble que l’impact soit moins important et qu’il porte uniquement sur la pression sanguine artérielle diastolique (Stewart et coll., 2005
). Les études concernant les sujets hypertendus âgés sont peu nombreuses. Il semble que l’impact soit moins important et qu’il porte uniquement sur la pression sanguine artérielle diastolique (Stewart et coll., 2005 ), ceci pouvant être expliqué par la rigidité de la paroi artérielle du sujet âgé (Berry et coll., 2004
), ceci pouvant être expliqué par la rigidité de la paroi artérielle du sujet âgé (Berry et coll., 2004 ).
). ).
). ; Fagard, 2006
; Fagard, 2006 ). Cet effet est plus prononcé lorsqu’il est évalué uniquement chez des sujets hypertendus : diminution de 11 mmHg de la pression systolique et de 8 mmHg de la pression diastolique (Hagberg et coll., 2000
). Cet effet est plus prononcé lorsqu’il est évalué uniquement chez des sujets hypertendus : diminution de 11 mmHg de la pression systolique et de 8 mmHg de la pression diastolique (Hagberg et coll., 2000 ). Cette méta-analyse n’a pas montré d’efficacité supérieure d’un entraînement intensif par rapport à une activité physique modérée chez les patients hypertendus. Les femmes (versus les hommes) et les sujets d’âge moyen (versus les sujets jeunes et les sujets âgés) présentaient une diminution plus importante de la pression artérielle.
). Cette méta-analyse n’a pas montré d’efficacité supérieure d’un entraînement intensif par rapport à une activité physique modérée chez les patients hypertendus. Les femmes (versus les hommes) et les sujets d’âge moyen (versus les sujets jeunes et les sujets âgés) présentaient une diminution plus importante de la pression artérielle. ). Cet effet sur l’hypertension au cours de l’effort est d’autant plus intéressant que cette dernière représente un facteur de risque indépendant de la pression de repos pour la survenue d’infarctus du myocarde et pour la mortalité globale (Mundal et coll., 1996
). Cet effet sur l’hypertension au cours de l’effort est d’autant plus intéressant que cette dernière représente un facteur de risque indépendant de la pression de repos pour la survenue d’infarctus du myocarde et pour la mortalité globale (Mundal et coll., 1996 ).
). ; Pendey, 2003
; Pendey, 2003 ). Ainsi, une élévation supérieure ou égale à 50 mmHg de la pression systolique, à un niveau d’effort correspondant à 50 % du pic de VO2, est considérée comme anormale et est améliorée par un entraînement en endurance de 8 semaines (Bond et coll., 2005
). Ainsi, une élévation supérieure ou égale à 50 mmHg de la pression systolique, à un niveau d’effort correspondant à 50 % du pic de VO2, est considérée comme anormale et est améliorée par un entraînement en endurance de 8 semaines (Bond et coll., 2005 ). L’activité physique est donc susceptible de différer voire de rendre inutile le traitement médicamenteux chez un sujet hypertendu.
). L’activité physique est donc susceptible de différer voire de rendre inutile le traitement médicamenteux chez un sujet hypertendu. ), ainsi qu’une meilleure adaptation du débit cardiaque (Ketelhut et coll., 1994
), ainsi qu’une meilleure adaptation du débit cardiaque (Ketelhut et coll., 1994 ). L’amélioration, déjà évoquée, du fonctionnement de l’endothélium vasculaire est probablement impliquée dans cet effet vasculaire avec meilleure vasodilatation réflexe (Kingwell et coll., 1995
). L’amélioration, déjà évoquée, du fonctionnement de l’endothélium vasculaire est probablement impliquée dans cet effet vasculaire avec meilleure vasodilatation réflexe (Kingwell et coll., 1995 ; Higashi et coll., 1999
; Higashi et coll., 1999 ), de même que l’action sur le système neurovégétatif (Brown et coll., 2002
), de même que l’action sur le système neurovégétatif (Brown et coll., 2002 ). Une augmentation de la capacité veineuse a été évoquée (Amaral et coll., 2001
). Une augmentation de la capacité veineuse a été évoquée (Amaral et coll., 2001 ). Si une amélioration de la compliance artérielle a été retrouvée après entraînement chez les sujets adultes normotendus (Cameron et Dart, 1994
). Si une amélioration de la compliance artérielle a été retrouvée après entraînement chez les sujets adultes normotendus (Cameron et Dart, 1994 ), cette amélioration n’a pas été confirmée dans une étude récente menée chez des sujets jeunes (Rakobowchuk et coll., 2004
), cette amélioration n’a pas été confirmée dans une étude récente menée chez des sujets jeunes (Rakobowchuk et coll., 2004 ). De la même façon, la compliance artérielle n’a pas été modifiée chez des patients hypertendus, à l’issue d’un reconditionnement aérobie de durée brève (Ferrier et coll., 2001
). De la même façon, la compliance artérielle n’a pas été modifiée chez des patients hypertendus, à l’issue d’un reconditionnement aérobie de durée brève (Ferrier et coll., 2001 ) ainsi que chez des sujets âgés après un entraînement de 6 mois (Stewart et coll., 2005
) ainsi que chez des sujets âgés après un entraînement de 6 mois (Stewart et coll., 2005 ). L’effet de l’entraînement sur le système rénine-angiotensine-aldostérone a été jugé longtemps comme négligeable (Hespel et coll., 1988
). L’effet de l’entraînement sur le système rénine-angiotensine-aldostérone a été jugé longtemps comme négligeable (Hespel et coll., 1988 ). Une méta-analyse récente a cependant retrouvé une diminution de 20 % de l’activité de la rénine plasmatique, associée à une diminution de 29 % de la noradrénaline et de 7,1 % des résistances vasculaires pour un entraînement en endurance d’au moins 4 semaines (Fagard, 2006
). Une méta-analyse récente a cependant retrouvé une diminution de 20 % de l’activité de la rénine plasmatique, associée à une diminution de 29 % de la noradrénaline et de 7,1 % des résistances vasculaires pour un entraînement en endurance d’au moins 4 semaines (Fagard, 2006 ).
). ; An et coll., 2003
; An et coll., 2003 ).
). ). Il existe en effet des liens épidémiologiques bien établis entre l’existence d’un diabète non insulino-dépendant et l’insuffisance d’activité physique (Helmrich et coll., 1991
). Il existe en effet des liens épidémiologiques bien établis entre l’existence d’un diabète non insulino-dépendant et l’insuffisance d’activité physique (Helmrich et coll., 1991 ; Manson et coll., 1991
; Manson et coll., 1991 ; Burchfiel et coll., 1995
; Burchfiel et coll., 1995 ; Paffenbarger et coll., 1997
; Paffenbarger et coll., 1997 ; Wei et coll., 2000
; Wei et coll., 2000 ; Hu et coll., 2003
; Hu et coll., 2003 ; Zinman et coll., 2003
; Zinman et coll., 2003 ).
). ; Manson et coll., 1993
; Manson et coll., 1993 ; Paffenbarger et coll., 1997
; Paffenbarger et coll., 1997 ; Pan et coll., 1997
; Pan et coll., 1997 ; Hu et coll., 1999
; Hu et coll., 1999 ; Tuomilheto et coll., 2001
; Tuomilheto et coll., 2001 ).
). ). Il existe une diminution IDEntique du risque cardiovasculaire (Bassuk et coll., 2005
). Il existe une diminution IDEntique du risque cardiovasculaire (Bassuk et coll., 2005 ). La réduction de l’incidence du diabète peut aller jusqu’à 65 % si le niveau d’activité physique est important (Laaksonen et coll., 2005
). La réduction de l’incidence du diabète peut aller jusqu’à 65 % si le niveau d’activité physique est important (Laaksonen et coll., 2005 ). L’étude de Framingham a montré que dans une population non sélectionnée de sujets âgés de 50 ans, l’espérance de vie sans diabète est augmentée de 2,3 ans pour des sujets modérément actifs et de 4 ans pour des sujets très actifs par rapport à des sujets sédentaires (Jonker et coll., 2006
). L’étude de Framingham a montré que dans une population non sélectionnée de sujets âgés de 50 ans, l’espérance de vie sans diabète est augmentée de 2,3 ans pour des sujets modérément actifs et de 4 ans pour des sujets très actifs par rapport à des sujets sédentaires (Jonker et coll., 2006 ).
). ), mais sans modification significative de la masse corporelle (Boule et coll., 2001
), mais sans modification significative de la masse corporelle (Boule et coll., 2001 ). L’équilibre glycémique est amélioré par l’entraînement aérobie mais sans effet dose-réponse (Kelley et Goodpaster, 2001
). L’équilibre glycémique est amélioré par l’entraînement aérobie mais sans effet dose-réponse (Kelley et Goodpaster, 2001 ). Il l’est également par le renforcement musculaire contre résistance (Castaneda et coll., 2002
). Il l’est également par le renforcement musculaire contre résistance (Castaneda et coll., 2002 ; Dunstan et coll., 2002
; Dunstan et coll., 2002 ; Cuff et coll., 2003
; Cuff et coll., 2003 ).
). ) et entraîne une diminution de l’hémoglobine glyquée (HbA1c) de 0,66 % ; démontrée par une méta-analyse, cette amélioration est considérée comme suffisamment importante pour réduire la fréquence des complications dégénératives (Boule et coll., 2001
) et entraîne une diminution de l’hémoglobine glyquée (HbA1c) de 0,66 % ; démontrée par une méta-analyse, cette amélioration est considérée comme suffisamment importante pour réduire la fréquence des complications dégénératives (Boule et coll., 2001 ).
). ; Batty et coll., 2002
; Batty et coll., 2002 ; Gregg et coll., 2003
; Gregg et coll., 2003 ; Tanasescu et coll., 2003
; Tanasescu et coll., 2003 ), indépendamment des autres facteurs de risque que sont la surcharge pondérale, l’hypertension, les dyslipidémies et l’intoxication tabagique (Hu et coll., 2005
), indépendamment des autres facteurs de risque que sont la surcharge pondérale, l’hypertension, les dyslipidémies et l’intoxication tabagique (Hu et coll., 2005 ). De plus, une obésité est souvent associée au diabète. L’effet protecteur de l’activité physique sur la survenue d’événements cardiovasculaires est indépendant du poids. En effet, la relation inverse avec le risque relatif de mortalité persiste, que les patients aient un poids normal (IMC<25 kg/m2), qu’ils soient en surcharge pondérale (IMC=25-29,9 kg/m2), ou qu’ils soient obèses (IMC>30 kg/m2) (Hu et coll., 2001
). De plus, une obésité est souvent associée au diabète. L’effet protecteur de l’activité physique sur la survenue d’événements cardiovasculaires est indépendant du poids. En effet, la relation inverse avec le risque relatif de mortalité persiste, que les patients aient un poids normal (IMC<25 kg/m2), qu’ils soient en surcharge pondérale (IMC=25-29,9 kg/m2), ou qu’ils soient obèses (IMC>30 kg/m2) (Hu et coll., 2001 ; Church et coll., 2004
; Church et coll., 2004 ).
). ; Perseghin et coll., 1996
; Perseghin et coll., 1996 ; Zinman et coll., 2003
; Zinman et coll., 2003 ), ceci étant probablement dû à la très grande hétérogénéité des populations étudiées. La réduction de l’insulino-résistance est associée à une diminution de l’intolérance au glucose, de l’hyperglycémie post-prandiale et de la production hépatique de glucose (Thompson et coll., 2001
), ceci étant probablement dû à la très grande hétérogénéité des populations étudiées. La réduction de l’insulino-résistance est associée à une diminution de l’intolérance au glucose, de l’hyperglycémie post-prandiale et de la production hépatique de glucose (Thompson et coll., 2001 ). L’amélioration de l’insulino-résistance est également corrélée à la diminution de la graisse abdominale (Mourier et coll., 1997
). L’amélioration de l’insulino-résistance est également corrélée à la diminution de la graisse abdominale (Mourier et coll., 1997 ) ainsi qu’aux modifications du profil lipidique (Corpeleijn et coll., 2006
) ainsi qu’aux modifications du profil lipidique (Corpeleijn et coll., 2006 ).
). ), avec un effet IDEntique chez des adolescents en surcharge pondérale (Shaibi et coll., 2006
), avec un effet IDEntique chez des adolescents en surcharge pondérale (Shaibi et coll., 2006 ). Les mêmes constatations ont été faites chez les sujets présentant un diabète de type 2 (Mayer-Davis et coll., 1998
). Les mêmes constatations ont été faites chez les sujets présentant un diabète de type 2 (Mayer-Davis et coll., 1998 ). Cependant, chez des sujets euglycémiques mais présentant une résistance à l’insuline, un programme intensif d’intervention comportant notamment une activité physique élevée (au moins 20 minutes par jour à 80-90 % de la fréquence cardiaque maximale théorique) est nécessaire pour obtenir une amélioration moyenne de 26 % de la sensibilité à l’insuline (McAuley et coll., 2002
). Cependant, chez des sujets euglycémiques mais présentant une résistance à l’insuline, un programme intensif d’intervention comportant notamment une activité physique élevée (au moins 20 minutes par jour à 80-90 % de la fréquence cardiaque maximale théorique) est nécessaire pour obtenir une amélioration moyenne de 26 % de la sensibilité à l’insuline (McAuley et coll., 2002 ). Par ailleurs, il semble exister des liens entre l’activité physique et l’amélioration de l’insulino-résistance chez le sujet hypertendu (Zavaroni et coll., 1989
). Par ailleurs, il semble exister des liens entre l’activité physique et l’amélioration de l’insulino-résistance chez le sujet hypertendu (Zavaroni et coll., 1989 ; Andersen et coll., 2003
; Andersen et coll., 2003 ). Il existe en effet une relation statistique entre la réduction d’une hypertension et de la noradrénaline induite par l’exercice d’une part et l’amélioration de la sensibilité à l’insuline d’autre part (Kohno et coll., 2000
). Il existe en effet une relation statistique entre la réduction d’une hypertension et de la noradrénaline induite par l’exercice d’une part et l’amélioration de la sensibilité à l’insuline d’autre part (Kohno et coll., 2000 ).
). ; Boule et coll., 2005
; Boule et coll., 2005 ).
). ). Un entraînement physique de 8 semaines, combinant reconditionnement global aérobie et renforcement musculaire contre résistance, l’améliore. Cet impact ne se limite pas aux territoires musculaires entraînés mais diffuse à l’ensemble de l’arbre artériel de façon systémique (Maiorana et coll., 2001
). Un entraînement physique de 8 semaines, combinant reconditionnement global aérobie et renforcement musculaire contre résistance, l’améliore. Cet impact ne se limite pas aux territoires musculaires entraînés mais diffuse à l’ensemble de l’arbre artériel de façon systémique (Maiorana et coll., 2001 ). A contrario, un travail récent n’a pas mis en évidence de modifications fonctionnelles microcirculatoires au décours d’un entraînement de 6 mois chez des diabétiques au bon équilibre glycémique (Middlebrooke et coll., 2006
). A contrario, un travail récent n’a pas mis en évidence de modifications fonctionnelles microcirculatoires au décours d’un entraînement de 6 mois chez des diabétiques au bon équilibre glycémique (Middlebrooke et coll., 2006 ).
). ), la tension artérielle (Lehmann et coll., 1995
), la tension artérielle (Lehmann et coll., 1995 ), le profil lipidique (Bourn et coll., 1994
), le profil lipidique (Bourn et coll., 1994 ). Une activité de marche de 45 minutes, 3 fois par semaine apparaît suffisante (Fritz et coll., 2006
). Une activité de marche de 45 minutes, 3 fois par semaine apparaît suffisante (Fritz et coll., 2006 ).
). ). L’activité physique fait donc partie des recommandations des sociétés savantes (Albright et coll., 2000
). L’activité physique fait donc partie des recommandations des sociétés savantes (Albright et coll., 2000 ; American Diabetes Association, 2002
; American Diabetes Association, 2002 ).
). ; Crouse et coll., 1997
; Crouse et coll., 1997 ; Durstine et coll., 2002
; Durstine et coll., 2002 ; Frasson et coll., 2003
; Frasson et coll., 2003 ; Sdringola et coll., 2003
; Sdringola et coll., 2003 ). Une méta-analyse incluant 52 études (4 700 sujets) a montré une réduction moyenne de 3,7 % du taux de triglycérides sériques, de 5 % du LDL3
-cholestérol et une augmentation moyenne de 4,6 % du HDL-cholestérol (Leon et Sanchez, 2001a
). Une méta-analyse incluant 52 études (4 700 sujets) a montré une réduction moyenne de 3,7 % du taux de triglycérides sériques, de 5 % du LDL3
-cholestérol et une augmentation moyenne de 4,6 % du HDL-cholestérol (Leon et Sanchez, 2001a ).
). ), facteur prédictif de diabète et d’hypertension (Haffner, 2000
), facteur prédictif de diabète et d’hypertension (Haffner, 2000 ). La participation dès le jeune âge à une activité physique régulière est un facteur de limitation de l’apparition de l’obésité abdominale à l’âge adulte (Yang et coll., 2006
). La participation dès le jeune âge à une activité physique régulière est un facteur de limitation de l’apparition de l’obésité abdominale à l’âge adulte (Yang et coll., 2006 ).
). ) qui améliore les résultats des programmes d’interventions comportementales (Marcus et coll., 1999
) qui améliore les résultats des programmes d’interventions comportementales (Marcus et coll., 1999 ).
). ; Pennix et coll., 2001
; Pennix et coll., 2001 ). L’activité physique augmente la sensation de bien-être et réduit l’anxiété et le stress par des impacts multiples, psychologique, neuro-hormonaux, et métaboliques encore mal élucidés (Schnohr et coll., 2005
). L’activité physique augmente la sensation de bien-être et réduit l’anxiété et le stress par des impacts multiples, psychologique, neuro-hormonaux, et métaboliques encore mal élucidés (Schnohr et coll., 2005 ).
). ) et sur la rigidité de la paroi artérielle évaluée par la vélocité de l’onde de pouls (Vaitkevicius et coll., 1993
) et sur la rigidité de la paroi artérielle évaluée par la vélocité de l’onde de pouls (Vaitkevicius et coll., 1993 ; Boreham et coll., 2004
; Boreham et coll., 2004 ).
). ; Hack et coll., 2003
; Hack et coll., 2003 ).
). ) conduisant au lancement de véritables campagnes d’incitation à l’activité physique, essentiellement la marche, avec une certaine efficacité en pratique courante (Young et coll., 1993
) conduisant au lancement de véritables campagnes d’incitation à l’activité physique, essentiellement la marche, avec une certaine efficacité en pratique courante (Young et coll., 1993 ; Staten et coll., 2004
; Staten et coll., 2004 ; Stoddard et coll., 2004
; Stoddard et coll., 2004 ). Cependant, les résultats restent limités compte tenu de la taille réduite des populations dans ces études (Bjaras et coll., 2001
). Cependant, les résultats restent limités compte tenu de la taille réduite des populations dans ces études (Bjaras et coll., 2001 ).
). ). Le taux d’abandon est en effet élevé, évalué à 50 % au bout de 6 mois, chez des sujets ayant débuté une modification de leur hygiène de vie (Dishman, 1982
). Le taux d’abandon est en effet élevé, évalué à 50 % au bout de 6 mois, chez des sujets ayant débuté une modification de leur hygiène de vie (Dishman, 1982 ). Un niveau élevé d’activité physique au cours de la jeunesse permet de présager d’une hygiène de vie adaptée au cours de l’âge adulte ce qui représente un argument supplémentaire pour la promotion de l’activité physique chez les jeunes (Conroy et coll., 2005
). Un niveau élevé d’activité physique au cours de la jeunesse permet de présager d’une hygiène de vie adaptée au cours de l’âge adulte ce qui représente un argument supplémentaire pour la promotion de l’activité physique chez les jeunes (Conroy et coll., 2005 ).
). ).
). ; Lakka et coll., 1994
; Lakka et coll., 1994 ; Sesso et coll., 2000
; Sesso et coll., 2000 ) et d’autres, au contraire, à proposer une activité physique modérée (Leon et coll., 1987
) et d’autres, au contraire, à proposer une activité physique modérée (Leon et coll., 1987 ; Slattery et Jacobs, 1989
; Slattery et Jacobs, 1989 ; Shaper et coll., 1991
; Shaper et coll., 1991 ; Wannamethee et Shaper, 1992
; Wannamethee et Shaper, 1992 ; Paffenbarger et coll., 1993
; Paffenbarger et coll., 1993 ).
). ; Fletcher et coll., 1992
; Fletcher et coll., 1992 ). Récemment, c’est une activité physique plus modérée qui est conseillée pendant au moins 30 minutes par séance et le plus de jours possible durant la semaine (Pate et coll., 1995
). Récemment, c’est une activité physique plus modérée qui est conseillée pendant au moins 30 minutes par séance et le plus de jours possible durant la semaine (Pate et coll., 1995 ; NIH Consensus Conference, 1996
; NIH Consensus Conference, 1996 ; Thompson et coll., 2003
; Thompson et coll., 2003 ). L’exemple le plus habituel est la marche à vitesse libre qui, comparée à une activité physique plus intense dans une importante population de femmes, a présenté une efficacité préventive de même niveau (Manson et coll., 2002
). L’exemple le plus habituel est la marche à vitesse libre qui, comparée à une activité physique plus intense dans une importante population de femmes, a présenté une efficacité préventive de même niveau (Manson et coll., 2002 ). Par ailleurs, les effets psychologiques bénéfiques de l’activité physique sur le stress et la sensation de bien-être sont plus importants lorsque celle-ci est modérée plutôt qu’intense (Schnohr et coll., 2005
). Par ailleurs, les effets psychologiques bénéfiques de l’activité physique sur le stress et la sensation de bien-être sont plus importants lorsque celle-ci est modérée plutôt qu’intense (Schnohr et coll., 2005 ).
). ), ce qui est cohérent avec la constatation déjà faite d’une relation inverse entre le niveau de capacité maximale évaluée par un test d’effort et la mortalité (Myers et coll., 2002
), ce qui est cohérent avec la constatation déjà faite d’une relation inverse entre le niveau de capacité maximale évaluée par un test d’effort et la mortalité (Myers et coll., 2002 ). L’hypothèse proposée pour expliquer cet effet plus marqué de l’activité physique intense est son impact supérieur sur le système neurovégétatif (Podolin et coll., 1991
). L’hypothèse proposée pour expliquer cet effet plus marqué de l’activité physique intense est son impact supérieur sur le système neurovégétatif (Podolin et coll., 1991 ) et sur l’insulino-résistance (Kang et coll., 1996
) et sur l’insulino-résistance (Kang et coll., 1996 ).
). ), un niveau minimal d’exercice étant indispensable à un contrôle des facteurs de risque. Ce niveau a été fixé chez des sujets sains entre 30 et 55 ans à une dépense énergétique de 1 000 à 1 500 kcal/semaine, comportant des exercices 4 fois par semaine d’une durée de 20 à 60 minutes à un minimum de 50 % des capacités maximales aérobies (Drygas et coll., 1988
), un niveau minimal d’exercice étant indispensable à un contrôle des facteurs de risque. Ce niveau a été fixé chez des sujets sains entre 30 et 55 ans à une dépense énergétique de 1 000 à 1 500 kcal/semaine, comportant des exercices 4 fois par semaine d’une durée de 20 à 60 minutes à un minimum de 50 % des capacités maximales aérobies (Drygas et coll., 1988 ). L’efficacité apparaît renforcée si cette activité est supérieure à 2 000 kcal/semaine, notamment en ce qui concerne le profil lipidique (Drygas et coll., 2000
). L’efficacité apparaît renforcée si cette activité est supérieure à 2 000 kcal/semaine, notamment en ce qui concerne le profil lipidique (Drygas et coll., 2000 ). La figure 16.1
). La figure 16.1 présente les effets sur la mortalité cardiovasculaire en fonction de l’activité physique selon différents auteurs.
présente les effets sur la mortalité cardiovasculaire en fonction de l’activité physique selon différents auteurs.
 ; NIH Consensus Conference, 1996
; NIH Consensus Conference, 1996 ), auto contrôlée par la perception de la fatigue et/ou la prise du pouls (Fletcher, 1997
), auto contrôlée par la perception de la fatigue et/ou la prise du pouls (Fletcher, 1997 ). Si l’activité physique est plus intense (par exemple la marche rapide), il semble que la durée de l’exercice puisse être réduite de 30 à 10 minutes par jour, avec les mêmes effets sur le profil lipidique, le tour de taille, le VO2 max et l’état psychologique (Murphy et coll., 2002
). Si l’activité physique est plus intense (par exemple la marche rapide), il semble que la durée de l’exercice puisse être réduite de 30 à 10 minutes par jour, avec les mêmes effets sur le profil lipidique, le tour de taille, le VO2 max et l’état psychologique (Murphy et coll., 2002 ). Ceci apparaît intéressant en pratique, car levant une barrière habituelle à la pratique de l’activité physique qui est le manque de temps. Cependant, une évaluation plus récente des effets de la marche rapide 20 minutes, 3 jours par semaine n’a pas confirmé ces résultats (Murtagh et coll., 2005
). Ceci apparaît intéressant en pratique, car levant une barrière habituelle à la pratique de l’activité physique qui est le manque de temps. Cependant, une évaluation plus récente des effets de la marche rapide 20 minutes, 3 jours par semaine n’a pas confirmé ces résultats (Murtagh et coll., 2005 ).
). ), le gain étant supérieur chez les sujets les plus actifs mais sans gain supérieur au-delà d’une dépense énergétique de 2 000 kcal/semaine (Lee et Paffenbarger, 1998). Cet effet positif de l’activité physique modérée est retrouvé même lorsqu’il existe une hypertrophie ventriculaire associée (Pitsavos et coll., 2004
), le gain étant supérieur chez les sujets les plus actifs mais sans gain supérieur au-delà d’une dépense énergétique de 2 000 kcal/semaine (Lee et Paffenbarger, 1998). Cet effet positif de l’activité physique modérée est retrouvé même lorsqu’il existe une hypertrophie ventriculaire associée (Pitsavos et coll., 2004 ). Il faut noter qu’une activité physique soutenue, voire énergique, n’a pas entraîné d’effets délétères (Wannamethee et Shaper, 1992
). Il faut noter qu’une activité physique soutenue, voire énergique, n’a pas entraîné d’effets délétères (Wannamethee et Shaper, 1992 ) avec même un effet bénéfique additionnel comparativement à une activité modérée (Sacco et coll., 1998
) avec même un effet bénéfique additionnel comparativement à une activité modérée (Sacco et coll., 1998 ). Les recommandations en prévention des accidents vasculaires cérébraux sont également d’une activité quotidienne, modérée, durant au moins 30 minutes (Pate et coll., 1995
). Les recommandations en prévention des accidents vasculaires cérébraux sont également d’une activité quotidienne, modérée, durant au moins 30 minutes (Pate et coll., 1995 ; Golstein et coll., 2001
; Golstein et coll., 2001 ).
). ; American Diabetes Association, 2002
; American Diabetes Association, 2002 ; Working Party of the International Diabetes Federation, 2003
; Working Party of the International Diabetes Federation, 2003 ).
). ). Ces recommandations rejoignent celles déjà rapportées : au minimum une dépense énergétique de 1 000 kcal/semaine, avec activité aérobie et entraînement contre résistance, au moins 3 fois par semaine et si possible quotidienne (Di Loreto et coll., 2005
). Ces recommandations rejoignent celles déjà rapportées : au minimum une dépense énergétique de 1 000 kcal/semaine, avec activité aérobie et entraînement contre résistance, au moins 3 fois par semaine et si possible quotidienne (Di Loreto et coll., 2005 ). Il est préconisé de débuter par un échauffement et terminer par une récupération active de 5 à 10 minutes. La durée de l’exercice (marche, vélo, natation...) doit augmenter progressivement de 30 à 45 minutes. Le contrôle de la fréquence cardiaque permet de contrôler de façon aisée l’intensité de l’effort. Cette approche est facilitée par l’utilisation d’un cardiofréquencemètre. Une fréquence cardiaque cible peut être proposée entre 60 et 80 % de la fréquence maximale. Pour les sujets n’ayant pas bénéficié d’un test d’effort et en l’absence d’une interaction médicamenteuse ou d’une neuropathie neurovégétative, la fréquence maximale peut être estimée par la formule : 220 – âge. Le renforcement musculaire contre résistance sera mis en œuvre au moins 2 fois par semaine. Si la force musculaire maximale est préalablement testée, on déterminera des charges correspondant à 30 à 50 % de celle-ci. Le sujet effectuera des séries de 12 à 15 répétitions en sollicitant successivement les plus volumineuses masses musculaires des 4 membres. Si un test de force n’est pas effectué, on choisira un poids pouvant être mobilisé facilement 10 à 15 fois (Stewart, 2002
). Il est préconisé de débuter par un échauffement et terminer par une récupération active de 5 à 10 minutes. La durée de l’exercice (marche, vélo, natation...) doit augmenter progressivement de 30 à 45 minutes. Le contrôle de la fréquence cardiaque permet de contrôler de façon aisée l’intensité de l’effort. Cette approche est facilitée par l’utilisation d’un cardiofréquencemètre. Une fréquence cardiaque cible peut être proposée entre 60 et 80 % de la fréquence maximale. Pour les sujets n’ayant pas bénéficié d’un test d’effort et en l’absence d’une interaction médicamenteuse ou d’une neuropathie neurovégétative, la fréquence maximale peut être estimée par la formule : 220 – âge. Le renforcement musculaire contre résistance sera mis en œuvre au moins 2 fois par semaine. Si la force musculaire maximale est préalablement testée, on déterminera des charges correspondant à 30 à 50 % de celle-ci. Le sujet effectuera des séries de 12 à 15 répétitions en sollicitant successivement les plus volumineuses masses musculaires des 4 membres. Si un test de force n’est pas effectué, on choisira un poids pouvant être mobilisé facilement 10 à 15 fois (Stewart, 2002 ).
). ). Une activité physique de loisir plus soutenue a permis chez des sujets à risque de diminuer l’incidence du diabète de 65 % (Laaksonen et coll., 2005
). Une activité physique de loisir plus soutenue a permis chez des sujets à risque de diminuer l’incidence du diabète de 65 % (Laaksonen et coll., 2005 ). Cette constatation a été faite par plusieurs études qui utilisent un test d’effort comme moyen d’analyse de l’activité physique plutôt que les questionnaires qui sont le moyen le plus largement utilisé (Lynch et coll., 1996
). Cette constatation a été faite par plusieurs études qui utilisent un test d’effort comme moyen d’analyse de l’activité physique plutôt que les questionnaires qui sont le moyen le plus largement utilisé (Lynch et coll., 1996 ; Wei et coll., 1999
; Wei et coll., 1999 ). Une activité physique modérée est conseillée lorsque l’on veut privilégier l’utilisation des acides gras libres par rapport à celle du glucose qui représente l’unique source d’énergie au cours d’un effort maximal (Sato, 2000
). Une activité physique modérée est conseillée lorsque l’on veut privilégier l’utilisation des acides gras libres par rapport à celle du glucose qui représente l’unique source d’énergie au cours d’un effort maximal (Sato, 2000 ).
). ). Il semble par ailleurs que les effets bénéfiques d’un programme d’intervention sur le mode de vie se maintiennent dans le temps (Lindstrom et coll., 2006
). Il semble par ailleurs que les effets bénéfiques d’un programme d’intervention sur le mode de vie se maintiennent dans le temps (Lindstrom et coll., 2006 ). Ces modifications sont particulièrement importantes à mettre en œuvre car il s’agit de sujets plutôt sédentaires. Ainsi, près de 70 % des patients présentant un diabète de type 2 n’ont pas d’activité physique régulière de loisir (Ford et Herman, 1995
). Ces modifications sont particulièrement importantes à mettre en œuvre car il s’agit de sujets plutôt sédentaires. Ainsi, près de 70 % des patients présentant un diabète de type 2 n’ont pas d’activité physique régulière de loisir (Ford et Herman, 1995 ). L’impact de l’augmentation du niveau d’activité physique chez ces patients ne se limite pas au versant cardiovasculaire mais agit également sur leurs incapacités fonctionnelles qui sont fréquentes avec notamment une limitation à la marche (Gregg et coll., 2000
). L’impact de l’augmentation du niveau d’activité physique chez ces patients ne se limite pas au versant cardiovasculaire mais agit également sur leurs incapacités fonctionnelles qui sont fréquentes avec notamment une limitation à la marche (Gregg et coll., 2000 ). Cependant, un obstacle est le peu de motivation souvent constaté de ces populations de patients pour des programmes contraignants d’activité physique (Survey et Ready, 1991
). Cependant, un obstacle est le peu de motivation souvent constaté de ces populations de patients pour des programmes contraignants d’activité physique (Survey et Ready, 1991 ). Des interventions de sensibilisation, de modifications comportementales et d’éducation à une auto-prise en charge comportant un rétrocontrôle d’activité fondé sur l’utilisation de podomètres ont permis une augmentation significative du niveau d’activité physique mais avec une perte d’efficacité progressive justifiant la mise en place de stratégies de soutien (Tudor-Locke et coll., 2004
). Des interventions de sensibilisation, de modifications comportementales et d’éducation à une auto-prise en charge comportant un rétrocontrôle d’activité fondé sur l’utilisation de podomètres ont permis une augmentation significative du niveau d’activité physique mais avec une perte d’efficacité progressive justifiant la mise en place de stratégies de soutien (Tudor-Locke et coll., 2004 ).
). ).
). ; Pescatello et coll., 2004
; Pescatello et coll., 2004 ). La diminution de la pression sanguine artérielle est peu différente entre une activité modérée (par exemple marche à vitesse modérée, 30 minutes 3 fois par semaine) et plus intense (60 minutes de marche rapide 5 jours par semaine) (Fagard, 2001
). La diminution de la pression sanguine artérielle est peu différente entre une activité modérée (par exemple marche à vitesse modérée, 30 minutes 3 fois par semaine) et plus intense (60 minutes de marche rapide 5 jours par semaine) (Fagard, 2001 ). À niveau d’intensité modérée (50 % de la VO2 max), 30 à 60 minutes d’exercices par semaine sont suffisantes pour diminuer la pression systolique et diastolique, alors que 60 à 90 minutes apportent un gain supplémentaire, mais pas au-delà de 90 minutes (Ishikawa-Takata et coll., 2003
). À niveau d’intensité modérée (50 % de la VO2 max), 30 à 60 minutes d’exercices par semaine sont suffisantes pour diminuer la pression systolique et diastolique, alors que 60 à 90 minutes apportent un gain supplémentaire, mais pas au-delà de 90 minutes (Ishikawa-Takata et coll., 2003 ). Le volume d’exercice nécessaire apparaît donc comme peu important et raisonnablement atteignable dans cette population de patients. Le renforcement musculaire très en vogue actuellement lorsqu’il est dynamique et à charge modérée, intervient également dans l’amélioration des chiffres tensionnels (Cornelissen et Fagard, 2005
). Le volume d’exercice nécessaire apparaît donc comme peu important et raisonnablement atteignable dans cette population de patients. Le renforcement musculaire très en vogue actuellement lorsqu’il est dynamique et à charge modérée, intervient également dans l’amélioration des chiffres tensionnels (Cornelissen et Fagard, 2005 ), bien qu’une altération de la compliance artérielle ait été mise en évidence (Miyachi et coll., 2004
), bien qu’une altération de la compliance artérielle ait été mise en évidence (Miyachi et coll., 2004 ). L’entraînement aérobie semble cependant plus efficace que le renforcement musculaire pour abaisser la tension artérielle (Halbert et coll., 1997
). L’entraînement aérobie semble cependant plus efficace que le renforcement musculaire pour abaisser la tension artérielle (Halbert et coll., 1997 ). Les activités aérobies sont donc à privilégier : marche, course à pied, vélo, à intensité basse à modérée plutôt qu’intense (Kokkinos et Papademetriou, 2000
). Les activités aérobies sont donc à privilégier : marche, course à pied, vélo, à intensité basse à modérée plutôt qu’intense (Kokkinos et Papademetriou, 2000 ). La pratique du vélo apparaît d’ailleurs la plus efficace (Whelton et coll., 2002
). La pratique du vélo apparaît d’ailleurs la plus efficace (Whelton et coll., 2002 ). En revanche, l’effet sur l’hypertension du renforcement musculaire uniquement statique n’a pas été évalué.
). En revanche, l’effet sur l’hypertension du renforcement musculaire uniquement statique n’a pas été évalué. ).
). )
) ) ce qui pour certains double le risque de complications cardiovasculaires (Grossman et coll., 2000
) ce qui pour certains double le risque de complications cardiovasculaires (Grossman et coll., 2000 ). Les recommandations pratiques rapportées pour le diabète s’appliquent à cette situation (Stewart, 2002
). Les recommandations pratiques rapportées pour le diabète s’appliquent à cette situation (Stewart, 2002 ).
). ). Par ailleurs, il semble que la moindre activité physique suffisamment régulière peut réduire la surcharge pondérale (Slentz et coll., 2004
). Par ailleurs, il semble que la moindre activité physique suffisamment régulière peut réduire la surcharge pondérale (Slentz et coll., 2004 ), par exemple la pratique d’une activité de marche quotidienne de 15 minutes semble suffisante (Hill et coll., 2003
), par exemple la pratique d’une activité de marche quotidienne de 15 minutes semble suffisante (Hill et coll., 2003 ).
). ). Il semble que cet effet soit plus lié à la durée de l’activité qu’à son intensité (Kraus et coll., 2002
). Il semble que cet effet soit plus lié à la durée de l’activité qu’à son intensité (Kraus et coll., 2002 ).
). ; Ford, 2002
; Ford, 2002 ). D’ailleurs, le niveau d’adaptation à l’effort (témoin des capacités aérobies du sujet) présente une corrélation inverse avec la protéine C réactive chez des sujets avec diabète (McGavock et coll., 2004
). D’ailleurs, le niveau d’adaptation à l’effort (témoin des capacités aérobies du sujet) présente une corrélation inverse avec la protéine C réactive chez des sujets avec diabète (McGavock et coll., 2004 ) et sans diabète (Church et coll., 2002b
) et sans diabète (Church et coll., 2002b ).
). ). Il est préférable de personnaliser le niveau d’effort aux capacités réelles des sujets, en tenant compte de la grande hétérogénéité des situations. Pour cela, le niveau d’effort ressenti par le sujet lui-même est un critère plus fiable et validé dans la prévention primaire pour des efforts modérés auto-contrôlés (Lee IM et coll., 2003
). Il est préférable de personnaliser le niveau d’effort aux capacités réelles des sujets, en tenant compte de la grande hétérogénéité des situations. Pour cela, le niveau d’effort ressenti par le sujet lui-même est un critère plus fiable et validé dans la prévention primaire pour des efforts modérés auto-contrôlés (Lee IM et coll., 2003 ) et a permis une évolution dans les recommandations à une activité physique adaptée aux possibilités réelles de chaque sujet (American College of Sports Medicine Position Stand, 1998
) et a permis une évolution dans les recommandations à une activité physique adaptée aux possibilités réelles de chaque sujet (American College of Sports Medicine Position Stand, 1998 ). La sensation de l’effort est transcrite à partir de scores spécifiques, dont celui de Borg est le plus utilisé car bien corrélé aux autres paramètres de l’adaptation à l’effort (Borg, 1982
). La sensation de l’effort est transcrite à partir de scores spécifiques, dont celui de Borg est le plus utilisé car bien corrélé aux autres paramètres de l’adaptation à l’effort (Borg, 1982 ).
). ). Elle ne nécessite pas d’apprentissage, ni d’équipement spécifique. Elle est par ailleurs rarement source de lésions musculo-squelettiques (Morris et Hardman, 1997
). Elle ne nécessite pas d’apprentissage, ni d’équipement spécifique. Elle est par ailleurs rarement source de lésions musculo-squelettiques (Morris et Hardman, 1997 ). Pratiquée 30 minutes par jour, 5 jours par semaine, durant 12 semaines, sans surveillance particulière, elle entraîne une réduction significative du risque cardiovasculaire (Tully et coll., 2005
). Pratiquée 30 minutes par jour, 5 jours par semaine, durant 12 semaines, sans surveillance particulière, elle entraîne une réduction significative du risque cardiovasculaire (Tully et coll., 2005 ). Les autres activités telles que la natation, le vélo, les différents sports, seront pratiquées en fonction des goûts de chacun et des possibilités offertes. De même, des exercices contre résistance, utilisant des poids à mobiliser ou différents ergomètres, seront préconisés deux à trois fois par semaine, incluant 8 à 10 types d’effort répétés 10 à 15 fois chacun (Fletcher, 1997
). Les autres activités telles que la natation, le vélo, les différents sports, seront pratiquées en fonction des goûts de chacun et des possibilités offertes. De même, des exercices contre résistance, utilisant des poids à mobiliser ou différents ergomètres, seront préconisés deux à trois fois par semaine, incluant 8 à 10 types d’effort répétés 10 à 15 fois chacun (Fletcher, 1997 ).
). ). Cependant, la pratique durant 4 mois d’une autre gymnastique chinoise traditionnelle, le qi gong, a permis une amélioration de patients hypertendus avec une réduction des chiffres de pression sanguine artérielle IDEntique à celle d’un entraînement conventionnel (Cheung et coll., 2005
). Cependant, la pratique durant 4 mois d’une autre gymnastique chinoise traditionnelle, le qi gong, a permis une amélioration de patients hypertendus avec une réduction des chiffres de pression sanguine artérielle IDEntique à celle d’un entraînement conventionnel (Cheung et coll., 2005 ).
). ; O’Connor et coll., 1989
; O’Connor et coll., 1989 ; Jolliffe et coll., 2002
; Jolliffe et coll., 2002 ; Taylor et coll., 2004
; Taylor et coll., 2004 ; Karmisholt et Gotzsche, 2005
; Karmisholt et Gotzsche, 2005 ). C’est cette démonstration d’efficacité qui a d’ailleurs été à l’origine du développement important de la réadaptation cardiaque à partir du début des années 1990.
). C’est cette démonstration d’efficacité qui a d’ailleurs été à l’origine du développement important de la réadaptation cardiaque à partir du début des années 1990. ) et confirmé de façon récente par une méta-analyse (Piepoli et coll., 2004
) et confirmé de façon récente par une méta-analyse (Piepoli et coll., 2004 ).
). ). Ce déconditionnement à l’effort est souvent aggravé par la sédentarité, facteur de risque majeur des maladies cardiovasculaires (Lee IM et coll., 2003
). Ce déconditionnement à l’effort est souvent aggravé par la sédentarité, facteur de risque majeur des maladies cardiovasculaires (Lee IM et coll., 2003 ). Il existe une diminution du volume sanguin, du remplissage ventriculaire, du volume d’éjection systolique, du retour veineux, du réseau capillaire musculaire et de la perfusion musculaire (Convertino, 1997
). Il existe une diminution du volume sanguin, du remplissage ventriculaire, du volume d’éjection systolique, du retour veineux, du réseau capillaire musculaire et de la perfusion musculaire (Convertino, 1997 ). Ces anomalies, combinées chez les patients coronariens, conduisent à une diminution des capacités aérobies et de l’endurance musculaire alors que la force musculaire maximale reste longtemps conservée (Gayda et coll., 2003
). Ces anomalies, combinées chez les patients coronariens, conduisent à une diminution des capacités aérobies et de l’endurance musculaire alors que la force musculaire maximale reste longtemps conservée (Gayda et coll., 2003 ). Chez le patient coronarien avec insuffisance cardiaque, la dégradation du métabolisme oxydatif est particulièrement marquée (Mancini et coll., 1992
). Chez le patient coronarien avec insuffisance cardiaque, la dégradation du métabolisme oxydatif est particulièrement marquée (Mancini et coll., 1992 ).
). ; Ades et coll., 1996
; Ades et coll., 1996 ), avec un impact similaire démontré depuis longtemps au cours de l’artériopathie oblitérante des membres inférieurs (Holm et coll., 1973
), avec un impact similaire démontré depuis longtemps au cours de l’artériopathie oblitérante des membres inférieurs (Holm et coll., 1973 ).
). ). Une méta-analyse récente a retrouvé une augmentation moyenne de 2,16 ml/kg/min de ce pic de VO2, associée à une amélioration de 15,1 watts de la puissance et de 2,38 minutes de la durée du test d’effort après rééducation, les performances étant d’autant meilleures que le programme est intense et prolongé (Rees et coll., 2004
). Une méta-analyse récente a retrouvé une augmentation moyenne de 2,16 ml/kg/min de ce pic de VO2, associée à une amélioration de 15,1 watts de la puissance et de 2,38 minutes de la durée du test d’effort après rééducation, les performances étant d’autant meilleures que le programme est intense et prolongé (Rees et coll., 2004 ). La spectroscopie en résonance magnétique nucléaire au phosphore 31 met en évidence une réduction de la déplétion en phosphocréatine et de la synthèse d’ADP au cours de l’exercice et une accélération de la re-synthèse de la phosphocréatine lors de la phase de récupération (Adamopoulos et coll., 1993
). La spectroscopie en résonance magnétique nucléaire au phosphore 31 met en évidence une réduction de la déplétion en phosphocréatine et de la synthèse d’ADP au cours de l’exercice et une accélération de la re-synthèse de la phosphocréatine lors de la phase de récupération (Adamopoulos et coll., 1993 ). Ceci est concordant avec les constatations histochimiques : augmentation de la densité en mitochondries (Hambrecht et coll., 1997
). Ceci est concordant avec les constatations histochimiques : augmentation de la densité en mitochondries (Hambrecht et coll., 1997 ), amélioration du matériel enzymatique oxydatif (Gielen et coll., 2002
), amélioration du matériel enzymatique oxydatif (Gielen et coll., 2002 ).
). ) et se traduisant en gain sur l’autonomie et la qualité de vie (Tyni-Lenne et coll., 1998
) et se traduisant en gain sur l’autonomie et la qualité de vie (Tyni-Lenne et coll., 1998 ). Ces différents effets sont retrouvés chez les patients coronariens stables (Goodman et coll., 1999
). Ces différents effets sont retrouvés chez les patients coronariens stables (Goodman et coll., 1999 ).
). ) par amélioration de la fonction endothéliale coronaire (Hambrecht et coll., 2000a
) par amélioration de la fonction endothéliale coronaire (Hambrecht et coll., 2000a ). Ceci permet une amélioration du débit cardiaque d’effort chez le coronarien stable (Goodman et coll., 1999
). Ceci permet une amélioration du débit cardiaque d’effort chez le coronarien stable (Goodman et coll., 1999 ; McConnell et coll., 2003
; McConnell et coll., 2003 ; Motohiro et coll., 2005
; Motohiro et coll., 2005 ) et une augmentation de la fraction d’éjection chez l’insuffisant cardiaque (Hambrecht et coll., 2000b
) et une augmentation de la fraction d’éjection chez l’insuffisant cardiaque (Hambrecht et coll., 2000b ) mais qui n’apparaît pas constante (McConnell et coll., 2003
) mais qui n’apparaît pas constante (McConnell et coll., 2003 ).
). ). La mesure des échanges gazeux au cours de l’effort est un témoin plus valide et un facteur pronostique fort (Mancini, 1995
). La mesure des échanges gazeux au cours de l’effort est un témoin plus valide et un facteur pronostique fort (Mancini, 1995 ). Utilisée dans la classification de Weber pour le diagnostic de gravité de l’insuffisance cardiaque, elle ne permet cependant pas de distinguer la composante centrale (débit cardiaque) et périphérique (différence artério-veineuse en oxygène) de la chaîne du transport et de l’utilisation de l’oxygène (Weber et Janicki, 1985
). Utilisée dans la classification de Weber pour le diagnostic de gravité de l’insuffisance cardiaque, elle ne permet cependant pas de distinguer la composante centrale (débit cardiaque) et périphérique (différence artério-veineuse en oxygène) de la chaîne du transport et de l’utilisation de l’oxygène (Weber et Janicki, 1985 ).
). ), du fait en particulier d’une diminution du produit de la fréquence cardiaque par la pression systolique, à niveau d’effort égal (Clausen, 1976
), du fait en particulier d’une diminution du produit de la fréquence cardiaque par la pression systolique, à niveau d’effort égal (Clausen, 1976 ).
). ). La conjonction de l’atteinte musculaire métabolique et des troubles de la perfusion musculaire au cours de l’insuffisance cardiaque chronique prédomine sur l’insuffisance de débit cardiaque dans la pathogénie de la désadaptation à l’effort (Zeli et coll., 1986
). La conjonction de l’atteinte musculaire métabolique et des troubles de la perfusion musculaire au cours de l’insuffisance cardiaque chronique prédomine sur l’insuffisance de débit cardiaque dans la pathogénie de la désadaptation à l’effort (Zeli et coll., 1986 ; Wilson et coll., 1993
; Wilson et coll., 1993 ).
). ). La réactivation de la vasodilatation NO-dépendante participe à l’amélioration des performances aérobies chez les patients coronariens (Brendle et coll., 2001
). La réactivation de la vasodilatation NO-dépendante participe à l’amélioration des performances aérobies chez les patients coronariens (Brendle et coll., 2001 ) ainsi qu’au cours de l’insuffisance cardiaque chronique (Hambrecht et coll., 1998
) ainsi qu’au cours de l’insuffisance cardiaque chronique (Hambrecht et coll., 1998 ).
). ) passant en particulier par la modification des contraintes pariétales (Malek et coll., 1999
) passant en particulier par la modification des contraintes pariétales (Malek et coll., 1999 ).
). ; Chatterjee, 2005
; Chatterjee, 2005 ).
). ), associée à une augmentation de la variabilité sinusale (Wood et coll., 1998
), associée à une augmentation de la variabilité sinusale (Wood et coll., 1998 ) et à un effet anti-arythmique (Billman, 2002
) et à un effet anti-arythmique (Billman, 2002 ) chez le coronarien sans dysfonction ventriculaire comme chez l’insuffisant cardiaque (Adamopoulos et coll., 1995
) chez le coronarien sans dysfonction ventriculaire comme chez l’insuffisant cardiaque (Adamopoulos et coll., 1995 ). De plus, le niveau de la variabilité sinusale est corrélé chez l’insuffisant cardiaque à l’activité physique évaluée par questionnaire (Garet et coll., 2005
). De plus, le niveau de la variabilité sinusale est corrélé chez l’insuffisant cardiaque à l’activité physique évaluée par questionnaire (Garet et coll., 2005 ). Cet effet anti-arythmique est probablement potentialisé par l’amélioration secondaire des défenses anti-oxydantes myocardiques à l’exercice (Hamilton et coll., 2004
). Cet effet anti-arythmique est probablement potentialisé par l’amélioration secondaire des défenses anti-oxydantes myocardiques à l’exercice (Hamilton et coll., 2004 ).
). ) à l’origine d’une hyperventilation réflexe délétère par probable mise en jeu excessive des chémorécepteurs et ergorécepteurs musculaires (Scott et coll., 2000
) à l’origine d’une hyperventilation réflexe délétère par probable mise en jeu excessive des chémorécepteurs et ergorécepteurs musculaires (Scott et coll., 2000 ). La dyspnée est le plus souvent corrélée à une augmentation de la pression artérielle pulmonaire (Mancini et coll., 2000
). La dyspnée est le plus souvent corrélée à une augmentation de la pression artérielle pulmonaire (Mancini et coll., 2000 ). L’activité physique augmente de plus de 20 % les capacités respiratoires chez l’insuffisant cardiaque (McConnell et coll., 2003
). L’activité physique augmente de plus de 20 % les capacités respiratoires chez l’insuffisant cardiaque (McConnell et coll., 2003 ) avec amélioration de la diffusion alvéolo-capillaire (Guazzi et coll., 2004
) avec amélioration de la diffusion alvéolo-capillaire (Guazzi et coll., 2004 ), participant à la régression de la dyspnée.
), participant à la régression de la dyspnée. ). L’insulino-résistance est probablement impliquée dans cette spécificité du coronarien diabétique car elle est corrélée au déconditionnement musculaire au cours de l’insuffisance cardiaque (Coats et Anker, 2000
). L’insulino-résistance est probablement impliquée dans cette spécificité du coronarien diabétique car elle est corrélée au déconditionnement musculaire au cours de l’insuffisance cardiaque (Coats et Anker, 2000 ).
). ; Durstine et coll., 2002
; Durstine et coll., 2002 ), et participe au contrôle de l’obésité (Savage et coll., 2003
), et participe au contrôle de l’obésité (Savage et coll., 2003 ).
). ). L’entraînement physique, tel que mis en œuvre au cours de la réadaptation permet la réduction de l’anxiété et de la dépression, notamment par une remise en confiance (Kugler et coll., 1994
). L’entraînement physique, tel que mis en œuvre au cours de la réadaptation permet la réduction de l’anxiété et de la dépression, notamment par une remise en confiance (Kugler et coll., 1994 ; Brosse et coll., 2002
; Brosse et coll., 2002 ; Scholz et coll., 2006
; Scholz et coll., 2006 ) mais sans démonstration à ce jour d’un impact sur la morbi-mortalité (Writing Committee for the Enrichd Investigators, 2003
) mais sans démonstration à ce jour d’un impact sur la morbi-mortalité (Writing Committee for the Enrichd Investigators, 2003 ).
). ) de débuter une modification de l’hygiène de vie vers une activité physique renforcée (Williams et coll., 2006
) de débuter une modification de l’hygiène de vie vers une activité physique renforcée (Williams et coll., 2006 ). Le challenge est de toute façon à son issue d’en pérenniser les effets par la poursuite d’une activité physique régulière. Les préconisations sont proches de celles faites en prévention primaire, avec cependant en préalable la nécessité d’une stratification du risque comportant notamment une évaluation de l’adaptation à l’effort afin de guider l’intensité des exercices et de les sécuriser au maximum (Pedersen et Saltin, 2006
). Le challenge est de toute façon à son issue d’en pérenniser les effets par la poursuite d’une activité physique régulière. Les préconisations sont proches de celles faites en prévention primaire, avec cependant en préalable la nécessité d’une stratification du risque comportant notamment une évaluation de l’adaptation à l’effort afin de guider l’intensité des exercices et de les sécuriser au maximum (Pedersen et Saltin, 2006 ).
). présente un exemple de recommandations d’activité physique chez un patient coronarien sans insuffisance cardiaque.
présente un exemple de recommandations d’activité physique chez un patient coronarien sans insuffisance cardiaque. ;2Giannuzzi et coll., 2003
;2Giannuzzi et coll., 2003 ).
). ).
). ; Khol et coll., 2001
; Khol et coll., 2001 ; Duncan et coll., 2005
; Duncan et coll., 2005 ).
). ), les auteurs montrent que l’entraînement physique assure une cardioprotection contre les lésions cardiaques résultant des épisodes d’ischémie reperfusion observés lors de la maladie coronaire. En effet, il a été démontré qu’une activité physique d’endurance (60 min par jour, à 60-70 % du VO2 max) apporte, durant les 18 jours suivant la session d’entraînement physique, une protection contre les dommages myocardiques induits par l’ischémie reperfusion.
), les auteurs montrent que l’entraînement physique assure une cardioprotection contre les lésions cardiaques résultant des épisodes d’ischémie reperfusion observés lors de la maladie coronaire. En effet, il a été démontré qu’une activité physique d’endurance (60 min par jour, à 60-70 % du VO2 max) apporte, durant les 18 jours suivant la session d’entraînement physique, une protection contre les dommages myocardiques induits par l’ischémie reperfusion. ). Compte tenu du déconditionnement à l’effort souvent important, le renforcement musculaire contre résistance, est privilégié par rapport à l’entraînement global conventionnel, du moins initialement, car mieux toléré. Secondairement, les exercices aérobies plus globaux sont associés. L’entraînement aérobie se situe à des niveaux variables, entre 40 et 80 % de la consommation d’O2 maximum selon les auteurs (Belardinelli et coll. 1999
). Compte tenu du déconditionnement à l’effort souvent important, le renforcement musculaire contre résistance, est privilégié par rapport à l’entraînement global conventionnel, du moins initialement, car mieux toléré. Secondairement, les exercices aérobies plus globaux sont associés. L’entraînement aérobie se situe à des niveaux variables, entre 40 et 80 % de la consommation d’O2 maximum selon les auteurs (Belardinelli et coll. 1999 ). Un entraînement en « internal training », alternant 30 secondes d’effort à 50 % de la VO2 max avec 60 secondes à niveau supérieur de 20 %, permet d’obtenir un résultat comparable en 3 semaines (Meyer et coll. 1996
). Un entraînement en « internal training », alternant 30 secondes d’effort à 50 % de la VO2 max avec 60 secondes à niveau supérieur de 20 %, permet d’obtenir un résultat comparable en 3 semaines (Meyer et coll. 1996 ). Une amélioration de l’adaptation à l’effort apparaît à partir de la 3e semaine d’un entraînement aérobie, pour atteindre un plateau entre la 16e et la 26e semaine (Kavanagh et coll. 1996
). Une amélioration de l’adaptation à l’effort apparaît à partir de la 3e semaine d’un entraînement aérobie, pour atteindre un plateau entre la 16e et la 26e semaine (Kavanagh et coll. 1996 ).
). ; Quittan et coll., 2001
; Quittan et coll., 2001 ). La force musculaire, la résistance à la fatigue et la qualité de vie sont meilleures après électrostimulation (Nuhr et coll., 2004
). La force musculaire, la résistance à la fatigue et la qualité de vie sont meilleures après électrostimulation (Nuhr et coll., 2004 ). Lorsque l’électrostimulation est comparée à un entraînement aérobie conventionnel, les effets sont identiques sur l’augmentation des capacités aérobies (VO2 max et seuil ventilatoire), sur la fonction évaluée par des tests de marche (test de 6 minutes, test de marche rapide) et sur la force musculaire (Deley et coll., 2005
). Lorsque l’électrostimulation est comparée à un entraînement aérobie conventionnel, les effets sont identiques sur l’augmentation des capacités aérobies (VO2 max et seuil ventilatoire), sur la fonction évaluée par des tests de marche (test de 6 minutes, test de marche rapide) et sur la force musculaire (Deley et coll., 2005 ). Cette technique peut donc être proposée au cours de l’insuffisance cardiaque, lorsque du fait de sa gravité les exercices sont difficiles à mettre en œuvre, voire à risque, ou en cas d’incapacité associée rendant l’entraînement conventionnel impossible (hémiplégie par exemple). Compte tenu de sa bonne tolérance et de son coût limité, elle pourrait être utilisée à domicile à visée d’entretien.
). Cette technique peut donc être proposée au cours de l’insuffisance cardiaque, lorsque du fait de sa gravité les exercices sont difficiles à mettre en œuvre, voire à risque, ou en cas d’incapacité associée rendant l’entraînement conventionnel impossible (hémiplégie par exemple). Compte tenu de sa bonne tolérance et de son coût limité, elle pourrait être utilisée à domicile à visée d’entretien. ), voire de 180 % (Gardner et Poehlman, 1995
), voire de 180 % (Gardner et Poehlman, 1995 ). Cet impact est supérieur à celui d’une revascularisation (angioplastie, pontage), mais sans amélioration des pressions artérielles périphériques (Perkins, 1996
). Cet impact est supérieur à celui d’une revascularisation (angioplastie, pontage), mais sans amélioration des pressions artérielles périphériques (Perkins, 1996 ; Whyman et Ruckley, 1998
; Whyman et Ruckley, 1998 ).
). ) et à la meilleure perfusion musculaire par réduction de la dysfonction endothéliale (Brendle, 2001
) et à la meilleure perfusion musculaire par réduction de la dysfonction endothéliale (Brendle, 2001 ). Elle est supérieure lorsque l’entraînement est contrôlé et personnalisé, comparativement à une activité libre non encadrée (Bendermacher et coll., 2006
). Elle est supérieure lorsque l’entraînement est contrôlé et personnalisé, comparativement à une activité libre non encadrée (Bendermacher et coll., 2006 ). Elle se traduit par une élévation du niveau d’activité et de la qualité de vie (Gardner et coll., 2001
). Elle se traduit par une élévation du niveau d’activité et de la qualité de vie (Gardner et coll., 2001 ). Un meilleur contrôle des facteurs de risque (Izquierdo-Porrera, 2000
). Un meilleur contrôle des facteurs de risque (Izquierdo-Porrera, 2000 ), une amélioration hémorhéologique (Arosio, 2001
), une amélioration hémorhéologique (Arosio, 2001 ) et une réduction du syndrome inflammatoire (Tisi, 1997
) et une réduction du syndrome inflammatoire (Tisi, 1997 ) sont associés à cette augmentation des capacités physiques.
) sont associés à cette augmentation des capacités physiques. ). En revanche, les programmes d’entraînement doivent être prolongés au moins durant 6 mois, et au cours de l’activité de marche les patients doivent aller pour certains jusqu’à l’apparition des douleurs de claudication (Gardner et Poehlman, 1995
). En revanche, les programmes d’entraînement doivent être prolongés au moins durant 6 mois, et au cours de l’activité de marche les patients doivent aller pour certains jusqu’à l’apparition des douleurs de claudication (Gardner et Poehlman, 1995 ). En effet, la question de la provocation des manifestations cliniques d’ischémie musculaire au cours de l’entraînement du claudicant artériel reste posée. Pour certains, la recherche du passage en acidose musculaire est justifiée par la stimulation ainsi induite de la production du facteur endothélial de croissance vasculaire (Pedersen et coll., 2006
). En effet, la question de la provocation des manifestations cliniques d’ischémie musculaire au cours de l’entraînement du claudicant artériel reste posée. Pour certains, la recherche du passage en acidose musculaire est justifiée par la stimulation ainsi induite de la production du facteur endothélial de croissance vasculaire (Pedersen et coll., 2006 ), alors que pour d’autres il est préférable de limiter le stress oxydatif et inflammatoire lié à l’acidose en restant dans les limites de l’indolence (Mika et coll., 2005
), alors que pour d’autres il est préférable de limiter le stress oxydatif et inflammatoire lié à l’acidose en restant dans les limites de l’indolence (Mika et coll., 2005 ), sans parvenir à une ischémie d’effort (Rexroth et coll, 1989
), sans parvenir à une ischémie d’effort (Rexroth et coll, 1989 ).
). ).
). ) et qui peut être amélioré par l’entraînement (Meek et coll., 2003
) et qui peut être amélioré par l’entraînement (Meek et coll., 2003 ; van Peppen et coll., 2004
; van Peppen et coll., 2004 ).
). ). Ce reconditionnement peut être dynamique contre résistance (Teixeira-Salmela et coll., 1999
). Ce reconditionnement peut être dynamique contre résistance (Teixeira-Salmela et coll., 1999 ) ou bien isocinétique (Sharp et Brouwer, 1997
) ou bien isocinétique (Sharp et Brouwer, 1997 ). L’amélioration induite des capacités semble se maintenir à 1 an d’autant plus s’il s’agit d’un programme d’entraînement développé en centre de rééducation plutôt qu’à domicile (Olney et coll., 2006
). L’amélioration induite des capacités semble se maintenir à 1 an d’autant plus s’il s’agit d’un programme d’entraînement développé en centre de rééducation plutôt qu’à domicile (Olney et coll., 2006 ).
). ).
). ).
). ). Cependant, une méta-analyse récente met en évidence une amélioration de la vitesse et de la durée de marche associée à l’augmentation du VO2 max secondaire à un entraînement aérobie (Pang et coll., 2006
). Cependant, une méta-analyse récente met en évidence une amélioration de la vitesse et de la durée de marche associée à l’augmentation du VO2 max secondaire à un entraînement aérobie (Pang et coll., 2006 ).
). ), mais le manque d’études multicentriques menées sur des populations suffisamment homogènes de patients doit faire relativiser ces données.
), mais le manque d’études multicentriques menées sur des populations suffisamment homogènes de patients doit faire relativiser ces données. ). Les femmes ont également un niveau d’activité inférieur (King, 2001
). Les femmes ont également un niveau d’activité inférieur (King, 2001 ). L’anxiété et l’inconfort psychologique sont également des éléments défavorables (Yates et coll., 2003
). L’anxiété et l’inconfort psychologique sont également des éléments défavorables (Yates et coll., 2003 ).
). ). Pourtant, l’efficacité de l’entraînement physique est démontrée chez le sujet âgé (Lavie et Milani, 1995a
). Pourtant, l’efficacité de l’entraînement physique est démontrée chez le sujet âgé (Lavie et Milani, 1995a ) comme chez la femme (Lavie et coll., 1995b
) comme chez la femme (Lavie et coll., 1995b ). Par ailleurs, les complications ne sont pas plus fréquentes chez les sujets âgés et ce sont eux qui présentent le déconditionnement préalable le plus important (Fletcher et coll., 1994
). Par ailleurs, les complications ne sont pas plus fréquentes chez les sujets âgés et ce sont eux qui présentent le déconditionnement préalable le plus important (Fletcher et coll., 1994 ). De plus, l’impact sur la mortalité reste significatif chez le sujet âgé (Wannamethee et coll., 2000
). De plus, l’impact sur la mortalité reste significatif chez le sujet âgé (Wannamethee et coll., 2000 ).
). ). Dans les suites de réadaptation cardiaque, le maintien d’une activité physique régulière semble meilleur si des techniques d’anticipation aux difficultés rencontrées (« coping ») sont mises en place (Sniehotta et coll., 2006
). Dans les suites de réadaptation cardiaque, le maintien d’une activité physique régulière semble meilleur si des techniques d’anticipation aux difficultés rencontrées (« coping ») sont mises en place (Sniehotta et coll., 2006 ).
). ). Quoiqu’il en soit, l’activité physique doit être désormais envisagée comme une thérapeutique à part entière au cours des maladies cardiovasculaires, sa prescription devant tenir compte des risques éventuels (Shephard et Balady, 1999
). Quoiqu’il en soit, l’activité physique doit être désormais envisagée comme une thérapeutique à part entière au cours des maladies cardiovasculaires, sa prescription devant tenir compte des risques éventuels (Shephard et Balady, 1999 ; Pedersen et Saltin, 2006
; Pedersen et Saltin, 2006 ).
). ) et à l’origine de complications souvent liées au caractère instable et vulnérable d’une plaque d’athérome, avec conjonction de facteurs thrombotiques et vasoconstricteurs (Muller, 1999
) et à l’origine de complications souvent liées au caractère instable et vulnérable d’une plaque d’athérome, avec conjonction de facteurs thrombotiques et vasoconstricteurs (Muller, 1999 ). Ces phénomènes peuvent conduire à une rupture de plaque d’athérome avec constitution d’un thrombus à l’origine d’un infarctus du myocarde (Willich et coll., 1993
). Ces phénomènes peuvent conduire à une rupture de plaque d’athérome avec constitution d’un thrombus à l’origine d’un infarctus du myocarde (Willich et coll., 1993 ), avec risque de mort subite (Burke et coll., 1999
), avec risque de mort subite (Burke et coll., 1999 ; Albert et coll., 2000
; Albert et coll., 2000 ). Le caractère instable de la plaque d’athérome apparaît comme essentiel dans la survenue d’un thrombus coronaire, plus que le caractère serré d’une sténose. En effet, ces lésions coronaires sévères ne sont pas les plus fréquemment retrouvées après nécrose myocardique chez le sujet sportif et c’est le caractère vulnérable de la plaque qui domine (Ciampricotti et coll., 1994
). Le caractère instable de la plaque d’athérome apparaît comme essentiel dans la survenue d’un thrombus coronaire, plus que le caractère serré d’une sténose. En effet, ces lésions coronaires sévères ne sont pas les plus fréquemment retrouvées après nécrose myocardique chez le sujet sportif et c’est le caractère vulnérable de la plaque qui domine (Ciampricotti et coll., 1994 ). Ceci complique l’évaluation du risque réel lié à l’activité physique chez le sportif vétéran qui présente souvent des lésions coronaires calcifiées non serrées, dépistées par les techniques récentes d’imagerie non invasive, telles que le scanner multi-barrettes. Ainsi, de telles anomalies sont retrouvées chez 41 % des hommes et 13 % des femmes entre 40 et 49 ans dans la population générale (Cheng et coll., 2003
). Ceci complique l’évaluation du risque réel lié à l’activité physique chez le sportif vétéran qui présente souvent des lésions coronaires calcifiées non serrées, dépistées par les techniques récentes d’imagerie non invasive, telles que le scanner multi-barrettes. Ainsi, de telles anomalies sont retrouvées chez 41 % des hommes et 13 % des femmes entre 40 et 49 ans dans la population générale (Cheng et coll., 2003 ). Ces techniques permettent l’établissement de scores qui pourront peut-être suppléer à l’avenir les carences actuelles dans le dépistage des sujets à risque (Church et coll., 2007
). Ces techniques permettent l’établissement de scores qui pourront peut-être suppléer à l’avenir les carences actuelles dans le dépistage des sujets à risque (Church et coll., 2007 ).
). ).
). ), les incidents s’avérant rares au cours de la pratique du sport (Lampert et coll., 2006
), les incidents s’avérant rares au cours de la pratique du sport (Lampert et coll., 2006 ). Un risque particulier pour ces patients est l’hypoperfusion cérébrale au cours de l’effort observée par le Doppler transcrânien (Hellstrom et coll., 1996
). Un risque particulier pour ces patients est l’hypoperfusion cérébrale au cours de l’effort observée par le Doppler transcrânien (Hellstrom et coll., 1996 ) et la spectroscopie infra-rouge (Koike et coll., 2004
) et la spectroscopie infra-rouge (Koike et coll., 2004 ), ces examens non invasifs pouvant représenter à l’avenir un moyen du dépistage au cours d’un test d’effort des patients les plus exposés.
), ces examens non invasifs pouvant représenter à l’avenir un moyen du dépistage au cours d’un test d’effort des patients les plus exposés. ). Les contre-indications à l’entraînement physique adapté au cours des maladies cardiovasculaires doivent rester exceptionnelles, compte tenu des effets bénéfiques attendus.
). Les contre-indications à l’entraînement physique adapté au cours des maladies cardiovasculaires doivent rester exceptionnelles, compte tenu des effets bénéfiques attendus. ). L’activité physique devient alors un moyen de prévenir les traumatismes notamment liés aux chutes (Guideline for the prevention of falls in older persons, 2001
). L’activité physique devient alors un moyen de prévenir les traumatismes notamment liés aux chutes (Guideline for the prevention of falls in older persons, 2001 ).
). ). Un test d’effort fera partie le plus souvent de ce bilan, cependant les modalités précises en seront appréciées au cas par cas.
). Un test d’effort fera partie le plus souvent de ce bilan, cependant les modalités précises en seront appréciées au cas par cas. ; Siscovick et coll., 1984
; Siscovick et coll., 1984 ), tout particulièrement chez les sportifs âgés de plus de 35 ans (Weaver et coll., 1982
), tout particulièrement chez les sportifs âgés de plus de 35 ans (Weaver et coll., 1982 ). Cependant, ce sont les sujets les plus sédentaires, effectuant un effort violent inhabituel qui sont les plus exposés (Giri et coll., 1999
). Cependant, ce sont les sujets les plus sédentaires, effectuant un effort violent inhabituel qui sont les plus exposés (Giri et coll., 1999 ).
). ; Morris et coll., 1980
; Morris et coll., 1980 ). Des travaux plus récents ont en revanche montré qu’une diminution significative (40 %) du risque de mort subite liée à une activité modérée mais régulière (30 à 60 minutes/jour) (Leon et coll., 1987
). Des travaux plus récents ont en revanche montré qu’une diminution significative (40 %) du risque de mort subite liée à une activité modérée mais régulière (30 à 60 minutes/jour) (Leon et coll., 1987 ; Lemaitre et coll., 1999
; Lemaitre et coll., 1999 ; Whang et coll., 2006
; Whang et coll., 2006 ).
). ).
). ), essentiellement par troubles du rythme. Elles sont responsables d’au moins 40 % des morts subites chez les jeunes sportifs (Maron et coll., 1996
), essentiellement par troubles du rythme. Elles sont responsables d’au moins 40 % des morts subites chez les jeunes sportifs (Maron et coll., 1996 ).
). ). Chez les sujets porteurs d’une dysplasie arythmogène du ventricule droit, un exercice important et prolongé peut entraîner une hyperpression ventriculaire droite avec augmentation du volume du ventricule et accélération de la dégénérescence adipeuse pariétale (Corrado et coll., 1997
). Chez les sujets porteurs d’une dysplasie arythmogène du ventricule droit, un exercice important et prolongé peut entraîner une hyperpression ventriculaire droite avec augmentation du volume du ventricule et accélération de la dégénérescence adipeuse pariétale (Corrado et coll., 1997 ). Au cours du syndrome de Marfan, c’est l’augmentation de la pression sanguine dans l’aorte, associée à l’effort intense, qui est incriminée dans l’aggravation de l’anévrysme (Pyeritz, 2000
). Au cours du syndrome de Marfan, c’est l’augmentation de la pression sanguine dans l’aorte, associée à l’effort intense, qui est incriminée dans l’aggravation de l’anévrysme (Pyeritz, 2000 ).
). ). Le dépistage systématique des cardiopathies à risque chez les athlètes s’est en effet montré efficace dans la prévention de la mort subite avec notamment, au cours d’une étude menée sur 10 ans en Italie, une réduction de 89 % du nombre de décès par l’interdiction de la compétition chez 2 % des sportifs chez lesquels avait été dépistée une cardiomyopathie (Corrado et coll., 2006
). Le dépistage systématique des cardiopathies à risque chez les athlètes s’est en effet montré efficace dans la prévention de la mort subite avec notamment, au cours d’une étude menée sur 10 ans en Italie, une réduction de 89 % du nombre de décès par l’interdiction de la compétition chez 2 % des sportifs chez lesquels avait été dépistée une cardiomyopathie (Corrado et coll., 2006 ). Cependant, ces jeunes patients peuvent vouloir bénéficier des effets, déjà décrits, d’une activité physique adaptée, au moins dans sa dimension psychologique. L’objectif prioritaire est, par l’association de l’adaptation du mode de vie et des différents moyens thérapeutiques (anti-arythmiques, défibrillateur implantable...), de réduire au maximum le risque de troubles du rythme graves (tachycardie et fibrillation ventriculaire). Cependant, compte tenu de la grande variabilité dans l’expression phénotypique et génotypique de ces affections, il s’avère très délicat de formuler des recommandations générales. Des recommandations personnalisées ont donc été proposées, fondées sur un réel dialogue entre le patient et le praticien (Maron et coll., 2004
). Cependant, ces jeunes patients peuvent vouloir bénéficier des effets, déjà décrits, d’une activité physique adaptée, au moins dans sa dimension psychologique. L’objectif prioritaire est, par l’association de l’adaptation du mode de vie et des différents moyens thérapeutiques (anti-arythmiques, défibrillateur implantable...), de réduire au maximum le risque de troubles du rythme graves (tachycardie et fibrillation ventriculaire). Cependant, compte tenu de la grande variabilité dans l’expression phénotypique et génotypique de ces affections, il s’avère très délicat de formuler des recommandations générales. Des recommandations personnalisées ont donc été proposées, fondées sur un réel dialogue entre le patient et le praticien (Maron et coll., 2004 ; Heidbuchel et coll., 2006
; Heidbuchel et coll., 2006 ). Dans cette communication avec le patient, l’accent doit être mis sur l’intérêt de l’activité physique de loisir par opposition à la compétition. Certains sports de loisir peuvent induire un réel effet de compétition entre les participants en conduisant à un excès de sollicitation cardiovasculaire. C’est par exemple le cas des sports collectifs tels que le foot, le rugby, le basket, le handball, le volley, mais ce peut être le cas aussi du squash, du tennis et du badminton. Ils devront être le plus souvent déconseillés.
). Dans cette communication avec le patient, l’accent doit être mis sur l’intérêt de l’activité physique de loisir par opposition à la compétition. Certains sports de loisir peuvent induire un réel effet de compétition entre les participants en conduisant à un excès de sollicitation cardiovasculaire. C’est par exemple le cas des sports collectifs tels que le foot, le rugby, le basket, le handball, le volley, mais ce peut être le cas aussi du squash, du tennis et du badminton. Ils devront être le plus souvent déconseillés. classe les activités sportives en fonction de leur niveau d’intensité et donne les recommandations de pratiques pour les différentes maladies cardiovasculaires génétiques (Maron et coll., 2004
classe les activités sportives en fonction de leur niveau d’intensité et donne les recommandations de pratiques pour les différentes maladies cardiovasculaires génétiques (Maron et coll., 2004 ).
). )
) ne représente qu’un élément d’orientation générale qui ne tient pas compte des différents niveaux d’intensité de chaque activité, des conditions psychologiques et environnementales de chaque situation, des effets des traitements et des spécificités pathologiques de chaque sujet. Il faut donc chaque fois évaluer le rapport bénéfice/risque.
ne représente qu’un élément d’orientation générale qui ne tient pas compte des différents niveaux d’intensité de chaque activité, des conditions psychologiques et environnementales de chaque situation, des effets des traitements et des spécificités pathologiques de chaque sujet. Il faut donc chaque fois évaluer le rapport bénéfice/risque. ) :
) : ) ;
) ; ).
). ) par augmentation de l’agrégation plaquettaire liée à l’action des catécholamines (Ikarugi et coll., 1999
) par augmentation de l’agrégation plaquettaire liée à l’action des catécholamines (Ikarugi et coll., 1999 ), augmentation associée de la production de thrombine (Weiss et coll., 1998
), augmentation associée de la production de thrombine (Weiss et coll., 1998 ), du fibrinogène et du facteur von Willebrand (Wang et coll., 1997
), du fibrinogène et du facteur von Willebrand (Wang et coll., 1997 ).
).