Activité physique et pathologies
2008
17-
Cancer
Les cancers les plus fréquents chez l’homme et la femme sont respectivement le cancer de la prostate et le cancer du sein, ils représentent à eux seuls plus de 80 000 nouveaux cas estimés en 2000 en France (Remontet et coll., 2003). Ils sont suivis en terme de fréquence par le cancer du poumon et du côlon chez l’homme et dans l’ordre inverse chez la femme (respectivement 2e et 4e). La prévention de la survenue de ces différents types de cancers représente un véritable enjeu de santé publique où l’activité physique pourrait jouer un rôle important. En effet, des études montrant une association entre prévention de certains cancers et activité physique ont été publiées ces dernières années, en particulier pour les cancers du côlon, du sein, du poumon et de la prostate. Des études recherchant une association sont en cours pour d’autres localisations. Par ailleurs, des travaux suggèrent des effets bénéfiques de l’activité physique chez des patients atteints de cancer en accompagnement du traitement.
Cancer du côlon
C’est pour le cancer du côlon qu’il existe le plus grand nombres d’études convaincantes sur l’effet bénéfique de l’activité physique (Rapport du
Surgeon General, 1996; Lee, 2003

; Roberts et Barnard, 2005

; Kruk et Aboul-Enein, 2006

).
Effet préventif
L’évidence scientifique d’un effet bénéfique de l’activité physique sur la prévention du cancer du côlon est de type « convaincant » (Friedenreich et Oreinstein, 2002

). Cette caractérisation repose sur les définitions développées par le Fond de recherche mondial sur le cancer et l’Institut américain de recherche sur le cancer (niveau d’évidence scientifique allant de « convaincant » à « probable », « limité » puis « insuffisant ») (pour les définitions, voir Kruk et Aboul-Enein, 2006

). En effet, sur les 51 études répertoriées par Friedenreich et Oreinstein (2002

), portant sur le cancer du côlon et le cancer colorectal, 43 ont démontré une diminution du risque chez les sujets ayant l’activité physique la plus intense avec une réduction moyenne de 40 à 50 %. Sur les 29 études ayant recherché un effet dose-réponse, 25 ont montré qu’une augmentation du niveau d’activité physique était associée à une diminution du risque (Friedenreich et Oreinstein, 2002

). Cet effet protecteur de l’activité physique pour le cancer du côlon n’est en revanche pas retrouvé pour le cancer du rectum.
Des travaux récents ont étudié le rôle de l’activité physique dans la prévention du cancer du côlon et du rectum à partir de la cohorte européenne EPIC (
European Prospective Investigation into Cancer and Nutrition) qui inclut 413 044 hommes et femmes (Friedenreich et coll., 2007

). Cette étude confirme l’absence d’effet de l’activité physique sur le cancer du rectum et la réduction du risque de cancer du côlon (20 à 25 %), en particulier sur les tumeurs du côté droit et chez les sujets présentant un poids normal (35 %). Cette réduction du risque est également observée dans les populations en surpoids et chez les sujets obèses.
Les relations entre le niveau d’activité physique et les facteurs de risque du cancer du côlon (régime riche, consommation faible de légumes et de fibres, poids, tabagisme…) ont été étudiées par Slattery et Potter (2002

). Les auteurs ont montré que les facteurs de risque ne peuvent pas être des facteurs de confusion dans l’association activité physique-prévention du risque de cancer du côlon. De plus, l’activité physique semble avoir une influence sur l’importance relative des autres facteurs et en particulier sur le régime alimentaire et le poids (tableau 17.I

).
Tableau 17.I Interactions (odds ratio, IC 95 %) entre le niveau d’activité physique à long terme chez l’homme et la femme et des facteurs de risque du cancer du côlon (d’après Slattery et Potter, 2002 )
)
| |
Activité physique*
|
| |
Élevée
|
Intermédiaire
|
Faible
|
|
Indice de masse corporelle (IMC)
| | | |
|
Faible
|
1,0**
|
1,1 [0,8-1,6]
|
1,3 [0,9-1,9]
|
|
Intermédiaire
|
1,1 [0,8-1,6]
|
1,5 [1,1-2,0]
|
2,0 [1,4-2,8]
|
|
Élevé
|
1,2 [0,8-1,7]
|
1,9 [1,3-2,6]
|
2,4 [1,7-3,5]
|
|
Apport énergétique
| | | |
|
Faible
|
1,0
|
1,2 [0,8-1,8]
|
1,4 [0,9-2,2]
|
|
Intermédiaire
|
1,0 [0,7-1,5]
|
1,4 [1,0-2,0]
|
1,8 [1,3-2,7]
|
|
Élevé
|
1,3 [0,8-2,1]
|
2,0 [1,3-2,9]
|
2,5 [1,6-4,0]
|
*L’activité physique a été estimée sur 20 ans. Trois niveaux d’activité physique ont été définis : sédentaire, intermédiaire, élevé (pour une méthodologie plus détaillée, voir Slattery et Potter, 2002 )
)
**Odds ratio (IC 95 %)
Caractéristiques de l’activité physique
Les caractéristiques d’une activité physique qui pourrait avoir un effet de protection vis-à-vis du cancer du côlon sont très controversées, les données de la littérature étant très contradictoires. Les catégorisations et les méthodes de mesure de l’activité physique sont certainement à l’origine de ces divergences. Un effet protecteur des activités professionnelles est quelquefois observé et les activités physiques de loisir sembleraient également avoir une influence (Quadrilatero et Hoffman-Goetz, 2003

; Isomura et coll., 2006

). Récemment, Larsson et coll. (2006

) montrent que, chez les hommes uniquement, les activités physiques de loisir et domestiques sont associées à une diminution du risque de développer un cancer du côlon. En revanche, aucun effet de l’activité physique professionnelle n’est observé.
Bien que les résultats soient hétérogènes, 30 à 60 minutes par jour d’activité physique d’intensité modérée à élevée semblent suffisantes pour réduire le risque de cancer du côlon (Lee, 2003

). Dans l’étude de Friedenreich et coll. (2007

), une heure par jour d’activité intense (MET=6) ou deux heures d’activité modérée (MET=3) sont nécessaires pour observer une réduction du risque chez l’homme et la femme. Dans l’étude de Wolin et coll. (2007

), une heure de marche par semaine chez les femmes apparaît suffisante pour réduire le risque.
En ce qui concerne l’intensité de l’activité physique, les résultats montrent qu’un niveau élevé d’activité physique est associé à une réduction du risque. Par exemple, dans la
Nurses’Health Study (Martinez et coll., 1997

), la diminution du risque atteint 33 % pour les exercices d’intensité modérée et 46 % pour les exercices intenses. Cet effet dose-réponse est retrouvé dans une étude plus récente sur la même cohorte (Wolin et coll., 2007

).
En tenant compte de l’ensemble des études, les recommandations actuelles préconisent un cumul de plusieurs sessions d’activité physique quotidiennes supérieures à 10 minutes.
Caractéristiques de la population
L’activité physique a un effet protecteur sur le développement du cancer du côlon chez l’homme et chez la femme. Les personnes présentant une surcharge pondérale sont plus exposées au risque de cancer (Lee et coll., 1997

; Thune et Furberg, 2001

) (risque relatif de 1 pour les sujets de poids normal et de 1,7 pour les sujets obèses dans l’étude de Lee et coll., 1997

).
Concernant la période optimale de pratique physique, pour maximaliser l’effet protecteur, les auteurs préconisent une pratique physique régulière tout au long de la vie (Thune et Furberg, 2001

; Steindorf et coll., 2005

).
Cancer du sein
Plusieurs études ont montré que la pratique d’une activité physique joue un rôle de protection vis-à-vis du cancer du sein. Pour l’IARC
1
International Agency for Research on Cancer
(2002), l’activité physique exerce un effet préventif sur le cancer du sein avec un niveau de preuve suffisante.
Effet préventif
En 2002, sur les 44 études portant sur le cancer du sein, 32 ont montré une diminution du risque chez les sujets ayant l’activité physique la plus importante (Friedenreich et Orenstein, 2002

). En 2006, 45 sur 64 études ont montré une diminution du risque chez les sujets ayant l’activité physique la plus importante avec une réduction moyenne de 30 à 40 % (Kruk et Aboul-Enein, 2006

). Sur les 23 études ayant recherché un effet dose-réponse, 20 ont établi qu’une augmentation du niveau d’activité physique était associée à une diminution du risque.
Ces résultats ont été confirmés et précisés dans une revue récente des articles publiés entre 1994 et 2006 sur les relations entre risque de cancer du sein et activité physique (Monninkhof et coll., 2007

). La qualité méthodologique de ces articles a été évaluée sur la base d’un score statistique. Ainsi, sur 76 études identifiées, 48 ont été retenues (incluant de 50 à 7 000 sujets) dont 19 analyses de cohortes et 29 études cas-témoins. Du fait de l’hétérogénéité méthodologique de ces études, l’analyse statistique de type métaanalyse n’a pas été possible. Les résultats mettent en évidence une association inverse entre activité physique et cancer du sein chez la femme ménopausée avec une réduction des risques allant de 20 à 80 % selon les études. Pour les femmes non ménopausées, l’association est moins forte. Quand l’ensemble des femmes est considéré, quel que soit le statut ménopausique, l’activité physique est associée avec une diminution modérée du risque (15 à 20 %). Près de la moitié de ces études rapportent une relation dose-réponse.
Dans un rapport récent (
World Cancer Research Fund/
American Institute for Cancer Research, 2007

), l’activité physique a un effet protecteur probable sur le cancer du sein chez les femmes ménopausées ; chez les femmes non ménopausées, les preuves d’un effet protecteur sont limitées.
Caractéristiques de l’activité physique
Les études épidémiologiques font état d’une relation inverse entre l’activité physique et le développement du cancer du sein. Cependant, les caractéristiques de l’activité sont loin de faire l’unanimité. En effet, certains auteurs rapportent que les activités physiques d’intensité modérée, telles que les activités professionnelles et domestiques sont les plus préventives (Friedenreich et coll., 2001a

). Par ailleurs, la diminution du risque est identique pour les activités physiques d’intensité modérée et élevée (Drake, 2001

; John et coll., 2003

). Ainsi, quatre heures par semaine d’activité physique d’intensité modérée (4-5 MET/h/sem) ou élevée (24,5 MET/h/sem) semblent donner des résultats équivalents (Thune et Furberg, 2001

). En revanche, d’autres études mettent en avant l’importance des activités physiques de loisir à intensité élevée (Tehard et coll., 2006

).
Enfin récemment, l’étude française de la cohorte E3N fait état d’une baisse du risque relatif de 18 % lorsque les activités ménagères sont d’intensité légère alors que cette diminution est de 38 % lorsque l’activité est d’intensité élevée (Tehard et coll., 2006

), un effet dose-réponse étant également démontré pour ces activités ménagères. Cet effet dose-réponse est observé dans 50 % des études qui ont rapporté une diminution du risque (Lee, 2003

; Monninkhof et coll., 2007

). Dans la
Nurses’ Health Study, la comparaison de l’intensité la plus faible à la plus élevée montre qu’il n’existe pas d’intérêt supplémentaire à augmenter l’intensité de l’activité physique au-dessus de 9-14 MET/h/semaine (Holmes et coll., 2005

).
L’activité physique joue par ailleurs un rôle en prévention secondaire du cancer du sein. Des études récentes montrent qu’une activité physique de type marche (3 à 5 h par semaine) diminue le risque de décès par cancer du sein ou de récidive d’un cancer du sein de 20 à 50 % chez des femmes préalablement traitées pour un cancer du sein au stade I, II ou III (Holmes et coll., 2005

).
Caractéristiques de la population
Les résultats concernant l’âge auquel l’exercice doit être pratiqué pour prévenir le cancer du sein divergent. Les variations peuvent être expliquées par les caractéristiques différentes de l’activité physique proposée et par la période d’intervention. En effet, Thune et coll. (1997

) font état de meilleurs résultats chez les femmes non ménopausées que chez les femmes ménopausées. Les résultats de Dorn et coll. (2003

) montrent des effets identiques chez les femmes non ménopausées ou ménopausées. Par ailleurs, Lee et coll. (2001a

) mettent en évidence une diminution du risque plus importante chez les femmes ménopausées que chez les femmes non ménopausées. La récente revue de littérature de Monninkhof et coll. (2007

) confirme ces derniers résultats. De plus, dans cette revue, une analyse de tendance sur 17 études cas-témoins montre que le risque de développer un cancer du sein diminue de 6 % chaque fois que l’on ajoute une heure d’activité par semaine, montrant que le niveau d’activité physique est essentiel.
Plusieurs travaux ont montré un effet significatif du statut pondéral et du niveau d’indice de masse corporelle sur le développement du cancer du sein (Verloop et coll., 2000

; McTiernan et coll., 2003

). La perte de masse corporelle est associée à un effet protecteur de l’activité physique sur ce cancer (Bardia et coll., 2006

). Cependant, chez des femmes jeunes, Abrahamson et coll. (2006

) ont rapporté que l’activité physique était protectrice même chez les femmes en surpoids.
Période optimale de pratique physique
Plusieurs travaux ont tenté de déterminer l’existence d’une période de la vie au cours de laquelle les effets protecteurs seraient maximaux. La période pubertaire, période importante de changements hormonaux, apparaît comme une période essentielle pour la pratique d’une activité physique ayant des effets bénéfiques à long terme (Marcus et coll., 1999

; Verloop et coll., 2000

; Thune et Furberg, 2001

). D’autres auteurs font état d’un lien plus fort entre la pratique à l’âge adulte et la prévention du cancer du sein (Verloop et coll., 2000

; Adams-Campbell et coll., 2001

). En résumé, un continuum de la pratique physique tout au long de la vie apparaît comme le moyen préventif le plus adapté (Friedenreich et coll., 2001b

; Lee et coll., 2001b

; Matthews et coll., 2001

; Dorn et coll., 2003

).
Cancer de l’endomètre
En 2002, l’IARC classait les effets préventifs de l’activité physique sur le cancer de l’endomètre avec un niveau de preuve limitée.
Dans une revue sur le cancer de l’endomètre (Cust et coll., 2007

), 18 études d’association avec l’activité physique ont été répertoriées. Dans 14 études sur 18, une réduction du risque de 30 % en moyenne est observée et une relation dose-réponse est rapportée dans 7 études sur 13. En résumé, il existe probablement un lien entre l’activité physique et la réduction du risque de cancer de l’endomètre mais l’effet dose-réponse n’est pas clairement établi.
Une étude de cohorte prospective suédoise (
Swedish Mammography cohort) incluant 33 723 femmes dont 199 cas de cancer de l’endomètre montre, après ajustement sur les facteurs de confusion, un lien inverse faible entre l’activité physique et la survenue de ce cancer. Elle met également en évidence que le temps d’inactivité pendant les loisirs est statistiquement associé avec un risque accru de cancer de l’endomètre (RR=1,66 ; IC 95 % [1,05-2,61]) (Friberg et coll., 2006

).
Une analyse du lien entre activité physique et risque de cancer de l’endomètre a été entreprise dans la
European Prospective Investigation into Cancer and Nutrition (EPIC) (Friedenreich et coll., 2007

). Dans cette cohorte de 253 023 femmes, 689 cas de cancers de l’endomètre ont été identifiés pendant une durée moyenne de 6,6 années. L’étude ne retrouve pas d’association claire entre le cancer de l’endomètre et tous les types d’activité physique (RR=0,88 ; IC 95 % [0,61-1,27]). En revanche, l’association est plus évidente pour les femmes non ménopausées ayant été actives
versus peu actives (RR=0,66 ; IC 95 % [0,38-1,14]). Parmi les femmes non ménopausées, cette association est plus importante pour les activités ménagères (RR=0,48 ; IC 95 % [0,23-0,99]) et de loisir (RR=0,78 ; IC 95 % [0,44-1,39]).
En 2007, dans le rapport du World Cancer Research Fund/American Institute for Cancer Research, il est indiqué que l’activité physique exerce un effet protecteur probable vis-à-vis du cancer de l’endomètre.
Cancer du poumon
Pour le cancer du poumon, la preuve d’un effet protecteur de l’activité physique est considérée comme limitée. En 2002, l’IARC indiquait qu’il n’était pas possible d’apporter une conclusion sur l’effet de l’activité physique sur le cancer du poumon (inadequate evidence).
Effet préventif
Dans la revue de Lee (2003

), sur les 21 études menées aux États-Unis et en Europe portant sur le cancer du poumon, la plupart ont montré une diminution du risque chez les sujets ayant une activité physique. Cette réduction varie de 20 à 60 % selon l’intensité de l’activité. Cependant, une étude a rapporté une augmentation du risque de 40 %. Dans la plupart de ces études, le rôle du tabac a été contrôlé. Il faut remarquer que la plupart du temps les sujets sportifs sont non fumeurs et ont donc une faible incidence du cancer du poumon. Néanmoins, les effets bénéfiques de l’activité physique apparaissent même lorsque les sujets sont fumeurs (Mao et coll., 2003

; Kubik et coll., 2004

; Tardon et coll., 2005

).
En 2007, le rapport du World Cancer Research Fund/American Institute for Cancer Research indique des preuves limitées pour l’effet de l’activité physique sur le cancer du poumon.
Caractéristiques de l’activité physique
Un effet dose-réponse a été observé conduisant à recommander au moins 4 h/semaine d’activité physique de loisir d’intensité modérée à élevée (>4-5 METs) (Thune et Furberg, 2001

). Plus récemment, Steindorf et coll. (2006

) rapportant les résultats de l’étude prospective européenne (
European Prospective Investigation into Cancer and Nutrition Cohort) incluant 9 pays, 416 227 participants et 1 000 cancers du poumon enregistrés, mettent en évidence une réduction significative du risque du cancer du poumon associée aux activités sportives et de loisir d’intensité élevée. En revanche, l’activité physique professionnelle ne diminue pas ce risque.
Caractéristiques de la population
Un effet protecteur de l’activité physique chez l’homme a été démontré pour une activité de 12 600 kJ par semaine, obtenus par 6 à 8 heures d’activité physique d’intensité au moins modérée (Lee et coll., 1999

). Concernant l’effet du sexe, les résultats sont divergents. La méta-analyse conduite par Tardon et coll. (2005

) fait état d’un effet plus protecteur chez la femme que chez l’homme, alors que l’étude de Mao et coll. (2003

) met en évidence un effet identique pour les deux sexes. Thune et Lund (1997

) rapportent un effet protecteur plus important chez l’homme que chez la femme. Toutefois, la publication récente se rapportant à
The Iowa women’s Health study incluant 36 929 femmes suivies de 1986 à 2002 met en évidence un effet protecteur de l’activité physique sur le cancer du poumon des femmes fumeuses actuelles ou passées (Sinner et coll., 2006

).
Cancer de la prostate
En 2002, la relation entre l’activité physique et le cancer de la prostate est classée comme preuve limitée par l’IARC.
Plusieurs revues de la littérature ayant analysé le lien entre l’activité physique et la survenue d’un cancer de la prostate concluent à une association inverse entre cancer de la prostate et activité physique (Friedenreich et Thune, 2001

) ou ne sont pas en faveur d’un rôle protecteur de l’activité physique (Thune et Fulberg, 2001

; Lee, 2003

).
Une revue récente (Kruk et Aboul-Enein, 2006

) rapporte que sur les 37 études publiées, la moitié ont montré que l’activité physique diminuait le risque de cancer de la prostate de 10 à 30 % (Friedenreich et Orenstein, 2002

). Une relation dose-réponse est retrouvée dans 10 études sur 19.
Une étude cas-témoin canadienne (Friedenreich et coll., 2004) ne montre pas d’association avec l’activité physique vie entière mesurée en MET par année quand on compare les quartiles d’activité les plus élevés et les plus bas. Cependant, quand les auteurs examinent la relation en fonction de l’intensité de l’activité physique, ils constatent que les hommes qui ont une activité vigoureuse ont une réduction du risque de 30 % comparés à ceux qui ont une activité physique de faible intensité.
Les résultats des différentes études restent encore trop contradictoires (certaines études rapportent une augmentation du risque de cancer de la prostate avec l’activité physique) pour tirer une conclusion définitive.
En 2007, le rapport du World Cancer Research Fund/American Institute for Cancer Research ne prend pas position sur la relation entre l’activité physique et le cancer de la prostate, et suggère une réduction du risque pour les formes agressives de ce cancer.
Autres cancers
Il existe d’autres cancers pour lesquels le lien entre activité physique et sur-venue d’un cancer a été exploré : cancer de l’ovaire, cancer du testicule (Thune et Furberg, 2001

). Les résultats sont encore insuffisants pour en tirer des conclusions claires.
Pour le cancer de l’ovaire, quatre études cas-témoins suggèrent un lien faible entre activité physique et réduction du risque de cancer de l’ovaire (Bertone et coll., 2002

; Zhang et coll., 2003

; Riman et coll., 2004

; Pan et coll., 2005

). Une étude prospective de cohorte (27 365 personnes, 121 cas de cancer de l’ovaire sur un suivi de 227 045 personnes-années) ne retrouve pas d’association significative entre l’activité physique et le risque de cancer de l’ovaire bien que les résultats tendent vers une relation inverse (Hannan et coll., 2004

).
Depuis la revue de Thune et Fulberg (2001

), aucune nouvelle étude sur le lien entre la survenue d’un cancer du testicule et l’activité physique n’a été publiée.
D’autres localisations telles que le pancréas et l’estomac ont fait l’objet d’études récentes. Aucune association n’a été retrouvée pour le cancer du pancréas dans l’
European Prospective Investigation into Cancer and Nutrition (EPIC) (Berrington de Gonzalez et coll., 2006

). En 2007, dans le rapport du
World Cancer Research Fund/
American Institute for Cancer Research, les auteurs indiquent un niveau de preuve limité pour le cancer du pancréas. Une association inverse entre une activité physique intense au cours de la vie et le cancer de l’estomac a été observée (Campbell et coll., 2007

).
Activité physique pendant et après le traitement d’un cancer
Plus de 40 essais randomisés et contrôlés publiés depuis 1980 ont rapporté que l’activité physique améliore les capacités fonctionnelles, la qualité de vie et la qualité du sommeil des patients atteints d’un cancer, pour tous les types de cancers bien que le plus étudié soit le cancer du sein (McNeely et coll., 2006

). D’autres études sont cependant nécessaires pour confirmer ce résultat à long terme sur la qualité de vie des anciens patients (Stevinson et coll., 2004

).
Une méta-analyse sur 32 études fait état de résultats bénéfiques pour le cancer du sein dans le cas d’interventions de 5 semaines à 3 mois réalisées pendant et après traitement par radiothérapie (Schmitz et coll., 2005

). L’activité physique améliore les aptitudes cardio-respiratoires pendant et après le traitement, les symptômes et les effets physiologiques pendant le traitement ainsi que la condition physique après le traitement. L’activité physique proposée était de type aérobie à intensité modérée à élevée de 3 à 5 fois par semaine d’une durée de 20 à 30 minutes par session. Les programmes structurés pendant 12 semaines ont aussi fait leurs preuves en améliorant la tolérance à l’exercice, la qualité du sommeil et la qualité de vie (Young-McCaughan et coll., 2003

).
Plusieurs travaux portant sur l’effet de l’activité physique lors du traitement par chimiothérapie pour le cancer du sein font état de nombreuses améliorations de paramètres psychologiques tels que la fatigue, l’anxiété, la dépression, le sommeil et l’image du corps (Mock et coll., 1997

). Un effet dose-réponse sur la fatigue est observé pour des sessions de durée inférieure à 60 minutes (Schwartz et coll., 2001

).
En revanche, les traitements chez les patients âgés (>65 ans) sont plus délicats que chez les patients plus jeunes. Aucune étude ne s’est intéressée à l’exercice chez les anciens patients âgés. Pour cette population, la proposition est de cumuler au moins 30 minutes d’activité physique d’intensité modérée aérobie (55-70 % de la fréquence cardiaque maximale) tous les jours de la semaine (Courneya et coll., 2004

).
Pour les anciennes patientes, l’activité physique recommandée après un cancer du sein est une activité de type aérobie d’intensité modérée (50 à 75 % de la fréquence cardiaque de réserve) trois à cinq jours par semaine et d’une durée de 20 à 60 minutes par session. Enfin, les anciens patients (cancer du côlon) qui ont pratiqué une activité physique d’intensité modérée à élevée pendant le traitement ont de meilleurs résultats posttraitement au niveau fonctionnel, physique, émotionnel et du bien-être (Courneya et coll., 2002

).
Recommandations d’activité physique
Suite à leur revue de littérature, Courneya et coll. (2002

) ont établi les recommandations d’activité physique aérobie pour les patients et anciens patients (tableau 17.II

).
Tableau 17.II Recommandations pour les patients et anciens patients (activité aérobie) (d’après Courneya et coll., 2002 )
)
|
Paramètres
|
Recommandations et commentaires
|
|
Mode
|
Marche, cyclisme et tai chi chuan…
|
| |
Mobiliser les grands groupes musculaires
|
|
Fréquence
|
Au moins 3 à 5 fois/semaine, si possible quotidien
|
|
Intensité
|
Intensité faible à modérée
|
| |
50-75 % VO2 max1 ou FCres2
|
| |
60-80 % FCres
|
| |
RPE3 de 11-14
|
|
Durée
|
Au moins 20-30 min d’activité continue
|
| |
Intérêt de l’intermittent (5-10 min)
|
1 VO2 max : Consommation maximale en oxygène
2 FCres (Fréquence cardiaque de réserve) = FC maximale–FC de repos
3 RPE : Score de perception des contraintes de l’effort
À partir des travaux de Courneya et coll. (2002

) pour le cancer du sein et ceux de Segal et coll. (2001

) pour le cancer de la prostate, des recommandations d’activité contre résistance ont été établies (tableau 17.III

).
Tableau 17.III Recommandations pour les patients et anciens patients (activité contre résistance) (d’après Segal et coll., 2001 ; Courneya et coll., 2002
; Courneya et coll., 2002 )
)
|
Paramètres
|
Recommandations et commentaires
|
|
Groupe musculaire et exercice
|
Intégrer des sessions de musculation et de stretching
|
|
Fréquence
|
3 séances d’entraînement par semaine avec 1 jour de récupération
|
|
Intensité
|
Faible charge et faible incrémentation (<10 % de la charge par semaine)
7 à 10 min d’étirement avant et après chaque séance
|
|
Durée
|
2 séries de 10 répétitions de chaque exercice pour les 2 premières semaines, puis passer à 2 séries de 15 répétitions
|
Il est nécessaire de prendre en compte l’état de fatigue des patients avant de prescrire un programme d’activité physique. Une prescription appropriée doit circonscrire et prévenir les risques. Par exemple, les anciennes patientes atteintes d’un cancer du sein avec des atteintes osseuses ou des métastases doivent plutôt pratiquer la natation. De même, des personnes qui présentent une fatigue importante doivent pratiquer une activité à intensité très modérée (Courneya et coll., 2002

).
Mécanismes des effets préventifs de l’activité physique sur certains cancers
L’effet bénéfique de l’activité physique sur la prévention de certains cancers fait intervenir soit des effets systémiques de l’activité physique soit des effets locaux. Les principaux mécanismes qui pourraient expliquer l’effet bénéfique de l’activité physique sur le risque de cancer sont liés à des effets sur les taux circulants d’hormones sexuelles et de facteurs de croissances (Insulin-like Growth Factor-I ou IGF-I), sur la masse corporelle et l’adiposité abdominale. D’autres facteurs sont probablement impliqués dans les effets de l’activité physique sur la prévention des cancers et des recherches sont en cours pour mieux comprendre ces mécanismes.
Effets systémiques de l’activité physique
L’activité physique régulière joue un rôle protecteur sur certains cancers en modulant la concentration plasmatique de certains facteurs (hormones, facteurs de croissance) qui vont agir à distance de leur site de production (foie, tissu adipeux).
Diminution de la fraction biologiquement active (fraction libre) des hormones sexuelle
L’effet préventif de l’activité physique est montré pour certains cancers hormono-dépendants par des études épidémiologiques. En effet, la pratique d’une activité physique induit une diminution du risque de développer le cancer du sein, de l’endomètre et de la prostate. Cet effet bénéfique pourrait être lié à la modulation du taux circulant d’hormones sexuelles par l’activité physique.
L’augmentation de l’exposition aux estrogènes endogènes pendant toute la vie à travers les événements naturels liés à la vie génitale (puberté précoce, âge tardif de la ménopause, âge tardif lors de la première grossesse, absence d’allaitement ou augmentation du nombre de cycles ovulatoires) ou à travers des variations individuelles des concentrations d’estrogènes est un facteur de risque connu du cancer du sein chez la femme non ménopausée comme chez la femme ménopausée (Toniolo et coll., 1995

; Cauley et coll., 1999

; Russo et coll., 2006

).
Le cancer de la prostate est associé à une augmentation de la concentration de la fraction biologiquement active (fraction libre) de la testostérone (Gann et coll., 1996

).
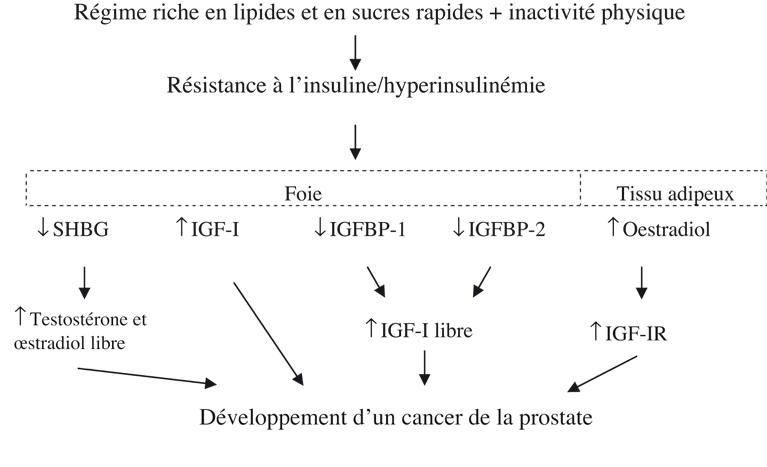
Pour ces deux types de cancer, l’activité physique régulière peut diminuer le risque en diminuant la production endogène des estrogènes et de la progestérone mais aussi en augmentant la SHBG (
Sex Hormone Binding Globulin) dont la production hépatique est inhibée par l’insuline et l’IGF-I mais stimulée par l’estradiol et la testostérone. Elle lie ces hormones et diminue leur fraction libre c’est-à-dire biologiquement active. Néanmoins, les effets de l’activité physique sur la SHBG dépendent aussi de la diététique (régime normo- ou hypocalorique, alimentation riche en fibres…) (Longcope et coll., 2000

) et sont parfois confondus avec les effets de l’exercice. Plusieurs études ont rapporté une relation inverse entre concentration plasmatique d’insuline (hyperinsulinémie avec un régime trop riche en lipides et sucres rapides et inactivité physique) et concentration plasmatique de SHBG (pour revue, et coll., 2002

). La figure 17.1

présente une hypothèse explicative des voies de régulation mises en jeux par l’inactivité physique associée à un régime trop riche dans le développement d’un cancer de la prostate. Le facteur protecteur qu’est l’activité physique (associé à un régime pauvre en graisse et sucres rapides) pourrait agir en inversant ces différentes voies.
Diminution de l’insuline et de l’IGF-I
L’obésité et la sédentarité induisent une insulino-résistance et un hyperinsulinisme compensatoire. L’insulino-résistance est associée à une cohorte d’altérations métaboliques définissant le syndrome métabolique et conduisant à une diminution de la SHBG et des IGFBP et donc à une augmentation de la fraction libre, biologiquement active, des hormones liées à ces protéines (œstradiol et androgènes pour la SHBG, IGF-I pour les IGFBP).
L’activité physique régulière diminue l’insulinémie (pour une même glycémie) (Ebeling et coll., 1993

; Kuo et coll., 1999

; pour revue, Leung et coll., 2004

) par augmentation de la sensibilité à l’insuline. Par ailleurs, il a été montré que des concentrations élevées d’insuline plasmatiques et d’IGF-I sont associées à un risque accru de cancer du côlon (pour revue, Giovannucci, 2001

). Des concentrations élevées d’IGF-I ont également été associées à un risque augmenté de cancer du sein et de cancer de la prostate (Friedenreich et Orenstein, 2002

). Les effets directs de l’activité physique sur l’IGF-I sont contradictoires, certaines études montrent une diminution et d’autres aucune variation. En revanche, les études sont plus concordantes pour montrer que l’activité physique régulière diminue la masse grasse et, par ce biais, diminue certaines IGFBP et en augmente d’autres, dont celles qui lient l’IGF-I, diminuant ainsi la fraction libre de l’IGF-I (Yu et coll., 2000

; Tymchuk et coll., 2001

; Barnard et coll., 2003

). En effet, dans le plasma, l’IGF-I circule majoritairement (99 %) liée à des protéines de liaison (IGFBPs) dont il existe 6 isoformes. La principale, IGFBP-3, est GH dépendante. IGBP-1 et IGFBP-2 sont régulées négativement par l’insuline. Les rôles respectifs des IGFBPs sont encore débattus. Leur rôle essentiel est de limiter les effets de l’IGF-I sur les tissus cibles, notamment dans la limitation de la croissance tumorale.
L’IGF-I est un facteur mitogène puissant dans les tissus, incluant la prostate (Leroith et Roberts, 2003

). Barnard et coll. (2002

) ont développé un modèle leur permettant d’explorer le rôle de l’IGF-I et de ses protéines porteuses (Ngo et coll., 2003

). Ils ont incubé des cellules cancéreuses de prostate (cellules LNCaP : lignée de cellules de cancer de la prostate androgénodépendantes) avec du sérum de sujets sédentaires et de sujets entraînés en endurance afin d’examiner les effets des modifications du mode de vie sur la croissance de ces cellules
in vitro. Quand ces cellules sont incubées avec du sérum provenant de sujets ayant suivi pendant 11 jours un programme associant activité physique et diététique, la croissance des cellules LNCaP diminue de 30 % par rapport aux sujets témoins. Le sérum obtenu chez les sujets ayant adhéré à ce programme (activité physique + régime pauvre en lipides et riche en fibres) pendant 14 ans induit une diminution supplémentaire de la croissance des cellules LNCaP de 15 % (Tymchuk et coll., 2001

). Ces résultats ont été confirmés par Ngo et coll. (2003

) sur une autre lignée cellulaire. Afin de dissocier les effets de l’activité physique de ceux de la diététique, Barnard et coll. (2003

) ont utilisé les sérums de sujets soumis à un programme seulement diététique et ceux de sujets soumis à un programme exclusivement d’activité physique sur une longue période (depuis 14,5 ans, 5 jours/semaine avec une heure par séance). Par rapport aux sujets témoins appariés pour l’âge, les concentrations plasmatiques d’insuline et d’IGF-I sont plus basses et celles d’IGFBP-1 plus élevées chez les sujets entraînés. Quand leur sérum est mis à incuber avec des cellules LNCaP, la croissance de ces cellules est diminuée dans le groupe « exercice » de 65 % et dans le groupe « diététique » (régime normocalorique pauvre en lipides <10 % ration et riche en fibres) de 55 %. On observe une augmentation significative de l’apoptose. Quand l’IGF-I est ajouté au sérum post-intervention, la réduction de la croissance des cellules LNCaP est abolie. Inversement, quand l’IGFBP-1 est ajoutée au sérum de base, la croissance des LNCaP diminue significativement (Ngo et coll., 2003

).
En plus d’être un régulateur de la croissance cellulaire, l’IGF-I inhibe l’apoptose. Un des mécanismes proposés de l’effet de l’IGF-I est que ce facteur de croissance supprime l’action de la p53 qui joue un rôle dans l’arrêt du cycle cellulaire, la réparation de l’ADN et l’induction de l’apoptose. Des défauts du gène codant pour p53 ont été rapportés dans les stades terminaux des cancers de la prostate. L’expression de la protéine p53 est significativement augmentée dans les lysats de cellules LNCaP incubées avec du sérum des sujets du groupe « exercice » (Leung et coll., 2004

). De plus, PCNA, un marqueur de cycle cellulaire, est diminué de 33 % dans les lysats de cellules LNCaP incubées avec du sérum des sujets du groupe « exercice ». En revanche, quand c’est la lignée cellulaire LN-56 qui est utilisée (lignée de cellules LNCaP dans laquelle la p53 est rendue non fonctionnelle par l’expression d’un mutant dominant négatif de la p53), il n’y a pas de différences de croissance entre les sujets du groupe exercice et ceux du groupe témoin. Enfin, quand un bloqueur du récepteur de l’IGF-I (AC anti-récepteur ou un inhibiteur de kinase) est ajouté dans le sérum des sujets du groupe témoin, la croissance cellulaire des LNCaP est diminuée et l’apoptose augmente au niveau observé dans les groupes exercice ou diététique. Ces résultats démontrent que la diminution de l’IGF-I et l’augmentation de l’IGFBP-1 obtenues après observance d’un régime pauvre en graisses et/ou l’adoption d’une activité physique régulière permettent aux cellules tumorales prostatiques de stabiliser la protéine p53 et d’activer des mécanismes en aval afin de diminuer la croissance tumorale et d’induire l’apoptose de ces cellules tumorales. L’ensemble de ces résultats suggère un mécanisme possible pour expliquer en partie les données épidémiologiques montrant une diminution du risque de cancer de la prostate chez les hommes qui ont une activité physique régulière.
Utilisant la même technique que décrite précédemment pour le cancer de la prostate, Barnard et coll. (2006

) ont incubé le sérum de femmes ménopausées (avec ou sans traitement hormonal de la ménopause) en surpoids ou obèses avec 3 types de lignées cellulaires tumorales de cancer du sein exprimant des récepteurs aux œstrogènes. La croissance tumorale des 3 lignées cellulaires est significativement diminuée de 6 à 18 % après 11 jours d’intervention (suivi d’un régime normocalorique mais pauvre en lipides et riche en fibres) et l’apoptose est augmentée de 20 à 30 % selon les lignées cellulaires. Biologiquement, les concentrations plasmatiques d’insuline, estradiol et IGF-I sont diminuées (-20 à -35 %) tandis que l’IGFBP-1 est augmentée (+30 %) (p<0,05 pour chacune de ces hormones). Cet effet est observé que les femmes soient sous traitement hormonal substitutif de la ménopause ou non. Arteaga et Osborne (1989

) avaient rapporté une diminution de la croissance de 6 types sur 7 de lignées tumorales de cancer du sein après blocage du récepteur de l’IGF-I. Cette étude montre que 11 jours d’intervention associant diététique et activité physique diminuent de façon significative plusieurs facteurs de risques de cancer du sein. Il reste à démontrer cependant leur pertinence clinique.
Pour le cancer du côlon, des études réalisées chez l’animal ont également mis en évidence le rôle de la concentration plasmatique de l’IGF-I dans la stimulation de la croissance d’explants de tumeur colique, l’IGF-I agissant à la fois sur la prolifération tumorale mais également sur l’apoptose (Dunn et coll., 1997

; Wu et coll., 2002

). L’activité physique pourrait avoir un effet protecteur en diminuant la concentration plasmatique d’IGF-I.
Effets sur la masse grasse
Les effets de l’activité physique régulière sur la diminution de la masse grasse sont bien démontrés y compris sur les sujets normo-pondérés (Holcomb et coll., 2004

; Williams, 2005

).
Les études épidémiologiques ont montré des associations positives entre surpoids et adiposité et certains cancers. Les évidences sont de niveau modéré à fort pour montrer qu’une masse corporelle élevée est associée à un risque plus important de cancer du côlon, rein, œsophage, endomètre et cancer du sein de la femme ménopausée. En effet, cet excès de masse grasse se traduit par une augmentation de l’insulino-résistance (cf. paragraphe effets de l’insuline), une augmentation de l’IGF-I et diminution des IGFBP et une diminution de la SHBG (Yu et coll., 2000

; Tymchuk et coll., 2001

; Barnard et coll., 2003

).
Effets locaux de l’activité physique
Dans le cas particulier du cancer du côlon, deux types de mécanismes ont été proposés pour expliquer les effets protecteurs de l’activité physique régulière sur la survenue de ce cancer :
• l’augmentation de la motilité intestinale. L’activité physique induit une réduction du temps de transit gastro-intestinal et donc une diminution de l’opportunité pour les cancérigènes d’être en contact avec la muqueuse coli-que et le contenu fécal ;
• modifications des concentrations de prostaglandines. L’exercice musculaire intense peut induire une augmentation des prostaglandines PGF qui inhibent la prolifération des cellules coliques et augmentent la motilité intestinale. En revanche, l’activité physique n’augmente pas le taux de PGE2 (
Prostaglandin E2) qui, au contraire, stimulent la prolifération des cellules coliques (Martinez et coll., 1999

).
Autres hypothèses
D’autres mécanismes biologiques ont été proposés (diminution du stress oxydatif, effets sur l’immunité). Il est évident que les effets bénéfiques de l’activité physique sont dépendants de mécanismes multiples intriqués entre eux. Néanmoins, le niveau de l’évidence scientifique pour chacun d’entre eux est encore bas et des recherches sont nécessaires pour déterminer quels sont les mécanismes opérant pour chaque type de cancer.
De nouvelles données suggèrent que l’activité physique régulière pourrait protéger de la survenue d’autres cancers : estomac (Campbell et coll., 2007

), endomètre (Matthews et coll., 2005

) et les mécanismes des effets bénéfiques de l’activité physique demandent à être préciser pour ces localisations.
Les mécanismes d’action connus pour les cancers de la prostate, du sein et du côlon ne permettent pas encore de proposer un (ou des) modèle(s) explicatif(s) bien établi(s), des voies de régulations restent encore à explorer et en particuliers celles situées en aval de la voie IGF-I/IGFBP.
Des données récentes montrent que l’activité physique régulière améliore aussi la survie après traitement d’un cancer et surtout la qualité de la survie (diminution de l’asthénie post traitement, amélioration des symptômes secondaires au traitement). Les mécanismes de ces effets bénéfiques restent à déterminer et sur le plan clinique des questions importantes se posent sur le moment de début de l’activité physique par rapport au traitement, et sur les caractéristiques de l’activité physique (dose, durée et intensité).
En conclusion, l’activité physique a un effet préventif convaincant sur le cancer du côlon, et probable sur le cancer du sein (chez les femmes ménopausées) et le cancer de l’endomètre. En revanche, les preuves sont limitées pour les cancers du poumon et de la prostate. Pour les autres cancers, cet effet reste à démontrer. Le plus souvent, un effet dose-réponse est observé pour une activité d’intensité modérée à élevée, une activité physique trop intense n’engendrant pas des bénéfices plus importants. Pendant et après le traitement, une activité physique adaptée d’intensité faible à modérée améliore la qualité de vie et diminue la sensation de fatigue.
Les mécanismes sous-tendant l’effet bénéfique de l’activité physique sur la prévention de certains cancers commencent à être identifiés. Cependant, des travaux sont nécessaires pour mieux comprendre ces mécanismes qui représentent encore un champ de recherche insuffisamment exploré.
Bibliographie
[1] abrahamson pe,
gammon md,
lund mj,
britton ja,
marshall sw, et coll.. Recreational physical activity and survival among young women with breast cancer.
Cancer. 2006;
107:1777
-1785

[2] adams-campbell ll,
rosenberg l,
rao rs,
palmer jr. Strenuous physical activity and breast cancer risk in African-American women.
J Natl Med Assoc. 2001;
93:267
-27

[3] arteaga cl,
osborne ck. Growth inhibition of human breast cancer cells in vitro with an antibody against the type I somatomedin receptor.
Cancer Res. 1989;
49:6237
-6241

[4] bardia a,
hartmann lc,
vachon cm,
vierkant ra,
wang ah, et coll.. Recreational physical activity and risk of postmenopausal breast cancer based on hormone receptor status.
Arch Intern Med. 2006;
166:2478
-2483

[5] barnard rj,
aronson wj,
tymchuk cn,
ngo th. Prostate cancer: another aspect of the insulin-resistance syndrome?.
Ob Rev. 2002;
3:303
-308

[6] barnard rj,
ngo th,
leung ps,
aronson wj,
golding la. A low-fat diet and/or strenuous exercise alters the IGF axis in vivo and reduces prostate tumor cell growth in vitro.
Prostate. 2003;
56:201
-206

[7] barnard rj,
gonzalez jh,
liva me,
ngo th. Effects of a low-fat, high-fiber diet and exercise program on breast cancer risk factors in vivo and tumor cell growth and apoptosis in vitro.
Nutr Cancer. 2006;
55:28
-34

[8] berrington de gonzalez a,
spencer ea,
bueno-de-mesquita hb,
roddam a,
stolzenberg-solomon r, et coll.. Anthropometry, physical activity, and the risk of pancreatic cancer in the European prospective investigation into cancer and nutrition.
Cancer Epidemiol Biomarkers Prev. 2006;
15:879
-885

[9] bertone er,
newcomb pa,
willett wc,
stampfer mj,
egan km. Recreational physical activity and ovarian cancer in a population-based case-control study.
Int J Cancer. 2002;
99:431
-436

[10] campbell pt,
sloan m,
kreiger n. Physical activity and stomach cancer risk: The influence of intensity and timing during the lifetime.
Eur J Cancer. 2007;
43:593
-600

[11] cauley ja,
gutai jp,
kuller lh,
ledonne d,
powell jg. The epidemiology of serum sex hormones in postmenopausal women.
Am J Epidemiol. 1989;
129:1120
-1131

[12] courneya ks,
mackey jr,
mckenzie dc. Exercise for breast cancer survivors: research evidence and clinical guidelines.
The Physician and Sports Medicine. 2002;
30:1
-17

[13] courneya ks,
vallance jk,
mcneely ml,
karvinen kh,
peddle cj, et coll.. Exercise issues in older cancer survivors.
Crit Rev Oncol Hematol. 2004;
51:249
-261

[14] cust ae,
armstrong bk,
friedenreich cm,
slimani n,
bauman a. Physical activity and endometrial cancer risk: a review of the current evidence, biologic mechanisms and the quality of physical activity assessment methods.
Cancer Causes Control. 2007;
18:243
-258

[15] dorn j,
vena j,
brasure j,
freudenheim j,
graham s. Lifetime physical activity and breast cancer risk in pre- and postmenopausal women.
Med Sci Sports Exerc. 2003;
35:278
-285

[16] drake da. A longitudinal study of physical activity and breast cancer prediction.
Cancer Nurs. 2001;
24:371
-377

[17] dunn se,
kari fw,
french j,
leininger jr,
travlos g, et coll.. Dietary restriction reduces insulin-like growth factor I levels, which modulates apoptosis, cell proliferation, and tumor progression in p53-deficient mice.
Cancer Res. 1997;
57:4667
-4672

[18] ebeling p,
bourey r,
koranyi l,
tuominen ja,
groop lc, et coll.. Mechanism of enhanced insulin sensitivity in athletes. Increased blood flow, muscle glucose transport protein (GLUT-4) concentration, and glycogen synthase activity.
J Clin Invest. 1993;
92:1623
-1631

[19] friberg e,
mantzoros cs,
wolk a. Physical activity and risk of endometrial cancer: A population-based prospective cohort study.
Cancer Epidemiol Biomarkers Prev. 2006;
15:2136
-2140

[20] friedenreich cm. Physical activity and cancer prevention: from observational to intervention research.
Cancer Epidemiol Biomarkers Prev. 2001;
10:287
-301

[21] friedenreich cm,
thune i. A review of physical activity and prostate cancer risk.
Cancer Causes Control. 2001;
12:461
-475

[22] friedenreich cm,
orenstein mr. Physical activity and cancer prevention: etiologic evidence and biological mechanisms.
J Nutr. 2002;
132:3456S
-3464S

[23] friedenreich cm,
courneya ks,
bryant he. Relation between intensity of physical activity and breast cancer risk reduction.
Med Sci Sports Exerc. 2001a;
33:1538
-1545

[24] friedenreich cm,
courneya ks,
bryant he. Influence of physical activity in different age and life periods on the risk of breast cancer.
Epidemiology. 2001b;
12:604
-612

[25] friedenreich c,
cust a,
lahmann ph,
steindorf k,
boutron-ruault mc,
clavel-chapelon f, et coll.. Physical activity and risk of endometrial cancer: The European prospective investigation into cancer and nutrition.
Int J Cancer. 2007;
121:347
-355

[26] gann ph,
hennekens ch,
ma j,
longcope c,
stampfer mj. Prospective study of sex hormone levels and risk of prostate cancer.
J Natl Cancer Inst. 1996;
88:1118
-1126

[27] giovannucci e. Insulin, insulin-like growth factors and colon cancer: a review of the evidence.
J Nutr. 2001;
131:3109S
-3120S

[28] hannan lm,
leitzmann mf,
lacey jv jr,
colbert lh,
albanes d,
schatzkin a,
schairer c. Physical activity and risk of ovarian cancer: a prospective cohort study in the United States.
Cancer Epidemiol Biomarkers Prev. 2004;
13:765
-770

[29] holcomb ca,
heim dl,
loughin tm. Physical activity minimizes the association of body fatness with abdominal obesity in white, premenopausal women: results from the Third National Health and Nutrition Examination Survey.
J Am Diet Assoc. 2004;
104:1859
-1862

[30] holmes md,
chen wy,
feskanich d,
kroenke ch,
colditz ga. Physical activity and survival after breast cancer diagnosi.
JAMA. 2005;
293:2479
-2486

[31] isomura k,
kono s,
moore ma,
toyomura k,
nagano j, et coll.. Physical activity and colorectal cancer: the Fukuoka Colorectal Cancer Study.
Cancer Sci. 2006;
97:1099
-1104

[32] john em,
horn-ross pl,
koo j. Lifetime physical activity and breast cancer risk in a multiethnic population: the San Francisco Bay area breast cancer study.
Cancer Epidemiol Biomarkers Prev. 2003;
12:1143
-1152

[33] kruk j,
aboul-enein hy. Physical activity in the prevention of cancer.
Asian Pac J Cancer Prev. 2006;
7:11
-21

[34] kubik a,
zatloukal p,
tomasek l,
pauk n,
petruzelka l,
plesko i. Lung cancer risk among nonsmoking women in relation to diet and physical activity.
Neoplasma. 2004;
51:136
-143

[35] kuo ch,
hunt dg,
ding z,
ivy jl. Effect of carbohydrate supplementation on postexercise GLUT-4 protein expression in skeletal muscle.
J Appl Physiol. 1999;
87:2290
-2295

[36] larsson sc,
rutegard j,
bergkvist l,
wolk a. Physical activity, obesity, and risk of colon and rectal cancer in a cohort of Swedish men.
Eur J Cancer. 2006;
42:2590
-2597

[37] lee im. Physical activity and cancer prevention--data from epidemiologic studies.
Med Sci Sports Exerc. 2003;
35:1823
-1827

[38] lee im,
manson je,
ajani u,
paffenbarger rs jr,
hennekens ch, et coll.. Physical activity and risk of colon cancer: the Physicians’ Health Study (United States).
Cancer Causes Control. 1997;
8:568
-574

[39] lee im,
sesso hd,
paffenbarger rs jr. Physical activity and risk of lung cancer.
Int J Epidemiol. 1999;
28:620
-625

[40] lee im,
rexrode km,
cook nr,
hennekens ch,
burin je. Physical activity and breast cancer risk: the Women’s Health Study (United States).
Cancer Causes Control. 2001a;
12:137
-145

[41] lee im,
cook nr,
rexrode km,
buring je. Lifetime physical activity and risk of breast cancer.
Br J Cancer. 2001b;
85:962
-965

[42] leroith d,
roberts ct. The insulin-like growth factor system and cancer.
Cancer Lett.. 2003;
195:127
-137

[43] leung ps,
aronson wj,
ngo th,
golding la,
barnard rj. Exercise alters the IGF axis in vivo and increases p53 protein in prostate tumor cells in vitro.
J Appl.Physiol. 2004;
96:450
-454

[44] longcope c,
feldman ha,
mckinlay jb,
araujo ab. Diet and sex hormone-bind ing globulin.
J.Clin.Endocrinol.Metab. 2000;
85:293
-296

[45] mao y,
pan s,
wen sw,
johnson kc. Physical activity and the risk of lung cancer in Canada.
Am J Epidemiol. 2003;
158:564
-575

[46] marcus pm,
newman b,
moorman pg,
millikan rc,
baird dd, et coll.. Physical activity at age 12 and adult breast cancer risk (United States).
Cancer Causes Control. 1999;
10:293
-302

[47] martinez me,
giovannucci e,
spiegelman d,
hunter dj,
willett wc,
colditz ga. Leisure-time physical activity, body size, and colon cancer in women.
J Natl Cancer Inst. 1997;
89:948
-55

[48] martinez me,
heddens d,
earnest dl,
bogert cl,
roe d, et coll.. Physical activity, body mass index, and prostaglandin E2 levels in rectal mucosa.
J Natl.Cancer Inst. 1999;
91:950
-953

[49] matthews ce,
shu xo,
jin f,
dai q,
hebert jr, et coll.. Lifetime physical activity and breast cancer risk in the Shanghai Breast Cancer Study.
Br J Cancer. 2001;
84:994
-1001

[50] matthews ce,
xu wh,
zhengw ,
gao yt,
ruan zx, et coll.. Physical activity and risk of endometrial cancer: a report from the Shanghai endometrial cancer study.
Cancer Epidemiol Biomarkers Prev. 2005;
14:779
-785

[51] mcneely ml,
campbell kl,
rowe bh,
klassen tp,
mackey jr, et coll.. Effects of exercise on breast cancer patients and survivors: a systematic review and meta-analysis.
CMAJ. 2006;
175:34
-41

[52] mctiernan a,
koopergerg c,
white e,
wilcox s,
coates r, et coll.. Recreational physical activity and the risk of breast cancer in postmenopausal women. The Women’s Health Initiative Cohort Study.
JAMA. 2003;
290:1331
-1336

[53] mock v,
dow kh,
meares cj,
grimm pm,
dienemann ja, et coll.. Effects of exercise on fatigue, physical functioning, and emotional distress during radiation therapy for breast cancer.
Oncol Nurs Forum. 1997;
24:991
-1000

[54] monninkhof em,
elias sg,
vlems fa,
van der tweel i,
schuit aj, et coll.. Physical activity and breast cancer: A systematic review.
Epidemiology. 2007;
18:137
-157

[55] ngo th,
barnard rj,
leung ps,
cohen p,
aronson wj. Insulin-like growth factor I (IGF-I) and IGF binding protein-1 modulate prostate cancer cell growth and apoptosis: possible mediators for the effects of diet and exercise on cancer cell survival.
Endocrinology. 2003;
144:2319
-2324

[56] pan sy,
ugnat am,
mao y. Physical activity and the risk of ovarian cancer: A case-control study in Canada.
Int J Cancer. 2005;
117:300
-307

[57] quadrilatero j,
hoffman-goetz l. Physical activity and colon cancer. A systematic review of potential mechanisms.
J Sports Med Phys Fitness. 2003;
43:121
-138

[58] riman t,
dickman pw,
nilsson s,
nordlinder h,
magnusson cm,
persson ir. Some life-style factors and the risk of invasive epithelial ovarian cancer in Swedish women.
Eur J Epidemiol. 2004;
19:1011
-1019

[59] roberts ck,
barnard rj. Effects of exercise and diet on chronic disease.
J Appl Physiol. 2005;
98:3
-30

[60] russo j,
fernandez sv,
russo pa,
fernbaugh r,
sheriff fs, et coll.. 17-Betaestradiol induces transformation and tumorigenesis in human breast epithelial cells.
FASEB J. 2006;
20:1622
-1634

[61] schmitz kh,
holtzman j,
courneya ks,
masse lc,
duval s, et coll.. Controlled physical activity trials in cancer survivors: a systematic review and meta-analysis.
Cancer Epidemiol Biomarkers Prev. 2005;
14:1588
-1595

[62] schwartz al,
mori m,
gao r,
nail lm,
king me. Exercise reduces daily fatigue in women with breast cancer receiving chemotherapy.
Med Sci Sports Exerc. 2001;
33:718
-723

[63] segal r,
evans w,
johnson d,
smith j,
colletta s, et coll.. Structured exercise improves physical functioning in women with stages I and II breast cancer: results of a randomized controlled trial.
J Clin Oncol. 2001;
19:657
-665

[64] sinner p,
folsom ar,
harnack l,
eberly le,
schmitz kh. The association of physical activity with lung cancer incidence in a cohort of older women: the Iowa Women’s Health Study.
Cancer Epidemiol Biomarkers Prev. 2006;
15:2359
-2363

[65] slattery ml,
potter jd. Physical activity and colon cancer: confounding or interaction?.
Med Sci Sports Exerc. 2002;
34:913
-919

[66] steindorf k,
jedrychowski w,
schmidt m,
popiela t,
penar a, et coll.. Case-control study of lifetime occupational and recreational physical activity and risks of colon and rectal cancer.
Eur J Cancer Prev. 2005;
14:363
-371

[67] steindorf k,
friedenreich c,
linseisen j,
rohrmann s,
rundle a, et coll.. Physical activity and lung cancer risk in the European Prospective Investigation into Cancer and Nutrition Cohort.
Int J Cancer. 2006;
119:2389
-2397

[68] stevinson c,
lawlor da,
fox kr. Exercise interventions for cancer patients: systematic review of controlled trials.
Cancer causes & control. 2004;
15:1035
-1056

[69] tardon a,
lee wj,
delgado-rodriguez m,
dosemeci m,
albanes d, et coll.. Leisure-time physical activity and lung cancer: a meta-analysis.
Cancer Causes Control. 2005;
16:389
-397

[70] tehard b,
friedenreich cm,
oppert jm,
clavel-chapelon f. Effect of physical activity on women at increased risk of breast cancer: results from the E3N cohort study.
Cancer Epidemiol Biomarkers Prev. 2006;
15:57
-64

[71] thune i,
lund e. The influence of physical activity on lung-cancer risk: A prospective study of 81,516 men and women.
Int J Cancer. 1997;
70:57
-62

[72] thune i,
furberg as. Physical activity and cancer risk: dose-response and cancer, all sites and site-specific.
Med Sci Sports Exerc. 2001;
33:S530
-S550

[73] thune i,
brenn t,
lund e,
gaard m. Physical activity and the risk of breast cancer.
N Engl J Med. 1997;
336:1269
-1275

[74] toniolo pg,
levitz m,
zeleniuch-jacquotte a,
banerjee s,
koenig kl, et coll.. A prospective study of endogenous estrogens and breast cancer in postmenopausal women.
J Natl Cancer Inst. 1995;
87:190
-197

[75] tymchuk cn,
barnard rj,
heber d,
aronson wj. Evidence of an inhibitory effect of diet and exercise on prostate cancer cell growth.
J Urol. 2001;
166:1185
-1189

[76] verloop j,
rookus ma,
van der kk,
van leeuwen fe. Physical activity and breast cancer risk in women aged 20-54 years.
J Natl Cancer Inst. 2000;
92:128
-135

[77] vgontzas an,
mastorakos g,
bixler eo,
kales a,
gold pw,
chrousos gp. Sleep deprivation effects on the activity of the hypothalamic-pituitary-adrenal and growth axes: potential clinical implications.
Clin Endocrinol (Oxf). 1999;
51:205
-215

[78] williams pt. Nonlinear relationships between weekly walking distance and adiposity in 27,596 women 2.
Med Sci Sports Exerc. 2005;
37:1893
-1901

[79] wolin ky,
lee im,
colditz ga,
glynn rj,
fuchs c,
giovannucci e. Leisure-time physical activity patterns and risk of colon cancer in women.
Int J Cancer. 2007;
121:2776
-2781

[80]world cancer research fund, american institute for cancer research. Food, Nutrition, Physical Activity, and the Prevention of Cancer: a Global Perspective.
Washington DC:AICR. 2007;

[81] wu y,
yakar s,
zhao l,
hennighausen l,
leroith d. Circulating insulin-like growth factor-I levels regulate colon cancer growth and metastasis.
Cancer Res. 2002;
62:1030
-1035

[82] young-mccaughan s,
mays mz,
arzola sm,
yoder lh,
dramiga sa, et coll.. Research and commentary: Change in exercise tolerance, activity and sleep patterns, and quality of life in patients with cancer participating in a structured exercise program.
Oncol Nurs Forum. 2003;
30:441
-454

[83] yu h,
rohan t. Role of the insulin-like growth factor family in cancer development and progression.
J Natl Cancer Inst. 2000;
92:1472
-1489

[84] zhang m,
lee ah,
binns cw. Physical activity and epithelial ovarian cancer risk: a case-control study in China.
Int J Cancer. 2003;
105:838
-843

→ Aller vers SYNTHESE
 ; Roberts et Barnard, 2005
; Roberts et Barnard, 2005 ; Kruk et Aboul-Enein, 2006
; Kruk et Aboul-Enein, 2006 ).
). ). Cette caractérisation repose sur les définitions développées par le Fond de recherche mondial sur le cancer et l’Institut américain de recherche sur le cancer (niveau d’évidence scientifique allant de « convaincant » à « probable », « limité » puis « insuffisant ») (pour les définitions, voir Kruk et Aboul-Enein, 2006
). Cette caractérisation repose sur les définitions développées par le Fond de recherche mondial sur le cancer et l’Institut américain de recherche sur le cancer (niveau d’évidence scientifique allant de « convaincant » à « probable », « limité » puis « insuffisant ») (pour les définitions, voir Kruk et Aboul-Enein, 2006 ). En effet, sur les 51 études répertoriées par Friedenreich et Oreinstein (2002
). En effet, sur les 51 études répertoriées par Friedenreich et Oreinstein (2002 ), portant sur le cancer du côlon et le cancer colorectal, 43 ont démontré une diminution du risque chez les sujets ayant l’activité physique la plus intense avec une réduction moyenne de 40 à 50 %. Sur les 29 études ayant recherché un effet dose-réponse, 25 ont montré qu’une augmentation du niveau d’activité physique était associée à une diminution du risque (Friedenreich et Oreinstein, 2002
), portant sur le cancer du côlon et le cancer colorectal, 43 ont démontré une diminution du risque chez les sujets ayant l’activité physique la plus intense avec une réduction moyenne de 40 à 50 %. Sur les 29 études ayant recherché un effet dose-réponse, 25 ont montré qu’une augmentation du niveau d’activité physique était associée à une diminution du risque (Friedenreich et Oreinstein, 2002 ). Cet effet protecteur de l’activité physique pour le cancer du côlon n’est en revanche pas retrouvé pour le cancer du rectum.
). Cet effet protecteur de l’activité physique pour le cancer du côlon n’est en revanche pas retrouvé pour le cancer du rectum. ). Cette étude confirme l’absence d’effet de l’activité physique sur le cancer du rectum et la réduction du risque de cancer du côlon (20 à 25 %), en particulier sur les tumeurs du côté droit et chez les sujets présentant un poids normal (35 %). Cette réduction du risque est également observée dans les populations en surpoids et chez les sujets obèses.
). Cette étude confirme l’absence d’effet de l’activité physique sur le cancer du rectum et la réduction du risque de cancer du côlon (20 à 25 %), en particulier sur les tumeurs du côté droit et chez les sujets présentant un poids normal (35 %). Cette réduction du risque est également observée dans les populations en surpoids et chez les sujets obèses. ). Les auteurs ont montré que les facteurs de risque ne peuvent pas être des facteurs de confusion dans l’association activité physique-prévention du risque de cancer du côlon. De plus, l’activité physique semble avoir une influence sur l’importance relative des autres facteurs et en particulier sur le régime alimentaire et le poids (tableau 17.I
). Les auteurs ont montré que les facteurs de risque ne peuvent pas être des facteurs de confusion dans l’association activité physique-prévention du risque de cancer du côlon. De plus, l’activité physique semble avoir une influence sur l’importance relative des autres facteurs et en particulier sur le régime alimentaire et le poids (tableau 17.I ).
). )
) )
) ; Isomura et coll., 2006
; Isomura et coll., 2006 ). Récemment, Larsson et coll. (2006
). Récemment, Larsson et coll. (2006 ) montrent que, chez les hommes uniquement, les activités physiques de loisir et domestiques sont associées à une diminution du risque de développer un cancer du côlon. En revanche, aucun effet de l’activité physique professionnelle n’est observé.
) montrent que, chez les hommes uniquement, les activités physiques de loisir et domestiques sont associées à une diminution du risque de développer un cancer du côlon. En revanche, aucun effet de l’activité physique professionnelle n’est observé. ). Dans l’étude de Friedenreich et coll. (2007
). Dans l’étude de Friedenreich et coll. (2007 ), une heure par jour d’activité intense (MET=6) ou deux heures d’activité modérée (MET=3) sont nécessaires pour observer une réduction du risque chez l’homme et la femme. Dans l’étude de Wolin et coll. (2007
), une heure par jour d’activité intense (MET=6) ou deux heures d’activité modérée (MET=3) sont nécessaires pour observer une réduction du risque chez l’homme et la femme. Dans l’étude de Wolin et coll. (2007 ), une heure de marche par semaine chez les femmes apparaît suffisante pour réduire le risque.
), une heure de marche par semaine chez les femmes apparaît suffisante pour réduire le risque. ), la diminution du risque atteint 33 % pour les exercices d’intensité modérée et 46 % pour les exercices intenses. Cet effet dose-réponse est retrouvé dans une étude plus récente sur la même cohorte (Wolin et coll., 2007
), la diminution du risque atteint 33 % pour les exercices d’intensité modérée et 46 % pour les exercices intenses. Cet effet dose-réponse est retrouvé dans une étude plus récente sur la même cohorte (Wolin et coll., 2007 ).
). ; Thune et Furberg, 2001
; Thune et Furberg, 2001 ) (risque relatif de 1 pour les sujets de poids normal et de 1,7 pour les sujets obèses dans l’étude de Lee et coll., 1997
) (risque relatif de 1 pour les sujets de poids normal et de 1,7 pour les sujets obèses dans l’étude de Lee et coll., 1997 ).
). ; Steindorf et coll., 2005
; Steindorf et coll., 2005 ).
). ). En 2006, 45 sur 64 études ont montré une diminution du risque chez les sujets ayant l’activité physique la plus importante avec une réduction moyenne de 30 à 40 % (Kruk et Aboul-Enein, 2006
). En 2006, 45 sur 64 études ont montré une diminution du risque chez les sujets ayant l’activité physique la plus importante avec une réduction moyenne de 30 à 40 % (Kruk et Aboul-Enein, 2006 ). Sur les 23 études ayant recherché un effet dose-réponse, 20 ont établi qu’une augmentation du niveau d’activité physique était associée à une diminution du risque.
). Sur les 23 études ayant recherché un effet dose-réponse, 20 ont établi qu’une augmentation du niveau d’activité physique était associée à une diminution du risque. ). La qualité méthodologique de ces articles a été évaluée sur la base d’un score statistique. Ainsi, sur 76 études identifiées, 48 ont été retenues (incluant de 50 à 7 000 sujets) dont 19 analyses de cohortes et 29 études cas-témoins. Du fait de l’hétérogénéité méthodologique de ces études, l’analyse statistique de type métaanalyse n’a pas été possible. Les résultats mettent en évidence une association inverse entre activité physique et cancer du sein chez la femme ménopausée avec une réduction des risques allant de 20 à 80 % selon les études. Pour les femmes non ménopausées, l’association est moins forte. Quand l’ensemble des femmes est considéré, quel que soit le statut ménopausique, l’activité physique est associée avec une diminution modérée du risque (15 à 20 %). Près de la moitié de ces études rapportent une relation dose-réponse.
). La qualité méthodologique de ces articles a été évaluée sur la base d’un score statistique. Ainsi, sur 76 études identifiées, 48 ont été retenues (incluant de 50 à 7 000 sujets) dont 19 analyses de cohortes et 29 études cas-témoins. Du fait de l’hétérogénéité méthodologique de ces études, l’analyse statistique de type métaanalyse n’a pas été possible. Les résultats mettent en évidence une association inverse entre activité physique et cancer du sein chez la femme ménopausée avec une réduction des risques allant de 20 à 80 % selon les études. Pour les femmes non ménopausées, l’association est moins forte. Quand l’ensemble des femmes est considéré, quel que soit le statut ménopausique, l’activité physique est associée avec une diminution modérée du risque (15 à 20 %). Près de la moitié de ces études rapportent une relation dose-réponse. ), l’activité physique a un effet protecteur probable sur le cancer du sein chez les femmes ménopausées ; chez les femmes non ménopausées, les preuves d’un effet protecteur sont limitées.
), l’activité physique a un effet protecteur probable sur le cancer du sein chez les femmes ménopausées ; chez les femmes non ménopausées, les preuves d’un effet protecteur sont limitées. ). Par ailleurs, la diminution du risque est identique pour les activités physiques d’intensité modérée et élevée (Drake, 2001
). Par ailleurs, la diminution du risque est identique pour les activités physiques d’intensité modérée et élevée (Drake, 2001 ; John et coll., 2003
; John et coll., 2003 ). Ainsi, quatre heures par semaine d’activité physique d’intensité modérée (4-5 MET/h/sem) ou élevée (24,5 MET/h/sem) semblent donner des résultats équivalents (Thune et Furberg, 2001
). Ainsi, quatre heures par semaine d’activité physique d’intensité modérée (4-5 MET/h/sem) ou élevée (24,5 MET/h/sem) semblent donner des résultats équivalents (Thune et Furberg, 2001 ). En revanche, d’autres études mettent en avant l’importance des activités physiques de loisir à intensité élevée (Tehard et coll., 2006
). En revanche, d’autres études mettent en avant l’importance des activités physiques de loisir à intensité élevée (Tehard et coll., 2006 ).
). ), un effet dose-réponse étant également démontré pour ces activités ménagères. Cet effet dose-réponse est observé dans 50 % des études qui ont rapporté une diminution du risque (Lee, 2003
), un effet dose-réponse étant également démontré pour ces activités ménagères. Cet effet dose-réponse est observé dans 50 % des études qui ont rapporté une diminution du risque (Lee, 2003 ; Monninkhof et coll., 2007
; Monninkhof et coll., 2007 ). Dans la Nurses’ Health Study, la comparaison de l’intensité la plus faible à la plus élevée montre qu’il n’existe pas d’intérêt supplémentaire à augmenter l’intensité de l’activité physique au-dessus de 9-14 MET/h/semaine (Holmes et coll., 2005
). Dans la Nurses’ Health Study, la comparaison de l’intensité la plus faible à la plus élevée montre qu’il n’existe pas d’intérêt supplémentaire à augmenter l’intensité de l’activité physique au-dessus de 9-14 MET/h/semaine (Holmes et coll., 2005 ).
). ).
). ) font état de meilleurs résultats chez les femmes non ménopausées que chez les femmes ménopausées. Les résultats de Dorn et coll. (2003
) font état de meilleurs résultats chez les femmes non ménopausées que chez les femmes ménopausées. Les résultats de Dorn et coll. (2003 ) montrent des effets identiques chez les femmes non ménopausées ou ménopausées. Par ailleurs, Lee et coll. (2001a
) montrent des effets identiques chez les femmes non ménopausées ou ménopausées. Par ailleurs, Lee et coll. (2001a ) mettent en évidence une diminution du risque plus importante chez les femmes ménopausées que chez les femmes non ménopausées. La récente revue de littérature de Monninkhof et coll. (2007
) mettent en évidence une diminution du risque plus importante chez les femmes ménopausées que chez les femmes non ménopausées. La récente revue de littérature de Monninkhof et coll. (2007 ) confirme ces derniers résultats. De plus, dans cette revue, une analyse de tendance sur 17 études cas-témoins montre que le risque de développer un cancer du sein diminue de 6 % chaque fois que l’on ajoute une heure d’activité par semaine, montrant que le niveau d’activité physique est essentiel.
) confirme ces derniers résultats. De plus, dans cette revue, une analyse de tendance sur 17 études cas-témoins montre que le risque de développer un cancer du sein diminue de 6 % chaque fois que l’on ajoute une heure d’activité par semaine, montrant que le niveau d’activité physique est essentiel. ; McTiernan et coll., 2003
; McTiernan et coll., 2003 ). La perte de masse corporelle est associée à un effet protecteur de l’activité physique sur ce cancer (Bardia et coll., 2006
). La perte de masse corporelle est associée à un effet protecteur de l’activité physique sur ce cancer (Bardia et coll., 2006 ). Cependant, chez des femmes jeunes, Abrahamson et coll. (2006
). Cependant, chez des femmes jeunes, Abrahamson et coll. (2006 ) ont rapporté que l’activité physique était protectrice même chez les femmes en surpoids.
) ont rapporté que l’activité physique était protectrice même chez les femmes en surpoids. ; Verloop et coll., 2000
; Verloop et coll., 2000 ; Thune et Furberg, 2001
; Thune et Furberg, 2001 ). D’autres auteurs font état d’un lien plus fort entre la pratique à l’âge adulte et la prévention du cancer du sein (Verloop et coll., 2000
). D’autres auteurs font état d’un lien plus fort entre la pratique à l’âge adulte et la prévention du cancer du sein (Verloop et coll., 2000 ; Adams-Campbell et coll., 2001
; Adams-Campbell et coll., 2001 ). En résumé, un continuum de la pratique physique tout au long de la vie apparaît comme le moyen préventif le plus adapté (Friedenreich et coll., 2001b
). En résumé, un continuum de la pratique physique tout au long de la vie apparaît comme le moyen préventif le plus adapté (Friedenreich et coll., 2001b ; Lee et coll., 2001b
; Lee et coll., 2001b ; Matthews et coll., 2001
; Matthews et coll., 2001 ; Dorn et coll., 2003
; Dorn et coll., 2003 ).
). ), 18 études d’association avec l’activité physique ont été répertoriées. Dans 14 études sur 18, une réduction du risque de 30 % en moyenne est observée et une relation dose-réponse est rapportée dans 7 études sur 13. En résumé, il existe probablement un lien entre l’activité physique et la réduction du risque de cancer de l’endomètre mais l’effet dose-réponse n’est pas clairement établi.
), 18 études d’association avec l’activité physique ont été répertoriées. Dans 14 études sur 18, une réduction du risque de 30 % en moyenne est observée et une relation dose-réponse est rapportée dans 7 études sur 13. En résumé, il existe probablement un lien entre l’activité physique et la réduction du risque de cancer de l’endomètre mais l’effet dose-réponse n’est pas clairement établi. ).
). ). Dans cette cohorte de 253 023 femmes, 689 cas de cancers de l’endomètre ont été identifiés pendant une durée moyenne de 6,6 années. L’étude ne retrouve pas d’association claire entre le cancer de l’endomètre et tous les types d’activité physique (RR=0,88 ; IC 95 % [0,61-1,27]). En revanche, l’association est plus évidente pour les femmes non ménopausées ayant été actives versus peu actives (RR=0,66 ; IC 95 % [0,38-1,14]). Parmi les femmes non ménopausées, cette association est plus importante pour les activités ménagères (RR=0,48 ; IC 95 % [0,23-0,99]) et de loisir (RR=0,78 ; IC 95 % [0,44-1,39]).
). Dans cette cohorte de 253 023 femmes, 689 cas de cancers de l’endomètre ont été identifiés pendant une durée moyenne de 6,6 années. L’étude ne retrouve pas d’association claire entre le cancer de l’endomètre et tous les types d’activité physique (RR=0,88 ; IC 95 % [0,61-1,27]). En revanche, l’association est plus évidente pour les femmes non ménopausées ayant été actives versus peu actives (RR=0,66 ; IC 95 % [0,38-1,14]). Parmi les femmes non ménopausées, cette association est plus importante pour les activités ménagères (RR=0,48 ; IC 95 % [0,23-0,99]) et de loisir (RR=0,78 ; IC 95 % [0,44-1,39]). ), sur les 21 études menées aux États-Unis et en Europe portant sur le cancer du poumon, la plupart ont montré une diminution du risque chez les sujets ayant une activité physique. Cette réduction varie de 20 à 60 % selon l’intensité de l’activité. Cependant, une étude a rapporté une augmentation du risque de 40 %. Dans la plupart de ces études, le rôle du tabac a été contrôlé. Il faut remarquer que la plupart du temps les sujets sportifs sont non fumeurs et ont donc une faible incidence du cancer du poumon. Néanmoins, les effets bénéfiques de l’activité physique apparaissent même lorsque les sujets sont fumeurs (Mao et coll., 2003
), sur les 21 études menées aux États-Unis et en Europe portant sur le cancer du poumon, la plupart ont montré une diminution du risque chez les sujets ayant une activité physique. Cette réduction varie de 20 à 60 % selon l’intensité de l’activité. Cependant, une étude a rapporté une augmentation du risque de 40 %. Dans la plupart de ces études, le rôle du tabac a été contrôlé. Il faut remarquer que la plupart du temps les sujets sportifs sont non fumeurs et ont donc une faible incidence du cancer du poumon. Néanmoins, les effets bénéfiques de l’activité physique apparaissent même lorsque les sujets sont fumeurs (Mao et coll., 2003 ; Kubik et coll., 2004
; Kubik et coll., 2004 ; Tardon et coll., 2005
; Tardon et coll., 2005 ).
). ). Plus récemment, Steindorf et coll. (2006
). Plus récemment, Steindorf et coll. (2006 ) rapportant les résultats de l’étude prospective européenne (European Prospective Investigation into Cancer and Nutrition Cohort) incluant 9 pays, 416 227 participants et 1 000 cancers du poumon enregistrés, mettent en évidence une réduction significative du risque du cancer du poumon associée aux activités sportives et de loisir d’intensité élevée. En revanche, l’activité physique professionnelle ne diminue pas ce risque.
) rapportant les résultats de l’étude prospective européenne (European Prospective Investigation into Cancer and Nutrition Cohort) incluant 9 pays, 416 227 participants et 1 000 cancers du poumon enregistrés, mettent en évidence une réduction significative du risque du cancer du poumon associée aux activités sportives et de loisir d’intensité élevée. En revanche, l’activité physique professionnelle ne diminue pas ce risque. ). Concernant l’effet du sexe, les résultats sont divergents. La méta-analyse conduite par Tardon et coll. (2005
). Concernant l’effet du sexe, les résultats sont divergents. La méta-analyse conduite par Tardon et coll. (2005 ) fait état d’un effet plus protecteur chez la femme que chez l’homme, alors que l’étude de Mao et coll. (2003
) fait état d’un effet plus protecteur chez la femme que chez l’homme, alors que l’étude de Mao et coll. (2003 ) met en évidence un effet identique pour les deux sexes. Thune et Lund (1997
) met en évidence un effet identique pour les deux sexes. Thune et Lund (1997 ) rapportent un effet protecteur plus important chez l’homme que chez la femme. Toutefois, la publication récente se rapportant à The Iowa women’s Health study incluant 36 929 femmes suivies de 1986 à 2002 met en évidence un effet protecteur de l’activité physique sur le cancer du poumon des femmes fumeuses actuelles ou passées (Sinner et coll., 2006
) rapportent un effet protecteur plus important chez l’homme que chez la femme. Toutefois, la publication récente se rapportant à The Iowa women’s Health study incluant 36 929 femmes suivies de 1986 à 2002 met en évidence un effet protecteur de l’activité physique sur le cancer du poumon des femmes fumeuses actuelles ou passées (Sinner et coll., 2006 ).
). ) ou ne sont pas en faveur d’un rôle protecteur de l’activité physique (Thune et Fulberg, 2001
) ou ne sont pas en faveur d’un rôle protecteur de l’activité physique (Thune et Fulberg, 2001 ; Lee, 2003
; Lee, 2003 ).
). ) rapporte que sur les 37 études publiées, la moitié ont montré que l’activité physique diminuait le risque de cancer de la prostate de 10 à 30 % (Friedenreich et Orenstein, 2002
) rapporte que sur les 37 études publiées, la moitié ont montré que l’activité physique diminuait le risque de cancer de la prostate de 10 à 30 % (Friedenreich et Orenstein, 2002 ). Une relation dose-réponse est retrouvée dans 10 études sur 19.
). Une relation dose-réponse est retrouvée dans 10 études sur 19. ). Les résultats sont encore insuffisants pour en tirer des conclusions claires.
). Les résultats sont encore insuffisants pour en tirer des conclusions claires. ; Zhang et coll., 2003
; Zhang et coll., 2003 ; Riman et coll., 2004
; Riman et coll., 2004 ; Pan et coll., 2005
; Pan et coll., 2005 ). Une étude prospective de cohorte (27 365 personnes, 121 cas de cancer de l’ovaire sur un suivi de 227 045 personnes-années) ne retrouve pas d’association significative entre l’activité physique et le risque de cancer de l’ovaire bien que les résultats tendent vers une relation inverse (Hannan et coll., 2004
). Une étude prospective de cohorte (27 365 personnes, 121 cas de cancer de l’ovaire sur un suivi de 227 045 personnes-années) ne retrouve pas d’association significative entre l’activité physique et le risque de cancer de l’ovaire bien que les résultats tendent vers une relation inverse (Hannan et coll., 2004 ).
). ), aucune nouvelle étude sur le lien entre la survenue d’un cancer du testicule et l’activité physique n’a été publiée.
), aucune nouvelle étude sur le lien entre la survenue d’un cancer du testicule et l’activité physique n’a été publiée. ). En 2007, dans le rapport du World Cancer Research Fund/American Institute for Cancer Research, les auteurs indiquent un niveau de preuve limité pour le cancer du pancréas. Une association inverse entre une activité physique intense au cours de la vie et le cancer de l’estomac a été observée (Campbell et coll., 2007
). En 2007, dans le rapport du World Cancer Research Fund/American Institute for Cancer Research, les auteurs indiquent un niveau de preuve limité pour le cancer du pancréas. Une association inverse entre une activité physique intense au cours de la vie et le cancer de l’estomac a été observée (Campbell et coll., 2007 ).
). ). D’autres études sont cependant nécessaires pour confirmer ce résultat à long terme sur la qualité de vie des anciens patients (Stevinson et coll., 2004
). D’autres études sont cependant nécessaires pour confirmer ce résultat à long terme sur la qualité de vie des anciens patients (Stevinson et coll., 2004 ).
). ). L’activité physique améliore les aptitudes cardio-respiratoires pendant et après le traitement, les symptômes et les effets physiologiques pendant le traitement ainsi que la condition physique après le traitement. L’activité physique proposée était de type aérobie à intensité modérée à élevée de 3 à 5 fois par semaine d’une durée de 20 à 30 minutes par session. Les programmes structurés pendant 12 semaines ont aussi fait leurs preuves en améliorant la tolérance à l’exercice, la qualité du sommeil et la qualité de vie (Young-McCaughan et coll., 2003
). L’activité physique améliore les aptitudes cardio-respiratoires pendant et après le traitement, les symptômes et les effets physiologiques pendant le traitement ainsi que la condition physique après le traitement. L’activité physique proposée était de type aérobie à intensité modérée à élevée de 3 à 5 fois par semaine d’une durée de 20 à 30 minutes par session. Les programmes structurés pendant 12 semaines ont aussi fait leurs preuves en améliorant la tolérance à l’exercice, la qualité du sommeil et la qualité de vie (Young-McCaughan et coll., 2003 ).
). ). Un effet dose-réponse sur la fatigue est observé pour des sessions de durée inférieure à 60 minutes (Schwartz et coll., 2001
). Un effet dose-réponse sur la fatigue est observé pour des sessions de durée inférieure à 60 minutes (Schwartz et coll., 2001 ).
). ).
). ).
). ) ont établi les recommandations d’activité physique aérobie pour les patients et anciens patients (tableau 17.II
) ont établi les recommandations d’activité physique aérobie pour les patients et anciens patients (tableau 17.II ).
). )
) ) pour le cancer du sein et ceux de Segal et coll. (2001
) pour le cancer du sein et ceux de Segal et coll. (2001 ) pour le cancer de la prostate, des recommandations d’activité contre résistance ont été établies (tableau 17.III
) pour le cancer de la prostate, des recommandations d’activité contre résistance ont été établies (tableau 17.III ).
). ; Courneya et coll., 2002
; Courneya et coll., 2002 )
) ).
). ; Cauley et coll., 1999
; Cauley et coll., 1999 ; Russo et coll., 2006
; Russo et coll., 2006 ).
). ).
). ) et sont parfois confondus avec les effets de l’exercice. Plusieurs études ont rapporté une relation inverse entre concentration plasmatique d’insuline (hyperinsulinémie avec un régime trop riche en lipides et sucres rapides et inactivité physique) et concentration plasmatique de SHBG (pour revue, et coll., 2002
) et sont parfois confondus avec les effets de l’exercice. Plusieurs études ont rapporté une relation inverse entre concentration plasmatique d’insuline (hyperinsulinémie avec un régime trop riche en lipides et sucres rapides et inactivité physique) et concentration plasmatique de SHBG (pour revue, et coll., 2002 ). La figure 17.1
). La figure 17.1 présente une hypothèse explicative des voies de régulation mises en jeux par l’inactivité physique associée à un régime trop riche dans le développement d’un cancer de la prostate. Le facteur protecteur qu’est l’activité physique (associé à un régime pauvre en graisse et sucres rapides) pourrait agir en inversant ces différentes voies.
présente une hypothèse explicative des voies de régulation mises en jeux par l’inactivité physique associée à un régime trop riche dans le développement d’un cancer de la prostate. Le facteur protecteur qu’est l’activité physique (associé à un régime pauvre en graisse et sucres rapides) pourrait agir en inversant ces différentes voies.
 )
) ; Kuo et coll., 1999
; Kuo et coll., 1999 ; pour revue, Leung et coll., 2004
; pour revue, Leung et coll., 2004 ) par augmentation de la sensibilité à l’insuline. Par ailleurs, il a été montré que des concentrations élevées d’insuline plasmatiques et d’IGF-I sont associées à un risque accru de cancer du côlon (pour revue, Giovannucci, 2001
) par augmentation de la sensibilité à l’insuline. Par ailleurs, il a été montré que des concentrations élevées d’insuline plasmatiques et d’IGF-I sont associées à un risque accru de cancer du côlon (pour revue, Giovannucci, 2001 ). Des concentrations élevées d’IGF-I ont également été associées à un risque augmenté de cancer du sein et de cancer de la prostate (Friedenreich et Orenstein, 2002
). Des concentrations élevées d’IGF-I ont également été associées à un risque augmenté de cancer du sein et de cancer de la prostate (Friedenreich et Orenstein, 2002 ). Les effets directs de l’activité physique sur l’IGF-I sont contradictoires, certaines études montrent une diminution et d’autres aucune variation. En revanche, les études sont plus concordantes pour montrer que l’activité physique régulière diminue la masse grasse et, par ce biais, diminue certaines IGFBP et en augmente d’autres, dont celles qui lient l’IGF-I, diminuant ainsi la fraction libre de l’IGF-I (Yu et coll., 2000
). Les effets directs de l’activité physique sur l’IGF-I sont contradictoires, certaines études montrent une diminution et d’autres aucune variation. En revanche, les études sont plus concordantes pour montrer que l’activité physique régulière diminue la masse grasse et, par ce biais, diminue certaines IGFBP et en augmente d’autres, dont celles qui lient l’IGF-I, diminuant ainsi la fraction libre de l’IGF-I (Yu et coll., 2000 ; Tymchuk et coll., 2001
; Tymchuk et coll., 2001 ; Barnard et coll., 2003
; Barnard et coll., 2003 ). En effet, dans le plasma, l’IGF-I circule majoritairement (99 %) liée à des protéines de liaison (IGFBPs) dont il existe 6 isoformes. La principale, IGFBP-3, est GH dépendante. IGBP-1 et IGFBP-2 sont régulées négativement par l’insuline. Les rôles respectifs des IGFBPs sont encore débattus. Leur rôle essentiel est de limiter les effets de l’IGF-I sur les tissus cibles, notamment dans la limitation de la croissance tumorale.
). En effet, dans le plasma, l’IGF-I circule majoritairement (99 %) liée à des protéines de liaison (IGFBPs) dont il existe 6 isoformes. La principale, IGFBP-3, est GH dépendante. IGBP-1 et IGFBP-2 sont régulées négativement par l’insuline. Les rôles respectifs des IGFBPs sont encore débattus. Leur rôle essentiel est de limiter les effets de l’IGF-I sur les tissus cibles, notamment dans la limitation de la croissance tumorale. ). Barnard et coll. (2002
). Barnard et coll. (2002 ) ont développé un modèle leur permettant d’explorer le rôle de l’IGF-I et de ses protéines porteuses (Ngo et coll., 2003
) ont développé un modèle leur permettant d’explorer le rôle de l’IGF-I et de ses protéines porteuses (Ngo et coll., 2003 ). Ils ont incubé des cellules cancéreuses de prostate (cellules LNCaP : lignée de cellules de cancer de la prostate androgénodépendantes) avec du sérum de sujets sédentaires et de sujets entraînés en endurance afin d’examiner les effets des modifications du mode de vie sur la croissance de ces cellules in vitro. Quand ces cellules sont incubées avec du sérum provenant de sujets ayant suivi pendant 11 jours un programme associant activité physique et diététique, la croissance des cellules LNCaP diminue de 30 % par rapport aux sujets témoins. Le sérum obtenu chez les sujets ayant adhéré à ce programme (activité physique + régime pauvre en lipides et riche en fibres) pendant 14 ans induit une diminution supplémentaire de la croissance des cellules LNCaP de 15 % (Tymchuk et coll., 2001
). Ils ont incubé des cellules cancéreuses de prostate (cellules LNCaP : lignée de cellules de cancer de la prostate androgénodépendantes) avec du sérum de sujets sédentaires et de sujets entraînés en endurance afin d’examiner les effets des modifications du mode de vie sur la croissance de ces cellules in vitro. Quand ces cellules sont incubées avec du sérum provenant de sujets ayant suivi pendant 11 jours un programme associant activité physique et diététique, la croissance des cellules LNCaP diminue de 30 % par rapport aux sujets témoins. Le sérum obtenu chez les sujets ayant adhéré à ce programme (activité physique + régime pauvre en lipides et riche en fibres) pendant 14 ans induit une diminution supplémentaire de la croissance des cellules LNCaP de 15 % (Tymchuk et coll., 2001 ). Ces résultats ont été confirmés par Ngo et coll. (2003
). Ces résultats ont été confirmés par Ngo et coll. (2003 ) sur une autre lignée cellulaire. Afin de dissocier les effets de l’activité physique de ceux de la diététique, Barnard et coll. (2003
) sur une autre lignée cellulaire. Afin de dissocier les effets de l’activité physique de ceux de la diététique, Barnard et coll. (2003 ) ont utilisé les sérums de sujets soumis à un programme seulement diététique et ceux de sujets soumis à un programme exclusivement d’activité physique sur une longue période (depuis 14,5 ans, 5 jours/semaine avec une heure par séance). Par rapport aux sujets témoins appariés pour l’âge, les concentrations plasmatiques d’insuline et d’IGF-I sont plus basses et celles d’IGFBP-1 plus élevées chez les sujets entraînés. Quand leur sérum est mis à incuber avec des cellules LNCaP, la croissance de ces cellules est diminuée dans le groupe « exercice » de 65 % et dans le groupe « diététique » (régime normocalorique pauvre en lipides <10 % ration et riche en fibres) de 55 %. On observe une augmentation significative de l’apoptose. Quand l’IGF-I est ajouté au sérum post-intervention, la réduction de la croissance des cellules LNCaP est abolie. Inversement, quand l’IGFBP-1 est ajoutée au sérum de base, la croissance des LNCaP diminue significativement (Ngo et coll., 2003
) ont utilisé les sérums de sujets soumis à un programme seulement diététique et ceux de sujets soumis à un programme exclusivement d’activité physique sur une longue période (depuis 14,5 ans, 5 jours/semaine avec une heure par séance). Par rapport aux sujets témoins appariés pour l’âge, les concentrations plasmatiques d’insuline et d’IGF-I sont plus basses et celles d’IGFBP-1 plus élevées chez les sujets entraînés. Quand leur sérum est mis à incuber avec des cellules LNCaP, la croissance de ces cellules est diminuée dans le groupe « exercice » de 65 % et dans le groupe « diététique » (régime normocalorique pauvre en lipides <10 % ration et riche en fibres) de 55 %. On observe une augmentation significative de l’apoptose. Quand l’IGF-I est ajouté au sérum post-intervention, la réduction de la croissance des cellules LNCaP est abolie. Inversement, quand l’IGFBP-1 est ajoutée au sérum de base, la croissance des LNCaP diminue significativement (Ngo et coll., 2003 ).
). ). De plus, PCNA, un marqueur de cycle cellulaire, est diminué de 33 % dans les lysats de cellules LNCaP incubées avec du sérum des sujets du groupe « exercice ». En revanche, quand c’est la lignée cellulaire LN-56 qui est utilisée (lignée de cellules LNCaP dans laquelle la p53 est rendue non fonctionnelle par l’expression d’un mutant dominant négatif de la p53), il n’y a pas de différences de croissance entre les sujets du groupe exercice et ceux du groupe témoin. Enfin, quand un bloqueur du récepteur de l’IGF-I (AC anti-récepteur ou un inhibiteur de kinase) est ajouté dans le sérum des sujets du groupe témoin, la croissance cellulaire des LNCaP est diminuée et l’apoptose augmente au niveau observé dans les groupes exercice ou diététique. Ces résultats démontrent que la diminution de l’IGF-I et l’augmentation de l’IGFBP-1 obtenues après observance d’un régime pauvre en graisses et/ou l’adoption d’une activité physique régulière permettent aux cellules tumorales prostatiques de stabiliser la protéine p53 et d’activer des mécanismes en aval afin de diminuer la croissance tumorale et d’induire l’apoptose de ces cellules tumorales. L’ensemble de ces résultats suggère un mécanisme possible pour expliquer en partie les données épidémiologiques montrant une diminution du risque de cancer de la prostate chez les hommes qui ont une activité physique régulière.
). De plus, PCNA, un marqueur de cycle cellulaire, est diminué de 33 % dans les lysats de cellules LNCaP incubées avec du sérum des sujets du groupe « exercice ». En revanche, quand c’est la lignée cellulaire LN-56 qui est utilisée (lignée de cellules LNCaP dans laquelle la p53 est rendue non fonctionnelle par l’expression d’un mutant dominant négatif de la p53), il n’y a pas de différences de croissance entre les sujets du groupe exercice et ceux du groupe témoin. Enfin, quand un bloqueur du récepteur de l’IGF-I (AC anti-récepteur ou un inhibiteur de kinase) est ajouté dans le sérum des sujets du groupe témoin, la croissance cellulaire des LNCaP est diminuée et l’apoptose augmente au niveau observé dans les groupes exercice ou diététique. Ces résultats démontrent que la diminution de l’IGF-I et l’augmentation de l’IGFBP-1 obtenues après observance d’un régime pauvre en graisses et/ou l’adoption d’une activité physique régulière permettent aux cellules tumorales prostatiques de stabiliser la protéine p53 et d’activer des mécanismes en aval afin de diminuer la croissance tumorale et d’induire l’apoptose de ces cellules tumorales. L’ensemble de ces résultats suggère un mécanisme possible pour expliquer en partie les données épidémiologiques montrant une diminution du risque de cancer de la prostate chez les hommes qui ont une activité physique régulière. ) ont incubé le sérum de femmes ménopausées (avec ou sans traitement hormonal de la ménopause) en surpoids ou obèses avec 3 types de lignées cellulaires tumorales de cancer du sein exprimant des récepteurs aux œstrogènes. La croissance tumorale des 3 lignées cellulaires est significativement diminuée de 6 à 18 % après 11 jours d’intervention (suivi d’un régime normocalorique mais pauvre en lipides et riche en fibres) et l’apoptose est augmentée de 20 à 30 % selon les lignées cellulaires. Biologiquement, les concentrations plasmatiques d’insuline, estradiol et IGF-I sont diminuées (-20 à -35 %) tandis que l’IGFBP-1 est augmentée (+30 %) (p<0,05 pour chacune de ces hormones). Cet effet est observé que les femmes soient sous traitement hormonal substitutif de la ménopause ou non. Arteaga et Osborne (1989
) ont incubé le sérum de femmes ménopausées (avec ou sans traitement hormonal de la ménopause) en surpoids ou obèses avec 3 types de lignées cellulaires tumorales de cancer du sein exprimant des récepteurs aux œstrogènes. La croissance tumorale des 3 lignées cellulaires est significativement diminuée de 6 à 18 % après 11 jours d’intervention (suivi d’un régime normocalorique mais pauvre en lipides et riche en fibres) et l’apoptose est augmentée de 20 à 30 % selon les lignées cellulaires. Biologiquement, les concentrations plasmatiques d’insuline, estradiol et IGF-I sont diminuées (-20 à -35 %) tandis que l’IGFBP-1 est augmentée (+30 %) (p<0,05 pour chacune de ces hormones). Cet effet est observé que les femmes soient sous traitement hormonal substitutif de la ménopause ou non. Arteaga et Osborne (1989 ) avaient rapporté une diminution de la croissance de 6 types sur 7 de lignées tumorales de cancer du sein après blocage du récepteur de l’IGF-I. Cette étude montre que 11 jours d’intervention associant diététique et activité physique diminuent de façon significative plusieurs facteurs de risques de cancer du sein. Il reste à démontrer cependant leur pertinence clinique.
) avaient rapporté une diminution de la croissance de 6 types sur 7 de lignées tumorales de cancer du sein après blocage du récepteur de l’IGF-I. Cette étude montre que 11 jours d’intervention associant diététique et activité physique diminuent de façon significative plusieurs facteurs de risques de cancer du sein. Il reste à démontrer cependant leur pertinence clinique. ; Wu et coll., 2002
; Wu et coll., 2002 ). L’activité physique pourrait avoir un effet protecteur en diminuant la concentration plasmatique d’IGF-I.
). L’activité physique pourrait avoir un effet protecteur en diminuant la concentration plasmatique d’IGF-I. ; Williams, 2005
; Williams, 2005 ).
). ; Tymchuk et coll., 2001
; Tymchuk et coll., 2001 ; Barnard et coll., 2003
; Barnard et coll., 2003 ).
). ).
). ), endomètre (Matthews et coll., 2005
), endomètre (Matthews et coll., 2005 ) et les mécanismes des effets bénéfiques de l’activité physique demandent à être préciser pour ces localisations.
) et les mécanismes des effets bénéfiques de l’activité physique demandent à être préciser pour ces localisations.