2008
24-
Chez la femme
Ce n’est que récemment que les travaux de recherche se sont intéressés à la relation qui pourrait exister entre l’activité physique et la santé de la fille et de la femme, que ce soit pour une activité physique de loisirs ou une activité sportive intensive. Les effets bénéfiques d’une pratique physique sur certaines pathologies spécifiques à la femme, comme le cancer du sein et l’ostéoporose, ont stimulé l’intérêt scientifique pour la compréhension du rôle de l’activité physique sur la santé de la femme. La mesure de l’activité physique quotidienne pose de nombreuses questions méthodologiques du fait de la diversité des actions accomplies (tâches ménagères, nombreux déplacements de faible distance, activité physique professionnelle, de loisir, de compétition...) et de la modification du mode de vie de la femme ces dernières décennies.
Bénéfices de la pratique
Plusieurs études se sont intéressées à la relation entre l’activité physique et la mortalité chez la femme. Les effets de l’activité physique sur la santé physique et mentale ont également été étudiés.
Activité physique et taux de mortalité chez la femme
Dès 1989, Blair et coll. (1989

) ont mis en évidence une relation négative très significative entre le taux de mortalité et le niveau de condition physique. En effet, un niveau élevé d’activité physique apparaît comme préventif d’une mortalité précoce, ceci étant dû à la réduction des risques de développer des maladies cardiovasculaires et certains cancers, tant chez l’homme que chez la femme. Trente à soixante minutes de marche à allure rapide chaque jour apparaissent suffisantes pour atteindre un niveau satisfaisant de condition physique. Cette quantité d’activité physique correspond à 9 METs chez la femme pour 10 METs chez l’homme. Hardman (1999

) a de plus mis en évidence une relation très significative entre la condition physique, la masse corporelle et le profil œstrogénique.
Plus récemment, la revue de littérature proposée par Oguma et coll. (2002

), qui recense 37 études prospectives et une rétrospective, s’est intéressée à la relation entre activité physique et mortalité chez la femme. Vingt trois de ces études font état d’un taux de mortalité plus faible chez les femmes actives ou ayant un bon niveau de condition physique. Cette revue indique que le risque relatif de mortalité est réduit de 34 % avec la pratique physique. Cette association entre l’activité physique et la mortalité est d’amplitude IDEntique chez la femme et chez l’homme. Un effet dose-réponse n’a en revanche pas été démontré de façon significative. La question est donc de savoir quelle est la quantité optimale d’activité physique bénéfique . La dépense énergétique associée au plus faible taux de mortalité est de 4 200 kJ par semaine (Oguma et coll., 2002

). Les divergences de résultats ou les imprécisions dans les données ne permettent pas de proposer une fréquence ou une durée d’activité physique optimale. De plus, la littérature fait apparaître des données apparemment divergentes dans la mesure où, chez la femme, une faible condition physique est très fortement associée à un risque élevé de mortalité (Paffenbarger et coll., 1986

) alors qu’un faible niveau d’activité physique n’est pas significativement associé à ce risque élevé (Blair et coll., 1993

). Il semblerait donc que la condition physique ne soit pas toujours associée au niveau d’activité physique. L’hypothèse explicative pourrait être une mauvaise quantification et qualification de la pratique d’activité physique dans toutes ses composantes.
Dans le même ordre d’idée, une étude canadienne récente analyse l’importance de la relation entre des indicateurs de sédentarité, le tour de taille et le risque de mortalité chez la femme (Katzmarzyk et Craig, 2006

). Les résultats montrent que ces deux facteurs augmentent le risque de mortalité et ce, de façon indépendante comme précédemment démontré dans «
the Nurses’ Health Study » (Hu et coll., 2004

).
Santé physique
L’activité physique entraîne des effets bénéfiques sur la santé physique, en particulier elle agit sur les facteurs de risque cardiovasculaires.
Risques cardiovasculaires
Il est clairement démontré que l’activité physique réduit les risques cardiovasculaires chez l’homme, mais peu d’études se sont intéressées spécifiquement à cette relation chez la femme.
Les femmes s’engageant dans une activité physique élevée de loisir réduisent approximativement de 30 % le risque de développer des pathologies coronariennes comparativement à celles qui sont sédentaires (Ashton et coll., 2000

). La
Nurses’ Health Study, réalisée chez des femmes de 40-65 ans, rapporte après un suivi longitudinal de 8 ans, un risque relatif de développer des problèmes coronariens diminué de moitié chez les femmes les plus actives (Manson et coll., 1999

). Les femmes qui marchent au moins 3 h par semaine ou qui participent à des activités physiques vigoureuses à hauteur de 1h30 par semaine ont 30 à 40 % moins de risques de développer des maladies cardiovasculaires que les femmes sédentaires. Il est intéressant de constater que les femmes qui deviennent actives voient aussi leur risque réduit comparativement à celles qui restent sédentaires. Cette étude rapporte aussi que la diminution du risque de développer un diabète est associée à la dépense d’énergie (marche
versus intensité vigoureuse) (Hu et coll., 1999

).
L’
Iowa Women’s Health Study a sélectionné 40 417 femmes ménopausées et les a suivies pendant 7 ans (Kushi et coll., 1997

). Le groupe de femmes les plus inactives présente une mortalité due aux facteurs cardiovasculaires 2 fois plus élevée que les femmes les plus actives. Celles qui participent à des activités élevées 4 fois ou plus par semaine ont un risque 80 % plus faible que celles qui ne participent que rarement ou jamais à une activité physique.
Hypertension
L’effet bénéfique de l’activité physique sur la pression artérielle a été démontré à de nombreuses reprises tant chez l’homme que chez la femme. Ces résultats sont bien analysés dans les revues de littérature (Arroll et Beaglehole, 1992

; Appel, 2003

) ou les méta-analyses (Whelton et coll., 2002

) qui concluent que l’activité physique diminue la pression artérielle tant chez les personnes hypertendues que chez les personnes normotendues, tant chez la femme que chez l’homme. Spécifiquement à la femme, le risque de développer de l’hypertension est augmenté de 52 % chez les femmes sédentaires comparées à des femmes ayant une très bonne condition physique (Blair et coll., 1984

).
Dans le même ordre d’idée, les pressions systolique et diastolique de femmes d’âge moyen diminuent avec l’augmentation du niveau d’activité physique (Owens et coll., 1990

). Les meilleurs résultats sont obtenus avec une fréquence d’activité de 3 fois par semaine et sont indépendants de la perte de poids qui « normalement » accompagne la mise en activité (Whelton et coll., 2002

).
Concernant la nature de l’activité physique, Toth et Poehlman (1995

) ne rapportent aucune différence pour la pression systolique entre des femmes d’âge moyen sédentaires ou participant régulièrement à un entraînement de renforcement musculaire ou en endurance.
Profils lipidique et glucidique
Bien que peu nombreuses, plusieurs études ont mis en évidence les effets bénéfiques de l’activité physique sur le profil lipidique de la femme (Owens et coll., 1990

; Eaton et coll., 1995

). Un programme d’activité physique en endurance diminue le LDL
1
-cholestérol (3-8 %) et les triglycérides (Durstine et Haskell, 1994

). La récente méta-analyse de Kodama et coll. (2007

) fait état à partir de 25 études randomisées et contrôlées d’une augmentation significative bien que modeste du HDL
2
-cholestérol (2,53 mg/dL, p<0,01) (Kodama et coll., 2007

). Cette publication met en évidence un niveau minimal d’activité physique estimé à 900 kcal de dépense énergétique par semaine ou 120 minutes d’activité hebdomadaire, nécessaire pour obtenir cette augmentation. De plus, les résultats sont d’amplitude plus importante chez les sujets ayant un faible indice de masse corporelle (IMC<28).
Cependant, très peu d’études ont contrôlé des facteurs tels que le statut hormonal, la composition corporelle, la distribution de graisse, les apports alimentaires et la consommation de tabac alors que ces facteurs sont connus comme susceptibles d’affecter le profil lipidique (Durstine et Haskell, 1994

). En effet, l’exercice, qui n’entraîne pas de perte de poids, n’a que peu d’effet sur le HDL-cholestérol, alors qu’une perte de poids seule, en particulier au niveau de la graisse abdominale, peut améliorer le niveau de HDL-cholestérol chez la femme (Despres et coll., 1991

).
De même, peu d’études se sont intéressées à l’effet des modalités d’exercice sur le profil lipidique. Comparant des femmes d’âge moyen participant habituellement à un entraînement de renforcement musculaire, celles suivant un entraînement en endurance et des femmes sédentaires, Toth et Poehlman (1995

) n’observent pas de variation significative du HDL-cholestérol et des triglycérides. Quand la masse grasse est contrôlée, les différences significatives entre les deux types d’exercice pour le LDL-cholestérol et le cholestérol total diminuent.
Activité physique et composition corporelle
Chez la femme, l’activité physique augmente la masse maigre et diminue la masse grasse (Westerterp, 1998

). Chez l’homme, la perte de masse grasse est corrélée avec la masse grasse de départ, ce qui n’est pas retrouvé chez la femme. Il a été suggéré pour expliquer cette différence homme/femme, que les femmes ont plus tendance à compenser la dépense énergétique engendrée par l’exercice, par un apport alimentaire augmenté (Westerterp et coll., 1992

; Westerterp et Goran, 1997

). Ainsi, les femmes ont tendance à préserver leur balance énergétique en compensant le déficit énergétique lié à l’activité par un apport énergétique équivalent, ce qui explique pourquoi la diminution de masse grasse bien que significative reste faible.
Un certain nombre d’études fait état d’une activité lipolytique plus élevée dans le tissu adipeux abdominal que glutéal au cours de l’exercice physique. Cette réponse est plus marquée chez la femme que chez l’homme (Arner et coll., 1990

; Despres et coll., 1991

; Barnard et Wen, 1994

).
Santé mentale
Dans la majorité des publications, l’activité physique est démontrée comme étant bénéfique pour la santé psychologique. Généralement, il existe une corrélation positive entre l’exercice physique et l’estime de soi, l’efficacité, le bien-être psychologique et cognitif. Une relation négative est aussi rapportée entre l’exercice physique et l’anxiété, le stress et la dépression. Les résultats sont très convergents pour des dysfonctionnements psychologiques spécifiques comme la dépression, l’anxiété et le stress chez des populations cliniques, mais il demeure beaucoup d’incertitude quant à la nature de cette relation pour des populations mentalement saines (Scully et coll., 1998

; Paluska et Schwenk, 2000

). En outre, l’effet dose-réponse des activités physiques sur la santé mentale reste à démontrer (Dunn et coll., 2001

).
Stress
Les études transversales et longitudinales font généralement état d’une diminution des réponses physiologiques au stress psychologique chez les personnes pratiquant une activité physique, bien que la significativité de la relation ne soit pas toujours démontrée (Scully et coll., 1998

). Le temps consacré aux activités physiques de loisir est corrélé à une augmentation du niveau d’activité physique et à une diminution du stress perçu (Aldana et coll., 1996

). Chez l’homme, l’étude de Norris et coll. (1990

) a comparé les effets de 10 semaines de programme d’activité aérobie à des activités de force. Les résultats sont en faveur d’une meilleure efficacité des activités aérobies.
Anxiété
Les bénéfices de l’activité physique pour la réduction de l’anxiété sont généralement admis, en particulier sur le stress chronique. En revanche, les mécanismes par lesquels l’activité physique réduit l’état d’anxiété ne sont pas clairs. L’activité physique de type aérobie semble avoir de meilleurs résultats que les activités de force ou de résistance (Scully et coll., 1998

). Les activités de faible intensité et la perception individuelle de sa performance apparaissent comme les déterminants de la réduction de l’anxiété (Bartholomew et Linder, 1998

), mais il n’existe pas de consensus quant à la durée et l’intensité optimales des activités physiques.
Dépression
Généralement, les auteurs sont d’accord pour dire que dans le cadre thérapeutique, les activités physiques ont un effet modéré à important sur la dépression chez l’homme et chez la femme. La diminution des symptômes dépressifs semble plus marquée chez la femme que chez l’homme d’après la revue de Dunn et coll. (2001

) analysant des études randomisées et contrôlées, des études d’observation et des études de consensus (37 études sélectionnées). L’étude de Cramer et coll. (1991

) fait état d’une amélioration des scores de santé psychologique (dépression, anxiété) chez 35 femmes non-ménopausées, non dépressives à la suite de 15 semaines d’activité physique de type aérobie. En revanche, l’effet de l’activité physique pour prévenir l’apparition de la dépression n’est pas très clair (Paluska et Schwenk, 2000

). L’étude de Cooper-Patrick et coll. (1997

), par exemple, ne fait pas état de différence significative de développement de la dépression chez des sujets actifs comparativement à des sujets non actifs (population d’étude : 690 hommes et 62 femmes). Cependant, chez les sujets atteints de dépression, l’inactivité est un fort déterminant de la dépression (Scully et coll., 1998

).
Humeur
Une relation très positive entre l’exercice physique et la bonne humeur a été démontrée par de nombreuses études (Biddle, 1995

; Scully et coll., 1998

). L’humeur a été utilisée pour investir les perceptions post-exercice, comme le bien-être, l’anxiété, l’estime de soi. L’estime de soi est liée à l’image du corps. Dans ce contexte, les femmes attendent de l’activité physique, qu’elle leur permette de contrôler leur masse corporelle en influant sur la masse grasse et le tonus musculaire, alors que les hommes désirent contrôler leur masse grasse et développer leur musculature (Hausenblas et Fallon, 2006

).
Autres facteurs
L’activité physique a un effet positif sur le bien-être et sur la qualité de vie (Woodruff et Conway, 1992

). Dans ce domaine, les résultats de la
Nurses’ Health Study évaluent l’évolution du niveau d’activité physique et du score de qualité de vie de 63 152 femmes âgées de 40 à 67 ans en 1986, et font état d’une amélioration de la qualité de vie pour les femmes ayant augmenté leur activité physique sur les dix ans d’étude. Le score de qualité de vie est passé de 2,23 (IC 95 % [1,94-2,52]) à 8,23 (IC 95 % [7,49-8,97]) (Wolin et coll., 2007

).
Bien que les mécanismes ne soient pas toujours très clairement IDEntifiés, l’augmentation du niveau d’activité physique est significativement corrélée au bien-être uniquement chez la femme (McTeer et Curtis, 1993

). Chez la femme, l’activité physique a également des effets bénéfiques sur l’image du corps, l’estime de soi et les fonctions cognitives (Levy et Ebbeck, 2005

).
Adolescence : période critique pour la santé du futur adulte
Plusieurs experts de la promotion de la santé ont suggéré que l’activité physique pendant l’enfance pouvait avoir des influences directes sur la santé de l’adulte (Malina, 2001

). Cette proposition repose sur deux hypothèses majeures. La première est que l’apprentissage de comportements de pratique régulière d’activité physique permettra aux enfants actifs de demeurer des adultes actifs. La seconde hypothèse repose sur la possibilité que la pratique d’activité physique au cours de l’enfance aura des effets bénéfiques sur la santé de l’adulte (Kelder et coll., 1994

; Aaron et coll., 2005

).
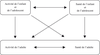
Quelques études se sont penchées sur la détermination d’une période optimale de la vie au cours de laquelle la pratique physique aurait un effet préventif sur le développement de certaines pathologies chez l’adulte. La question ainsi posée renvoie au modèle de Blair et coll. (1989

) qui propose des relations d’influence entre l’activité de l’enfant et de l’adolescent/la santé de l’enfant et de l’adolescent/l’activité et la santé de l’adulte (figure 24.1

).
S’il existe de nombreuses études qui font état d’une relation positive entre l’activité physique et la santé chez l’adulte, les résultats sont beaucoup moins conséquents et convergents chez l’enfant et l’adolescent (Boreham et Riddoch, 2001

; Twisk, 2001

). Un effet bénéfique de la pratique d’activité physique a été mis en exergue pour la composition corporelle, la condition physique, le métabolisme osseux, la santé mentale et le profil lipidique (HDL-cholestérol et triglycérides) (Suter et Hawes, 1993

).
Pour ce qui concerne une possible relation entre la santé de l’enfant et la santé de l’adulte, il existe peu d’évidences scientifiques hormis pour les facteurs cardiovasculaires tels que les lipoprotéines, le rapport cholestérol total sur HDL-cholestérol (OR=22,9 [10,6–49,6]) et la composition corporelle (masse grasse, OR=17,7 [9,2–34,1]) (Twisk et coll., 1997

).
Les deux principales revues de littérature sur la question du lien existant entre pratique physique à l’adolescence et mortalité adulte, Twisk (2001

) et Hallal et coll. (2006

), s’accordent à dire que l’étude de Paffenberger et coll. (1986

) (
Harvard Alumni Study) a été la première à se pencher sur le sujet. Cependant, ce travail n’a pas mis en exergue de relation significative entre l’activité physique à l’adolescence et des effets bénéfiques sur les risques de pathologies cardiovasculaires à l’âge adulte. D’autres travaux observent une relation plus positive mais non significative (Malina, 1996

; Twisk, 2001

; Boreham et coll., 2002

).
En revanche, les effets préventifs d’une pratique physique au cours de l’adolescence sur le développement du cancer du sein ont été mis en évidence (Okasha et coll., 2003

). Plusieurs études se sont intéressées à cette problématique et sont traitées par ailleurs dans cet ouvrage. Dans le même ordre d’idée, l’intérêt d’une activité physique à l’adolescence sur l’augmentation et la préservation du capital osseux est une évidence (Khan et coll., 2000

; Karlsson, 2004

).
Caractéristiques de l’activité physique en relation avec le sexe et l’âge
La pratique de l’activité physique varie selon le sexe et l’âge. À l’âge adulte comme pendant l’enfance, les motivations et les modalités d’activité physique sont différentes entre l’homme et la femme.
Variations avec le sexe
Dès le plus jeune âge, les garçons ont une pratique physique significativement plus importante que les filles. Quantitativement, cette différence apparaît dès l’âge de 4 ans (Trost et coll., 2003

), se retrouve à 9-10 ans (Trost et coll., 2002

; Page et coll., 2005

) et persiste à l’adolescence (Kimm et coll., 2005

).
L’étude de Wilkin et coll. (2006

) montre, par des mesures d’accélérométrie, qu’à 5-6 ans comme à 9 ans, les garçons sont plus actifs que les filles, mais que cette différence est surtout marquée pour les activités d’intensité élevée (tableau 24.I

). Qualitativement, la baisse d’activité physique observée avec l’âge a lieu préférentiellement pour les activités d’intensité élevée au bénéfice des activités à intensité modérée.
Non seulement les filles diminuent leur quantité d’activité physique avec l’âge, mais cette diminution s’accompagne d’une baisse de l’intensité de cette activité. Comme le confirme le Baromètre santé (Guilbert et coll., 2003

), cette évolution existe également chez les garçons, mais de façon moins marquée. Ainsi, dans l’étude du Baromètre santé :
• 95 % des filles et 96 % des garçons adolescents (12-19 ans) déclarent avoir été actifs la veille (marche ou activité physique) ;
• 64 % des filles et 79 % des garçons ont réalisé des activités physiques plus de 30 minutes ;
• 15 % des filles et 24 % des garçons déclarent avoir eu une activité physique vigoureuse dans les 15 jours précédents.
Tableau 24.I Différences d’activité physique totale et de haute intensité entre les filles et les garçons (unités arbitraires countsx105 par jour) (d’après Wilkin et coll., 2006 )
)
|
Activité physique
|
Âge (années)
|
Garçons
|
Filles
|
Différence* (%)
Garçons/Filles
|
p**
Garçons/Filles
|
|
Totale
|
4,9
5,9
9,0
|
38,8
38,4
36,8
|
35,8
36,2
33,6
|
8,4
6,1
9,5
|
<0,01
0,02
<0,01
|
|
Haute intensité
|
4,9
5,9
9,0
|
13,2
13,6
14,5
|
10,9
11,6
10,5
|
21,1
17,2
38,1
|
<0,001
0,01
<0,001
|
* % de différence garçons versus filles ; ** Le test statistique est une comparaison de moyennes
À l’âge adulte, les motivations et les modalités d’activité physique entre l’homme et la femme sont très significativement différentes. En terme de perception, les femmes ont plus tendance à lier les bénéfices de l’activité aux facteurs sociaux et psychologiques, alors que les hommes définissent les bénéfices en termes de santé et de condition physique (Sherwood et Jeffery, 2000

). Les hommes semblent pratiquer des activités physiques avec des dépenses énergétiques plus importantes que celles mesurées chez les femmes. Cette différence s’exprime par le choix des activités pratiquées. Ainsi, les hommes privilégient le jardinage, les exercices de force, le jogging ou la course et les sports de contact ou à intensité élevée, alors que les femmes adhèrent plus à la marche, la danse, l’aérobic et la gymnastique (Sherwoog et Jeffery, 2000

). Les hommes sont généralement plus actifs dans leur travail alors que les femmes sont plus actives dans les travaux domestiques (Belza et Warms, 2004

). Cependant, peu d’études se sont intéressées uniquement à la femme. Les variables prédictives de la pratique d’une activité physique chez la femme sont l’âge, le rôle social conféré à l’activité physique, le soutien de l’entourage et les paramètres environnementaux (Belza et Warms, 2004

).
Variations avec l’âge
L’activité physique de l’enfant est de nature intermittente se caractérisant par des changements brusques entre des périodes d’activité physique intense et des périodes de repos. L’étude de Bailey et coll. (1995

) a montré que chez les enfants pré-pubères, la durée moyenne des activités physiques d’intensité légère et modérée était de 6 secondes (s), alors que 95 % des activités physiques d’intensité élevée avaient une durée d’au moins 15 s avec une moyenne de 3 s. En moyenne, une période d’activité physique a une durée de 20 s et n’excède pas 10 minutes. Avec l’âge, l’activité physique diminue. L’étude de Kimm et coll. (2005

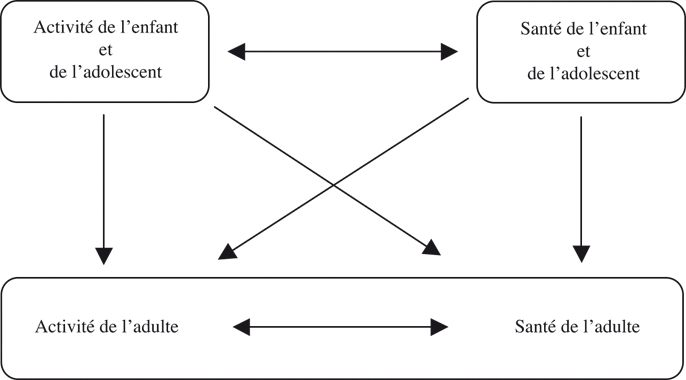
) réalisée chez une population importante de filles rapporte que le niveau d’activité physique décroît avec l’âge quel que soit la valeur de ce niveau d’activité physique (filles actives, modérément actives ou inactives) (figure 24.2

).
Dans le même ordre d’idée, Van Mechelen et coll. (2000

) ont montré chez le garçon et chez la fille que les activités intenses (au moins 7 METs) diminuaient sérieusement avec l’âge, alors que les activités d’intensité modérée (4-7 METs) augmentaient entre 13 et 17 ans.
Au cours de la croissance, de l’enfance à l’âge adulte, l’activité physique évolue et change de nature et d’objectif, dans la mesure où les facteurs d’influence changent. Des interventions orientées vers les familles et/ou les parents mettent en évidence une augmentation de l’activité physique des enfants. Si le comportement des enfants est principalement influencé par celui des parents et leur statut socioéconomique, celui des adolescents est probablement plus influencé par celui des camarades de même âge et par la mode (Vilhjalmsson et Thorlindsson, 1998

). Au moment de l’adolescence, l’activité physique devient plus organisée et le plaisir du jeu laisse peu à peu la place à des objectifs de santé, de condition physique (Strong et coll., 2005

). Ainsi, il est important de tenir compte des facteurs facilitant la pratique en fonction des intérêts, des objectifs et de l’âge des jeunes. Par exemple, un programme d’activité physique associé à une restriction énergétique, peut être très sollicitant physiologiquement si le but est de perdre du poids, mais devra se rapprocher rapidement des possibilités et des raisons qui poussent à continuer une pratique physique tout au long de la vie. Il ne faut pas oublier que le plaisir reste le premier déterminant de la pratique d’une activité physique.
La diminution de la pratique d’une activité physique a un effet direct sur la condition physique des enfants. Ainsi, Tomkinson et coll. (2003

) font état d’une diminution de la performance à un test de course de 0,46 % par an chez les garçons et 0,41 % chez les filles (6-19 ans).
Enfin, en terme de comportements, certains travaux font état d’une forte relation entre certains comportements délétères liés à l’inactivité pendant l’enfance et les comportements à l’âge adulte, tels que la consommation de tabac et une faible condition physique (Trudeau et coll., 1999

; Hancox et coll., 2004

). Pour la pratique d’activité physique, une revue systématique va dans le sens d’une contribution significative de l’activité physique à l’adolescence pour la pérennisation d’une pratique physique à l’âge adulte (Trudeau et coll., 2004

; Hallal et coll., 2006

). Tammelin et coll. (2003

) mettent en évidence que la participation des adolescents au sport avec une fréquence d’au moins une fois par semaine pour les filles et de deux fois pour les garçons est associée à un haut niveau d’activité physique dans la vie adulte. Il semble également qu’une pratique physique diversifiée est le meilleur atout de pérennisation de la pratique d’activité physique à l’âge adulte. Chez la femme plus spécifiquement, un faible niveau d’activité physique à l’adolescence se traduit par un faible niveau d’activité physique à l’âge adulte. Ainsi, chez les adolescentes (14-18 ans) actives (plus de 3 h d’activité physique par semaine), 54,4 % restent actives à l’âge adulte (37-43 ans) et 45,6 % deviennent sédentaires (Matton et coll., 2006

). Chez les filles considérées comme inactives, 62,5 % le restent et 37,5 % deviennent actives à l’âge adulte. Chez le garçon, une étude Finlandaise montre que 71 % des garçons actifs à l’âge de 14 ans (au moins 1 h d’activité physique par semaine) restent actifs à l’âge adulte (24 ans), alors que 55 % des garçons inactifs restent des adultes inactifs (Pietilä et coll., 1995

).
Adolescence : période critique pour la pratique adulte
Au moment de la puberté, la différence de pratique physique devient très importante entre les filles et les garçons, en raison d’une importante diminution de la pratique des filles. Les études ont clairement montré que l’adolescence est la période à laquelle la baisse d’activité physique est la plus marquée (Caspersen et coll., 2000

; Telama et Yang, 2000

; Van Mechelen et coll., 2000

). Sallis (2000

) analyse ce déclin de la pratique d’une activité physique et montre que la période pour laquelle cette baisse est la plus significative est la même chez les filles et chez les garçons.
L’étude de Neumark-Sztainer et coll. (2003

) avait pour objectif de déterminer les facteurs responsables des modifications des pratiques d’activité physique au moment de l’adolescence chez les filles. Les résultats ont fait apparaître deux variables majeures de la diminution de l’activité physique à cette période sensible : le temps qui représente la contrainte majeure est inversement associé à l’activité physique et le soutien sous forme de l’aide apportée par les parents, les enseignants, l’entourage, qui est positivement associé à l’activité physique. Toutes les études qui se sont intéressées à cette question classent les facteurs de modification des pratiques d’activité physique en trois grandes catégories : les déterminants personnels (biologiques, psychosociologiques et comportementaux), socioculturels et environnementaux (Sallis et coll., 2000

). Comparativement à l’enfant, l’adolescent accorde une valeur très importante aux facteurs comportementaux et socio-culturels. Par ailleurs, l’étude ICAPS
3
Intervention centrée sur l’activité physique et le comportement sédentaire
(Simon et coll., 2004

) met en exergue que le fait de faciliter l’accès aux pratiques entraîne une augmentation significative de la pratique d’une activité physique chez les adolescents.
D’autres études se sont penchées sur l’identification des raisons de pratiquer une activité physique chez les jeunes filles. Comparativement aux garçons, les filles font état d’une plus grande insatisfaction de leur apparence physique et de leur poids. Les filles pratiquent donc le plus souvent pour perdre du poids et pour le plaisir. Il est important de souligner que l’estime de soi est corrélée avec l’image corporelle d’où l’importance d’une pratique physique orientée sur le corps (Furnham et coll., 2002

; Strelan et coll., 2003

).
Caractéristiques et recommandations d’activité physique
Pour la femmes les recommandations sont de 30 minutes d’activité physique d’intensité modérée par jour (Pate et coll., 1995

; Lee, 2003

). Ces recommandations se fondent sur des études d’observation épidémiologiques impliquant plus de 100 000 personnes. En terme de prévention de la mortalité (toutes causes), l’activité physique nécessaire doit représenter une dépense énergétique de 4 200 kJ par semaine (1 000 kcal par semaine) (Oguma et coll., 2002

).
Période pubertaire
Les filles sous-évaluent et sous-estiment leurs capacités, leur potentiel et leur compétence pour l’activité physique. Les adolescentes énoncent plus d’obstacles à la pratique d’une activité physique que les garçons tels que le temps, l’argent, les ressources et la pratique sécurisée.
Il n’existe pas de recommandations précises pour l’activité physique des adolescentes.
Comme le discute Twisk (2001

) dans une revue de synthèse, il existe de nombreuses recommandations qui évoluent avec l’apparition et l’augmentation de nouvelles pathologies touchant les jeunes. Les dernières études préconisent au moins une heure d’activité physique par jour à intensité modérée à élevée (Strong et coll., 2005

; Andersen et coll., 2006

). Il est classiquement convenu que plus la quantité d’activité physique est augmentée et plus les bénéfices sont importants.
Pour une bonne adhésion et une bonne participation, il est nécessaire de respecter les déterminants mis en exergue par Sallis et coll. (2000

) :
• activités physiques à la mode, qui correspond à la culture des jeunes filles (hip-hop, danse, aquagym...) ;
• activités physiques pratiquées avec des amies (favoriser l’accès de proximité) ;
• activités physiques visant la perte de poids et l’amélioration de l’estime de soi (recommandations pour la population générale).
Pendant la grossesse
Plusieurs études récentes vont dans le sens d’un effet bénéfique de la pratique d’une activité physique au cours de la grossesse (Brown, 2002

).
Bien qu’il n’existe que peu de recherches, les résultats vont dans le sens d’effets positifs de l’activité physique sur le diabète gestationnel, la sensibilité à l’insuline, l’utilisation du glucose, la santé mentale et le bien-être (Da Costa et coll., 2003

; Poudevigne et O’Connor, 2006

), les nausées, la douleur, la fatigue et la constipation (Stevenson et coll., 1998

; Brown, 2002

). L’étude de Da Costa et coll. (2003) qui compare un groupe de femmes actives à un groupe de femmes inactives au cours des 1
er et 2
e trimestres de la grossesse fait état d’effets bénéfiques de l’activité physique sur l’humeur, le bien-être et l’état d’anxiété. Une activité physique modérée de 30 minutes par jour régulièrement et chaque jour de la semaine a des effets bénéfiques sur le contrôle du poids et sur la condition physique (Lynch et coll., 2003

). Les activités préconisées sont la marche, le vélo stationnaire, la natation. La plongée sous-marine doit être évitée pendant la période de grossesse dans la mesure où le fœtus est soumis à un risque accru lié aux phénomènes de décompression (Davies et coll., 2003

).
La Société des obstétriciens et gynécologues du Canada et la Société canadienne de physiologie de l’exercice ont établi des recommandations très précises (voir Davies et coll., 2003

). L’intensité de l’exercice doit se situer à 1214 sur l’échelle de perception des contraintes de l’exercice de Borg (échelle de 6 à 20) ou répondre aux zones cibles de fréquence cardiaque définies dans le tableau 24.II

.
Tableau 24.II Zones cibles de fréquence cardiaque pour l’exercice aérobie pendant la grossesse (d’après Davies et coll., 2003 )
)
|
Âge maternel
|
Zone cible de la fréquence cardiaque
(battements/minute)
|
Zone cible de la fréquence cardiaque
(battements/10 secondes)
|
|
Moins de 20 ans
|
140-155
|
23-26
|
|
De 20 à 29 ans
|
135-140
|
22-25
|
|
De 30 à 39 ans
|
130-145
|
21-24
|
|
40 ans ou plus
|
125-140
|
20-23
|
En terme de fréquence, il est déconseillé de réaliser deux jours de suite des activités physiques d’intensité élevée. Pour les femmes actives avant la grossesse, il est préférable de réduire l’activité physique habituelle tout en maintenant des activités aérobies et musculaires permettant de conserver une bonne condition physique. Pour les femmes inactives avant la grossesse, une incitation à la pratique d’activité physique légère est souhaitable mais sans programmes exigeants. Il est conseillé de commencer par 15 minutes d’exercice continu 3 fois par semaine pouvant aller jusqu’à 30 minutes d’exercice continu 4 fois par semaine. L’
American College of Obstetricians and Gynecologists (ACOG) dresse la liste des contre-indications à la pratique physique lors de la grossesse et du post-partum (ACOG, 2002

).
Au moment de la ménopause
Les résultats de l’étude prospective
Nurses’ Health Study concernant la relation entre le score de marche, le score d’exercices intenses, le score total d’activité physique et l’incidence des événements coronariens chez 72 488 femmes âgées de 40 à 65 ans (non ménopausées et ménopausées), mettent en exergue le rôle protecteur de l’activité physique régulière sur les pathologies cardiovasculaires (Manson et coll., 1999

). Le résultat important est que les femmes pratiquant au moins 3 heures de marche par semaine à une allure vive, 4,8 à 6,2 km/h, présentent un risque relatif de pathologies cardiovasculaires égal à 0,65 comparativement aux femmes qui marchent non régulièrement. La pratique d’une activité physique d’intensité élevée (>6 METs) se traduit par une réduction du risque de pathologies cardiovasculaires de 30 à 40 %.
Sur 28 études, randomisées et contrôlées avec 2 646 participantes ménopausées, 18 font état d’effets bénéfiques de la pratique d’activité physique sur la masse corporelle et le pourcentage de masse grasse ; 18 études ont des effets bénéfiques sur le VO
2 max, 16 sur la densité et le contenu minéraux osseux, 11 sur la force musculaire ou l’endurance, 9 sur le profil lipidique, 7 sur la pression artérielle, 6 sur l’équilibre, 5 sur la souplesse et 2 sur le profil glucidique et l’insulinémie (Asikainen et coll., 2004

).
Les recommandations répertoriées dans la littérature suggèrent une pratique physique avec des sessions d’au moins 30 minutes par jour, d’une fréquence de 1 à 3 jours par semaine, d’intensité : modérée (4-5 km/h), de type marche à laquelle il faut ajouter 2 fois par semaine la pratique d’exercices de résistance (Asikainen et coll., 2003

).
Pour la femme ménopausée, Jordan et coll. (2005

) proposent de déterminer quel doit être le nombre de pas à effectuer par jour pour atteindre 50, 100 ou 150 % des recommandations d’activité physique préconisées en population générale qui sont de « au moins 30 minutes d’activité physique d’intensité modérée à élevée de préférence tous les jours » (Pate et coll., 1995

). Les résultats font état de la nécessité d’accumuler 2 800 pas (50 %), 5 500 (100 %) et 6 500 pas par jour 3-4 jours par semaine pour atteindre 150 % des recommandations.
Ainsi selon les objectifs recherchés (protection cardiovasculaire, modification de composition corporelle...), les recommandations varient. Une prescription optimale prenant en compte l’ensemble des variables correspondrait à 30 minutes de marche à allure vive (5 km/h) cinq fois par semaine. La marche pouvant être remplacée par une session de vélo ou de natation. Deux séances de 30 minutes de musculation par semaine sont à ajouter (exemple : exercices avec haltères) (Duclos, 2005

).
Des études assez récentes mettent en exergue l’intérêt du tai chi chuan, en particulier pour limiter la perte osseuse des membres inférieurs (Chan et coll., 2004

).
Facteurs conditionnant l’adhésion
Une revue de questions publiée récemment par White et coll. (2005

) apporte des éléments de réponse quant aux caractéristiques de l’activité physique engendrant une adhésion optimale.
Aucune étude ne permet de relier l’adhésion à la nature de l’activité physique. En revanche, la variété des activités physiques représente pour un grand nombre de femmes un plaisir qui conditionne une meilleure participation. Lors des phases initiales des programmes d’activité physique, les femmes ont une préférence pour la marche (Jakicic et coll., 1999

). Il n’y a pas d’explication à cela, si ce n’est l’hypothèse que cette activité demande peu d’attention et peu de vigilance.
Le fractionnement de l’activité physique est un facteur favorable à l’adhésion. En effet, Jakicic et coll. (1995

) montrent que les femmes qui participent à 3 sessions de 10 minutes par jour d’activité physique, continuent et adhèrent plus longtemps à l’activité physique que des femmes qui effectuent une session de 30 minutes.
Il existe de fortes évidences montrant que plusieurs sessions quotidiennes à faible intensité entraînent une meilleure adhésion (King et coll., 1995

; Perri et coll., 2002

). Cependant, certaines études font état d’une meilleure adhésion de femmes participant à des activités physiques d’intensité vigoureuse
versus modérée (Dacey et coll., 2003

). L’hypothèse qui en résulte est donc une motivation pour la progression et l’expérience.
La relation entre l’intensité de l’activité physique et l’adhésion n’est pas très claire. King et coll. (1995

) rapportent que la durée du programme augmentant, le lieu devient plus important, comme déterminant de la persistance de la participation au programme, que l’intensité ou la fréquence des sessions. La pratique à domicile ou à proximité du domicile provoque une meilleure adhésion. De plus, les femmes qui ont un domicile équipé peuvent réaliser plusieurs sessions de courte durée dans la journée ce qui correspond mieux au mode de vie (Jakicic et coll., 1999

).
Les facteurs sociaux sont également déterminants pour la participation des jeunes femmes, en particulier pour des activités physiques à intensité vigoureuse (Dacey et coll., 2003

). En revanche, pour les femmes plus âgées, les déterminants principaux sont ceux qui ont un lien avec la santé, l’autonomie... (Rhodes et coll., 2001

). D’après Courneya et McAuley (1995

), le contexte social peut être un déterminant majeur pour débuter une activité physique mais n’est plus significatif comme variable pour ce qui concerne la durée de la pratique et sa pérennité.
Oman et King (2000

) ont étudié l’impact d’événements de la vie sur l’adhésion à la pratique d’activité physique et ont déterminé quatre facteurs majeurs pouvant interférer avec la pratique physique :
• changements majeurs des heures et des conditions de travail ;
• changements majeurs dans le comportement ou la santé d’un membre de la famille ;
• changements majeurs dans le comportement et les rythmes alimentaires ;
• les enfants quittent la maison familiale.
Le plaisir, la durée des sessions, un lieu adapté et approprié, un bon niveau de compétence et un programme personnalisé sont les facteurs qui apparaissent comme favorisant l’adhésion à une pratique d’activité physique chez la femme.
Effets de l’activité physique sur le cycle hormonal de l’athlète et les conséquences au niveau osseux
Chez la femme sportive, beaucoup de fausses idées circulent encore sur les relations entre la pratique sportive (surtout intensive) et ses conséquences sur le cycle hormonal ovarien. L’entraînement sportif – même intensif – ne doit pas induire de troubles du cycle. Et s’il existe des troubles du cycle, il faut les prendre en charge car ils peuvent avoir des conséquences délétères sur la santé de la sportive.
Troubles du cycle chez les sportives
Les troubles du cycle qui peuvent être rencontrés chez la femme sportive et non sportive peuvent être représentés selon une échelle de gravité croissante. Depuis la présence de cycles normaux, ovulatoires, dont la durée est de 26 à 32 jours, il y a un continuum qui commence par l’insuffisance lutéale (phase lutéale de durée <10 jours), suivie par l’anovulation puis l’oligoménorrhée (durée des cycles >35 jours) et enfin l’aménorrhée.
L’insuffisance lutéale et les cycles anovulatoires représentent les troubles du cycle les plus fréquemment rencontrés chez les femmes sportives. Cependant, la plupart de ces troubles ne sont pas diagnostiqués du fait de leur caractère asymptomatique (leur diagnostic ne peut être fait que sur des dosages plasmatiques ou urinaires d’hormones ovariennes). Chez les femmes qui pratiquent régulièrement la course à pied, la fréquence des troubles du cycle de type phase lutéale courte (durée des cycles <24 jours) ou oligoménorrhée (durée des cycles >35 jours) a été estimée à 21 % par Burrows et coll. (2003

), 40 % par Rosetta et coll. (1998

) et 78 % par Redman et Loucks (2005

) contre 9 % dans la population de femmes sédentaires. Cette variabilité entre les études s’explique par l’hétérogénéité de la population étudiée (quantité d’entraînement, temps disponible pour la récupération post-exercice). Quant à l’aménorrhée, sa fréquence chez la sportive varie aussi suivant le type de sport. Sa fréquence est plus élevée dans les sports d’endurance (30,9 %), dans les sports dits « esthétiques » (patinage artistique, gymnastique) (34,5 %) et dans les sports à catégorie de poids (23,5 %) (Torstveit et Sundgot-Borgen, 2005

), c’est-à-dire dans les sports qui ont en commun d’être des sports dits portés, pour lesquels les contraintes mécaniques imposées par le poids sont une limite à la performance. La fréquence de l’aménorrhée est plus faible pour les sports non portés (natation et cyclisme) : autour de 12 % (ce qui correspond aussi à la fréquence retrouvée dans la population générale) (Torstveit et Sundgot-Borgen, 2005

). Ces différences suggèrent que l’aménorrhée est plus fréquente chez les sportives qui se soumettent à des régimes permettant de maintenir une masse grasse faible dans les sports où la maîtrise de la composition corporelle est un facteur de réussite. À l’inverse, dans les sports dits techniques (golf, plongeon, curling, équitation, tir) ou les sports de balle (volley, basket) la fréquence des troubles du cycle n’est pas plus élevée chez les athlètes ayant une activité sportive intensive (jusqu’à 12 à 18 heures d’entraînement par semaine) que chez les femmes sédentaires (Torstveit et Sundgot-Borgen, 2005

).
Physiopathologie des troubles du cycle chez la sportive
Bien que les mécanismes exacts sous-tendant les troubles du cycle ne soient pas encore clairement définis, le déséquilibre énergétique entre les apports énergétiques alimentaires et les dépenses énergétiques est l’hypothèse la plus probable.
Rôle du déficit énergétique chronique
De nombreuses données obtenues soit sur l’animal soit sur la femme (De Souza et coll., 1998

; Hilton et Loucks, 2000

; Williams et coll., 2001

) confirment le rôle du déficit énergétique sur les troubles de la fonction ovarienne induits par l’exercice musculaire, avec un continuum réversible (parallèle à l’importance du déficit énergétique) allant des cycles ovulatoires à la phase lutéale courte puis à l’anovulation, et enfin à l’oligoménorrhée et à l’aménorrhée. À l’inverse, si le bilan énergétique est équilibré (et à l’exception de charges d’entraînement aberrantes), le volume d’entraînement (jusqu’à 17 heures par semaine) n’induit pas de troubles du cycle (Torstveit et Sundgot-Borgen, 2005

).
Les troubles du cycle chez la sportive sont d’origine hypothalamo-hypophysaire. La transduction centrale des effets délétères de l’entraînement sur l’équilibre énergétique se situe au niveau du générateur hypothalamique de GnRH (
Gonadotropin Releasing Hormone) avec des modifications de la pulsatilité (fréquence de la pulsation) de GnRH, conduisant à une diminution voire une abolition de la pulsatilité de LH (hormone lutéinisante). En d’autres termes, les modifications de la fonction ovarienne chez la femme sportive sont d’origine centrale en rapport avec le métabolisme énergétique et non pas avec le stress de l’exercice (hyperthermie, sécrétion prolongée et répétée de cortisol...). Les adaptations neuroendocrines à une prise alimentaire insuffisante (et non pas à l’exercice musculaire régulier) sont la clé du problème ovarien chez les femmes pratiquant l’exercice musculaire régulier. On peut en effet reproduire les anomalies neuroendocriniennes et en particulier la diminution de la pulsatilité de LH, chez des femmes sédentaires en induisant un déficit énergétique (sans exercice associé), mais on n’arrive pas à reproduire ces anomalies endocriniennes si les femmes sont soumises à un entraînement musculaire sans déficit énergétique associé (Hilton et Loucks, 2000

). Ces résultats ont été confirmés et précisés par Loucks et Thuma (2003

) qui ont défini le seuil de disponibilité énergétique en dessous duquel les troubles de la pulsatilité de LH apparaissent. Des femmes sédentaires présentant des cycles réguliers, ont été soumises à différents niveaux de disponibilité énergétique par des apports alimentaires et une quantité d’activité physique rigoureusement contrôlés pendant 5 jours. La dépense énergétique des 24 h a été mesurée (calorimétrie indirecte, port d’un accéléromètre) ainsi que les apports alimentaires des 24 h. Chaque jour un exercice de marche sur tapis roulant était réalisé pendant 40 minutes à 70 % du VO
2 max. Son coût énergétique exact était mesuré par calorimétrie indirecte. Compte tenu de tous ces éléments, les femmes ont été réparties en différents niveaux de disponibilité alimentaire. La disponibilité énergétique était définie par les apports alimentaires des 24 h (en kcal) moins la dépense énergétique liée à l’exercice, ce qui correspond à l’énergie apportée à l’organisme pour subvenir aux besoins des tissus métaboliquement actifs (métabolisme de base). Après cinq jours, des prélèvements veineux ont été réalisés toutes les 10 minutes pendant 24 h pour doser la LH et différents paramètres métaboliques. Les résultats montrent que la pulsatilité de la LH ne varie pas de façon linéaire avec la disponibilité énergétique mais diminue significativement en dessous d’un seuil de disponibilité énergétique de 30 kcal/kg de masse maigre par jour (ou à un déficit énergétique total dépassant –15 kcal/kg de masse maigre par jour). Ces résultats corroborent ceux obtenus chez les sportives en aménorrhée montrant que la disponibilité énergétique qu’elles s’auto-administrent est plutôt autour de 16 kcal/kg de masse maigre par jour contre 30 kcal/kg de masse maigre par jour chez les cyclistes ayant des cycles réguliers. De plus, l’étude de Loucks et Thuma (2003

) montre que cette atteinte de la pulsatilité de LH est plus marquée chez les femmes ayant les durées de phase lutéale les plus courtes.
En résumé, les troubles du cycle associés à la pratique régulière de l’exercice musculaire sont dus à une inadéquation chronique entre les apports alimentaires insuffisants et la dépense énergétique augmentée liée à l’exercice musculaire. De plus, l’implication des facteurs nutritionnels dans la physiopathologie de l’hypo-œstrogénie de la sportive est à la fois quantitative et qualitative. En effet, plusieurs études montrent qu’il existe à la fois un déficit nutritionnel global par rapport aux dépenses énergétiques (–700 à –1 000 kcal/jour) et un déficit qualitatif en apports lipidiques (12 à 15 % de la ration alimentaire) chez l’athlète féminine en aménorrhée (Laughlin et Yen, 1997

).
Hypothalamus et réserves énergétiques
Il reste à déterminer ce qui lie le générateur hypothalamique de pulses de GnRH et le déficit énergétique.
Le lien entre l’hypothalamus et le déficit énergétique se fait directement par la diminution de la disponibilité des substrats énergétiques (glucose surtout voire acides gras) au niveau des cellules à GnRH. Des signaux périphériques, insuline et leptine, traduisent également au niveau central (cellules à GnRH) le niveau des réserves énergétiques de l’organisme. La sécrétion de leptine par les adipocytes est sous contrôle de la balance énergétique et de la proportion de tissu adipeux. Il a été démontré que les exercices musculaires prolongés ou les situations d’entraînement intenses qui rendent négative la balance énergétique se traduisent par une baisse de la concentration plasmatique de leptine (Laughlin et Yen, 1997

). Cette diminution serait un des principaux signaux permettant d’informer l’ensemble de l’organisme et particulièrement le système nerveux central d’un déficit énergétique. Il existe par ailleurs des récepteurs de la leptine au niveau de l’hypothalamus et au niveau de l’ovaire. L’action de la leptine peut donc être soit indirecte (information sur le niveau des réserves énergétiques) soit directe puisque la leptine agit aussi directement au niveau cellulaire en augmentant la disponibilité des substrats énergétiques. Les athlètes pourraient représenter un modèle dans lequel la leptine agit comme un signal métabolique pour l’axe gonadotrope. En effet, la moyenne de la concentration plasmatique de leptine sur 24 h est trois fois plus faible chez les athlètes indépendamment de leur statut ovarien (cycles réguliers ou non), par rapport à celle des sédentaires (Laughlin et Yen, 1997

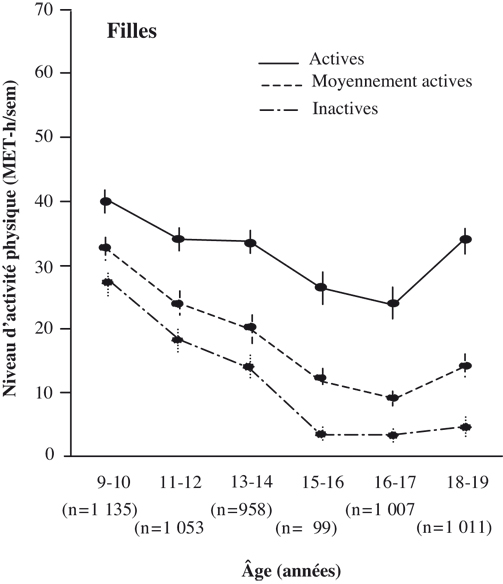
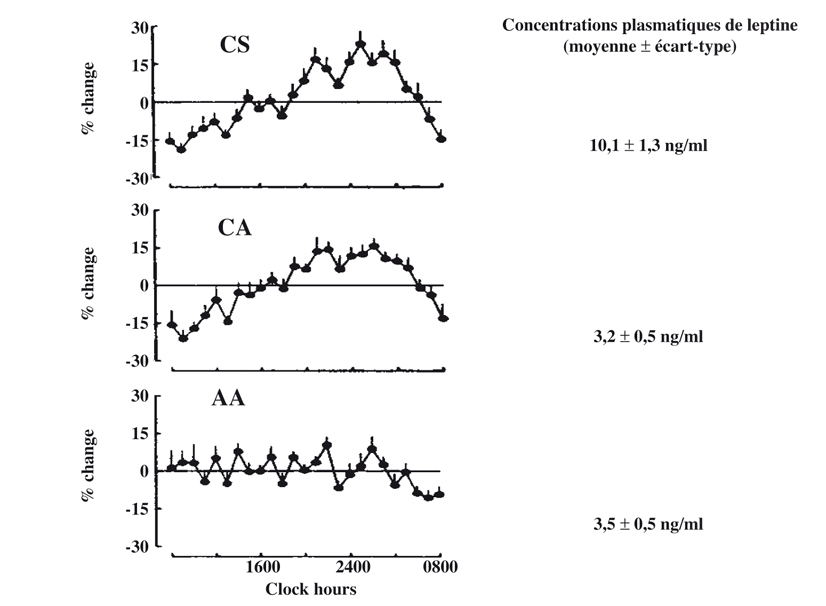
). Cette concentration de leptine est inversement corrélée à la masse grasse. Il existe par ailleurs un rythme nycthéméral (sur 24 h) de la leptine avec une augmentation d’environ 50 % entre le nadir (à 9 h) et le pic de concentration (à 1 h). Ce rythme nycthéméral est retrouvé chez les femmes sédentaires et sportives ayant des cycles réguliers mais, en revanche, il est totalement aboli chez les sportives en aménorrhée (figure 24.3

).
Une étude (Hilton et Loucks, 2000

) montre que la baisse de la disponibilité énergétique (le déficit énergétique) et non le stress de l’exercice est responsable de l’hypoleptinémie et des modifications de son rythme nycthéméral chez les femmes sportives ayant des troubles du cycle. Neuf femmes sédentaires ont été explorées à 4 reprises dans un protocole combinant variations de la disponibilité énergétique (normale
versus basse) et variations du niveau d’exercice musculaire (sédentarité
versus 4 jours d’exercices à raison de 30 min de marche par jour à 70 % du VO
2 max). Le coût énergétique de l’exercice était de 30 kcal/kg du masse maigre par jour. On obtenait donc 4 groupes : sédentaires avec apport énergétique normal (45 kcal/kg de masse maigre/jour), sédentaires avec apport énergétique insuffisant (10 kcal/kg de masse maigre d’où un déficit énergétique de 35 kcal/kg de masse maigre/jour), exercice avec apport énergétique normal (45+30 soit 75 kcal/kg de masse maigre/jour), exercice avec apport énergétique insuffisant (40 kcal/kg de masse maigre d’où un déficit énergétique de 35 kcal/kg de masse maigre). Dans les 2 groupes (sédentaire
versus exercice) avec apport énergétique insuffisant, le déficit énergétique total était donc le même. À la fin du 4
e jour, les femmes étaient admises dans le Centre de recherche pour la mise en place d’un cathéter permettant un prélèvement sanguin toutes les 10 min sur une durée totale de 24 h. Les résultats sont exprimés sur le tableau 24.III

.
Tableau 24.III Paramètres de la leptinémie après variations de l’apport énergétique (d’après Hilton et Loucks, 2000 )
)
| |
Groupe sédentaires
Apport alimentaire
|
Groupe exercice
Apport alimentaire
|
| |
Normal
|
Insuffisant
|
Normal
|
Insuffisant
|
|
Leptine (ng/ml)
| | | | |
|
Moyenne des 24 h
|
14,3±1,8
|
10,5±1,6
|
15,0±1,8
|
8,2±1,4*
|
|
Amplitude du rythme
|
4,6±0,7
|
3,9±0,6
|
4,6±0,6
|
2,8±0,6*
|
* p<0,05 : apport énergétique normal versus apport énergétique insuffisant
La leptinémie moyenne des 24 h et le rythme nycthéméral de la sécrétion de leptine sont normaux lorsque les dépenses énergétiques sont adéquatement compensées par les apports alimentaires, chez les femmes sédentaires. En revanche, toujours chez ces femmes sédentaires, le déficit énergétique abolit le rythme nycthéméral de la leptine. Le stress de l’exercice en lui-même (les auteurs entendent par « stress de l’exercice » tout ce qui peut être associé à l’exercice, physiquement et psychologiquement, à l’exception de son coût énergétique, puisque cette dernière variable a été contrôlée et manipulée au cours de l’expérimentation) n’a aucun effet suppresseur sur la moyenne de la leptinémie des 24 h ni sur l’amplitude des variations du rythme nycthéméral de la leptine. Cette donnée innocente donc le rôle potentiel de l’élévation du cortisol et des catécholamines induite par l’exercice musculaire et qui se produit malgré un apport alimentaire suffisant. L’effet possiblement suppresseur de l’exercice sur la leptinémie a été prévenu en enrichissant l’apport alimentaire de ces femmes de façon à compenser l’augmentation de leur dépense énergétique. Ainsi, exercice musculaire et leptinémie et/ou amplitude des variations nycthémérales de la leptine sont liés uniquement par l’intermédiaire du coût énergétique de l’exercice.
En résumé, ces résultats soulignent le lien existant entre les adipocytes, le statut nutritionnel et l’intégrité de l’axe gonadotrope chez l’humain. Les données récentes montrant que l’administration de leptine recombinante pendant 3 mois chez des femmes en aménorrhée hypothalamique (dont des sportives) améliore les fonctions de reproduction (augmentation de la concentration plasmatique de LH et de la fréquence des pulses de LH, apparition de cycles ovulatoires) démontrent que la leptine, marqueur d’un niveau adéquat de réserves énergétiques, est nécessaire à une fonction de reproduction et à une fonction neuroendocrine normale (Welt et coll., 2004

).
Conséquences des troubles du cycle chez la sportive
Les troubles du cycle chez la sportive ont des conséquences démontrées sur la fécondité, la densité osseuse et sur la fonction endothéliale.
Fécondité
Les conséquences à court terme de l’aménorrhée de la sportive portent sur la fécondité. Malheureusement, nous ne disposons pas de données épidémiologiques exploitables sur des populations de sportives non aménorrhéiques pour conclure à une diminution de la fécondité. La fréquence des cycles anovulatoires laisse présager que la fertilité moyenne sur une population sportive est diminuée.
Une autre conséquence de l’impact de l’entraînement physique intense sur les fonctions de reproduction est le retard pubertaire. Les nombreux travaux rapportés dans la revue de Warren et Perlroth (2001

) ont mis en évidence un retard pubertaire se traduisant par une apparition tardive de la ménarche (jusqu’à l’âge de 17 ans) chez des jeunes sportives soumises à un entraînement intense. Certains sports sont plus concernés que d’autres et l’on retrouve la notion de sports imposant une maîtrise de la composition corporelle comme la danse ou la gymnastique. Dans ce cas, il est bien établi que ce retard est lié au déficit énergétique. Des travaux obtenus sur des rats soumis à un déficit énergétique laissent également penser qu’une diminution chronique de la sécrétion de leptine serait impliquée dans ce retard pubertaire (Warren et Perlroth, 2001

). Il a été bien établi que ce retard pubertaire et ses conséquences sur le développement staturo-pondéral sont rattrapés lors de l’arrêt de l’entraînement intensif (Malina, 1983

).
Troubles de la fonction endothéliale
Des données récentes montrent que paradoxalement, les femmes sportives en aménorrhée ont aussi du fait de l’arrêt de la production d’œstrogènes, des troubles de la fonction endothéliale (activation inflammatoire endothéliale) et un profil lipidique athérogène (augmentation significative du cholestérol total, du LDL cholestérol, des Apo B et de la lipoprotéine par rapport à des femmes sédentaires ayant des cycles réguliers) (Rickenlund et coll., 2005

). Les mêmes anomalies sont retrouvées chez les sportives en oligoménorrhée mais à un niveau intermédiaire c’est-à-dire moins important que chez les sportives en aménorrhée et toutefois augmenté par rapport aux sportives ayant des cycles réguliers. Les conséquences à long terme par rapport au risque cardiovasculaire ne sont pas connues.
Ostéopénie et ostéoporose
L’aménorrhée de la femme sportive s’accompagne également d’un pronostic osseux extrêmement péjoratif car la carence œstrogénique induit une perte osseuse IDEntique à celle observée chez la femme ménopausée et, surtout, cette perte osseuse est maximale les premières années suivant l’installation de l’aménorrhée. Il faut donc la dépister et la traiter précocement. Deux cas de figures sont possibles. Soit l’aménorrhée survient après 25-30 ans (aménorrhée secondaire), c’est-à-dire dans un contexte où le pic de masse osseuse est constitué, et la perte osseuse survient au même rythme qu’à la ménopause. Ainsi, il a été montré que les sportives aménorrhéiques perdent surtout leur masse osseuse les premières années suivant l’installation de l’aménorrhée (en moyenne 4 % par an au niveau lombaire) alors que la perte osseuse est moindre ultérieurement. Soit l’aménorrhée survient au moment de la puberté (aménorrhée primaire), dans ce cas, la perte osseuse se produit alors que le pic de masse osseuse n’est pas atteint. Ces adolescentes entreront dans la vie adulte avec ce qui pourrait être un déficit en masse osseuse irréversible et un risque augmenté de fractures-tassements osseux tout au long de leur vie (Drinkwater et coll., 1984

; Marcus et coll., 1985

; Tomten et coll., 1998

; Gibson et coll., 2000

). Ni un apport élevé de calcium ni l’activité physique ne suffiront à compenser le manque d’accrétion osseuse en fin d’adolescence.
Les troubles du cycle moins graves que l’aménorrhée (oligoménorrhée voire anovulation) ont aussi des conséquences au niveau osseux. Plusieurs études ont montré qu’il existe une relation entre la sévérité des troubles du cycle et la densité minérale osseuse (Tomten et coll., 1998

; Gibson et coll., 2000

) et que le retour à des cycles réguliers après plusieurs années d’irrégularités menstruelles ne s’accompagne pas d’une restauration totale de la densité osseuse (Tomten et coll., 1998

), même au niveau de l’os cortical chez des femmes ayant une activité physique en charge.
Activité physique, ménopause et os
L’ostéoporose représente l’une des complications majeures de la ménopause. La masse osseuse résulte d’une balance entre la résorption osseuse (ostéoclastes) et l’accrétion osseuse (ostéoblastes). Or, seuls les ostéoblastes possèdent des mécanorécepteurs, expliquant qu’une augmentation des contraintes imprimées sur l’os (forces de compression) stimule l’activité ostéoblastique et donc l’ostéoformation tandis qu’une diminution des contraintes (microgravité ou immobilisation) découple le remodelage osseux en diminuant l’activité ostéoblastique sans modifier la résorption osseuse. Il en résultera à moyen terme une diminution de la masse osseuse.
Il est intéressant de noter que la sensibilité des mécanorécepteurs semble modulée par l’âge (elle diminue avec l’âge) et l’imprégnation hormonale (le seuil augmente en cas de carence œstrogénique). Pour maintenir le capital osseux à un niveau constant, la stimulation physique doit donc s’accroître au cours du vieillissement, et ceci d’autant plus qu’il s’agit d’une femme ménopausée non substituée.
Femme ménopausée qui a toujours fait de l’exercice
Après la ménopause, les femmes qui ont pratiqué régulièrement une activité physique ont en général une masse osseuse plus importante (à condition que ces femmes n’aient pas d’antécédent d’aménorrhée et/ou d’autres troubles du cycle de durée prolongée en rapport avec un entraînement physique trop intense et surtout mal compensé par un apport alimentaire adéquat). Par ailleurs, chez la femme ménopausée, il existe une relation positive entre l’exercice musculaire et la densité osseuse, après ajustement de tous les facteurs qui peuvent agir sur la masse osseuse, en particulier en tenant compte de l’existence ou non d’un traitement substitutif œstrogénique (Cheng et coll., 1991

).
Néanmoins, la pratique régulière d’une activité physique intense (jusqu’à 12 h/semaine) pendant la vie ne protège pas les femmes de la diminution de la densité osseuse survenant avec l’âge. Ceci est bien illustré par le travail de Ryan et Elahi (1998

) qui ont comparé des athlètes s’entraînant 12 h/semaine (natation, course ou triathlon) à des femmes sédentaires. Ces femmes étaient âgées de 20 à 70 ans (les femmes ménopausées ne prenaient pas de traitement hormonal de substitution). Bien que les athlètes âgées aient été en très bonne santé et toujours très actives pour leur âge, elles présentaient néanmoins une perte osseuse (réduction de la densité de masse osseuse (DMO) du col fémoral et lombaire), avec une augmentation de la résorption osseuse avec l’âge. Ainsi, un niveau d’activité physique élevé après la ménopause ne peut que diminuer mais pas supprimer la perte osseuse inexorable liée au vieillissement. En revanche, la DMO était plus élevée chez les femmes sportives que chez les sédentaires du même âge.
Femme ménopausée qui démarre une activité physique
L’étude de Rikli et McManis (1990

) illustre l’intérêt de démarrer un programme d’activité physique régulier chez la femme ménopausée. L’objectif de ce travail était de tester l’effet d’un programme de 10 mois d’exercice musculaire sur la densité osseuse de femmes ménopausées, la densité osseuse étant mesurée au niveau du radius du bras non dominant. Trente et une femmes ont été recrutées (âge de 57 à 83 ans) et séparées en 3 groupes : groupe A (n=10) : programme aérobie ; groupe B : programme aérobie + programme de musculation de la moitié supérieure du corps et groupe C : groupe témoin sans exercice. Dans les groupes A et B, la densité osseuse a augmenté respectivement de 1,38 et 1,33 %, sans différence entre les deux groupes. En revanche, dans le groupe C, la densité osseuse a diminué de 2,50 %. Des résultats similaires ont été retrouvés avec 2 h d’activité physique par semaine (marche, jogging, volley, tennis, natation) depuis au moins 2 ans chez des femmes ménopausées sans traitement hormonal substitutif (Douchi et coll., 2003

).
Une méta-analyse récente reprenant l’ensemble des publications entre 1966 et 1996 démontre de façon significative que la pratique régulière de l’exercice musculaire peut prévenir la perte osseuse liée au vieillissement voire l’augmenter d’au moins 1 % par an, à la fois au niveau vertébral et au niveau du col fémoral (Wolff et coll., 1999

). Après la perte massive de masse osseuse survenant les premières années suivant l’installation de la ménopause (3 à 4 % par an pendant 5 ans, en moyenne), la perte moyenne osseuse se situe ensuite autour de 1 % par an. Ce qui signifie que la deuxième phase de perte osseuse plus lente peut être complètement prévenue par la pratique régulière d’une activité musculaire. En revanche, seul le traitement hormonal substitutif semble actuellement capable de prévenir la perte rapide de masse osseuse accompagnant le déficit œstrogénique après la ménopause. À noter que les résultats sont contradictoires sur les effets de l’association œstrogènes et activité physique au moment de la ménopause : cette association induit soit un gain supplémentaire de DMO par rapport aux œstrogènes seuls ou pas de gain supplémentaire (Kohrt et coll., 2004

; Borer, 2005

). Au-delà de 70 ans, l’activité physique ne peut que freiner la perte osseuse.
Sur le plan pratique, toutes les études s’accordent sur les points suivants (Kohrt et coll., 2004

; Borer, 2005

) :
• l’activité physique régulière doit s’accompagner d’un apport calcique d’au moins 1 g/j (Specker, 1996

) ;
• les exercices qui n’impliquent pas de mise en charge (natation, cyclisme) sont peu ou pas efficaces. Seuls les exercices avec mise en charge ont pu faire la preuve de leur efficacité (course à pied, musculation, marche à bon rythme, montée d’escaliers). À noter que la musculation est efficace car elle augmente la force du muscle donc l’importance de la contrainte mécanique imprimée par le muscle sur l’os ;
• les sites osseux réagissent localement en réponse à une stimulation mécanique alors que d’autres sites à distance ne bénéficient pas de manière significative de cette ostéoformation ;
• les femmes non ménopausées comme les femmes ménopausées peuvent profiter des effets bénéfiques de l’exercice musculaire régulier sur la densité osseuse ;
• les programmes d’entraînement peuvent être efficaces à la fois de façon prophylactique et de façon thérapeutique ;
• dans tous les cas, les bénéfices obtenus ne sont pas définitivement acquis. Ils ne persisteront qu’à condition que l’activité physique régulière soit maintenue.
Il faut cependant regretter qu’aucune étude n’ait porté sur l’impact de l’activité physique associée aux nouveaux traitements de l’ostéoporose sur le gain de densité osseuse (biphosphonates, modulateurs spécifiques des récepteurs aux œstrogènes ou SERM).
Relations entre activité physique et risques de fracture chez les femmes ménopausées
La
Nurses’ Health Study portant sur plus de 61 000 femmes ménopausées a montré que le risque relatif de fracture du col du fémur était diminué de 6 % pour chaque dépense énergétique équivalente à 1 heure de marche par semaine (après contrôle de l’âge, de l’IMC, de la prise ou non de traitement hormonal de la ménopause et du tabagisme) (Feskanich et coll., 2002

). Les femmes qui marchent au moins 4 h/semaine ont un risque de survenue d’une fracture du col du fémur diminué de 41 % par rapport aux femmes sédentaires marchant moins de 1 h/semaine. Ce qui suggère que même une activité physique ayant un faible impact au niveau des contraintes imprimées à l’os comme la marche (lors d’une marche tranquille, chaque pas impose une charge sur le squelette axial d’une fois le poids corporel) peut diminuer le risque de fracture même dans des conditions où on attend peu de gain de densité osseuse. Il y aurait un gain de la résistance de l’os aux contraintes mécaniques (données animales : résistance à la fracture) qui est beaucoup plus important que le gain de densité osseuse.
De nouvelles techniques permettant de mesurer la résistance osseuse (
three-scan densitometry) confirment ces résultats (Cleek et Whalen, 2005

). La DMO n’est qu’un moyen indirect d’apprécier la résistance de l’os aux contraintes mécaniques. La question importante est de savoir si une personne est à risque de se fracturer la hanche, le fémur ou le radius. Or, la mesure de la densité osseuse par absorptiométrie biphotonique (DEXA) ne semble pas être un moyen approprié de répondre à cette question, au moins pour apprécier les effets de l’activité physique régulière sur ce risque de fracture.
En conclusion, plusieurs études mettent en évidence des effets bénéfiques de l’activité physique sur la santé des femmes. Cependant, il existe en proportion peu d’études s’intéressant spécifiquement aux femmes. L’évolution des déterminants de l’activité physique avec l’âge engage à adapter les contraintes de la pratique aux différentes périodes de la vie. De même, le statut physiologique des femmes (puberté, grossesse, ménopause, traitement thérapeutique hormonal...) est à prendre en compte dans les recommandations spécifiques.
En ce qui concerne la pratique sportive intensive, il existe encore trop peu d’études s’intéressant spécifiquement aux femmes. Néanmoins, les données récentes démontrent clairement que l’activité physique régulière voire intensive chez la femme n’est pas synonyme de troubles du cycle ovarien. Ainsi, une athlète de haut niveau s’entraînant plus de 20 h par semaine gardera des cycles réguliers mais à condition que ses apports alimentaires soient suffisants (en quantité (kcal) et en apports lipidiques). Étant données les conséquences délétères, en particulier osseuses, des troubles du cycle prolongés, la régularité des cycles est un élément qui doit faire partie du suivi systématique des sportives (données d’interrogatoire clinique).
Bibliographie
[1] aaron dj,
jekal ys,
laporte re. Epidemiology of physical activity from adolescence to young adulthood.
World Rev Nutr Diet. 2005;
94:36
-41

[2] aldana sg,
sutton ld,
jacobson bh,
quirk mg. Relationships between leisure time physical activity and perceived stress.
Percept Mot Skills. 1996;
82:315
-321

[3]american college of obstetricians and gynecologists (acog). ACOG Committee opinion. Number 267, January 2002: exercise during pregnancy and the postpartum period.
Obstet Gynecol. 2002;
99:171
-173

[4] andersen lb,
harro m,
sardinha lb,
froberg k,
ekelund u,
brage s,
anderssen sa. Physical activity and clustered cardiovascular risk in children: a cross-sectional study (The European Youth Heart Study).
Lancet. 2006;
22:299
-304

[5] appel lj. Lifestyle modification as a means to prevent and treat high blood pressure.
J Am Soc Nephrol. 2003;
14:S99
-S102

[6] arner p,
kriegholm e,
engfeldt p,
bolinder j. Adrenergic regulation of lipolysis in situ at rest and during exercise.
J Clin Invest. 1990;
85:893
-898

[7] arroll b,
beaglehole r. Does physical activity lower blood pressure: a critical review of the clinical trials.
J Clin Epidemiol. 1992;
45:439
-447

[8] ashton wd,
nanchahal k,
wood da. Leisure-time physical activity and coronary risk factors in women.
J Cardiovasc Risk. 2000;
7:259
-266

[9] asikainen tm,
miilunpalo s,
kukkonen-harjula k,
nenonen a,
pasanen m. Walking trials in postmenopausal women: effect of low doses of exercise and exercise fractionization on coronary risk factors.
Scand J Med Sci Sports. 2003;
13:284
-292

[10] asikainen tm,
kukkonen-harjula k,
miilunpalo s. Exercise for health for early postmenopausal women: a systematic review of randomised controlled trials.
Sports Med. 2004;
34:753
-778

[11] bailey rc,
olson j,
pepper sl,
porszasz j,
barstow tj. The level and tempo of children’s physical activities: an observational study.
Med Sci Sports Exerc. 1995;
27:1033
-1041

[12] barnard rj,
wen sj. Exercise and diet in the prevention and control of the metabolic syndrome.
Sports Med. 1994;
18:218
-228

[13] bartholomew jb,
linder de. State anxiety following resistance exercise: the role of gender and exercise intensity.
J Behav Med. 1998;
21:205
-219

[14] belza b,
warms c. Physical activity and exercise in women’s health.
Nurs Clin North Am. 2004;
39:181
-193, viii

[15] biddle s. Exercise and psychosocial health.
Res Q Exerc Sport. 1995;
66:292
-297

[16] blair sn,
goodyear nn,
gibbons lw,
cooper kh. Physical fitness and incidence of hypertension in healthy normotensive men and women.
JAMA. 1984;
252:487
-490

[17] blair sn,
kohl hw, iii,
paffenbarger rs jr,
clark dg,
cooper kh. Physical fitness and all-cause mortality. A prospective study of healthy men and women.
JAMA. 1989;
262:2395
-2401

[18] blair sn,
kohl hw,
barlow ce. Physical activity, physical fitness, and all-cause mortality in women: do women need to be active?.
J Am Coll Nutr. 1993;
12:368
-371

[19] boreham c,
riddoch c. The physical activity, fitness and health of children.
J Sports Sci. 2001;
19:915
-929

[20] boreham c,
twisk j,
neville c,
savage m,
murray l. Associations between physical fitness and activity patterns during adolescence and cardiovascular risk factors in young adulthood: the Northern Ireland Young Hearts Project.
Int J Sports Med. 2002;
23(suppl 1):S22
-S26

[21] borer kt. Physical activity in the prevention and amelioration of osteoporosis in women : interaction of mechanical, hormonal and dietary factors.
Sports Med. 2005;
35:779
-830

[22] brown w. The benefits of physical activity during pregnancy.
J Sci Med Sport. 2002;
5:37
-45

[23] burrows m,
nevill am,
bird s,
simpson d. Physiological factors associated with low bone mineral density in female endurance runners.
Br J Sports Med. 2003;
37:67
-71

[24] caspersen cj,
pereira ma,
curran km. Changes in physical activity patterns in the United States, by sex and cross-sectional age.
Med Sci Sports Exerc. 2000;
32:1601
-1609

[25] chan k,
qin l,
lau m,
woo j,
au s. A randomized, prospective study of the effects of Tai Chi Chun exercise on bone mineral density in postmenopausal women.
Arch Phys Med Rehabil. 2004;
85:717
-722

[26] cheng s,
suominen h,
rantanen t,
parkatti t,
heikkinen e. Bone mineral density and physical activity in 50-60-year-old women.
Bone Miner. 1991;
12:123
-132

[27] cleek tm,
whalen rt. Effect of activity and age on long bones using a new densitometric technique.
Med Sci Sports Exerc. 2005;
37:1806
-1813

[28] cooper-patrick l,
ford de,
mead la,
chang pp,
klag mj. Exercise and depression in midlife: a prospective study.
Am J Public Health. 1997;
87:670
-673

[29] courneya ks,
mcauley e. Cognitive mediators of the social influence-exercise adherence relationship: a test of the theory of planned behavior.
J Behav Med. 1995;
18:499
-515

[30] cramer sr,
nieman dc,
lee jw. The effects of moderate exercise training on psychological well-being and mood state in women.
J Psychosom Res. 1991;
35:437
-49

[31] da costa d,
rippen n,
dritsa m,
ring a. Self-reported leisure-time physical activity during pregnancy and relationship to psychological well-being.
J Psychosom Obstet Gynaecol. 2003;
24:111
-119

[32] dacey m,
baltzell a,
zaichkowsky l. Factors in women’s maintenance of vigorous or moderate physical activity.
Women in Sport & Physical Activity Journal. 2003;
12:87
-111

[33] davies g a,
wolfe l a,
mottola m f,
mackinnon c. L’exercice physique pendant la grossesse et le postpartum.
J Obstet Gynaecol Can. 2003;
25:523
-529

[34] de souza mj,
miller be,
loucks ab,
luciano aa,
pescatello ls. High frequency of luteal phase deficiency and anovulation in recreational women runners: blunted elevation in follicle-stimulating hormone observed during luteal-follicular transition.
J Clin Endocrinol Metab. 1998;
83:4220
-4232

[35] despres jp,
pouliot mc,
moorjani s,
nadeau a,
tremblay a. Loss of abdominal fat and metabolic response to exercise training in obese women.
Am J Physiol. 1991;
261:E159
-E167

[36] douchi t,
kosha s,
uto h,
oki t,
nakae m. Precedence of bone loss over changes in body composition and body fat distribution within a few years after menopause.
Maturitas. 2003;
46:133
-138

[37] drinkwater bl,
nilson k,
chesnut ch,
bremner wj,
shainholtz s,
southworth mb. Bone mineral content of amenorrheic and eumenorrheic athletes.
N Engl J Med. 1984;
311:277
-281

[38] duclos m. La ménopause après l’AFFSAPS. Les autres prises en charge. L’exercice physique.
Reprod Hum Horm. 2005;
18:237
-245

[39] dunn al,
trivedi mh,
o’neal ha. Physical activity dose-response effects on outcomes of depression and anxiety.
Med Sci Sports Exerc. 2001;
33:S587
-S597

[40] durstine jl,
haskell wl. Effects of exercise training on plasma lipids and lipoproteins.
Exerc Sport Sci Rev. 1994;
22:477
-521

[41] eaton cb,
lapane kl,
garber ce,
assaf ar,
lasater tm. Physical activity, physical fitness, and coronary heart disease risk factors.
Med Sci Sports Exerc. 1995;
27:340
-346

[42] feskanich d,
willett w,
colditz g. Walking and leisure-time activity and risk of hip fracture in postmenopausal women.
JAMA. 2002;
288:2300
-2306

[43] furnham a,
badmin n,
sneade i. Body image dissatisfaction: gender differences in eating attitudes, self-esteem, and reasons for exercise.
J Psychol. 2002;
136:581
-596

[44] gibson jh,
harries m,
mitchell a,
godfrey r,
lunt m,
reeve j. Determinants of bone density and prevalence of osteopenia among female runners in their second to seventh decades of age.
Bone. 2000;
26:591
-598

[45] guilbert p,
delamaire c,
oddoux k,
leon c,
gautier a. Baromètre santé nutrition 2002 : premiers résultats.
Bulletin Epidémiologique Hebdomadaire de l’Institut de veille sanitaire. 2003;
:18
-19

[46] hallal pc,
victora cg,
azevedo mr,
wells jc. Adolescent physical activity and health: a systematic review.
Sports Med. 2006;
36:1019
-1030

[47] hancox rj,
milne bj,
poulton r. Association between child and adolescent television viewing and adult health: a longitudinal birth cohort study.
Lancet. 2004;
364:257
-262

[48] hardman ae. Accumulation of physical activity for health gains: what is the evidence?.
Br J Sports Med. 1999;
33:87
-92

[49] hausenblas ea,
fallon ea. Exercise and body image: a meta-analysis.
Psychol Health. 2006;
21:33
-47

[50] hilton lk,
loucks ab. Low energy availability, not exercise stress, suppresses the diurnal rhythm of leptin in healthy young women.
Am J Physiol. 2000;
278:E43
-E49

[51] hu fb,
sigal rj,
rich-edwards jw,
colditz ga,
solomon cg. Walking compared with vigorous physical activity and risk of type 2 diabetes in women: a prospective study.
JAMA. 1999;
282:1433
-1439

[52] hu fb,
willett wc,
li t,
stampfer mj,
colditz ga. Adiposity as compared with physical activity in predicting mortality among women.
N Engl J Med. 2004;
351:2694
-2703

[53] jakicic jm,
wing rr,
butler ba,
robertson rj. Prescribing exercise in multiple short bouts versus one continuous bout: effects on adherence, cardiorespiratory fitness, and weight loss in overweight women.
Int J Obes Relat Metab Disord. 1995;
19:893
-901

[54] jakicic jm,
winters c,
lang w,
wing rr. Effects of intermittent exercise and use of home exercise equipment on adherence, weight loss, and fitness in overweight women: a randomized trial.
JAMA. 1999;
282:1554
-1560

[55] jordan an,
jurca gm,
tudor locke c,
church ts. Pedometer Indices for Weekly Physical Activity Recommendations in Postmenopausal Women.
Med Sci Sports Exerc. 2005;
37:1627
-1632

[56] karlsson mk. Physical activity, skeletal health and fractures in a long term perspective.
J Musculoskelet Neuronal Interact. 2004;
4:12
-21

[57] katzmarzyk pt,
craig cl. Independent effects of waist circumference and physical activity on all-cause mortality in Canadian women.
Appl Physiol Nutr Metab. 2006;
31:271
-276

[58] kelder sh,
perry cl,
klepp ki,
lytle ll. Longitudinal tracking of adolescent smoking, physical activity, and food choice behaviors.
Am J Public Health. 1994;
84:1121
-1126

[59] khan k,
mckay ha,
haapasalo h,
bennell kl,
forwood mr. Does childhood and adolescence provide a unique opportunity for exercise to strengthen the skeleton?.
J Sci Med Sport. 2000;
3:150
-164

[60] kimm sy,
glynn nw,
obarzanek e,
kriska am,
daniels sr. Relation between the changes in physical activity and body-mass index during adolescence: a multicentre longitudinal study.
Lancet. 2005;
366:301
-307

[61] king ac,
haskell wl,
young dr,
oka rk,
stefanick ml. Long-term effects of varying intensities and formats of physical activity on participation rates, fitness, and lipoproteins in men and women aged 50 to 65 years.
Circulation. 1995;
91:2596
-2604

[62] kodama s,
tanaka s,
saito k,
shu m,
sone y. Effect of aerobic exercise training on serum levels of high-density lipoprotein cholesterol: a meta-analysis.
Arch Intern Med. 2007;
28:999
-1008

[63] kohrt wm,
bloomfield sa,
little kd,
nelson me,
yingling vr. American College of Sports Medicine Position Stand: physical activity and bone health.
Med Sci Sports Exerc. 2004;
36:1985
-1996

[64] kushi lh,
fee rm,
folsom ar,
mink pj,
anderson ke. Physical activity and mortality in postmenopausal women.
JAMA. 1997;
277:1287
-1292

[65] laughlin ga,
yen ss. Hypoleptinemia in women athletes: absence of diurnal rhythm with amenorrhea.
J Clin Endocrinol Metab. 1997;
82:318
-321

[66] lee im. Physical activity in women: how much is good enough?.
JAMA. 2003;
290:1377
-1379

[67] levy ss,
ebbeck v. The exercise and self-esteem model in adult women: the inclusion of physical acceptance.
Psychology of Sport and Exercise. 2005;
6:571
-584

[68] loucks ab,
thuma jr. Luteinizing hormone pulsatility is disrupted at a threshold of energy availability in regularly menstruating women.
J Clin Endocrinol Metabol. 2003;
88:297
-311

[69] lynch am,
mcdonald s,
magann ef,
evans sf,
choy pl. Effectiveness and safety of a structured swimming program in previously sedentary women during pregnancy.
J Matern Fetal Neonatal Med. 2003;
14:163
-169

[70] malina rm. Menarche in athletes: a synthesis and hypothesis.
Ann Hum Biol. 1983;
10:1
-24

[71] malina rm. Tracking of physical activity and physical fitness across the lifespan.
Res Q Exerc Sport. 1996;
67:S48
-S57

[72] malina rm. Physical activity and fitness: pathways from childhood to adulthood.
Am J Hum Biol. 2001;
13:162
-172

[73] manson je,
hu fb,
rich-edwards jw,
colditz ga,
stampfer mj. A prospective study of walking as compared with vigorous exercise in the prevention of coronary heart disease in women.
N Engl J Med. 1999;
341:650
-658

[74] mao y,
pan s,
wen sw,
johnson kc. Physical activity and the risk of lung cancer in Canada.
Am J Epidemiol. 2003;
158:564
-575

[75] marcus r,
cann c,
madvig p,
minkoff j,
goddard mb. Menstrual function and bone mass in elite women distance runners. Endocrine and metabolic features.
Ann Intern Med. 1985;
102:158
-163

[76] matton l,
thomis m,
wijndaele k,
duvigneaud n,
beunen g. Tracking of physical fitness and physical activity from youth to adulthood in females.
Med Sci Sports Exerc. 2006;
38:1114
-1120

[77] mcteer w,
curtis j. Sport and Physical Activity and Subjective Well Being: National Panel Data for the U.S.
International Review for the Sociology of Sport. 1993;
28:397
-412

[78] neumark-sztainer d,
story m,
hannan pj,
tharp t,
rex j. Factors associated with changes in physical activity: a cohort study of inactive adolescent girls.
Arch Pediatr Adolesc Med. 2003;
157:803
-810

[79] norris r,
carroll d,
cochrane r. The effects of aerobic and anaerobic training on fitness, blood pressure, and psychological stress and well-being.
J Psychosom Res. 1990;
34:367
-375

[80] oguma y,
sesso hd,
paffenbarger rs jr,
lee im. Physical activity and all cause mortality in women: a review of the evidence.
Br J Sports Med. 2002;
36:162
-172

[81] okasha m,
mccarron p,
gunnell d,
smith gd. Exposures in childhood, adolescence and early adulthood and breast cancer risk: a systematic review of the literature.
Breast Cancer Res Treat. 2003;
78:223
-276

[82] oman rf,
king ac. The effect of life events and exercise program format on the adoption and maintenance of exercise behavior.
Health Psychol. 2000;
19:605
-612

[83] owens jf,
matthews ka,
wing rr,
kuller lh. Physical activity and cardiovascular risk: a cross-sectional study of middle-aged premenopausal women.
Prev Med. 1990;
19:147
-157

[84] paffenbarger rs jr,
hyde rt,
wing al,
hsieh cc. Physical activity, all-cause mortality, and longevity of college alumni.
N Engl J Med. 1986;
314:605
-613

[85] page a,
cooper ar,
stamatakis e,
foster lj,
crowne ec. Physical activity patterns in nonobese and obese children assessed using minute-by-minute accelerometry.
Int J Obes (Lond). 2005;
29:1070
-1076

[86] paluska sa,
schwenk tl. Physical activity and mental health: current concepts.
Sports Med. 2000;
29:167
-180

[87] pate rr,
pratt m,
blair sn,
haskell wl,
macera ca. Physical activity and public health. A recommendation from the Centers for Disease Control and Prevention and the American College of Sports Medicine.
JAMA. 1995;
273:402
-407

[88] perri mg,
anton sd,
durning pe,
ketterson tu,
sydeman sj. Adherence to exercise prescriptions: effects of prescribing moderate versus higher levels of intensity and frequency.
Health Psychol. 2002;
21:452
-458

[89] pietilä am,
hentinen m,
myhrman a. The health of Northern Finnish men in adolescence and adulthood.
Int J Nurs Stud. 1995;
32:325
-338

[90] poudevigne ms,
o’connor pj. A review of physical activity patterns in pregnant women and their relationship to psychological health.
Sports Med. 2006;
36:19
-38

[91] redman lm,
loucks ab. Menstrual disorders in athletes.
Sports Med. 2005;
35:747
-755

[92] rhodes re,
martin ad,
taunton je. Temporal relationships of self-efficacy and social support as predictors of adherence in a 6-month strength-training program for older women.
Percept Mot Skills. 2001;
93:693
-703

[93] rickenlund a,
eriksson mj,
schenck-gustafsson k,
hirschberg al. Amenorrhea in female athletes is associated with endothelial dysfunction and unfavorable lipid profile.
J Clin Endocrinol Metab. 2005;
90:1354
-1359

[94] rikli re,
mcmanis bg. Effects of exercise on bone mineral content in postmenopausal women.
Res Q Exerc Sport. 1990;
61:243
-249

[95] rosetta l,
harrison ga,
read gf. Ovarian impairments of female recreational distance runners during a season of training.
Ann Hum Biol. 1998;
25:345
-357

[96] ryan as,
elahi d. Loss of bone mineral density in women athletes during aging.
Calcif Tissue Int. 1998;
63:287
-292

[97] sallis jf. Age-related decline in physical activity: a synthesis of human and animal studies.
Med Sci Sports Exerc. 2000;
32:1598
-1600

[98] sallis jf,
prochaska jj,
taylor wc. A review of correlates of physical activity of children and adolescents.
Med Sci Sports Exerc. 2000;
32:963
-975

[99] scully d,
kremer j,
meade mm,
graham r,
dudgeon k. Physical exercise and psychological well being: a critical review.
Br J Sports Med. 1998;
32:111
-120

[100] sherwood ne,
jeffery rw. The behavorial determinants of exercise: implications for physical activity interventions.
Annu Rev Nutr. 2000;
20:21
-44

[101] simon c,
wagner a,
divita c,
rauscher e,
klein-platat c. Intervention centred on adolescents’ physical activity and sedentary behaviour (ICAPS): concept and 6-month results.
Int J Obes Relat Metab Disord. 2004;
28(suppl 3):S96
-S103

[102] specker bl. Evidence for an interaction between calcium intake and physical activity on changes in bone mineral density.
J Bone Miner Res. 1996;
11:1539
-1544

[103] stevenson l,
alleyne j,
mottola m,
wolfe l,
hammond ja. L’activité physique et la grossesse. Enoncé de Position.
CASM ACMS. 1998;
:1
-10

[104] stone ej,
mckenzie tl,
welk gj,
booth ml. Effects of physical activity interventions in youth. Review and synthesis.
Am J Prev Med. 1998;
15:298
-315

[105] strelan p,
mehaffey s j,
tiggemann m. Self-objectification and esteem in young women: the mediating role of reasons for exercise.
Sex Roles. 2003;
48:89
-95

[106] strong wb,
malina rm,
blimkie cj,
daniels sr,
dishman rk. Evidence based physical activity for school-age youth.
J Pediatr. 2005;
146:732
-737

[107] suter e,
hawes mr. Relationship of physical activity, body fat, diet, and blood lipid profile in youths 10-15 year.
Med Sci Sports Exerc. 1993;
25:748
-754

[108] tammelin t,
nayha s,
hills ap,
jarvelin mr. Adolescent participation in sports and adult physical activity.
Am J Prev Med. 2003;
24:22
-28

[109] telama r,
yang x. Decline of physical activity from youth to young adulthood in Finland.
Med Sci Sports Exerc. 2000;
32:1617
-1622

[110] tomkinson gr,
leger la,
olds ts,
cazorla g. Secular trends in the performance of children and adolescents (1980-2000): an analysis of 55 studies of the 20m shuttle run test in 11 countries.
Sports Med. 2003;
33:285
-300

[111] tomten se,
falch ja,
birkeland ki,
hemmersbach p,
hostmark at. Bone mineral density and menstrual irregularities. A comparative study on cortical and trabecular bone structures in runners with alleged normal eating behavior.
Int J Sports Med. 1998;
19:92
-97

[112] torstveit mk,
sundgot-borgen j. Participation in leanness sports but not training volume is associated with menstrual dysfunction: a national survey of 1276 elite athletes and controls.
Br J Sports Med. 2005;
39:141
-147

[113] toth mj,
poehlman et. Resting metabolic rate and cardiovascular disease risk in resistance- and aerobic-trained middle-aged women.
Int J Obes Relat Metab Disord. 1995;
19:691
-698

[114] trost sg,
pate rr,
sallis jf,
freedson ps,
taylor wc. Age and gender differences in objectively measured physical activity in youth.
Med Sci Sports Exerc. 2002;
34:350
-355

[115] trost sg,
sirard jr,
dowda m,
pfeiffer ka,
pate rr. Physical activity in overweight and nonoverweight preschool children.
Int J Obes Relat Metab Disord. 2003;
27:834
-839

[116] trudeau f,
laurencelle l,
tremblay j,
rajic m,
shephard rj. Daily primary school physical education: effects on physical activity during adult life.
Med Sci Sports Exerc. 1999;
31:111
-117

[117] trudeau f,
laurencelle l,
shephard rj. Tracking of physical activity from childhood to adulthood.
Med Sci Sports Exerc. 2004;
36:1937
-1943

[118] twisk jw. Physical activity guidelines for children and adolescents: a critical review.
Sports Med. 2001;
31:617
-627

[119] twisk jw,
kemper hc,
van mechelen w,
post gb. Tracking of risk factors for coronary heart disease over a 14-year period: a comparison between lifestyle and biologic risk factors with data from the Amsterdam Growth and Health Study.
Am J Epidemiol. 1997;
145:888
-898

[120] van mechelen w,
twisk jw,
post gb,
snel j,
kemper hc. Physical activity of young people: the Amsterdam Longitudinal Growth and Health Study.
Med Sci Sports Exerc. 2000;
32:1610
-1616

[121] vilhjalmsson r,
thorlindsson t. Factors related to physical activity: a study of adolescents.
Soc Sci Med. 1998;
47:665
-675

[122] warren mp,
perlroth ne. The effects of intense exercise on the female reproductive system.
Journal of Endocrinology. 2001;
170:3
-11

[123] welt ck,
chan jl,
bullen j,
murphy r,
smith p. Recombinant human leptin in women with hypothalamic amenorrhea.
N Engl J Med. 2004;
351:987
-997

[124] westerterp kr. Alterations in energy balance with exercise.
Am J Clin Nutr. 1998;
68:970S
-974S

[125] westerterp kr,
goran mi. Relationship between physical activity related energy expenditure and body composition: a gender difference.
Int J Obes Relat Metab Disord. 1997;
21:184
-188

[126] westerterp kr,
meijer ga,
janssen em,
saris wh,
ten hoor f. Long-term effect of physical activity on energy balance and body composition.
Br J Nutr. 1992;
68:21
-30

[127] whelton sp,
chin a,
xin x,
jiang h. Effect of aerobic exercise on blood pressure: a met-analysis of randomized, controlled trials.
Ann Intern Med. 2002;
136:493
-503

[128] white jl,
ransdell lb,
vener j,
flohr ja. Factors related to physical activity adherence in women: review and suggestions for future research.
Women Health. 2005;
41:123
-148

[129] wilkin tj,
mallam km,
metcalf bs,
jeffery an,
voss ld. Variation in physical activity lies with the child, not his environment: evidence for an ’activitystat’ in young children (EarlyBird 16).
Int J Obes (Lond). 2006;
30:1050
-1055

[130] williams ni,
helmreich dl,
parfitt db,
caston-balderrama a,
cameron jl. Evidence for a causal role of low energy availability in the induction of menstrual cycle disturbances during strenuous exercise training.
J Clin Endocrinol Metab. 2001;
86:5184
-5193

[131] wolff i,
van croonenborg jj,
kemper hc,
kostense pj,
twisk jw. The effect of exercise training programs on bone mass: a meta-analysis of published controlled trials in pre- and postmenopausal women.
Osteoporos Int. 1999;
9:1
-12

[132] wolin ky,
glynn rj,
colditz ga,
lee im,
awachi i. Long-term physical activity patterns and health-related quality of life in U.S. women.
Am J Prev Med. 2007;
32:490
-499

[133] woodruff si,
conway tl. A longitudinal assessment of the impact of health/fitness status and health behavior on perceived quality of life.
Percept Mot Skills. 1992;
75:3
-14

→ Aller vers SYNTHESE
 ) ont mis en évidence une relation négative très significative entre le taux de mortalité et le niveau de condition physique. En effet, un niveau élevé d’activité physique apparaît comme préventif d’une mortalité précoce, ceci étant dû à la réduction des risques de développer des maladies cardiovasculaires et certains cancers, tant chez l’homme que chez la femme. Trente à soixante minutes de marche à allure rapide chaque jour apparaissent suffisantes pour atteindre un niveau satisfaisant de condition physique. Cette quantité d’activité physique correspond à 9 METs chez la femme pour 10 METs chez l’homme. Hardman (1999
) ont mis en évidence une relation négative très significative entre le taux de mortalité et le niveau de condition physique. En effet, un niveau élevé d’activité physique apparaît comme préventif d’une mortalité précoce, ceci étant dû à la réduction des risques de développer des maladies cardiovasculaires et certains cancers, tant chez l’homme que chez la femme. Trente à soixante minutes de marche à allure rapide chaque jour apparaissent suffisantes pour atteindre un niveau satisfaisant de condition physique. Cette quantité d’activité physique correspond à 9 METs chez la femme pour 10 METs chez l’homme. Hardman (1999 ) a de plus mis en évidence une relation très significative entre la condition physique, la masse corporelle et le profil œstrogénique.
) a de plus mis en évidence une relation très significative entre la condition physique, la masse corporelle et le profil œstrogénique. ), qui recense 37 études prospectives et une rétrospective, s’est intéressée à la relation entre activité physique et mortalité chez la femme. Vingt trois de ces études font état d’un taux de mortalité plus faible chez les femmes actives ou ayant un bon niveau de condition physique. Cette revue indique que le risque relatif de mortalité est réduit de 34 % avec la pratique physique. Cette association entre l’activité physique et la mortalité est d’amplitude IDEntique chez la femme et chez l’homme. Un effet dose-réponse n’a en revanche pas été démontré de façon significative. La question est donc de savoir quelle est la quantité optimale d’activité physique bénéfique . La dépense énergétique associée au plus faible taux de mortalité est de 4 200 kJ par semaine (Oguma et coll., 2002
), qui recense 37 études prospectives et une rétrospective, s’est intéressée à la relation entre activité physique et mortalité chez la femme. Vingt trois de ces études font état d’un taux de mortalité plus faible chez les femmes actives ou ayant un bon niveau de condition physique. Cette revue indique que le risque relatif de mortalité est réduit de 34 % avec la pratique physique. Cette association entre l’activité physique et la mortalité est d’amplitude IDEntique chez la femme et chez l’homme. Un effet dose-réponse n’a en revanche pas été démontré de façon significative. La question est donc de savoir quelle est la quantité optimale d’activité physique bénéfique . La dépense énergétique associée au plus faible taux de mortalité est de 4 200 kJ par semaine (Oguma et coll., 2002 ). Les divergences de résultats ou les imprécisions dans les données ne permettent pas de proposer une fréquence ou une durée d’activité physique optimale. De plus, la littérature fait apparaître des données apparemment divergentes dans la mesure où, chez la femme, une faible condition physique est très fortement associée à un risque élevé de mortalité (Paffenbarger et coll., 1986
). Les divergences de résultats ou les imprécisions dans les données ne permettent pas de proposer une fréquence ou une durée d’activité physique optimale. De plus, la littérature fait apparaître des données apparemment divergentes dans la mesure où, chez la femme, une faible condition physique est très fortement associée à un risque élevé de mortalité (Paffenbarger et coll., 1986 ) alors qu’un faible niveau d’activité physique n’est pas significativement associé à ce risque élevé (Blair et coll., 1993
) alors qu’un faible niveau d’activité physique n’est pas significativement associé à ce risque élevé (Blair et coll., 1993 ). Il semblerait donc que la condition physique ne soit pas toujours associée au niveau d’activité physique. L’hypothèse explicative pourrait être une mauvaise quantification et qualification de la pratique d’activité physique dans toutes ses composantes.
). Il semblerait donc que la condition physique ne soit pas toujours associée au niveau d’activité physique. L’hypothèse explicative pourrait être une mauvaise quantification et qualification de la pratique d’activité physique dans toutes ses composantes. ). Les résultats montrent que ces deux facteurs augmentent le risque de mortalité et ce, de façon indépendante comme précédemment démontré dans « the Nurses’ Health Study » (Hu et coll., 2004
). Les résultats montrent que ces deux facteurs augmentent le risque de mortalité et ce, de façon indépendante comme précédemment démontré dans « the Nurses’ Health Study » (Hu et coll., 2004 ).
). ). La Nurses’ Health Study, réalisée chez des femmes de 40-65 ans, rapporte après un suivi longitudinal de 8 ans, un risque relatif de développer des problèmes coronariens diminué de moitié chez les femmes les plus actives (Manson et coll., 1999
). La Nurses’ Health Study, réalisée chez des femmes de 40-65 ans, rapporte après un suivi longitudinal de 8 ans, un risque relatif de développer des problèmes coronariens diminué de moitié chez les femmes les plus actives (Manson et coll., 1999 ). Les femmes qui marchent au moins 3 h par semaine ou qui participent à des activités physiques vigoureuses à hauteur de 1h30 par semaine ont 30 à 40 % moins de risques de développer des maladies cardiovasculaires que les femmes sédentaires. Il est intéressant de constater que les femmes qui deviennent actives voient aussi leur risque réduit comparativement à celles qui restent sédentaires. Cette étude rapporte aussi que la diminution du risque de développer un diabète est associée à la dépense d’énergie (marche versus intensité vigoureuse) (Hu et coll., 1999
). Les femmes qui marchent au moins 3 h par semaine ou qui participent à des activités physiques vigoureuses à hauteur de 1h30 par semaine ont 30 à 40 % moins de risques de développer des maladies cardiovasculaires que les femmes sédentaires. Il est intéressant de constater que les femmes qui deviennent actives voient aussi leur risque réduit comparativement à celles qui restent sédentaires. Cette étude rapporte aussi que la diminution du risque de développer un diabète est associée à la dépense d’énergie (marche versus intensité vigoureuse) (Hu et coll., 1999 ).
). ). Le groupe de femmes les plus inactives présente une mortalité due aux facteurs cardiovasculaires 2 fois plus élevée que les femmes les plus actives. Celles qui participent à des activités élevées 4 fois ou plus par semaine ont un risque 80 % plus faible que celles qui ne participent que rarement ou jamais à une activité physique.
). Le groupe de femmes les plus inactives présente une mortalité due aux facteurs cardiovasculaires 2 fois plus élevée que les femmes les plus actives. Celles qui participent à des activités élevées 4 fois ou plus par semaine ont un risque 80 % plus faible que celles qui ne participent que rarement ou jamais à une activité physique. ; Appel, 2003
; Appel, 2003 ) ou les méta-analyses (Whelton et coll., 2002
) ou les méta-analyses (Whelton et coll., 2002 ) qui concluent que l’activité physique diminue la pression artérielle tant chez les personnes hypertendues que chez les personnes normotendues, tant chez la femme que chez l’homme. Spécifiquement à la femme, le risque de développer de l’hypertension est augmenté de 52 % chez les femmes sédentaires comparées à des femmes ayant une très bonne condition physique (Blair et coll., 1984
) qui concluent que l’activité physique diminue la pression artérielle tant chez les personnes hypertendues que chez les personnes normotendues, tant chez la femme que chez l’homme. Spécifiquement à la femme, le risque de développer de l’hypertension est augmenté de 52 % chez les femmes sédentaires comparées à des femmes ayant une très bonne condition physique (Blair et coll., 1984 ).
). ). Les meilleurs résultats sont obtenus avec une fréquence d’activité de 3 fois par semaine et sont indépendants de la perte de poids qui « normalement » accompagne la mise en activité (Whelton et coll., 2002
). Les meilleurs résultats sont obtenus avec une fréquence d’activité de 3 fois par semaine et sont indépendants de la perte de poids qui « normalement » accompagne la mise en activité (Whelton et coll., 2002 ).
). ) ne rapportent aucune différence pour la pression systolique entre des femmes d’âge moyen sédentaires ou participant régulièrement à un entraînement de renforcement musculaire ou en endurance.
) ne rapportent aucune différence pour la pression systolique entre des femmes d’âge moyen sédentaires ou participant régulièrement à un entraînement de renforcement musculaire ou en endurance. ; Eaton et coll., 1995
; Eaton et coll., 1995 ). Un programme d’activité physique en endurance diminue le LDL1
-cholestérol (3-8 %) et les triglycérides (Durstine et Haskell, 1994
). Un programme d’activité physique en endurance diminue le LDL1
-cholestérol (3-8 %) et les triglycérides (Durstine et Haskell, 1994 ). La récente méta-analyse de Kodama et coll. (2007
). La récente méta-analyse de Kodama et coll. (2007 ) fait état à partir de 25 études randomisées et contrôlées d’une augmentation significative bien que modeste du HDL2
-cholestérol (2,53 mg/dL, p<0,01) (Kodama et coll., 2007
) fait état à partir de 25 études randomisées et contrôlées d’une augmentation significative bien que modeste du HDL2
-cholestérol (2,53 mg/dL, p<0,01) (Kodama et coll., 2007 ). Cette publication met en évidence un niveau minimal d’activité physique estimé à 900 kcal de dépense énergétique par semaine ou 120 minutes d’activité hebdomadaire, nécessaire pour obtenir cette augmentation. De plus, les résultats sont d’amplitude plus importante chez les sujets ayant un faible indice de masse corporelle (IMC<28).
). Cette publication met en évidence un niveau minimal d’activité physique estimé à 900 kcal de dépense énergétique par semaine ou 120 minutes d’activité hebdomadaire, nécessaire pour obtenir cette augmentation. De plus, les résultats sont d’amplitude plus importante chez les sujets ayant un faible indice de masse corporelle (IMC<28). ). En effet, l’exercice, qui n’entraîne pas de perte de poids, n’a que peu d’effet sur le HDL-cholestérol, alors qu’une perte de poids seule, en particulier au niveau de la graisse abdominale, peut améliorer le niveau de HDL-cholestérol chez la femme (Despres et coll., 1991
). En effet, l’exercice, qui n’entraîne pas de perte de poids, n’a que peu d’effet sur le HDL-cholestérol, alors qu’une perte de poids seule, en particulier au niveau de la graisse abdominale, peut améliorer le niveau de HDL-cholestérol chez la femme (Despres et coll., 1991 ).
). ) n’observent pas de variation significative du HDL-cholestérol et des triglycérides. Quand la masse grasse est contrôlée, les différences significatives entre les deux types d’exercice pour le LDL-cholestérol et le cholestérol total diminuent.
) n’observent pas de variation significative du HDL-cholestérol et des triglycérides. Quand la masse grasse est contrôlée, les différences significatives entre les deux types d’exercice pour le LDL-cholestérol et le cholestérol total diminuent. ). Chez l’homme, la perte de masse grasse est corrélée avec la masse grasse de départ, ce qui n’est pas retrouvé chez la femme. Il a été suggéré pour expliquer cette différence homme/femme, que les femmes ont plus tendance à compenser la dépense énergétique engendrée par l’exercice, par un apport alimentaire augmenté (Westerterp et coll., 1992
). Chez l’homme, la perte de masse grasse est corrélée avec la masse grasse de départ, ce qui n’est pas retrouvé chez la femme. Il a été suggéré pour expliquer cette différence homme/femme, que les femmes ont plus tendance à compenser la dépense énergétique engendrée par l’exercice, par un apport alimentaire augmenté (Westerterp et coll., 1992 ; Westerterp et Goran, 1997
; Westerterp et Goran, 1997 ). Ainsi, les femmes ont tendance à préserver leur balance énergétique en compensant le déficit énergétique lié à l’activité par un apport énergétique équivalent, ce qui explique pourquoi la diminution de masse grasse bien que significative reste faible.
). Ainsi, les femmes ont tendance à préserver leur balance énergétique en compensant le déficit énergétique lié à l’activité par un apport énergétique équivalent, ce qui explique pourquoi la diminution de masse grasse bien que significative reste faible. ; Despres et coll., 1991
; Despres et coll., 1991 ; Barnard et Wen, 1994
; Barnard et Wen, 1994 ).
). ; Paluska et Schwenk, 2000
; Paluska et Schwenk, 2000 ). En outre, l’effet dose-réponse des activités physiques sur la santé mentale reste à démontrer (Dunn et coll., 2001
). En outre, l’effet dose-réponse des activités physiques sur la santé mentale reste à démontrer (Dunn et coll., 2001 ).
). ). Le temps consacré aux activités physiques de loisir est corrélé à une augmentation du niveau d’activité physique et à une diminution du stress perçu (Aldana et coll., 1996
). Le temps consacré aux activités physiques de loisir est corrélé à une augmentation du niveau d’activité physique et à une diminution du stress perçu (Aldana et coll., 1996 ). Chez l’homme, l’étude de Norris et coll. (1990
). Chez l’homme, l’étude de Norris et coll. (1990 ) a comparé les effets de 10 semaines de programme d’activité aérobie à des activités de force. Les résultats sont en faveur d’une meilleure efficacité des activités aérobies.
) a comparé les effets de 10 semaines de programme d’activité aérobie à des activités de force. Les résultats sont en faveur d’une meilleure efficacité des activités aérobies. ). Les activités de faible intensité et la perception individuelle de sa performance apparaissent comme les déterminants de la réduction de l’anxiété (Bartholomew et Linder, 1998
). Les activités de faible intensité et la perception individuelle de sa performance apparaissent comme les déterminants de la réduction de l’anxiété (Bartholomew et Linder, 1998 ), mais il n’existe pas de consensus quant à la durée et l’intensité optimales des activités physiques.
), mais il n’existe pas de consensus quant à la durée et l’intensité optimales des activités physiques. ) analysant des études randomisées et contrôlées, des études d’observation et des études de consensus (37 études sélectionnées). L’étude de Cramer et coll. (1991
) analysant des études randomisées et contrôlées, des études d’observation et des études de consensus (37 études sélectionnées). L’étude de Cramer et coll. (1991 ) fait état d’une amélioration des scores de santé psychologique (dépression, anxiété) chez 35 femmes non-ménopausées, non dépressives à la suite de 15 semaines d’activité physique de type aérobie. En revanche, l’effet de l’activité physique pour prévenir l’apparition de la dépression n’est pas très clair (Paluska et Schwenk, 2000
) fait état d’une amélioration des scores de santé psychologique (dépression, anxiété) chez 35 femmes non-ménopausées, non dépressives à la suite de 15 semaines d’activité physique de type aérobie. En revanche, l’effet de l’activité physique pour prévenir l’apparition de la dépression n’est pas très clair (Paluska et Schwenk, 2000 ). L’étude de Cooper-Patrick et coll. (1997
). L’étude de Cooper-Patrick et coll. (1997 ), par exemple, ne fait pas état de différence significative de développement de la dépression chez des sujets actifs comparativement à des sujets non actifs (population d’étude : 690 hommes et 62 femmes). Cependant, chez les sujets atteints de dépression, l’inactivité est un fort déterminant de la dépression (Scully et coll., 1998
), par exemple, ne fait pas état de différence significative de développement de la dépression chez des sujets actifs comparativement à des sujets non actifs (population d’étude : 690 hommes et 62 femmes). Cependant, chez les sujets atteints de dépression, l’inactivité est un fort déterminant de la dépression (Scully et coll., 1998 ).
). ; Scully et coll., 1998
; Scully et coll., 1998 ). L’humeur a été utilisée pour investir les perceptions post-exercice, comme le bien-être, l’anxiété, l’estime de soi. L’estime de soi est liée à l’image du corps. Dans ce contexte, les femmes attendent de l’activité physique, qu’elle leur permette de contrôler leur masse corporelle en influant sur la masse grasse et le tonus musculaire, alors que les hommes désirent contrôler leur masse grasse et développer leur musculature (Hausenblas et Fallon, 2006
). L’humeur a été utilisée pour investir les perceptions post-exercice, comme le bien-être, l’anxiété, l’estime de soi. L’estime de soi est liée à l’image du corps. Dans ce contexte, les femmes attendent de l’activité physique, qu’elle leur permette de contrôler leur masse corporelle en influant sur la masse grasse et le tonus musculaire, alors que les hommes désirent contrôler leur masse grasse et développer leur musculature (Hausenblas et Fallon, 2006 ).
). ). Dans ce domaine, les résultats de la Nurses’ Health Study évaluent l’évolution du niveau d’activité physique et du score de qualité de vie de 63 152 femmes âgées de 40 à 67 ans en 1986, et font état d’une amélioration de la qualité de vie pour les femmes ayant augmenté leur activité physique sur les dix ans d’étude. Le score de qualité de vie est passé de 2,23 (IC 95 % [1,94-2,52]) à 8,23 (IC 95 % [7,49-8,97]) (Wolin et coll., 2007
). Dans ce domaine, les résultats de la Nurses’ Health Study évaluent l’évolution du niveau d’activité physique et du score de qualité de vie de 63 152 femmes âgées de 40 à 67 ans en 1986, et font état d’une amélioration de la qualité de vie pour les femmes ayant augmenté leur activité physique sur les dix ans d’étude. Le score de qualité de vie est passé de 2,23 (IC 95 % [1,94-2,52]) à 8,23 (IC 95 % [7,49-8,97]) (Wolin et coll., 2007 ).
). ). Chez la femme, l’activité physique a également des effets bénéfiques sur l’image du corps, l’estime de soi et les fonctions cognitives (Levy et Ebbeck, 2005
). Chez la femme, l’activité physique a également des effets bénéfiques sur l’image du corps, l’estime de soi et les fonctions cognitives (Levy et Ebbeck, 2005 ).
). ). Cette proposition repose sur deux hypothèses majeures. La première est que l’apprentissage de comportements de pratique régulière d’activité physique permettra aux enfants actifs de demeurer des adultes actifs. La seconde hypothèse repose sur la possibilité que la pratique d’activité physique au cours de l’enfance aura des effets bénéfiques sur la santé de l’adulte (Kelder et coll., 1994
). Cette proposition repose sur deux hypothèses majeures. La première est que l’apprentissage de comportements de pratique régulière d’activité physique permettra aux enfants actifs de demeurer des adultes actifs. La seconde hypothèse repose sur la possibilité que la pratique d’activité physique au cours de l’enfance aura des effets bénéfiques sur la santé de l’adulte (Kelder et coll., 1994 ; Aaron et coll., 2005
; Aaron et coll., 2005 ).
). ) qui propose des relations d’influence entre l’activité de l’enfant et de l’adolescent/la santé de l’enfant et de l’adolescent/l’activité et la santé de l’adulte (figure 24.1
) qui propose des relations d’influence entre l’activité de l’enfant et de l’adolescent/la santé de l’enfant et de l’adolescent/l’activité et la santé de l’adulte (figure 24.1 ).
). ; Twisk, 2001
; Twisk, 2001 ). Un effet bénéfique de la pratique d’activité physique a été mis en exergue pour la composition corporelle, la condition physique, le métabolisme osseux, la santé mentale et le profil lipidique (HDL-cholestérol et triglycérides) (Suter et Hawes, 1993
). Un effet bénéfique de la pratique d’activité physique a été mis en exergue pour la composition corporelle, la condition physique, le métabolisme osseux, la santé mentale et le profil lipidique (HDL-cholestérol et triglycérides) (Suter et Hawes, 1993 ).
). ).
). ) et Hallal et coll. (2006
) et Hallal et coll. (2006 ), s’accordent à dire que l’étude de Paffenberger et coll. (1986
), s’accordent à dire que l’étude de Paffenberger et coll. (1986 ) (Harvard Alumni Study) a été la première à se pencher sur le sujet. Cependant, ce travail n’a pas mis en exergue de relation significative entre l’activité physique à l’adolescence et des effets bénéfiques sur les risques de pathologies cardiovasculaires à l’âge adulte. D’autres travaux observent une relation plus positive mais non significative (Malina, 1996
) (Harvard Alumni Study) a été la première à se pencher sur le sujet. Cependant, ce travail n’a pas mis en exergue de relation significative entre l’activité physique à l’adolescence et des effets bénéfiques sur les risques de pathologies cardiovasculaires à l’âge adulte. D’autres travaux observent une relation plus positive mais non significative (Malina, 1996 ; Twisk, 2001
; Twisk, 2001 ; Boreham et coll., 2002
; Boreham et coll., 2002 ).
). ). Plusieurs études se sont intéressées à cette problématique et sont traitées par ailleurs dans cet ouvrage. Dans le même ordre d’idée, l’intérêt d’une activité physique à l’adolescence sur l’augmentation et la préservation du capital osseux est une évidence (Khan et coll., 2000
). Plusieurs études se sont intéressées à cette problématique et sont traitées par ailleurs dans cet ouvrage. Dans le même ordre d’idée, l’intérêt d’une activité physique à l’adolescence sur l’augmentation et la préservation du capital osseux est une évidence (Khan et coll., 2000 ; Karlsson, 2004
; Karlsson, 2004 ).
). ), se retrouve à 9-10 ans (Trost et coll., 2002
), se retrouve à 9-10 ans (Trost et coll., 2002 ; Page et coll., 2005
; Page et coll., 2005 ) et persiste à l’adolescence (Kimm et coll., 2005
) et persiste à l’adolescence (Kimm et coll., 2005 ).
). ) montre, par des mesures d’accélérométrie, qu’à 5-6 ans comme à 9 ans, les garçons sont plus actifs que les filles, mais que cette différence est surtout marquée pour les activités d’intensité élevée (tableau 24.I
) montre, par des mesures d’accélérométrie, qu’à 5-6 ans comme à 9 ans, les garçons sont plus actifs que les filles, mais que cette différence est surtout marquée pour les activités d’intensité élevée (tableau 24.I ). Qualitativement, la baisse d’activité physique observée avec l’âge a lieu préférentiellement pour les activités d’intensité élevée au bénéfice des activités à intensité modérée.
). Qualitativement, la baisse d’activité physique observée avec l’âge a lieu préférentiellement pour les activités d’intensité élevée au bénéfice des activités à intensité modérée. ), cette évolution existe également chez les garçons, mais de façon moins marquée. Ainsi, dans l’étude du Baromètre santé :
), cette évolution existe également chez les garçons, mais de façon moins marquée. Ainsi, dans l’étude du Baromètre santé : )
) ). Les hommes semblent pratiquer des activités physiques avec des dépenses énergétiques plus importantes que celles mesurées chez les femmes. Cette différence s’exprime par le choix des activités pratiquées. Ainsi, les hommes privilégient le jardinage, les exercices de force, le jogging ou la course et les sports de contact ou à intensité élevée, alors que les femmes adhèrent plus à la marche, la danse, l’aérobic et la gymnastique (Sherwoog et Jeffery, 2000
). Les hommes semblent pratiquer des activités physiques avec des dépenses énergétiques plus importantes que celles mesurées chez les femmes. Cette différence s’exprime par le choix des activités pratiquées. Ainsi, les hommes privilégient le jardinage, les exercices de force, le jogging ou la course et les sports de contact ou à intensité élevée, alors que les femmes adhèrent plus à la marche, la danse, l’aérobic et la gymnastique (Sherwoog et Jeffery, 2000 ). Les hommes sont généralement plus actifs dans leur travail alors que les femmes sont plus actives dans les travaux domestiques (Belza et Warms, 2004
). Les hommes sont généralement plus actifs dans leur travail alors que les femmes sont plus actives dans les travaux domestiques (Belza et Warms, 2004 ). Cependant, peu d’études se sont intéressées uniquement à la femme. Les variables prédictives de la pratique d’une activité physique chez la femme sont l’âge, le rôle social conféré à l’activité physique, le soutien de l’entourage et les paramètres environnementaux (Belza et Warms, 2004
). Cependant, peu d’études se sont intéressées uniquement à la femme. Les variables prédictives de la pratique d’une activité physique chez la femme sont l’âge, le rôle social conféré à l’activité physique, le soutien de l’entourage et les paramètres environnementaux (Belza et Warms, 2004 ).
). ) a montré que chez les enfants pré-pubères, la durée moyenne des activités physiques d’intensité légère et modérée était de 6 secondes (s), alors que 95 % des activités physiques d’intensité élevée avaient une durée d’au moins 15 s avec une moyenne de 3 s. En moyenne, une période d’activité physique a une durée de 20 s et n’excède pas 10 minutes. Avec l’âge, l’activité physique diminue. L’étude de Kimm et coll. (2005
) a montré que chez les enfants pré-pubères, la durée moyenne des activités physiques d’intensité légère et modérée était de 6 secondes (s), alors que 95 % des activités physiques d’intensité élevée avaient une durée d’au moins 15 s avec une moyenne de 3 s. En moyenne, une période d’activité physique a une durée de 20 s et n’excède pas 10 minutes. Avec l’âge, l’activité physique diminue. L’étude de Kimm et coll. (2005 ) réalisée chez une population importante de filles rapporte que le niveau d’activité physique décroît avec l’âge quel que soit la valeur de ce niveau d’activité physique (filles actives, modérément actives ou inactives) (figure 24.2
) réalisée chez une population importante de filles rapporte que le niveau d’activité physique décroît avec l’âge quel que soit la valeur de ce niveau d’activité physique (filles actives, modérément actives ou inactives) (figure 24.2 ).
).
 )
) ) ont montré chez le garçon et chez la fille que les activités intenses (au moins 7 METs) diminuaient sérieusement avec l’âge, alors que les activités d’intensité modérée (4-7 METs) augmentaient entre 13 et 17 ans.
) ont montré chez le garçon et chez la fille que les activités intenses (au moins 7 METs) diminuaient sérieusement avec l’âge, alors que les activités d’intensité modérée (4-7 METs) augmentaient entre 13 et 17 ans. ). Au moment de l’adolescence, l’activité physique devient plus organisée et le plaisir du jeu laisse peu à peu la place à des objectifs de santé, de condition physique (Strong et coll., 2005
). Au moment de l’adolescence, l’activité physique devient plus organisée et le plaisir du jeu laisse peu à peu la place à des objectifs de santé, de condition physique (Strong et coll., 2005 ). Ainsi, il est important de tenir compte des facteurs facilitant la pratique en fonction des intérêts, des objectifs et de l’âge des jeunes. Par exemple, un programme d’activité physique associé à une restriction énergétique, peut être très sollicitant physiologiquement si le but est de perdre du poids, mais devra se rapprocher rapidement des possibilités et des raisons qui poussent à continuer une pratique physique tout au long de la vie. Il ne faut pas oublier que le plaisir reste le premier déterminant de la pratique d’une activité physique.
). Ainsi, il est important de tenir compte des facteurs facilitant la pratique en fonction des intérêts, des objectifs et de l’âge des jeunes. Par exemple, un programme d’activité physique associé à une restriction énergétique, peut être très sollicitant physiologiquement si le but est de perdre du poids, mais devra se rapprocher rapidement des possibilités et des raisons qui poussent à continuer une pratique physique tout au long de la vie. Il ne faut pas oublier que le plaisir reste le premier déterminant de la pratique d’une activité physique. ) font état d’une diminution de la performance à un test de course de 0,46 % par an chez les garçons et 0,41 % chez les filles (6-19 ans).
) font état d’une diminution de la performance à un test de course de 0,46 % par an chez les garçons et 0,41 % chez les filles (6-19 ans). ; Hancox et coll., 2004
; Hancox et coll., 2004 ). Pour la pratique d’activité physique, une revue systématique va dans le sens d’une contribution significative de l’activité physique à l’adolescence pour la pérennisation d’une pratique physique à l’âge adulte (Trudeau et coll., 2004
). Pour la pratique d’activité physique, une revue systématique va dans le sens d’une contribution significative de l’activité physique à l’adolescence pour la pérennisation d’une pratique physique à l’âge adulte (Trudeau et coll., 2004 ; Hallal et coll., 2006
; Hallal et coll., 2006 ). Tammelin et coll. (2003
). Tammelin et coll. (2003 ) mettent en évidence que la participation des adolescents au sport avec une fréquence d’au moins une fois par semaine pour les filles et de deux fois pour les garçons est associée à un haut niveau d’activité physique dans la vie adulte. Il semble également qu’une pratique physique diversifiée est le meilleur atout de pérennisation de la pratique d’activité physique à l’âge adulte. Chez la femme plus spécifiquement, un faible niveau d’activité physique à l’adolescence se traduit par un faible niveau d’activité physique à l’âge adulte. Ainsi, chez les adolescentes (14-18 ans) actives (plus de 3 h d’activité physique par semaine), 54,4 % restent actives à l’âge adulte (37-43 ans) et 45,6 % deviennent sédentaires (Matton et coll., 2006
) mettent en évidence que la participation des adolescents au sport avec une fréquence d’au moins une fois par semaine pour les filles et de deux fois pour les garçons est associée à un haut niveau d’activité physique dans la vie adulte. Il semble également qu’une pratique physique diversifiée est le meilleur atout de pérennisation de la pratique d’activité physique à l’âge adulte. Chez la femme plus spécifiquement, un faible niveau d’activité physique à l’adolescence se traduit par un faible niveau d’activité physique à l’âge adulte. Ainsi, chez les adolescentes (14-18 ans) actives (plus de 3 h d’activité physique par semaine), 54,4 % restent actives à l’âge adulte (37-43 ans) et 45,6 % deviennent sédentaires (Matton et coll., 2006 ). Chez les filles considérées comme inactives, 62,5 % le restent et 37,5 % deviennent actives à l’âge adulte. Chez le garçon, une étude Finlandaise montre que 71 % des garçons actifs à l’âge de 14 ans (au moins 1 h d’activité physique par semaine) restent actifs à l’âge adulte (24 ans), alors que 55 % des garçons inactifs restent des adultes inactifs (Pietilä et coll., 1995
). Chez les filles considérées comme inactives, 62,5 % le restent et 37,5 % deviennent actives à l’âge adulte. Chez le garçon, une étude Finlandaise montre que 71 % des garçons actifs à l’âge de 14 ans (au moins 1 h d’activité physique par semaine) restent actifs à l’âge adulte (24 ans), alors que 55 % des garçons inactifs restent des adultes inactifs (Pietilä et coll., 1995 ).
). ; Telama et Yang, 2000
; Telama et Yang, 2000 ; Van Mechelen et coll., 2000
; Van Mechelen et coll., 2000 ). Sallis (2000
). Sallis (2000 ) analyse ce déclin de la pratique d’une activité physique et montre que la période pour laquelle cette baisse est la plus significative est la même chez les filles et chez les garçons.
) analyse ce déclin de la pratique d’une activité physique et montre que la période pour laquelle cette baisse est la plus significative est la même chez les filles et chez les garçons. ) avait pour objectif de déterminer les facteurs responsables des modifications des pratiques d’activité physique au moment de l’adolescence chez les filles. Les résultats ont fait apparaître deux variables majeures de la diminution de l’activité physique à cette période sensible : le temps qui représente la contrainte majeure est inversement associé à l’activité physique et le soutien sous forme de l’aide apportée par les parents, les enseignants, l’entourage, qui est positivement associé à l’activité physique. Toutes les études qui se sont intéressées à cette question classent les facteurs de modification des pratiques d’activité physique en trois grandes catégories : les déterminants personnels (biologiques, psychosociologiques et comportementaux), socioculturels et environnementaux (Sallis et coll., 2000
) avait pour objectif de déterminer les facteurs responsables des modifications des pratiques d’activité physique au moment de l’adolescence chez les filles. Les résultats ont fait apparaître deux variables majeures de la diminution de l’activité physique à cette période sensible : le temps qui représente la contrainte majeure est inversement associé à l’activité physique et le soutien sous forme de l’aide apportée par les parents, les enseignants, l’entourage, qui est positivement associé à l’activité physique. Toutes les études qui se sont intéressées à cette question classent les facteurs de modification des pratiques d’activité physique en trois grandes catégories : les déterminants personnels (biologiques, psychosociologiques et comportementaux), socioculturels et environnementaux (Sallis et coll., 2000 ). Comparativement à l’enfant, l’adolescent accorde une valeur très importante aux facteurs comportementaux et socio-culturels. Par ailleurs, l’étude ICAPS3
(Simon et coll., 2004
). Comparativement à l’enfant, l’adolescent accorde une valeur très importante aux facteurs comportementaux et socio-culturels. Par ailleurs, l’étude ICAPS3
(Simon et coll., 2004 ) met en exergue que le fait de faciliter l’accès aux pratiques entraîne une augmentation significative de la pratique d’une activité physique chez les adolescents.
) met en exergue que le fait de faciliter l’accès aux pratiques entraîne une augmentation significative de la pratique d’une activité physique chez les adolescents. ; Strelan et coll., 2003
; Strelan et coll., 2003 ).
). ; Lee, 2003
; Lee, 2003 ). Ces recommandations se fondent sur des études d’observation épidémiologiques impliquant plus de 100 000 personnes. En terme de prévention de la mortalité (toutes causes), l’activité physique nécessaire doit représenter une dépense énergétique de 4 200 kJ par semaine (1 000 kcal par semaine) (Oguma et coll., 2002
). Ces recommandations se fondent sur des études d’observation épidémiologiques impliquant plus de 100 000 personnes. En terme de prévention de la mortalité (toutes causes), l’activité physique nécessaire doit représenter une dépense énergétique de 4 200 kJ par semaine (1 000 kcal par semaine) (Oguma et coll., 2002 ).
). ) dans une revue de synthèse, il existe de nombreuses recommandations qui évoluent avec l’apparition et l’augmentation de nouvelles pathologies touchant les jeunes. Les dernières études préconisent au moins une heure d’activité physique par jour à intensité modérée à élevée (Strong et coll., 2005
) dans une revue de synthèse, il existe de nombreuses recommandations qui évoluent avec l’apparition et l’augmentation de nouvelles pathologies touchant les jeunes. Les dernières études préconisent au moins une heure d’activité physique par jour à intensité modérée à élevée (Strong et coll., 2005 ; Andersen et coll., 2006
; Andersen et coll., 2006 ). Il est classiquement convenu que plus la quantité d’activité physique est augmentée et plus les bénéfices sont importants.
). Il est classiquement convenu que plus la quantité d’activité physique est augmentée et plus les bénéfices sont importants. ) :
) : ).
). ; Poudevigne et O’Connor, 2006
; Poudevigne et O’Connor, 2006 ), les nausées, la douleur, la fatigue et la constipation (Stevenson et coll., 1998
), les nausées, la douleur, la fatigue et la constipation (Stevenson et coll., 1998 ; Brown, 2002
; Brown, 2002 ). L’étude de Da Costa et coll. (2003) qui compare un groupe de femmes actives à un groupe de femmes inactives au cours des 1er et 2e trimestres de la grossesse fait état d’effets bénéfiques de l’activité physique sur l’humeur, le bien-être et l’état d’anxiété. Une activité physique modérée de 30 minutes par jour régulièrement et chaque jour de la semaine a des effets bénéfiques sur le contrôle du poids et sur la condition physique (Lynch et coll., 2003
). L’étude de Da Costa et coll. (2003) qui compare un groupe de femmes actives à un groupe de femmes inactives au cours des 1er et 2e trimestres de la grossesse fait état d’effets bénéfiques de l’activité physique sur l’humeur, le bien-être et l’état d’anxiété. Une activité physique modérée de 30 minutes par jour régulièrement et chaque jour de la semaine a des effets bénéfiques sur le contrôle du poids et sur la condition physique (Lynch et coll., 2003 ). Les activités préconisées sont la marche, le vélo stationnaire, la natation. La plongée sous-marine doit être évitée pendant la période de grossesse dans la mesure où le fœtus est soumis à un risque accru lié aux phénomènes de décompression (Davies et coll., 2003
). Les activités préconisées sont la marche, le vélo stationnaire, la natation. La plongée sous-marine doit être évitée pendant la période de grossesse dans la mesure où le fœtus est soumis à un risque accru lié aux phénomènes de décompression (Davies et coll., 2003 ).
). ). L’intensité de l’exercice doit se situer à 1214 sur l’échelle de perception des contraintes de l’exercice de Borg (échelle de 6 à 20) ou répondre aux zones cibles de fréquence cardiaque définies dans le tableau 24.II
). L’intensité de l’exercice doit se situer à 1214 sur l’échelle de perception des contraintes de l’exercice de Borg (échelle de 6 à 20) ou répondre aux zones cibles de fréquence cardiaque définies dans le tableau 24.II .
. )
)  ).
). ). Le résultat important est que les femmes pratiquant au moins 3 heures de marche par semaine à une allure vive, 4,8 à 6,2 km/h, présentent un risque relatif de pathologies cardiovasculaires égal à 0,65 comparativement aux femmes qui marchent non régulièrement. La pratique d’une activité physique d’intensité élevée (>6 METs) se traduit par une réduction du risque de pathologies cardiovasculaires de 30 à 40 %.
). Le résultat important est que les femmes pratiquant au moins 3 heures de marche par semaine à une allure vive, 4,8 à 6,2 km/h, présentent un risque relatif de pathologies cardiovasculaires égal à 0,65 comparativement aux femmes qui marchent non régulièrement. La pratique d’une activité physique d’intensité élevée (>6 METs) se traduit par une réduction du risque de pathologies cardiovasculaires de 30 à 40 %. ).
). ).
). ) proposent de déterminer quel doit être le nombre de pas à effectuer par jour pour atteindre 50, 100 ou 150 % des recommandations d’activité physique préconisées en population générale qui sont de « au moins 30 minutes d’activité physique d’intensité modérée à élevée de préférence tous les jours » (Pate et coll., 1995
) proposent de déterminer quel doit être le nombre de pas à effectuer par jour pour atteindre 50, 100 ou 150 % des recommandations d’activité physique préconisées en population générale qui sont de « au moins 30 minutes d’activité physique d’intensité modérée à élevée de préférence tous les jours » (Pate et coll., 1995 ). Les résultats font état de la nécessité d’accumuler 2 800 pas (50 %), 5 500 (100 %) et 6 500 pas par jour 3-4 jours par semaine pour atteindre 150 % des recommandations.
). Les résultats font état de la nécessité d’accumuler 2 800 pas (50 %), 5 500 (100 %) et 6 500 pas par jour 3-4 jours par semaine pour atteindre 150 % des recommandations. ).
). ).
). ) apporte des éléments de réponse quant aux caractéristiques de l’activité physique engendrant une adhésion optimale.
) apporte des éléments de réponse quant aux caractéristiques de l’activité physique engendrant une adhésion optimale. ). Il n’y a pas d’explication à cela, si ce n’est l’hypothèse que cette activité demande peu d’attention et peu de vigilance.
). Il n’y a pas d’explication à cela, si ce n’est l’hypothèse que cette activité demande peu d’attention et peu de vigilance. ) montrent que les femmes qui participent à 3 sessions de 10 minutes par jour d’activité physique, continuent et adhèrent plus longtemps à l’activité physique que des femmes qui effectuent une session de 30 minutes.
) montrent que les femmes qui participent à 3 sessions de 10 minutes par jour d’activité physique, continuent et adhèrent plus longtemps à l’activité physique que des femmes qui effectuent une session de 30 minutes. ; Perri et coll., 2002
; Perri et coll., 2002 ). Cependant, certaines études font état d’une meilleure adhésion de femmes participant à des activités physiques d’intensité vigoureuse versus modérée (Dacey et coll., 2003
). Cependant, certaines études font état d’une meilleure adhésion de femmes participant à des activités physiques d’intensité vigoureuse versus modérée (Dacey et coll., 2003 ). L’hypothèse qui en résulte est donc une motivation pour la progression et l’expérience.
). L’hypothèse qui en résulte est donc une motivation pour la progression et l’expérience. ) rapportent que la durée du programme augmentant, le lieu devient plus important, comme déterminant de la persistance de la participation au programme, que l’intensité ou la fréquence des sessions. La pratique à domicile ou à proximité du domicile provoque une meilleure adhésion. De plus, les femmes qui ont un domicile équipé peuvent réaliser plusieurs sessions de courte durée dans la journée ce qui correspond mieux au mode de vie (Jakicic et coll., 1999
) rapportent que la durée du programme augmentant, le lieu devient plus important, comme déterminant de la persistance de la participation au programme, que l’intensité ou la fréquence des sessions. La pratique à domicile ou à proximité du domicile provoque une meilleure adhésion. De plus, les femmes qui ont un domicile équipé peuvent réaliser plusieurs sessions de courte durée dans la journée ce qui correspond mieux au mode de vie (Jakicic et coll., 1999 ).
). ). En revanche, pour les femmes plus âgées, les déterminants principaux sont ceux qui ont un lien avec la santé, l’autonomie... (Rhodes et coll., 2001
). En revanche, pour les femmes plus âgées, les déterminants principaux sont ceux qui ont un lien avec la santé, l’autonomie... (Rhodes et coll., 2001 ). D’après Courneya et McAuley (1995
). D’après Courneya et McAuley (1995 ), le contexte social peut être un déterminant majeur pour débuter une activité physique mais n’est plus significatif comme variable pour ce qui concerne la durée de la pratique et sa pérennité.
), le contexte social peut être un déterminant majeur pour débuter une activité physique mais n’est plus significatif comme variable pour ce qui concerne la durée de la pratique et sa pérennité. ) ont étudié l’impact d’événements de la vie sur l’adhésion à la pratique d’activité physique et ont déterminé quatre facteurs majeurs pouvant interférer avec la pratique physique :
) ont étudié l’impact d’événements de la vie sur l’adhésion à la pratique d’activité physique et ont déterminé quatre facteurs majeurs pouvant interférer avec la pratique physique : ), 40 % par Rosetta et coll. (1998
), 40 % par Rosetta et coll. (1998 ) et 78 % par Redman et Loucks (2005
) et 78 % par Redman et Loucks (2005 ) contre 9 % dans la population de femmes sédentaires. Cette variabilité entre les études s’explique par l’hétérogénéité de la population étudiée (quantité d’entraînement, temps disponible pour la récupération post-exercice). Quant à l’aménorrhée, sa fréquence chez la sportive varie aussi suivant le type de sport. Sa fréquence est plus élevée dans les sports d’endurance (30,9 %), dans les sports dits « esthétiques » (patinage artistique, gymnastique) (34,5 %) et dans les sports à catégorie de poids (23,5 %) (Torstveit et Sundgot-Borgen, 2005
) contre 9 % dans la population de femmes sédentaires. Cette variabilité entre les études s’explique par l’hétérogénéité de la population étudiée (quantité d’entraînement, temps disponible pour la récupération post-exercice). Quant à l’aménorrhée, sa fréquence chez la sportive varie aussi suivant le type de sport. Sa fréquence est plus élevée dans les sports d’endurance (30,9 %), dans les sports dits « esthétiques » (patinage artistique, gymnastique) (34,5 %) et dans les sports à catégorie de poids (23,5 %) (Torstveit et Sundgot-Borgen, 2005 ), c’est-à-dire dans les sports qui ont en commun d’être des sports dits portés, pour lesquels les contraintes mécaniques imposées par le poids sont une limite à la performance. La fréquence de l’aménorrhée est plus faible pour les sports non portés (natation et cyclisme) : autour de 12 % (ce qui correspond aussi à la fréquence retrouvée dans la population générale) (Torstveit et Sundgot-Borgen, 2005
), c’est-à-dire dans les sports qui ont en commun d’être des sports dits portés, pour lesquels les contraintes mécaniques imposées par le poids sont une limite à la performance. La fréquence de l’aménorrhée est plus faible pour les sports non portés (natation et cyclisme) : autour de 12 % (ce qui correspond aussi à la fréquence retrouvée dans la population générale) (Torstveit et Sundgot-Borgen, 2005 ). Ces différences suggèrent que l’aménorrhée est plus fréquente chez les sportives qui se soumettent à des régimes permettant de maintenir une masse grasse faible dans les sports où la maîtrise de la composition corporelle est un facteur de réussite. À l’inverse, dans les sports dits techniques (golf, plongeon, curling, équitation, tir) ou les sports de balle (volley, basket) la fréquence des troubles du cycle n’est pas plus élevée chez les athlètes ayant une activité sportive intensive (jusqu’à 12 à 18 heures d’entraînement par semaine) que chez les femmes sédentaires (Torstveit et Sundgot-Borgen, 2005
). Ces différences suggèrent que l’aménorrhée est plus fréquente chez les sportives qui se soumettent à des régimes permettant de maintenir une masse grasse faible dans les sports où la maîtrise de la composition corporelle est un facteur de réussite. À l’inverse, dans les sports dits techniques (golf, plongeon, curling, équitation, tir) ou les sports de balle (volley, basket) la fréquence des troubles du cycle n’est pas plus élevée chez les athlètes ayant une activité sportive intensive (jusqu’à 12 à 18 heures d’entraînement par semaine) que chez les femmes sédentaires (Torstveit et Sundgot-Borgen, 2005 ).
). ; Hilton et Loucks, 2000
; Hilton et Loucks, 2000 ; Williams et coll., 2001
; Williams et coll., 2001 ) confirment le rôle du déficit énergétique sur les troubles de la fonction ovarienne induits par l’exercice musculaire, avec un continuum réversible (parallèle à l’importance du déficit énergétique) allant des cycles ovulatoires à la phase lutéale courte puis à l’anovulation, et enfin à l’oligoménorrhée et à l’aménorrhée. À l’inverse, si le bilan énergétique est équilibré (et à l’exception de charges d’entraînement aberrantes), le volume d’entraînement (jusqu’à 17 heures par semaine) n’induit pas de troubles du cycle (Torstveit et Sundgot-Borgen, 2005
) confirment le rôle du déficit énergétique sur les troubles de la fonction ovarienne induits par l’exercice musculaire, avec un continuum réversible (parallèle à l’importance du déficit énergétique) allant des cycles ovulatoires à la phase lutéale courte puis à l’anovulation, et enfin à l’oligoménorrhée et à l’aménorrhée. À l’inverse, si le bilan énergétique est équilibré (et à l’exception de charges d’entraînement aberrantes), le volume d’entraînement (jusqu’à 17 heures par semaine) n’induit pas de troubles du cycle (Torstveit et Sundgot-Borgen, 2005 ).
). ). Ces résultats ont été confirmés et précisés par Loucks et Thuma (2003
). Ces résultats ont été confirmés et précisés par Loucks et Thuma (2003 ) qui ont défini le seuil de disponibilité énergétique en dessous duquel les troubles de la pulsatilité de LH apparaissent. Des femmes sédentaires présentant des cycles réguliers, ont été soumises à différents niveaux de disponibilité énergétique par des apports alimentaires et une quantité d’activité physique rigoureusement contrôlés pendant 5 jours. La dépense énergétique des 24 h a été mesurée (calorimétrie indirecte, port d’un accéléromètre) ainsi que les apports alimentaires des 24 h. Chaque jour un exercice de marche sur tapis roulant était réalisé pendant 40 minutes à 70 % du VO2 max. Son coût énergétique exact était mesuré par calorimétrie indirecte. Compte tenu de tous ces éléments, les femmes ont été réparties en différents niveaux de disponibilité alimentaire. La disponibilité énergétique était définie par les apports alimentaires des 24 h (en kcal) moins la dépense énergétique liée à l’exercice, ce qui correspond à l’énergie apportée à l’organisme pour subvenir aux besoins des tissus métaboliquement actifs (métabolisme de base). Après cinq jours, des prélèvements veineux ont été réalisés toutes les 10 minutes pendant 24 h pour doser la LH et différents paramètres métaboliques. Les résultats montrent que la pulsatilité de la LH ne varie pas de façon linéaire avec la disponibilité énergétique mais diminue significativement en dessous d’un seuil de disponibilité énergétique de 30 kcal/kg de masse maigre par jour (ou à un déficit énergétique total dépassant –15 kcal/kg de masse maigre par jour). Ces résultats corroborent ceux obtenus chez les sportives en aménorrhée montrant que la disponibilité énergétique qu’elles s’auto-administrent est plutôt autour de 16 kcal/kg de masse maigre par jour contre 30 kcal/kg de masse maigre par jour chez les cyclistes ayant des cycles réguliers. De plus, l’étude de Loucks et Thuma (2003
) qui ont défini le seuil de disponibilité énergétique en dessous duquel les troubles de la pulsatilité de LH apparaissent. Des femmes sédentaires présentant des cycles réguliers, ont été soumises à différents niveaux de disponibilité énergétique par des apports alimentaires et une quantité d’activité physique rigoureusement contrôlés pendant 5 jours. La dépense énergétique des 24 h a été mesurée (calorimétrie indirecte, port d’un accéléromètre) ainsi que les apports alimentaires des 24 h. Chaque jour un exercice de marche sur tapis roulant était réalisé pendant 40 minutes à 70 % du VO2 max. Son coût énergétique exact était mesuré par calorimétrie indirecte. Compte tenu de tous ces éléments, les femmes ont été réparties en différents niveaux de disponibilité alimentaire. La disponibilité énergétique était définie par les apports alimentaires des 24 h (en kcal) moins la dépense énergétique liée à l’exercice, ce qui correspond à l’énergie apportée à l’organisme pour subvenir aux besoins des tissus métaboliquement actifs (métabolisme de base). Après cinq jours, des prélèvements veineux ont été réalisés toutes les 10 minutes pendant 24 h pour doser la LH et différents paramètres métaboliques. Les résultats montrent que la pulsatilité de la LH ne varie pas de façon linéaire avec la disponibilité énergétique mais diminue significativement en dessous d’un seuil de disponibilité énergétique de 30 kcal/kg de masse maigre par jour (ou à un déficit énergétique total dépassant –15 kcal/kg de masse maigre par jour). Ces résultats corroborent ceux obtenus chez les sportives en aménorrhée montrant que la disponibilité énergétique qu’elles s’auto-administrent est plutôt autour de 16 kcal/kg de masse maigre par jour contre 30 kcal/kg de masse maigre par jour chez les cyclistes ayant des cycles réguliers. De plus, l’étude de Loucks et Thuma (2003 ) montre que cette atteinte de la pulsatilité de LH est plus marquée chez les femmes ayant les durées de phase lutéale les plus courtes.
) montre que cette atteinte de la pulsatilité de LH est plus marquée chez les femmes ayant les durées de phase lutéale les plus courtes. ).
). ). Cette diminution serait un des principaux signaux permettant d’informer l’ensemble de l’organisme et particulièrement le système nerveux central d’un déficit énergétique. Il existe par ailleurs des récepteurs de la leptine au niveau de l’hypothalamus et au niveau de l’ovaire. L’action de la leptine peut donc être soit indirecte (information sur le niveau des réserves énergétiques) soit directe puisque la leptine agit aussi directement au niveau cellulaire en augmentant la disponibilité des substrats énergétiques. Les athlètes pourraient représenter un modèle dans lequel la leptine agit comme un signal métabolique pour l’axe gonadotrope. En effet, la moyenne de la concentration plasmatique de leptine sur 24 h est trois fois plus faible chez les athlètes indépendamment de leur statut ovarien (cycles réguliers ou non), par rapport à celle des sédentaires (Laughlin et Yen, 1997
). Cette diminution serait un des principaux signaux permettant d’informer l’ensemble de l’organisme et particulièrement le système nerveux central d’un déficit énergétique. Il existe par ailleurs des récepteurs de la leptine au niveau de l’hypothalamus et au niveau de l’ovaire. L’action de la leptine peut donc être soit indirecte (information sur le niveau des réserves énergétiques) soit directe puisque la leptine agit aussi directement au niveau cellulaire en augmentant la disponibilité des substrats énergétiques. Les athlètes pourraient représenter un modèle dans lequel la leptine agit comme un signal métabolique pour l’axe gonadotrope. En effet, la moyenne de la concentration plasmatique de leptine sur 24 h est trois fois plus faible chez les athlètes indépendamment de leur statut ovarien (cycles réguliers ou non), par rapport à celle des sédentaires (Laughlin et Yen, 1997 ). Cette concentration de leptine est inversement corrélée à la masse grasse. Il existe par ailleurs un rythme nycthéméral (sur 24 h) de la leptine avec une augmentation d’environ 50 % entre le nadir (à 9 h) et le pic de concentration (à 1 h). Ce rythme nycthéméral est retrouvé chez les femmes sédentaires et sportives ayant des cycles réguliers mais, en revanche, il est totalement aboli chez les sportives en aménorrhée (figure 24.3
). Cette concentration de leptine est inversement corrélée à la masse grasse. Il existe par ailleurs un rythme nycthéméral (sur 24 h) de la leptine avec une augmentation d’environ 50 % entre le nadir (à 9 h) et le pic de concentration (à 1 h). Ce rythme nycthéméral est retrouvé chez les femmes sédentaires et sportives ayant des cycles réguliers mais, en revanche, il est totalement aboli chez les sportives en aménorrhée (figure 24.3 ).
). ) montre que la baisse de la disponibilité énergétique (le déficit énergétique) et non le stress de l’exercice est responsable de l’hypoleptinémie et des modifications de son rythme nycthéméral chez les femmes sportives ayant des troubles du cycle. Neuf femmes sédentaires ont été explorées à 4 reprises dans un protocole combinant variations de la disponibilité énergétique (normale versus basse) et variations du niveau d’exercice musculaire (sédentarité versus 4 jours d’exercices à raison de 30 min de marche par jour à 70 % du VO2 max). Le coût énergétique de l’exercice était de 30 kcal/kg du masse maigre par jour. On obtenait donc 4 groupes : sédentaires avec apport énergétique normal (45 kcal/kg de masse maigre/jour), sédentaires avec apport énergétique insuffisant (10 kcal/kg de masse maigre d’où un déficit énergétique de 35 kcal/kg de masse maigre/jour), exercice avec apport énergétique normal (45+30 soit 75 kcal/kg de masse maigre/jour), exercice avec apport énergétique insuffisant (40 kcal/kg de masse maigre d’où un déficit énergétique de 35 kcal/kg de masse maigre). Dans les 2 groupes (sédentaire versus exercice) avec apport énergétique insuffisant, le déficit énergétique total était donc le même. À la fin du 4e jour, les femmes étaient admises dans le Centre de recherche pour la mise en place d’un cathéter permettant un prélèvement sanguin toutes les 10 min sur une durée totale de 24 h. Les résultats sont exprimés sur le tableau 24.III
) montre que la baisse de la disponibilité énergétique (le déficit énergétique) et non le stress de l’exercice est responsable de l’hypoleptinémie et des modifications de son rythme nycthéméral chez les femmes sportives ayant des troubles du cycle. Neuf femmes sédentaires ont été explorées à 4 reprises dans un protocole combinant variations de la disponibilité énergétique (normale versus basse) et variations du niveau d’exercice musculaire (sédentarité versus 4 jours d’exercices à raison de 30 min de marche par jour à 70 % du VO2 max). Le coût énergétique de l’exercice était de 30 kcal/kg du masse maigre par jour. On obtenait donc 4 groupes : sédentaires avec apport énergétique normal (45 kcal/kg de masse maigre/jour), sédentaires avec apport énergétique insuffisant (10 kcal/kg de masse maigre d’où un déficit énergétique de 35 kcal/kg de masse maigre/jour), exercice avec apport énergétique normal (45+30 soit 75 kcal/kg de masse maigre/jour), exercice avec apport énergétique insuffisant (40 kcal/kg de masse maigre d’où un déficit énergétique de 35 kcal/kg de masse maigre). Dans les 2 groupes (sédentaire versus exercice) avec apport énergétique insuffisant, le déficit énergétique total était donc le même. À la fin du 4e jour, les femmes étaient admises dans le Centre de recherche pour la mise en place d’un cathéter permettant un prélèvement sanguin toutes les 10 min sur une durée totale de 24 h. Les résultats sont exprimés sur le tableau 24.III .
. )
) ).
). ) ont mis en évidence un retard pubertaire se traduisant par une apparition tardive de la ménarche (jusqu’à l’âge de 17 ans) chez des jeunes sportives soumises à un entraînement intense. Certains sports sont plus concernés que d’autres et l’on retrouve la notion de sports imposant une maîtrise de la composition corporelle comme la danse ou la gymnastique. Dans ce cas, il est bien établi que ce retard est lié au déficit énergétique. Des travaux obtenus sur des rats soumis à un déficit énergétique laissent également penser qu’une diminution chronique de la sécrétion de leptine serait impliquée dans ce retard pubertaire (Warren et Perlroth, 2001
) ont mis en évidence un retard pubertaire se traduisant par une apparition tardive de la ménarche (jusqu’à l’âge de 17 ans) chez des jeunes sportives soumises à un entraînement intense. Certains sports sont plus concernés que d’autres et l’on retrouve la notion de sports imposant une maîtrise de la composition corporelle comme la danse ou la gymnastique. Dans ce cas, il est bien établi que ce retard est lié au déficit énergétique. Des travaux obtenus sur des rats soumis à un déficit énergétique laissent également penser qu’une diminution chronique de la sécrétion de leptine serait impliquée dans ce retard pubertaire (Warren et Perlroth, 2001 ). Il a été bien établi que ce retard pubertaire et ses conséquences sur le développement staturo-pondéral sont rattrapés lors de l’arrêt de l’entraînement intensif (Malina, 1983
). Il a été bien établi que ce retard pubertaire et ses conséquences sur le développement staturo-pondéral sont rattrapés lors de l’arrêt de l’entraînement intensif (Malina, 1983 ).
).  ). Les mêmes anomalies sont retrouvées chez les sportives en oligoménorrhée mais à un niveau intermédiaire c’est-à-dire moins important que chez les sportives en aménorrhée et toutefois augmenté par rapport aux sportives ayant des cycles réguliers. Les conséquences à long terme par rapport au risque cardiovasculaire ne sont pas connues.
). Les mêmes anomalies sont retrouvées chez les sportives en oligoménorrhée mais à un niveau intermédiaire c’est-à-dire moins important que chez les sportives en aménorrhée et toutefois augmenté par rapport aux sportives ayant des cycles réguliers. Les conséquences à long terme par rapport au risque cardiovasculaire ne sont pas connues. ; Marcus et coll., 1985
; Marcus et coll., 1985 ; Tomten et coll., 1998
; Tomten et coll., 1998 ; Gibson et coll., 2000
; Gibson et coll., 2000 ). Ni un apport élevé de calcium ni l’activité physique ne suffiront à compenser le manque d’accrétion osseuse en fin d’adolescence.
). Ni un apport élevé de calcium ni l’activité physique ne suffiront à compenser le manque d’accrétion osseuse en fin d’adolescence. ; Gibson et coll., 2000
; Gibson et coll., 2000 ) et que le retour à des cycles réguliers après plusieurs années d’irrégularités menstruelles ne s’accompagne pas d’une restauration totale de la densité osseuse (Tomten et coll., 1998
) et que le retour à des cycles réguliers après plusieurs années d’irrégularités menstruelles ne s’accompagne pas d’une restauration totale de la densité osseuse (Tomten et coll., 1998 ), même au niveau de l’os cortical chez des femmes ayant une activité physique en charge.
), même au niveau de l’os cortical chez des femmes ayant une activité physique en charge. ).
). ) qui ont comparé des athlètes s’entraînant 12 h/semaine (natation, course ou triathlon) à des femmes sédentaires. Ces femmes étaient âgées de 20 à 70 ans (les femmes ménopausées ne prenaient pas de traitement hormonal de substitution). Bien que les athlètes âgées aient été en très bonne santé et toujours très actives pour leur âge, elles présentaient néanmoins une perte osseuse (réduction de la densité de masse osseuse (DMO) du col fémoral et lombaire), avec une augmentation de la résorption osseuse avec l’âge. Ainsi, un niveau d’activité physique élevé après la ménopause ne peut que diminuer mais pas supprimer la perte osseuse inexorable liée au vieillissement. En revanche, la DMO était plus élevée chez les femmes sportives que chez les sédentaires du même âge.
) qui ont comparé des athlètes s’entraînant 12 h/semaine (natation, course ou triathlon) à des femmes sédentaires. Ces femmes étaient âgées de 20 à 70 ans (les femmes ménopausées ne prenaient pas de traitement hormonal de substitution). Bien que les athlètes âgées aient été en très bonne santé et toujours très actives pour leur âge, elles présentaient néanmoins une perte osseuse (réduction de la densité de masse osseuse (DMO) du col fémoral et lombaire), avec une augmentation de la résorption osseuse avec l’âge. Ainsi, un niveau d’activité physique élevé après la ménopause ne peut que diminuer mais pas supprimer la perte osseuse inexorable liée au vieillissement. En revanche, la DMO était plus élevée chez les femmes sportives que chez les sédentaires du même âge. ) illustre l’intérêt de démarrer un programme d’activité physique régulier chez la femme ménopausée. L’objectif de ce travail était de tester l’effet d’un programme de 10 mois d’exercice musculaire sur la densité osseuse de femmes ménopausées, la densité osseuse étant mesurée au niveau du radius du bras non dominant. Trente et une femmes ont été recrutées (âge de 57 à 83 ans) et séparées en 3 groupes : groupe A (n=10) : programme aérobie ; groupe B : programme aérobie + programme de musculation de la moitié supérieure du corps et groupe C : groupe témoin sans exercice. Dans les groupes A et B, la densité osseuse a augmenté respectivement de 1,38 et 1,33 %, sans différence entre les deux groupes. En revanche, dans le groupe C, la densité osseuse a diminué de 2,50 %. Des résultats similaires ont été retrouvés avec 2 h d’activité physique par semaine (marche, jogging, volley, tennis, natation) depuis au moins 2 ans chez des femmes ménopausées sans traitement hormonal substitutif (Douchi et coll., 2003
) illustre l’intérêt de démarrer un programme d’activité physique régulier chez la femme ménopausée. L’objectif de ce travail était de tester l’effet d’un programme de 10 mois d’exercice musculaire sur la densité osseuse de femmes ménopausées, la densité osseuse étant mesurée au niveau du radius du bras non dominant. Trente et une femmes ont été recrutées (âge de 57 à 83 ans) et séparées en 3 groupes : groupe A (n=10) : programme aérobie ; groupe B : programme aérobie + programme de musculation de la moitié supérieure du corps et groupe C : groupe témoin sans exercice. Dans les groupes A et B, la densité osseuse a augmenté respectivement de 1,38 et 1,33 %, sans différence entre les deux groupes. En revanche, dans le groupe C, la densité osseuse a diminué de 2,50 %. Des résultats similaires ont été retrouvés avec 2 h d’activité physique par semaine (marche, jogging, volley, tennis, natation) depuis au moins 2 ans chez des femmes ménopausées sans traitement hormonal substitutif (Douchi et coll., 2003 ).
). ). Après la perte massive de masse osseuse survenant les premières années suivant l’installation de la ménopause (3 à 4 % par an pendant 5 ans, en moyenne), la perte moyenne osseuse se situe ensuite autour de 1 % par an. Ce qui signifie que la deuxième phase de perte osseuse plus lente peut être complètement prévenue par la pratique régulière d’une activité musculaire. En revanche, seul le traitement hormonal substitutif semble actuellement capable de prévenir la perte rapide de masse osseuse accompagnant le déficit œstrogénique après la ménopause. À noter que les résultats sont contradictoires sur les effets de l’association œstrogènes et activité physique au moment de la ménopause : cette association induit soit un gain supplémentaire de DMO par rapport aux œstrogènes seuls ou pas de gain supplémentaire (Kohrt et coll., 2004
). Après la perte massive de masse osseuse survenant les premières années suivant l’installation de la ménopause (3 à 4 % par an pendant 5 ans, en moyenne), la perte moyenne osseuse se situe ensuite autour de 1 % par an. Ce qui signifie que la deuxième phase de perte osseuse plus lente peut être complètement prévenue par la pratique régulière d’une activité musculaire. En revanche, seul le traitement hormonal substitutif semble actuellement capable de prévenir la perte rapide de masse osseuse accompagnant le déficit œstrogénique après la ménopause. À noter que les résultats sont contradictoires sur les effets de l’association œstrogènes et activité physique au moment de la ménopause : cette association induit soit un gain supplémentaire de DMO par rapport aux œstrogènes seuls ou pas de gain supplémentaire (Kohrt et coll., 2004 ; Borer, 2005
; Borer, 2005 ). Au-delà de 70 ans, l’activité physique ne peut que freiner la perte osseuse.
). Au-delà de 70 ans, l’activité physique ne peut que freiner la perte osseuse. ; Borer, 2005
; Borer, 2005 ) :
) : ) ;
) ; ). Les femmes qui marchent au moins 4 h/semaine ont un risque de survenue d’une fracture du col du fémur diminué de 41 % par rapport aux femmes sédentaires marchant moins de 1 h/semaine. Ce qui suggère que même une activité physique ayant un faible impact au niveau des contraintes imprimées à l’os comme la marche (lors d’une marche tranquille, chaque pas impose une charge sur le squelette axial d’une fois le poids corporel) peut diminuer le risque de fracture même dans des conditions où on attend peu de gain de densité osseuse. Il y aurait un gain de la résistance de l’os aux contraintes mécaniques (données animales : résistance à la fracture) qui est beaucoup plus important que le gain de densité osseuse.
). Les femmes qui marchent au moins 4 h/semaine ont un risque de survenue d’une fracture du col du fémur diminué de 41 % par rapport aux femmes sédentaires marchant moins de 1 h/semaine. Ce qui suggère que même une activité physique ayant un faible impact au niveau des contraintes imprimées à l’os comme la marche (lors d’une marche tranquille, chaque pas impose une charge sur le squelette axial d’une fois le poids corporel) peut diminuer le risque de fracture même dans des conditions où on attend peu de gain de densité osseuse. Il y aurait un gain de la résistance de l’os aux contraintes mécaniques (données animales : résistance à la fracture) qui est beaucoup plus important que le gain de densité osseuse. ). La DMO n’est qu’un moyen indirect d’apprécier la résistance de l’os aux contraintes mécaniques. La question importante est de savoir si une personne est à risque de se fracturer la hanche, le fémur ou le radius. Or, la mesure de la densité osseuse par absorptiométrie biphotonique (DEXA) ne semble pas être un moyen approprié de répondre à cette question, au moins pour apprécier les effets de l’activité physique régulière sur ce risque de fracture.
). La DMO n’est qu’un moyen indirect d’apprécier la résistance de l’os aux contraintes mécaniques. La question importante est de savoir si une personne est à risque de se fracturer la hanche, le fémur ou le radius. Or, la mesure de la densité osseuse par absorptiométrie biphotonique (DEXA) ne semble pas être un moyen approprié de répondre à cette question, au moins pour apprécier les effets de l’activité physique régulière sur ce risque de fracture.